Способ профилактики гнойных осложнений послеоперационных ран передней брюшной стенки и боковых отделов живота
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к области хирургии, и может быть использовано для профилактики гнойных осложнений у больных с высоким риском их развития. Комплекс цитокинов, инкубированных из крови пациента с интерлейкином-2, вводят в область краев послеоперационной раны через полихлорвиниловые трубки, установленные симметрично на расстоянии 1,5 см от краев раны под поверхностную фасцию живота в глубокий слой подкожной клетчатки из расчета 5 мл раствора на каждые 2 см длины раны, в 1-е и 3-и сутки послеоперационного периода. Равномерное распределение и высокая концентрация цитокинов в глубоком слое жировой клетчатки способствует заживлению ран первичным натяжением. Способ позволяет осуществлять лечение пациентов с высоким риском развития гнойных осложнений со стороны послеоперационных ран за счет создания высокой концентрации и равномерного распределения лекарственного препарата. 1 з.п. ф-лы, 1 ил., 2 прим.
Реферат
Изобретение относится к области медицины, а именно к области хирургии и может использоваться для профилактики гнойных осложнений у больных с высоким риском их развития.
Известен способ местной цитокинотерапии гнойных ран с использованием комплекса аутологичных цитокинов, полученных при стимуляции лимфоцитов фитогемаглютинином.
Данный способ используется только для лечения и только гнойных ран, без использования стимуляции клеточной массы интерлейкинами.
Известен способ лечения с использованием интерлейкина-2 при расширенных бактериальных инфекциях (патент Германии №3910011, A61K 37/02, 1990). По этому способу введение интерлейкина-2 внутривенно, подкожно, внутрибрюшинно, внутримышечно приводит к усилению неспецифического клеточного ответа, что способствует снижению числа бактерий в перитонеальной полости и снижению эндотоксинов в плазме крови. Способ по патенту может быть использован путем введения интерлейкина-2 в дозе 1-3,5·106 ЕД/кг в послеоперационном периоде, состояниях после тяжелой травмы, распространенной грамположительной и грамотрицательной инфекции, перитоните.
Известен также способ (по патенту РСТ №94/04174, кл. A61K 37/02, 1992 г.), при котором с целью усиления иммунной реакции на патоген используются природные ксеногенные цитокины.
Однако при данных способах использования цитокинов происходит их быстрое выведение, что диктует необходимость использования цитокинов в высоких дозах, что может вызывать выраженные побочные токсические реакции.
Известен способ адаптивной иммунотерапии для лечения больных с гнойно-септическими процессами (патент RU №2098125 C1, A61K 38/20, A61K 38/00), при котором выделяют мононуклеарные клетки, культивируют их с интерлейкином-2 и возвращают парэнтерально пациенту, а имеющиеся гнойные полости промывают раствором, содержащим комбинацию цитокинов, полученных при культивировании мононуклеарных клеток с интелейкином-2.
Данный метод применяется только в комбинации с внутривенным введением и не используется как самостоятельный способ только местной цитокинотерапии. Данный способ используется только при лечении гнойных ран, а не в профилактических целях.
Низкая проницаемость препарата при промывании требует более высокой концентрации препарата, частоты и длительности применения, а также увеличения сроков лечения.
Наиболее близким является способ профилактики послеоперационных гнойных осложнений области хирургического вмешательства и лечения инфицированных послеоперационных ран без гнойного отделяемого с использованием комплекса аутологичных цитокинов, в котором используются подкожные инъекции, для создания инфильтрационного вала в зоне операции на расстоянии 1,5 см от краев раны (Патент РФ №2394602, МПК A61M 1/38; A61K 31/7042; A61K 38/19; A61P 37/00; A61P 41/00. Бюлл. №20 от 20.07. 2010 г.).
Но способ по патенту не учитывает анатомическое деление подкожно жировой клетчатки передней брюшной стенки и боковых отделов живота на слои, разделенные плотным глубоким листком поверхностной фасции живота фактически на два различных по строению и функциональному состоянию слоя. Это имеет большое значение в развитии гнойно-воспалительных заболеваний, и в частности осложнений со стороны послеоперационной раны, при выполнении оперативных доступов в данных областях. В некоторых случаях глубокий листок настолько развит, что может быть принят за апоневроз наружной косой мышцы живота. Это затрудняет проникновение комплекса аутологичных цитокинов при его подкожной инъекции, особенно в случаях избыточно развитой подкожно-жировой клетчатки. Также лимфатические сосуды глубокого слоя подкожно-жировой клетчатки имеют развитые анастомозы с лимфатическими сосудами мышечно-апоневротического слоя, таким образом повышается локальная концентрация аутологичных цитокинов и в данном слое, что способствует ускорению образования и созревания рубцовой ткани и как отдаленное следствие может косвенно препятствовать такому грозному осложнению, как эвентрация.
Задача настоящего изобретения - повышение эффективности способа профилактики гнойных осложнений послеоперационных ран передней брюшной стенки и боковых отделов живота с использованием местной цитокиновой терапии, за счет дифференцированного способа доставки комплекса аутологичных цитокинов, непосредственно в глубокий слой подкожной клетчатки, а также более равномерного распределения его в данном слое.
Поставленная задача решается способом профилактики гнойных осложнений послеоперационных ран передней брюшной стенки и боковых отделов живота, включающим проведение антибиотикотерапии и иммунотерапии. Для иммунотерапии получают комплекс цитокинов путем инкубирования клеточной массы крови пациента с интерлейкином-2. Иммунотерапию проводят путем введения цитокинов в область краев послеоперационной раны.
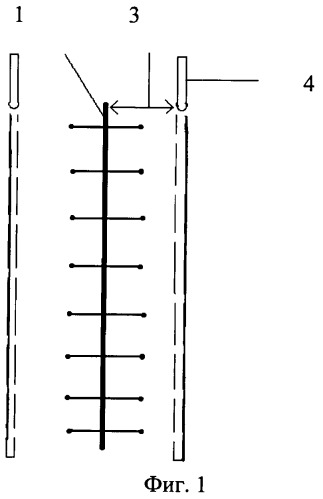
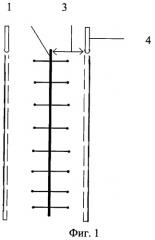
Цитокины вводят через полихлорвиниловые трубки, установленные симметрично на расстоянии 1,5 см от краев раны под поверхностную фасцию живота в глубокий слой подкожной клетчатки из расчета 5 мл раствора на каждые 2 см длины раны, в 1-е и 3-и сутки послеоперационного периода.
Для введения раствора используют полихлорвиниловые трубки диаметром 0,9-1,0 мм с отверстиями диаметром 0,3 мм на боковой поверхности, выполненными на расстоянии 2 см.
Новизна изобретения:
- Цитокины вводят через полихлорвиниловые трубки, установленные симметрично на расстоянии 1,5 см от краев раны под поверхностную фасцию живота в глубокий слой подкожной клетчатки из расчета 5 мл раствора на каждые 2 см длины раны, в 1-е и 3-и сутки послеоперационного периода.
- Для введения раствора используют полихлорвиниловые трубки диаметром 0,9-1,0 мм с отверстиями диаметром 0,3 мм на боковой поверхности, выполненными на расстоянии 2 см.
Впервые в хирургической практике применена, с целью профилактики развития гнойных осложнений со стороны послеоперационной раны живота, местная цитокиновая терапия с учетом анатомического строения подкожно-жировой клетчатки, а использование полихлорвиниловых трубок позволяет обеспечить равномерное распределение препарата и снизить болевую реакцию пациента на иньекции. Введение препарата в расчете 5 мл на каждые два сантиметра обусловлено тем, что при этом создается достаточная инфильтрация жировой клетчатки.
Подкожный способ введения, локально именно в глубокий слой клетчатки, используя предварительно установленные трубки, в отличие от внутривенного, внутримышечного, аппликационного и традиционного введения в поверхностный слой, позволяет быстро создать более высокую концентрацию препарата в глубоком слое жировой клетчатки, а также добиться более равномерного распределения препарата в данном слое, что повышает эффективность его действия. Учитывая то, что лимфатические сосуды глубокого слоя подкожно-жировой клетчатки имеют развитые анастомозы с лимфатическими сосудами мышечно-апоневротического слоя, то и в нем повышается локальная концентрация аутологичных цитокинов, что способствует ускорению образования и созревания рубцовой ткани и способствует профилактике другого серьезного осложнения - эвентрации, что и является новым техническим результатом данного изобретения.
Препарат вводится непосредственно в область послеоперационной раны, где и формируется местный иммунный ответ и повышение иммунологической реактивности.
Совокупность существенных признаков изобретения в доступной нам литературе не найдена, следовательно, изобретение соответствует критерию «новизна».
Изобретение поясняется рисунками, представленными на Фиг.1-2.
На Фиг.1 изображен вид сверху операционной раны и установленных полихлорвиниловых трубок.
На Фиг.2 показан вид стенки раны с установленной в глубокий слой подкожной клетчатки трубкой.
Способ осуществляется следующим образом.
При выполнении оперативного вмешательства любым способом при заведомо высоком риске развития гнойных осложнений со стороны послеоперационной раны 1 передней брюшной стенки и боковых отделов живота помимо антибиотикотерапии проводят иммунотерапию. Для этого в глубокий слой клетчатки 2 под поверхностную фасцию живота в глубокий слой подкожной клетчатки, интраоперационно, на расстоянии 1,5 см от краев раны 3 устанавливаются полихловиниловые трубки 4, диаметром 0,9-1,0 мм, с отверстиями 5 на боковых поверхностях. Диаметр отверстий 5-0,3 мм, они располагаются через каждые 2 см, для последующего проведения местной цитокиновой терапии путем введения в них комплекса аутологичных цитокинов. В первые сутки послеоперационного периода, в случае экстренной операции, или перед плановой операцией у пациентов, в систему «Гемакон» производится забор 450-500 мл крови. Кровь центрифугируется при 3700 об. в течение 20 мин. Затем из системы удаляется плазма, таким образом, чтобы над эритроцитами остался лейко-тромбоцитарный слой. Далее в клеточную массу добавляется 200 мл физиологического раствора NaCl 0,9%, после чего производят центрифугирование в том же режиме и удаление надосадочной жидкости с оставлением того же лейко-тромбоцитарного слоя. В полученную клеточную массу добавляем 500000 ЕД. интерлейкина-2 и 200 мл физиологического раствора NaCl 0,9%, инкубируют в течение часа при температуре 37°С. Далее центрифугируют в том же режиме, и распределяют надосадочный слой по 80 мл в стерильные флаконы, а оставшуюся клеточную массу утилизируют или возвращают пациенту.
Введение комплекса аутологичных цитокинов осуществляется в 1-е и 3-и сутки послеоперационного периода в количестве 20-80 мл из расчета 5 мл раствора на каждые 2 см длины послеоперационной раны через полихлорвиниловые трубки.
Клинический пример №1
Пациентка К., 68 лет (история болезни №2015). Поступила в экстренное хирургическое отделение с диагнозом:
Ущемленная вентральная грыжа.
Сопутствующий: Гипертоническая болезнь 3 ст. риск 3.
Состояние средней степени тяжести за счет болевого и воспалительного синдромов, выраженный болевой абдоминальный синдром в области грыжевого выпячивания, температура 37,7° по Цельсию, гемодинамика стабильная, тахикардии нет, лейкоциты крови до 5,8 млрд/л со сдвигом влево (палочкоядерные - 15, сегментоядерные - 66, моноциты - 2, лимфоциты - 16, эозинофилы - 1).
В биохимическом анализе крови билирубинемия: общий билирубин - 22,2 мкмоль/л, прямая фракция - 4,4 мкмоль/л. Гиперамилаземии крови нет. Остальные показатели в пределах нормы. ЭКГ: Систолическая перегрузка левых отделов сердца, синдром укороченного PQ.
Вышеуказанные жалобы в течение 72 часов. В анамнезе отмечает подъем температуры тела до 38° по Цельсию.
Диагноз при поступлении не вызывал сомнений. Предоперационная подготовка. Профилактика тромбэмболических осложнений.
По жизненным показаниям 17.05.2010 г. Операция: Грыжесечение, пластика грыжевых ворот сетчатым имплантатом в позиции sub-lay, в глубокий слой подкожной клетчатки установлены трубки для проведения местной цитокиновой терапии диаметром 1,0 мм, длиной - 14 см.
Интраоперационно выявлено ущемление предбрюшинной клетчатки с некрозом последней, резецирована.
Диагноз после операции: Ущемленная грыжа белой линии живота с ущемлением и некрозом предбрюшинной клетчатки.
Дальнейшее лечение в условиях экстренного хирургического отделения, коррекция лечения сопутствующей патологии, антибиотикотерапия: цефазолин 2.0×2 раза в день в/м (3 сут).
Состояние средней степени тяжести, субфебрилитет в первые 3-е суток после операции, температура до 37,3°С. Гиперлейкоцитоз в общем анализе крови не наблюдался, биохимические показатели в пределах нормы. Введение комплекса аутологичных цитокинов через установленные трубки двукратно в 1 и 3 сутки предложенным способом. Длина раны и соответственно трубок - 14 см, введено 70 мл, по 35 мл в каждую трубку. Осложнений при введении не наблюдалось. Течение послеоперационного периода гладкое, осложнений со стороны послеоперационной раны не отмечено, заживление раны первичное. Больная выписана на 9-е сутки в удовлетворительном состоянии.
Клинический пример №2
Пациент З., 54 года, поступил в экстренное хирургическое отделение 29.06.10 г. 14:45 с Дз: Стеноз выходного отдела желудка.
Состояние больного тяжелое за счет имеющегося нарушения водно-электролитного обмена, болей в верхней половине живота. Температура при поступлении 36,4°С. Гемодинамика стабильная: АД - 130/80, ЧСС - 84 в мин.
В анализах крови имеются выраженные воспалительные изменения: лейкоцитоз до 24,1·109 формула: палочкоядерные - 17, сегментоядерные - 60, моноциты - 7, лимфоциты - 16, увеличение количества тромбоцитов до 503·109.
В биохимическом анализе крови повышение мочевины до 27,3 ммоль/л, гиперамилаземия до 306 ЕД./л (норма до 220 ЕД./л), гиперпротеинемия 92 г/л (норма до 80 г/л). В анализах мочи протеинурия - белок 0,3 г/л, лейкоцитурия до 10 в поле зрения.
Остальные показатели в пределах нормы. ЭКГ: синусовая тахикардия, блокада передне-верхней ветви ЛНПГ.
Вышеуказанные жалобы в течение 72 часов. В анамнезе отмечает наличие рвоты съеденной пищей 1 р./нед. в течение месяца. Для проведения предоперационной подготовки больной переводится в отделение реанимации, где проводится коррекция водно-электролитных нарушений, проведение парентерального питания.
02.07.2010 г. Операция: Лапаротомия, резекция 2/3 желудка по Б-2 с анастамозом по Витебскому. Дренирование брюшной полости. Под поверхностную фасцию живота в глубокий слой подкожной клетчатки установлены полихлорвиниловые трубки длиной 16 см для проведения местной цитокиновой терапии.
Интраоперационно выявлена постбульбарная язва двенадцатиперстной кишки, осложненная стенозом, микроперфорацией с формированием перидуоденального абсцесса.
Дигноз после операции: Постбульбарная язва двенадцатиперстной кишки, осложненная стенозом, микроперфорацией. Перидуоденальный абсцесс.
Дальнейшее лечение в условиях отделения реанимации. Имеются сопутствующие осложнения неврологического характера: ЦВБ. Психоорганический синдром. Также дважды желудочно-кишечное кровотечение, источник не верифицирован.
Состояние тяжелое по совокупности патологий, субфебрилитет весь период нахождения в отделении. Введение комплекса аутологичных цитокинов через установленные трубки длиной 16 см, в количестве 80 мл, по 40 мл в каждую трубку двукратно в 1 и 3 сутки предложенным способом. Осложнений при введении не наблюдалось. Осложнений со стороны послеоперационной раны не отмечено, заживление раны первичное.
Таким образом, использование предложенного способа местной цитокиновой терапии позволяет существенно повысить результаты лечения пациентов с высоким риском развития гнойных осложнений со стороны послеоперационных ран в качестве способа профилактики.
1. Способ профилактики гнойных осложнений послеоперационных ран передней брюшной стенки и боковых отделов живота, включающий проведение антибиотикотерапии и иммунотерапии, причем для иммунотерапии получают комплекс цитокинов путем инкубирования клеточной массы крови пациента с интерлейкином-2, иммунотерапию проводят путем введения цитокинов в область краев послеоперационной раны, отличающийся тем, что цитокины вводят через полихлорвиниловые трубки, установленные симметрично на расстоянии 1,5 см от краев раны, под поверхностную фасцию живота в глубокий слой подкожной клетчатки из расчета 5 мл раствора на каждые 2 см длины раны, в 1-е и 3-и сутки послеоперационного периода.
2. Способ профилактики гнойных осложнений послеоперационных ран передней брюшной стенки и боковых отделов живота по п.1, отличающийся тем, что используют полихлорвиниловые трубки диаметром 0,9-1,0 мм с отверстиями диаметром 0,3 мм на боковой поверхности, выполненными на расстоянии 2 см.