Способ лечения импрессионного перелома метаэпифизарного отдела трубчатой кости
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к хирургии и травматологии, может найти применение при лечении импрессионных переломов метаэпифизарных отделов трубчатых костей. Сущность способа состоит в формировании в полости костного дефекта слоя из крупинок пористого никелида титана. При этом слой крупинок пористого никелида титана, образующий губчатую часть имплантата, формируют по толще слоя губчатой кости в выемке дефекта. После чего устанавливают на губчатую часть монолитную часть имплантата из пористого никелида титана. Обе части имплантата перед установкой предварительно насыщают богатой тромбоцитами аутоплазмой и антибиотиком при соотношении объемов 1:1. После окончательной репозиции суставной поверхности фиксируют перелом поддерживающей пластиной и компрессирующими винтами. Использование данного изобретения позволяет оптимизировать биомеханические характеристики имплантата, замещающего костный дефект, ускорить процессы репаративного остеогенеза и сократить сроки функционального нагружения поврежденной кости. 1 з.п. ф-лы, 7 ил., 1 пр.
Реферат
Изобретение относится к хирургическим способам лечения повреждений опорно-двигательного аппарата, а именно импрессионных переломов метаэпифизарных отделов трубчатых костей.
Лечение больных с импрессионными (вдавленными) переломами метаэпифизарных отделов трубчатых костей (в частности, проксимальных мыщелков большеберцовой кости), которые сопровождаются большими потерями костной ткани, сопряжено с большими трудностями, связанными с функциональными особенностями и биомеханическими условиями поврежденного сегмента, что и объясняет тяжесть последствий: высокую вероятность развития посттравматического артроза и, как следствие, нарушения функции сустава.
Одним из факторов, сдерживающих развитие органосохраняющей хирургии, является ограниченный набор надежных и быстрых методов и материалов для восполнения костных дефектов, образующихся после травматических воздействий, особенно у категории больных с высокоэнергетической травмой.
Известен способ замещения дефектов проксимальных суставных концов берцовых костей [1]. Способ включает остеотомию берцовых костей и дозированное перемещение выделенных фрагментов до замещения дефекта с последующим сращением с противостоящим концом бедренной кости. При истончении берцовых костей формируют продольные отщепы от них на протяжении диафиза и дозированно перемещают их по ширине до нормализации толщины кости.
Известен также способ фиксации метаэпифизарных переломов костей [2], включающий введение коротких спиц в дистальный отломок кости, закрепление их в фиксационных узлах и введение в проксимальный отломок наружного стержня-шурупа.
Недостатком рассмотренных способов чрескостного дистракционного остеосинтеза является длительность лечения и возможность развития специфических осложнений. Кроме этого, способ не позволяет восполнять утрату костного материала при объемных, распространяющихся вглубь кости дефектах, возникающих при импрессионных переломах.
Одним из известных направлений развития хирургических способов замещения костных дефектов различного происхождения и размеров является использование ауто- и аллотрансплантатов.
Так, известен способ замещения мыщелка большеберцовой кости [3], согласно которому дефект мыщелка замещают костным аутотрансплантатом, а пластику суставной поверхности выполняют костно-хрящевым деминерализованным аллотрансплантатом, который помещают поверх костного трансплантата.
В развитие этого направления предлагаются имплантаты, обладающие остеогенной активностью, как, например, в способе восстановления целостности кости [4]. Согласно этому способу дефект заполняют частью здоровой аутокости с надкостницей или используют отсепарированную надкостницу с имплантатом, выполненным на основе трехмерного аллогенного костного матрикса и губки из биодеградируемого материала, которой окутывают и уплотняют дистальную и проксимальную области дефекта. Имплантат и губка из биодеградируемого материала обладают остеогенной активностью за счет культивирования в них клеток стромального и лимфомакрофагального ряда аутологичного костного мозга. Аллогенный костный матрикс представляет собой соломку из деминерализованной кости сечением 1,5-5 мм2, а губка из биодеградируемого материала представляет собой пластинку толщиной 1-2 мм, шириной 25-35 мм и длиной, зависящей от длины окружности места стыка имплантата с собственной костью больного.
Однако возможности использования ауто- и аллотрансплантатов для костной пластики ограничены в связи с дополнительной травмой и лимитируемым объемом заготовляемой аутокости, возможными иммунологическими конфликтами при использовании аллотрансплантатов, потерей прочностных качеств губчатых трансплантатов, длительностью перестройки костной ткани, а также длительной иммобилизацией и поздним восстановлением функции сегмента.
Другим направлением является использование для замещения костных дефектов имплантатов неорганического происхождения.
Известно, например, использование для замещения костных дефектов Коллапан-геля, содержащего коллаген, синтетический гидроксилаппатит и антибиотики [5]. Экспериментально-морфологическое исследование показало выраженные остеокондуктивные и остеоиндуктивные свойства Коллапан-геля - формирование новообразованных костных трабекул происходило уже на 12 сутки после имплантации.
Однако новообразованная кость формировалась лишь на поверхности гидроксилаппатита, что ограничивает возможную область использования предлагаемого материала.
Известен также способ замещения костных дефектов мыщелков большеберцовой кости при эндопротезировании коленного сустава [6], согласно которому после удаления измененных участков суставных поверхностей мыщелков от мягких тканей выравнивают дефект так, чтобы он приобрел клиновидную форму и замещают его металлическим модульным клиновидным имплантатом с использованием костного цемента.
Недостатком способа является несоответствие упруго-эластических характеристик кости и жесткого металлического имплантата, который под воздействием нагрузки на сустав может травмировать и деформировать кость, нарушая естественные условия функционирования сустава. Кроме этого, несоответствие биомеханических характеристик имплантата и кости затрудняет процессы репаративного остеогенеза, требует длительной иммобилизации конечности, и в ряде случаев приводит к посттравматическим осложнениям.
Наиболее перспективным материалом для замещения костной ткани в последнее время является пористый никелид титана [7]. Как показали исследования [8], реакция костной ткани на имплантацию пористого никелида титана заключается в том, что в порах имплантата к 6 месяцам формируется костная ткань, структура которой аналогична структуре матричной кости. Важным условием для успешной имплантации является биологическая совместимость имплантатов из никелида титана с тканями организма, а также присущая им механическая прочность, сочетающаяся со сверхэластичностью, что позволяет при правильном выборе типа конструкции имплантата достичь биомеханического равновесия системы имплантат-кость.
Наиболее близким аналогом, принятым за прототип предлагаемого изобретения, является способ замещения костных дефектов [9], согласно которому полость костного дефекта после обработки растворами антисептиков заполняют гранулами (крупинками) пористого никелида титана.
Недостатком прототипа является сравнительно невысокая плотность сформированного имплантата, не соответствующая структуре и плотности монолитной кости, ввиду чего при замещении дефектов суставной поверхности возможно проседание сформированной суставной площадки под нагрузкой.
Техническим результатом изобретения является оптимизация биомеханических характеристик имплантата, замещающего костный дефект, при одновременном ускорении процессов репаративного остеогенеза и сокращении сроков функционального нагружения поврежденной кости.
Сущность изобретения заключается в том, что в способе лечения импрессионного перелома метаэпифизарного отдела трубчатой кости, включающем формирование в полости костного дефекта слоя из крупинок пористого никелида титана, поверх указанного слоя, образующего губчатую часть имплантата, устанавливают монолитную часть имплантата, выполненную из пористого никелида титана, при этом обе части имплантата перед установкой предварительно насыщают богатой тромбоцитами аутоплазмой и антибиотиком, а после окончательной репозиции суставной поверхности фиксируют перелом поддерживающей пластиной и компрессирующими винтами.
При этом в состав губчатой части имплантата дополнительно вводят мелкие отломки аутокости.
Сущность изобретения модели поясняется чертежами, на которых представлены:
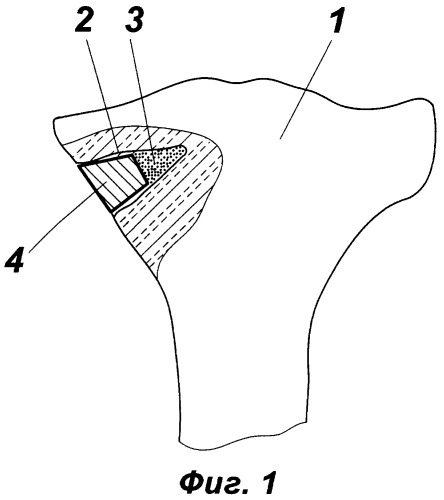
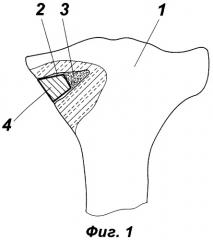
фиг.1 - конструкция имплантата;
фиг.2 - подготовительный этап операции;
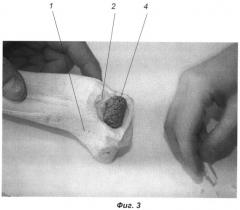
фиг.3 - этап установки монолитной части имплантата;
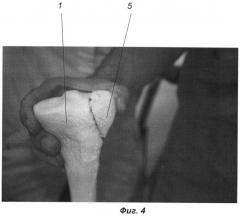
фиг.4 - этап репозиции суставной поверхности кости;
фиг.5 - этап фиксации перелома;
фиг.6 - рентгенограмма инверсионного перелома большеберцовой кости до операции;
фиг.7 - рентгенограмма оперированной большеберцовой кости через 11 месяцев после операции.
На фиг.1-7 приняты следующие обозначения:
1 - метаэпифизарный отдел трубчатой кости,
2 - выемка (полость) костного дефекта,
3 - губчатая часть имплантата,
4 - монолитная часть имплантата,
5 - отломок мыщелка,
6 - большеберцовая кость,
7 - заготовка губчатой части имплантата,
8 - заготовка монолитной части имплантата,
9 - поддерживающая пластина,
10 - компрессирующий винт.
Как показано на фиг.1, имплантат для замещения костного дефекта, образующегося при импрессионном переломе метаэпифизарного отдела 1 трубчатой кости (в рассматриваемом примере - большеберцовой кости), состоит из губчатой части 3 и монолитной части 4, установленной на губчатую часть.
Губчатая часть 3 имплантата состоит из механической смеси крупинок (гранул) пористого никелида титана и мелких костных отломков или, при отсутствии костного материала, из крупинок никелида титана. Толщина слоя губчатой части 3 зависит от глубины выемки 2 костного дефекта, т.е. от глубины проникновения в губчатую кость, и обычно составляет не менее 1/3 общей толщины имплантата.
Монолитная часть 4 имплантата выполнена из монолитной заготовки пористного никелида титана.
Пористый никелид титана получают методами порошковой металлургии: диффузным спеканием порошка никелида титана для мелких изделий и самораспространяющимся высокотемпературным синтезом (СВС) из порошков титана, никеля, молибдена, железа - для более крупных заготовок. Пористый никелид титана, полученный методом СВС, имеет неупорядоченную структуру, размеры пор в диапазоне от 100 до 600 мкм и пористость 30-80%. Металлическая матрица с достаточно гладкой поверхностью содержит «бесконечный» трехмерный поровый кластер.
Пористые имплантаты на основе никелида титана характеризуются способностью быстрой самофиксации в тканях, стромоподобной каркасностью, сходным с биологическими тканями удельным весом, адгезивностью к биологическим тканям и средам, стабильной фиксацией к окружающим тканям и способностью преобразования вросшей ткани в более дифференцированную. Ткань прорастает в поры постепенно, начиная с капиллярной пропитки пор физиологическими жидкостями, а затем постепенным образованием уплотненной соединительной ткани, хрящевой ткани и костной, хорошо сформированной ткани [10].
Динамика остеогенеза в слое крупинок пористого никелида титана сходна с таковой в пористом монолите. Отличие заключается в том, что формирующаяся в промежутках между крупинками костная ткань имеет меньшую плотность и более рыхлую структуру, аналогичную характеристикам губчатой кости [11].
Выбор состава, которым пропитывают губчатую и монолитную части имплантата, определяется следующим.
Богатая тромбоцитами плазма (БТП) - это плазма, в которой содержится в 3-4 раза большее количество тромбоцитов на 1 микролитр по сравнению с обычной плазмой. В процессе активизации каскада свертывания в БТП формируется фибриновая матрица, представленная естественным фибриновым сгустком, который способствует нормальной клеточной инфильтрации моноцитов, фибробластов и других клеток, играющих важную роль в заживлении ран. В процессе дегрануляции тромбоциты высвобождают большое количество веществ, обеспечивающих первичный гомеостаз, а также факторов роста (таких как PDGF, TGFβ-1, TGFβ-2), которые играют важную роль в стимуляции процессов заживления ран в организме.
Изготовление БТП основано на отделении форменных элементов крови, различных по удельному весу, друг от друга при двукратном центрифугировании. При первом центрифугировании крови, проводимом с небольшой скоростью (1000 об/мин), более тяжелые эритроциты и лейкоциты отделяются от плазмы и тромбоцитов. При втором центрифугировании (2000 об/мин) тромбоциты отделяются от плазмы и оседают на дне пробирки (тромбоцитарный концентрат), над ними находится бедная тромбоцитами плазма, которую отбирают шприцем, оставляя в пробирке 1/3 ее объема. Оставшаяся часть бедной тромбоцитами плазмы смешивается с тромбоцитарным концентратом и получается богатая тромбоцитами плазма [12].
Насыщение пор имплантата антибиотиком позволяет снизить риск возникновения воспалительных процессов, что подтверждается исследованиями противомикробных свойств пористого никелида титана, пропитанного растворами антибиотика [13].
Способ осуществляют следующим образом.
Перед подготовкой операции по рентгенограмме инверсионного перелома, например, как показано на фиг.2, импрессионного перелома мыщелка большеберцовой кости 6, подбирают заготовку 8 пористого никелида титана, соответствующую размеру выемки 2 костного дефекта, и стерилизуют ее. За 2-3 часа до операции производят забор крови больного, из которой рассмотренным выше способом получают богатую тромбоцитами аутоплазму.
В ходе операции под одним из видов обезболивания обнажают линию перелома и удаляют, если они есть, свободнолежащие мелкие отломки кости, которые помещают в емкость с простерилизованными крупинками 7 пористого никелида титана и перемешивают с ними. Промывают полость выемки 2 образовавшегося костного дефекта перекисью водорода и фурацилином и осушают. С помощью костных кусачек окончательно подгоняют форму и размеры заготовки 8, формируя монолитную часть 4 имплантата.
Одновременно богатую тромбоцитами аутоплазму активизируют смесью хлористого кальция и тромбина и добавляют в этот состав антибиотик (например, Ванкомицин) при соотношении объемов компонентов 1:1. Частью полученного пропитывающего состава заливают смесь крупинок 7 пористого никелида титана и костных отломков и перемешивают смесь для лучшего проникновения раствора в поры. Монолитную часть 4 имплантата насыщают оставшейся частью пропитывающего состава БТП и антибиотика путем многократного (3-5 раз) погружения в раствор, встряхивания между погружениями и так вплоть до исчезновения с поверхности имплантата пузырьков воздуха.
Укладывают в полость 2 костного дефекта пропитанную раствором смесь крупинок пористого никелида титана и костных отломков, формируя губчатую часть 3 имплантата, толщина которой определяется толщиной слоя губчатой кости в выемке 2 и составляет обычно не менее 1/3 общей толщины (высоты) имплантата. При отсутствии костного материала губчатую часть 3 имплантата формируют из пропитанных крупинок 7 пористого никелида титана. Затем устанавливают на эту подложку монолитную часть 4 имплантата (см. фиг.3), после чего производят окончательную репозицию суставной поверхности, например, как показано на фиг.4, воссоединяют отломок 5 мыщелка с неповрежденной частью метаэпифизарного отдела 1 кости. По окончании репозиции фиксируют перелом поддерживающей пластиной 9 и компрессирующими винтами 10, как, например, показано на фиг.5. Затем операционную рану послойно ушивают с дренированием активными дренажами.
В процессе отработки способа в течение двух лет в отделении ортопедии и травматологии больницы Святого великомученика Георгия проведено лечение 112 больных с внутрисуставными переломами мыщелков большеберцовой кости, 87% из которых составили импрессионные переломы. Произведено 52 артротомии коленного сустава, в ходе которых помимо переломов мыщелков большеберцовой кости имелись повреждения связочного аппарата коленного сустава и менисков различного характера. Во всех случаях восстанавливались все поврежденные структуры. Результатом консервативного лечения подобных повреждений является нестабильность, блокада контрактуры сустава, что приводит в дальнейшем к сложным реконструктивным операциям.
Во всех 52 случаях наблюдалась импрессия губчатой кости с дефектом губчатого вещества (вдавливание суставной поверхности с повреждением хряща). Для восстановления суставной поверхности в 23 случаях применялись имплантаты из пористого никелида титана, с помощью которых поднимали и стабилизировали суставную площадку, после чего производили металлоостеосинтез L- или Т-образной пластиной и винтами. У 28 пострадавших костные дефекты замещались аутотрансплантатами из гребня подвздошной кости, а в одном случае использовали в качестве трансплантата Chronos. Рана ушивалась наглухо с оставлением активного дренажа на 24-48 часов.
В раннем послеоперационном периоде отмечены два осложнения: в первом случае - краевой некроз кожи в нижней трети послеоперационной раны, во втором - остаточная гематома, которая была санирована, а рана зажила вторичным натяжением. В первом случае в качестве трансплантата использовался гребень подвздошной кости, во втором - Chronos. У пациентов с аутотрансплантатами наблюдался стойкий болевой синдром в донорской зоне, превышающий боль в зоне основной операции.
По данным рентгенологического исследования пористый никелид титана обеспечивает более прочную фиксацию и стабильность и препятствует проседанию суставной площадки при ранней нагрузке. На рентгенограммах в двух проекциях через месяц после операции сохранялась четкая граница между имплантатом и костным ложем, смещения имплантата в кости не было. Нарушения конгруэнтности суставных поверхностей, сужения суставной щели коленного сустава не отмечено. Определялась слабо выраженная периостальная реакция. Зоны резорбции не прослеживались, остеопороза большеберцовой кости не выявлено.
Ко второму месяцу после операции над поверхностью имплантата формировалась рентгеноконтрастная, увеличивающаяся в размере костная мозоль. В последующем происходила ее компактизация; восстанавливалась структура большеберцовой кости в области костного дефекта. Пустоты между имплантатом и стенками полости полностью заполнялись вновь образованной костной тканью.
В последующие 3-6 месяцев рентгенологическая картина не менялась.
В целях оптимизации процессов регенерации и сокращения сроков функционального нагружения конечности в течение следующих двух лет в отделении продолжалась отработка методики замещения костных дефектов имплантатами из пористого никелида титана.
Прооперировано 26 больных с импрессионными переломами, восьми из которых были установлены двухслойные имплантаты из пористого никелида титана, предварительно насыщенные антибиотиком и богатой тромбоцитами аутоплазмой. Контрольную группу составили пациенты, которым устанавливались монолитные имплантаты из пористого никелида титана без пропитки.
Рентгенологическая картина костной ткани через месяц после операции в обеих группах наблюдений показала плотный контакт имплантатов с костью, однако в контрольной группе наблюдались зоны с меньшей минерализацией вдоль поверхности имплантатов. По данным рентгеновизиографического исследования показатели оптической плотности тканей у насыщенных имплантатов в более ранние сроки по сравнению с ненасыщенными соответствовали картине полной остеоинтеграции.
Клинические наблюдения подтвердили возможность снятия иммобилизации через 3 недели после операции и полного нагружения конечности через 5-6 недель. В контрольной группе эти сроки составили соответственно 4 недели и 6-8 недель.
Эффективность предлагаемого способа подтверждается следующим клиническим примером.
Больной Л., 52 года, история болезни №12345, у поребрика тротуара упал на подвернутую ногу. Доставлен в отделение ортопедии и травматологии больницы, где после клинико-рентгенологического обследования был поставлен диагноз: закрытый внутрисуставной Т-образный чрезмыщелковый перелом правой большеберцовой кости (см. фиг.6). На третьи сутки после получения травмы под спинномозговой анестезией произведена операция - открытая репозиция, остеосинтез Т-образной пластиной 9 и компрессирующими винтами 10. Образовавшаяся выемка 2 подмыщелкового пространства заполнена на 1/3 глубины крупинками пористого никелида титана, на слой 3 которого установлена монолитная часть 4 имплантата (см. фиг.7). Обе части имплантата перед установкой насыщали антибиотиком, разведенным в богатой тромбоцитами аутоплазме. Во время операции произведена ревизия связочного аппарата коленного сустава - повреждений не выявлено. Послеоперационное течение гладкое, швы сняты на 12-е сутки, заживление раны первичным натяжением. В течение 2 недель конечность была иммобилизована съемной гипсовой шиной, которую дважды в день снимали для выполнения движений в суставе. Разрешена ходьба при помощи костылей с 4-х суток без опоры на оперированную конечность. С 4-й недели начата дозированная нагрузка. Прошел курс амбулаторного восстановительного лечения. Осмотрен через 11 мес. После операции: ось конечности и соотношения в суставе правильные, движения практически в полном объеме.
Таким образом, преимуществом предлагаемого способа является обеспечение полной биомеханической совместимости имплантата с мыщелком большеберцовой кости, прочность которого убывает в дистальном направлении.
Насыщение пор имплантата антибиотиком, разведенным в богатой тромбоцитами аутоплазме, во-первых, обеспечивает профилактику воспалительных осложнений, а во-вторых, оказывает стимулирующее влияние на процесс репаративного остеогенеза, что позволяет сократить сроки восстановления функции оперируемой конечности.
Способ может быть осуществлен при использовании известных приемов оперативного доступа к поврежденному суставу, известного в хирургической практике оборудования и материалов, что характеризует изобретение как промышленно применимое.
Источники информации
1. Патент РФ №2176905 на изобретение, МПК А61В 17/56, публикация 20.12.2001 г.
2. Патент РФ №2228723 на изобретение, МПК А61В 17/56, публикация 20.05.2004 г.
3. Патент РФ №2241396, МПК А61В 17/56, публикация 10.12.2004 г.
4. Патент РФ №2240135, МПК А61К 39/00, публикация 20.11.2004 г.
5. Берченко Г.Н., Снетков А.И., Жердев К.В. Использование инъецируемого коллапан-геля для активизации процессов репаративного остеогенеза / Травматология и ортопедия России. - 2006 г., №2. - С.44.
6. Патент РФ №2241399, МПК А61В 17/56, публикация 10.12.2004 г.
7. Ясенчук Ю.Ф. Структура и свойства пористых сплавов на основе никелида титана: Автореф. дисс. канд. физ.-мат. наук. - Томск, 2002 г.
8. Алабут А.В. Экспериментальные исследования остеогенеза при пластике костных дефектов пористым никелидом титана / А.В.Алабут, В.Д.Сикилинда, Г.Л.Плоткин, А.А.Домашенко // Биоматериалы и имплантаты с памятью формы: Материалы / Международная конференция. - Томск, 2001. - С.357-358.
9. Заявка РФ №2003109960 на изобретение, МПК А61В 17/00, публикация 31.10.2004 г., прототип.
10. Г.Ц.Дамбаев, В.Э.Гюнтер и др. Пористые проницаемые сверхэластичные имплантаты в хирургии. Томск, 1996 г., с.10-15.
11. Патент РФ №2178277 на изобретение, МПК А61С 13/00, А61К 6/00, публикация 20.01.2002 г.
12. С.Н.Савельев, П.В.Афонин и др. Первый опыт применения богатой тромбоцитами аутоплазмы в лечении повреждений и заболеваний костно-мышечной системы / в сб. тезисов IX Съезда травматологов и ортопедов. - Саратов, 2010 г., с.1136-1137.
13. Гюнтер В.Э. и др. Медицинские материалы и имплантаты с памятью формы. - Томск.: Томский университет. 1998 г. - С.181-183.
1. Способ лечения импрессионного перелома метаэпифизарного отдела трубчатой кости, включающий формирование в полости костного дефекта слоя из крупинок пористого никелида титана, отличающийся тем, что слой крупинок пористого никелида титана, образующий губчатую часть имплантата, формируют по толще слоя губчатой кости в выемке дефекта, а затем устанавливают на губчатую часть монолитную часть имплантата из пористого никелида титана, при этом обе части имплантата перед установкой предварительно насыщают богатой тромбоцитами аутоплазмой и антибиотиком при соотношении объемов 1:1, а после окончательной репозиции суставной поверхности фиксируют перелом поддерживающей пластиной и компрессирующими винтами.
2. Способ по п.1, отличающийся тем, что в состав губчатой части имплантата дополнительно вводят мелкие отломки аутокости.