Получение вакцин, содержащих поверхностный антиген вируса гепатита в и поверхностно-активное вещество
Иллюстрации
Показать всеИзобретение относится к области медицины и фармакологии и представляет собой способ получения комбинированной вакцины, где вакцина содержит: (i) неионогенное поверхностно-активное вещество, которое включает поли(оксиэтен)овые остатки, где неионогенное поверхностно-активное вещество присутствует в вакцине в количестве ≤30 мкг/мл; (ii) поверхностный антиген (HBsAg) вируса гепатита В (HBV), где HBsAg присутствует в вакцине в количестве <60 мкг/мл; и (iii) антиген по меньшей мере из одного не-HBV-патогена, где по меньшей мере один не-HBV-патоген включает C.diphtheriae и C.tetani; и антигены из этих двух патогенов представляют собой дифтерийный анатоксин и столбнячный анатоксин; и где способ включает: (i) очистку поверхностного антигена HBV от рекомбинантных дрожжевых клеток, где очистка включает в себя стадию, на которой дрожжевые клетки разрушают в присутствии неионогенного поверхностно-активного вещества, с образованием очищенного HbsAg-компонента; и (ii) объединения очищенного HBsAg-компонента по меньшей мере с одним дополнительным антигеном из не-HBV-патогена, с получением комбинированной вакцины. Изобретение обеспечивает снижение риска контаминации и времени, затрачиваемого на изготовление вакцины. 6 н. и 39 з.п. ф-лы, 7 табл., 12 ил.
Реферат
Все упомянутые здесь документы включены сюда в полном объеме в виде ссылки.
Область техники
Настоящее изобретение относится к способам получения комбинированных вакцин, где вакцины содержат смешанные иммуногены из более чем одного патогена, так что введение вакцины приводит к одновременной иммунизации субъекта против более чем одного патогена. В частности, изобретение касается применения поверхностно-активных веществ при получении комбинированных вакцин.
Уровень техники
Вакцины, содержащие антигены из более чем одного патогенного организма в пределах одной дозировки, известны как "поливалентные", или "комбинированные" вакцины. В Европе и США были одобрены для использования человеком различные комбинированные вакцины, включая в себя трехвалентные вакцины против дифтерии, столбняка и коклюша (вакцины "DTP") и трехвалентные вакцины против кори, свинки и краснухи (вакцины "MMR").
Преимущество комбинированных вакцин заключается в уменьшении количества инъекций пациентам, что приводит к клиническому преимуществу в связи с повешенной восприимчивостью (например, см. главу 29 документа 1), особенно в случае вакцинации детей. Однако при этом существуют трудности в изготовлении, возникающие из-за ряда факторов, включая физическую и биохимическую несовместимость антигенов и других компонентов; иммунологическое взаимодействие и стабильность.
Включение неантигенных компонентов в вакцины необходимо, но может вызвать трудности. В комбинированных вакцинах поверхностно-активные вещества представляют собой определенную проблему, потому что для оптимальной активности одного антигена требуется поверхностно-активное вещество, тогда как для другого наличие поверхностно-активного вещества может сказываться отрицательно. Кроме того, включение поверхностно-активных веществ в вакцины для детей вызывает сложности для некоторых групп пациентов, даже при том, что поверхностно-активное вещество считается безопасным.
Особенный интерес в области вакцин представляют поверхностно-активные вещества сложных эфиров полиоксиэтиленсорбитана, особенно такие как полисорбат 20 (также известный как 'Tween 20', или полиоксиэтиленсорбитанмонолаурат) и полисорбат 80 (также известный как 'Tween 80', или полиоксиэтиленсорбитанмоноолеат). Полисорбат 20 включен в моновалентную вакцину гепатита А HAVRIX™, а полисорбат 80 включен в комбинированные вакцины, такие как вакцины серии TRIPEDIA™ и INFANRIX™. Эти два поверхностно-активных вещества также используют для стабилизации жидких ротавирусных вакцин [2].
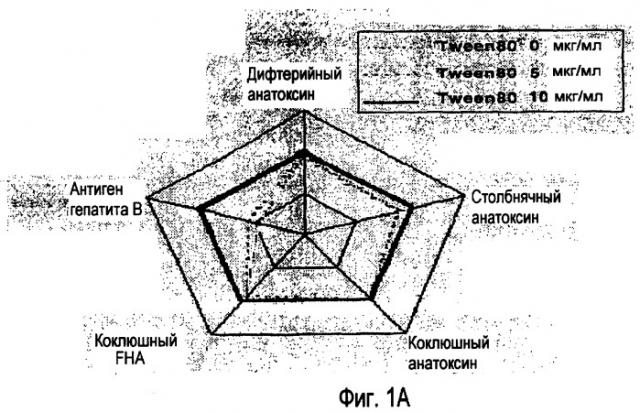
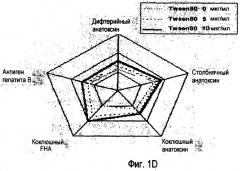
Полисорбаты используют также при получении комбинированных вакцин, которые содержат поверхностный антиген гепатита B ('HBsAg'); например, в документах 3 и 4 раскрыт способ получения четырехвалентной вакцины D-T-P-HBsAg, в которой отсутствует взаимодействие с фосфолипидным компонентом HBsAg за счет добавления неионогенного поверхностно-активного вещества, такого как Tween 20, Tween 80 или Triton X-100. По данным на фигуре 2 документов 3 и 4 (здесь фигура 1) видно, что поверхностно-активное вещество требуется для поддержания антигенности HBsAg, но является менее важным для других компонентов. Самая высокая измеренная концентрация поверхностно-активного вещества составляла 10 мкг/мл при 20 мкг/мл HBsAg, и это обеспечивало наилучшую антигенность.
Согласно способу, описанному в документах 3 и 4, неионогенный детергент добавляли после очистки HBsAg. Однако добавление детергентов после очистки HBsAg не является оптимальным, поскольку это требует отдельной стадии во время получения, которая увеличивает время процесса и также увеличивает риск контаминации HBsAg. При использовании контаминированного компонента при получении комбинированной вакцины возможные потери оказываются большими, чем при получении моновалентных вакцин, например, если контаминированный компонент HBsAg смешивают с чистым D-T-P-компонентом, то вся смесь D-T-P-HBsAg должна быть признана негодной, а не только HBsAg.
Для комбинированных вакцин, содержащих неионогенные поверхностно-активные вещества, существует потребность в способах получения, в которых поверхностно-активное вещество не добавляют в виде отдельного компонента во время выполнения способа.
Краткое описание изобретения
Вместо того, чтобы добавлять неионогенные поверхностно-активные вещества к антигенам после того, как они были очищены [3, 4], в настоящем изобретении их используют во время очистки антигена. Таким образом, поверхностно-активное вещество может выполнять свою функцию в конечной комбинированной вакцине, но риск контаминации снижается (а значит, и риск потери всей комбинированной вакцины после получения).
Таким образом, изобретение обеспечивает способ получения комбинированной вакцины, где вакцина включает в себя (i) неионогенное поверхностно-активное вещество, (ii) поверхностный антиген вируса гепатита B (HBV) и (iii) антиген по меньшей мере из одного не-HBV-патогена, и где способ включает в себя (i) очистку поверхностного антигена HBV от рекомбинантных дрожжевых клеток, где очистка включает в себя стадию, в которой дрожжевые клетки разрушаются в присутствии неионогенного поверхностно-активного вещества, с получением очищенного компонента HBsAg; и (ii) объединение очищенного компонента HBsAg по меньшей мере с одним дополнительным антигеном из не-HBV-патогена, для получения комбинированной вакцины.
Для предотвращения описанных выше проблем, связанных с контаминацией, способ не включает в себя стадию добавления неионогенного поверхностно-активного вещества как отдельного компонента после очистки HBsAg. Возможно присутствие поверхностно-активного вещества (или других поверхностно-активных веществ, ионных или неионных) в других компонентах антигена, с которыми объединяют HBsAg, для получения комбинированной вакцины, но не должно происходить добавление поверхностно-активного вещества как самостоятельного отдельного компонента. Таким образом, поверхностно-активное вещество не добавляется в виде отдельного компонента к очищенному компоненту HBsAg, и оно не добавляется во время объединения антигенов.
Изобретение также обеспечивает способ получения комбинированной вакцины, где вакцина включает в себя (i) неионогенное поверхностно-активное вещество, (ii) поверхностный антиген вируса гепатита B (HBV) и (iii) антиген по меньшей мере из одного не-HBV-патогена, и где способ включает в себя стадию объединения очищенного поверхностного антигена HBV по меньшей мере с одним дополнительным антигеном из не-HBV-патогена, с получением комбинированной вакцины, где очищенный поверхностный антиген HBV был получен способом, при котором рекомбинантные HBsAg-экспрессирующие дрожжевые клетки разрушают в присутствии неионогенного поверхностно-активного вещества. И снова, поверхностно-активное вещество отдельно не добавляют.
Изобретение также обеспечивает иммуногенную композицию, включающую в себя (i) неионогенное поверхностно-активное вещество, (ii) поверхностный антиген вируса гепатита B (HBV) и (iii) антиген по меньшей мере из одного не-HBV-патогена, где поверхностный антиген HBV был получен способом, при котором рекомбинантные HBsAg-экспрессирующие дрожжевые клетки разрушают в присутствии неионогенного поверхностно-активного вещества. И снова, HBsAg был получен без отдельного добавления поверхностно-активного вещества. Этот продукт можно отличить от продуктов, где HBsAg был получен другими способами, поскольку неионогенное поверхностно-активное вещество, использованное при очистке, сохраняется в частице HBsAg.
Неионогенное поверхностно-активное вещество
Согласно изобретению, можно использовать различные неионогенные поверхностно-активные вещества [5], и, в частности, те, которые обычно используются в вакцинных препаратах. Предпочтительными являются органические поверхностно-активные вещества. Обычно они представляют собой продукт реакции алкиленоксида (например, этиленоксида) со спиртом жирного ряда, жирной кислотой, алкилфенолом, алкиламином или другим соответствующим соединением, имеющим по меньшей мере один активный водородный атом. Для большинства поверхностно-активных веществ обычно длина углеродной цепи спирта, амина и кислоты составляет С8-С18. Обычные алкилфенолы представляют собой нонилфенол и октилфенол. Особенно предпочтительными являются поверхностно-активные вещества, содержащие поли(оксиэтен)ые остатки.
Например, согласно изобретению, могут быть использованы без ограничения следующие поверхностно-активные вещества: поверхностно-активные вещества сложных эфиров полиоксиэтиленсорбитана (обычно называемые Tween), в частности, полисорбат 20 и полисорбат 80; сополимеры этиленоксида (EO), пропиленоксида (PO), и/или бутиленоксида (BO), продаваемые под товарным знаком DOWFAX™, такие как линейные блок-сополимеры EO/PO; октоксинолы, с варьируемым числом повторов этокси(окси-1,2-этанедил)ьных групп, с октоксинолом-9 (Triton X-100 или t-октилфеноксиполиэтоксиэтанол) является особенно интересным; (октилфенокси)полиэтоксиэтанол (IGEPAL CA-630/NP-40); полиоксиэтилированные жирные эфиры, производные лаурилового, цетилового, стеарилового и олеилового спиртов (известные как поверхностно-активные вещества Brij), такие как монолауриловый простой эфир триэтиленгликоля (Brij 30); и сложные эфиры сорбитана (обычно называемые SPAN), такие как триолеат сорбитана (Span 85) и сорбитанмонолаурат.
Согласно изобретению, в частности, может быть использован полисорбат 20. Это поверхностно-активное вещество имеет установленный профиль безопасности при введении человеку, включая профиль безопасности в случае вакцин.
Поверхностно-активные вещества могут быть классифицированы по их ГЛБ (гидрофильно-липофильный баланс). Предпочтительные поверхностно-активные вещества согласно изобретению имеют ГЛБ по меньшей мере 10, предпочтительно, по меньшей мере 15, и более предпочтительно, по меньшей мере, 16.
Неионогенное поверхностно-активное вещество является компонентом композиций согласно изобретению. Чтобы избежать введения больших доз поверхностно-активного вещества пациенту, предпочтительные концентрации поверхностно-активного вещества в композиции должны составлять не более 30 мкг/мл, например, ≤25 мкг/мл, ≤20 мкг/мл, ≤15 мкг/мл, ≤10 мкг/мл, ≤5 мкг/мл, и т.д. Предпочтительная концентрация составляет ≤10 мкг/мл.
В качестве альтернативного варианта определения концентрации поверхностно-активного вещества, предпочтительное количество поверхностно-активного вещества в композиции должно составлять меньше чем 50 мкг (например, ≤40 мкг, ≤30 мкг, ≤25 мкг, ≤20 мкг, ≤15 мкг, ≤10 мкг, и т.д.) на каждые 100 мкг HBsAg. Аналогично, в документах 3 и 4 предлагается, что массовое соотношение поверхностно-активное вещество:HBsAg составляет меньше чем 50%. Предпочтительным является меньше чем 25 мкг поверхностно-активного вещества на 100 мкг HBsAg.
Как будет подробно описано ниже, в предпочтительном способе согласно изобретению способов используют предварительно смешенный компонент, включающий в себя анатоксины столбняка и дифтерии. Предпочтительно, этот D-T-компонент по существу не содержит неионогенные поверхностно-активные вещества, и, в частности, не содержит полисорбаты 20 и 80. Аналогично, предварительно смешанный D-T-Pw-компонент не содержит неионогенные поверхностно-активные вещества, например, полисорбаты 20 и 80.
Поверхностные антигены вируса гепатита В
Вирус гепатита В (HBV) является одним из известных агентов, вызывающих вирусный гепатит. Вирион HBV состоит из внутреннего ядра, окруженного внешней белковой оболочкой или капсидом, а вирусное ядро содержит вирусный геном ДНК. Основным компонентом капсида является белок, известный как поверхностный антиген HBV или, более часто, 'HBsAg', который типично представляет собой полипептид с 226 аминокислотами с молекулярной массой ~24 кДа. Все существующие вакцины от гепатита B содержат HBsAg, и при введении этого антигена нормальному вакцинируемому пациенту, он стимулирует выработку анти-HBsAg антител, которые предохраняют против HBV инфекции.
Для получения вакцины HBsAg может быть получен двумя способами. Первый способ включает в себя выделение антигена в форме частиц из плазмы носителя хронического гепатита B, поскольку при HBV инфекции большие количества HBsAg синтезируются в печени и высвобождаются в кровоток. Второй путь включает в себя экспрессию белка методами рекомбинантных ДНК. Для применения в способе согласно изобретению HBsAg представляет собой рекомбинантно экспрессированный в дрожжевых клетках. Подходящие дрожжи включают в себя Saccharomyces (такие как S.cerevisiae) или Hanensula (такие как H.polymorpha) клетки-хозяева.
В отличие от нативного HBsAg (т.е. выделенного из плазмы продукта), экспрессированный дрожжами HBsAg в общем случае является негликозилированным, и он представляет собой наиболее предпочтительный вид HBsAg для использования согласно изобретению. Экспрессированный дрожжами HBsAg является высоко иммуногенным и может быть получен без риска контаминации продукта крови.
В общем случае HBsAg представлен в виде по существу сферических частиц (средний диаметр приблизительно 20 нм), включая в себя липидный матрикс, включающий в себя фосфолипиды. Экспрессированные дрожжами частицы HBsAg могут включать в себя фосфатидилинозитол, который не обнаружен в природных вирионах HBV. Также частицы могут включать в себя нетоксичное количество ЛПС для стимуляции иммунной системы [6].
Предпочтительный HBsAg - из HBV подтипа adw2.
В данной области известно множество способов очистки HBsAg (например, см. документы 7-33). Эти способы раскрывают получение моновалентных препаратов HBsAg, но, в отличие от способа, раскрытого в документах 3 и 4, ни один из них не относится к очистке HBsAg, особенно для использования в комбинированных вакцинах. Любой из этих и других способов может быть использован, при условии, что способ является подходящим для очистки антигена после экспрессии в рекомбинантных дрожжевых клетках, где очистка включает в себя стадию, в которой дрожжевые клетки разрушаются в присутствии неионогенного поверхностно-активного вещества.
Предпочтительный способ очистки HBsAg после разрушения клетки включает в себя: ультрафильтрацию; эксклюзионную хроматографию; анионообменную хроматографию; ультрацентрифугирование; обессоливание; и стерильную фильтрацию. Лизаты могут осаждаться после разрушения клетки (например, используя полиэтиленгликоль), оставляя HBsAg в растворе, готовом для ультрафильтрации.
После очистки HBsAg может быть подвергнут диализу (например, с цистеином), который может быть использован для удаления ртутных консервантов, таких как тимеросал, который может быть использован во время получения HBsAg [30, 34].
Количества HBsAg обычно выражены в микрограммах, и обычное количество HBsAg на вакцинную дозу составляет 10 мкг.
Кроме 'S' последовательности, поверхностный антиген может включать в себя всю или часть pre-S последовательности, такую как всю или часть pre-S1 и/или pre-S2 последовательности.
Антигены не-HBV
Иммуногенные композиции согласно изобретению включают в себя по меньшей мере один защитный антиген по меньшей мере из одного не-HBV-патогена. Не-HBV-патоген(ы) могут быть вирусными и/или бактериальными.
Типичные вирусные патогены без ограничения включают в себя: полиовирус; вирус гепатита А; вирус гриппа; вирус кори; вирус свинки; вирус краснухи; и вирус ветряной оспы.
Типичные бактериальные патогены без ограничения включают в себя: Corynebacterium diphtheriae, Clostridium tetani, Bordetella pertussis; Haemophilus influenzae, включая тип b и нетипируемые штаммы; Neisseria meningitidis, включая серотипы A, B, C, W135 и/или Y; Streptococcus pneumoniae, включая серотипы 4, 6B, 9V, 14, 18C, 19F и 23F; и Moraxella catarrhalis.
Corynebacterium diphtheriae вызывает дифтерию. Дифтерийный токсин может быть обработан (например, формалином или формальдегидом) для удаления токсичности, при этом сохраняется способность вызывать выработку специфических антител против токсина после инъекции. Такие дифтерийные анатоксины используют в противодифтерийных вакцинах, и они более подробно раскрыты в главе 13 документа 1. Предпочтительными дифтерийными анатоксинами являются таковые, полученные посредством обработки формальдегидом. Дифтерийный анатоксин может быть получен культивированием C.diphtheriae в питательной среде (например, среда Фентона или среда Линггода и Фентона), в которую может быть добавлен бычий экстракт, с последующей обработкой формальдегидом, ультрафильтрацией и осаждением. Затем токсоидный материал может быть обработан методами, включающими в себя стерильную фильтрацию и/или диализ.
Clostridium tetani вызывает столбняк. Столбнячный токсин может быть обработан для получения защитного анатоксина. Такие анатоксины используют в вакцинах против столбняка и более подробно они раскрыты в главе 27 документа 1. Предпочтительными столбнячными анатоксинами являются таковые, полученные посредством обработки формальдегидом. Столбнячный анатоксин может быть получен культивированием C.tetani в питательной (например, среда Латама, полученная из коровьевого казеина) с последующей обработкой формальдегидом, ультрафильтрацией и осаждением. Затем материал может быть обработан методами, включающими в себя стерильную фильтрацию и/или диализ.
Bordetella pertussis вызывает коклюш. Коклюшные антигены в вакцинах являются либо клеточными (целая клетка, в виде инактивированной клетки B.pertussis), либо бесклеточными ('aP'). Препараты клеточных коклюшных антигенов широко описаны в литературе [например, см., глава 21 документ 1], например, они могут быть получены инактивацией нагреванием фазы I культуры B. pertussis. В случае, если используют бесклеточные антигены, то включают один, два или (предпочтительно) три из следующих антигенов: (1) детоксифицированный коклюшный токсин (коклюшный анатоксин или 'PT'); (2) филаментный гемагглютинин ('FHA'); (3) пертактин (также называемый как 'белок наружной мембраны 69 килоДальтон'). Эти три антигена, предпочтительно, готовят выделением из культуры B.pertussis, выращенную в модифицированной жидкой среде Stainer-Scholte. PT и FHA могут быть выделены из ферментационного бульона (например. адсорбцией на гидроксиапатитном геле), тогда как пертактин может быть экстагирован из клеток посредством термической обработки и флокуляции (например, используя хлорид бария). Антигены могут быть очищены при использовании поочередных стадий хроматографии и/или осаждения. PT и FHA могут быть очищены гидрофобной хроматографией, афинной хроматографией и эксклюзионной хроматографией. Пертактин может быть очищен ионообменной хроматографией, гидрофобной хроматографией и эксклюзионной хроматографией. FHA и пертактин могут быть обработаны формальдегидом перед использованием согласно изобретению. PT, предпочтительно, детоксифицирован обработкой формальдегидом и/или глютаральдегидом. В качестве альтернативы химической детоксикации PT может представлять собой мутантный PT, в котором ферментативная активность уменьшена за счет мутагенеза [35], но предпочтительным является химическая детоксикация.
Haemophilus influenzae типа ('Ηib') вызывает бактериальный менингит. Обычно, вакцины Hib в основе содержат капсульный сахаридный антиген [например, глава 14 документа 1], такие препараты широко описаны в литературе [например, документы 36-45]. Сахарид конъюгирован Hib с белком-носителем для усиления иммуногенности, особенно для детей. Обычные белки-носители представляют собой столбнячный анатоксин, дифтерийный анатоксин, производное дифтерийного анатоксина CRM197, белок D Н.influenzae и комплекс наружного белка мембраны менингококков от серологической группы B. Столбнячный анатоксин является предпочтительным носителем, и используется в продукте, обычно называемом 'PRP-T'. PRP-T может быть получен активацией бромцианом капсульного полисахарида Hib, соединяя активированный сахарид с линкером адипиновой кислоты (такие как (1-этил-3-(3-диметиламинопропил) карбодиимид), обычно гидрохлоридная соль), и затем проводят реакцию линкер-сахаридного комплекса с белком-носителем столбнячного анатоксина. Сахаридная часть конъюгата может включать в себя непроцессированный полирибозилрибит фосфат (PRP), полученные из бактерий Hib, и/или фрагменты непроцессированного PRP. Могут быть использованы конъюгаты с соотношением (вес./вес.) сахарид:белок составляющим между 1:5 (т.е. избыток белка) и 5:1 (т.е. избыток сахарида), например, соотношение, составляющее между 1:2 и 5:1, и соотношение, составляющее между 1:1,25 и 1:2,5. Однако в предпочтительных вакцинах соотношение сахарида к белку-носителю по весу составляет между 1:2,5 и 1:3,5. В вакцинах, где столбнячный анатоксин присутствует к качестве как антигена, так и как белка-носителя соотношение сахарида к белку-носителю по весу в конъюгате может составлять между 1:0,3 и 1:2 [46]. Введение конъюгата Hib, предпочтительно, приводит к концентрации против-PRP антитела составляющей ≥0,15 мкг/мл, и более, предпочтительно, ≥1 мкг/мл, и это является стандартными пороговыми реакциями.
Neisseria meningitidis вызывает бактериальный менингит. На основе капсульного полисахарида организма были идентифицированы различные серологические группы N.meningitidis, включая в себя A, B, C, Н, I, K, L, 29E, W135, X, Y и Z. Серологическими группами, наиболее ассоциируемыми с заболеванием, являются A, B, C, W135 и Y. Существующие вакцины против серологических групп A, C, W135 и Y имеют в основе капсульные сахаридные антигены, но этот принцип не подходит для серологической группы B, вместо них используют белковые антигены и носители наружной мембраны. Капсульные сахариды конъюгированы с белками-носителями для усиления иммуногенности. Типичными белками-носителями являются столбнячный анатоксин, дифтерийный анатоксин, производное дифтерийного анатоксина CRM197 и белкок D H.influenzae. Сахаридная часть конъюгата может включать в себя непроцессированный сахарид, полученный от менингококков, и/или его фрагменты. Сахариды серогруппы C могут быть получены как от OAc+, так и от OAc-штаммов. Для сахаридов серогруппы А, предпочтительно, по меньшей мере 50% (например, по меньшей мере 60%, 70%, 80%, 90%, 95% или более) маннозаминных остатков O-ацетилированы по положению C-3. Менингококковые конъюгаты с сахаридом:белком с соотношением (вес./вес.) между 1:10 (то есть избыток белка), и 10:1 (т.e. избыток сахарида) могут быть использованы например, соотношения между 1:5 и 5:1, между 1:2,5 и 2,5:1, или между 1:1,25 и 1,25:1. Введение конъюгата, предпочтительно, приводит к увеличению титра в серологическом бактерицидном анализе (SBA) для релевантной серогруппы по меньшей в 4 раза, и, предпочтительно, по меньшей мере в 8 раз. Титры SBA можно измерять, используя комплемент детеныша кролика или человеческий комплемент [47].
Streptococcus pneumoniae вызывает бактериальный менингит. Что касается Hib и менингококков, то существующие вакцины имеют в основе капсульные сахариды. Предпочтительно, включать сахариды от более чем одного серотипа С.pneumoniae и особенно от по меньшей мере серотипов 6B, 14, 19F и 23F. Другие серотипы, предпочтительно, выбирают из: 1, 3, 4, 5, 7F, 9V и 18C. Например, широко используются смеси полисахаридов от 23 различных серотипов, а также конъюгированные вакцины с полисахаридами из от 5 до 11 различных серотипов [48]. Например, PrevNar™ [49] содержит конъюгированные антигены от семи серотипов (4, 6B, 9V, 14, 18C, 19F, и 23F). Сахариды, предпочтительно, конъюгированы с белками-носителями [например, документы 50-52]. Типичными белками-носителями являются столбнячный анатоксин, дифтерийный анатоксин, производное дифтерийного анатоксина CRM197, и белок D H.influenzae.
Сахариды в продукте PrevNar™ отдельно конъюгированы с CRM197 восстановительным аминированием по 2 мкг каждого сахарида на 0,5 мл дозу (4 мкг серотипа 6B). В качестве альтернативы использования сахаридных антигенов от пневмококка, композиция может включать в себя один или более полипептидных антигенов. Доступны геномные последовательности для нескольких штаммов пневмококка [53, 54] и могут быть подвергнуты обратному вакцинологическому анализу [55-58] для идентификации подходящих полипептидных антигенов [59, 60]. Например, композиция может включать в себя один или более из следующих антигенов: PhtA, PhtD, PhtB, PhtE, SpsA, LytB, LytC, LytA, Sp125, Sp101, Sp128, Sp130 и Sp130, как указано в документе 61. Композиция может включать в себя более чем один (т.е. 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14) указанных антигенов. В некоторых вариантах выполнения изобретения, композиция может включать в себя как сахарид, так и полипептидные антигены от пневмококка. Они могут быть использованы как простая смесь, или пневмококковый сахаридный антиген может быть конъюгирован с пневмококковым белком. Соответствующие белки-носители для таких вариантов выполнения изобретения включают в себя пневмококковые белковые антигены, упомянутые выше [61].
Moraxella catarrhalis вызывает средний отит и синусит, и является нетипичной причиной ларингита. В настоящее время вакцины исследуются, как сообщается в документе 62.
Как и HBV, HAV вызывает гепатит. Вакцины HAV раскрыты в главе 15 документа 1. Предпочтительный компонент HAV имеет в основе инактивированный вирус, и инактивация может быть проведена обработкой формалином. Вирус может быть выращен на эмбриональных диплоидных фибробластах человека, таких как MRC-5 клетки. Предпочтительным штаммом HAV является HM175, хотя также может быть использован CR326F. Клетки выращивают в условиях, обеспечивающих рост вируса. Клетки лизируют, и полученную суспензию можно очищать ультрафильтрацией и гель-проникающей хроматографией.
Полиовирус вызывает полиомиелит. Вместо того, чтобы использовать пероральную вакцину полиовируса, в изобретении используется инактивированная вакцина вируса полиомиелита (IPV), как раскрыто более подробно в главе 24 документа 1. Полиовирусы могут быть выращены в клеточной культуре, и предпочтительная культура из клеточной линии Vero, полученной из почки обезьяны. Для удобства клетки Vero могут быть культивированы на микроносителях. После выращивания вирионы могут быть очищены, используя методы ультрафильтрации, диафильтрации и хроматографии. Перед введением пациентам полиовирусы должны быть инактивированы, это осуществляют обработкой формальдегидом. Полиомиелит может быть вызван одним из трех типов полиовируса. Эти три типа похожи и вызывают идентичные симптомы, но они значительно различаются антигенами, и заражение одним типом не предохраняет против заражения другими. Поэтому согласно изобретению, предпочтительно, использовать три полиовирусных антигена: полиовирус типа 1 (например, штамм Mahoney), полиовирус типа 2 (например, штамм MEF-I), и полиовирус типа 3 (например, штамм Saukett). Вирусы, предпочтительно, выращивают, очищают и инактивируют по отдельности, и затем объединяют, получая трехвалентную смесь для использования согласно изобретению. Количество IPV обычно выражают в 'DU' единицах ("единица D-антигена" [63]).
Антигены, предохраняющие против вирусов кори, свинки и краснухи, обычно являются живыми вирусами, которые содержатся в известных моновалентных и трехвалентных вакцинах ('MMR'). Вакцины вируса кори описаны более подробно в главе 19 документа 1. Вакцины вируса свинки описаны более подробно в главе 20 документа 1. Вакцины вируса краснухи описаны более подробно в главе 26 документа 1. Типичсный штамм вируса кори включает в себя: Moraten; Connaught; Schwarz; Edmonston-Zagreb; CAM-70; AIK-C; TD97; Leningrad-16; Shanghai-191; и т.д. Штаммы Schwarz и Moraten наиболее часто используемые в США и Европе. Типичный штамм вируса свинки включает в себя: Jeryl Lynn; RIT 4385; Urabe; Hoshino; Rubini; Leningrad-3; Leningrad-Zagreb; Miyahara; Torii; NK M-46; S-12 и т.д. Штаммы Jeryl Lynn, RIT 4385, Urabe и Leningrad-Zagreb наиболее часто повсеместно используемые. Типичный штамм вируса краснухи включает в себя: RA27/3; Matsuba; TCRB 19; Takahashi; Matsuura; TP-336 и т.д. Штамм RA27/3 наиболее часто используемый на западе.
Антигены VZV, предохраняющие против ветрянки, обычно являются живыми вирусами, основанными на штаммах вируса Oka. Вакцины VZV описаны более подробно в главе 28 документа 1.
Антигены вируса гриппа описаны более подробно в главах 17 и 18 документа 1. В широком понимании вакцины вируса гриппа могут быть основаны на живом вирусе или инактивированном вирусе, и инактивированные вакцины могут быть основаны на целом вирусе, 'расщепленном' вирусе или на очищенных поверхностных антигенах (включая гемагглютинин и нейраминидазы). Вирусы, использованные для получения вакцины, могут быть выращены как на яйцах, так и на культуре клеток. Вакцинные штаммы вируса гриппа изменяются от сезона к сезону. В настоящий межпандемический период вакцины обычно включают в себя два штамма гриппа (H1N1 и H3N2) и один штамм гриппа B, и обычными являются трехвалентные вакцины. Также могут быть использованы согласно изобретению вирусы от пандемичных штаммов (то есть штамм, к которому вакцинный реципиент и большая часть человеческой популяции являются иммунологически наивными), такие как штаммы подтипов H2, H5, H7 или H9 (в частности, вирус гриппа А), и вакцины от гриппа для пандемичных штаммов могут быть моновалентные или могут быть основаны на обычной трехвалентной вакцине, дополненной пандемичным штаммом. Вирус гриппа может быть химерным штаммом, и может быть получен методами "обратной генетики". Вирус может быть аттенюирован. Вирус может быть чувствительным к изменению температуры. Вирус может быть адаптирован к холоду.
Антигенные компоненты от этих патогенов для использования в вакцинах обычно обозначают упрощенными названиями: 'D' для дифтерийного анатоксина; 'T' для столбнячного анатоксина; 'P' для коклюшного антигена, где 'Pa' для ацеллюлярного и 'Pw' для клеточного; 'Hib' для капсульного сахарида b H.influenzae; 'MenA', 'MenB', 'MenC', MenW и 'MenY' для соответствующих менингококковых серогрупп; 'IPV' для инактивированного полиовируса и 'Spn' для пневмококка.
При объединении антигенных компонентов с HBsAg для получения поливалентной композиции, антигены могут быть добавлены по отдельности, или они могут быть заранее смешаны, перед объединением с HBsAg. В случае если используют D и T антигены, предпочтительно, использование заранее смешанного D-T-компонента. Этот двухвалентный компонент может быть использован в способе согласно изобретению, например, он может быть объединен HBsAg для получения трехвалентного D-T-HBV-компонента. Как вариант, D-T-компонент может быть объединен с дополнительными антигенами не-HBV (например, с ацеллюлярными коклюшными антигенами), и такой компонент затем может быть объединен с HBsAg, и т.д. В случае если используют антигены D, T и Pw, предпочтительно, использовать заранее смешанный компонент D-T-Pw, и затем использовать этот компонент при выполнении способа согласно изобретению.
В случае включения адъюванта в композицию согласно изобретению, он также может быть добавлен на различных стадиях. Как правило, антигены объединяют с адъювантами до использования в способе согласно изобретению (например, двухвалентная D-T смесь адсорбируют на адъюванте(ах) соли алюминия до использования в способе согласно изобретению, который может быть обеспечен отдельным получением анатоксинов, адсорбируя каждый из них на отдельном адъюванте из гидроксида алюминия, и затем смешивая два адсорбированных анатоксина (необязательно, с дополнительным адъювантом) для получения материала для использования в способе согласно изобретению), но также возможно добавлять адъювант после смешивания антигенов, или добавление антигенов к адъюванту (например, начиная с водного адъюванта, затем добавить антигены, или по отдельности, или заранее смешанные). Как описано ниже, HbsAg-компонент, предпочтительно, адсорбируют на адъюванте из фосфата алюминия до объединения с антигенными компонентами не-HBV.
Предпочтительные композиции согласно изобретению включают в себя по меньшей мере антигены D, T и P (сравни с документами 3 и 4) в дополнение к HBsAg. Особенно предпочтительными являются композиции со следующими комбинациями:
- HBsAg, D, T.
- HBsAg, D, T, Pw.
- HBsAg, D, T, Pw, Hib.
- HBsAg, D, T, Pw, Hib, MenA, MenC.
- HBsAg, D, T, Pw, Hib, MenA, MenC, MenW135.
- HBsAg, D, T, Pw, Hib, MenA, MenC, MenY.
- HBsAg, D, T, Pw, Hib, MenA, MenC, MenW135, MenY.
- HBsAg, D, T, Pa.
- HBsAg, D, T, Pa, Hib.
- HBsAg, D, T, Pa, полиовирус.
- HBsAg, D, T, Pa, полиовирус, Hib.
- HbsAg, D, T, Pa, полиовирус, Hib, MenC.
- HBsAg, D, T, Pa, полиовирус, Hib, MenC, MenA.
- HBsAg, D, T, Pa, полиовирус, Hib, MenC, MenY.
- HbsAg, D, T, Pa, полиовирус, Hib, MenC, MenW135.
- HBsAg, D, T, Pa, полиовирус, Hib, MenC, MenA, MenW135, MenY.
- HBsAg, Hib.
- HBsAg, вирус гепатита А.
Эти композиции могут состоять из вышеперечисленных антигенов или дополнительно могут включать в себя антигены от других патогенов. Таким образом, они могут быть использованы отдельно или как компоненты дополнительных вакцин.
В некоторых вариантах выполнения изобретения композиция не является 5-валентной D-T-Pa-HBV-IPV [30]. Таким образом, композиция может включать в себя компонент Pw и/или по меньшей мере один конъюгат.
Адъюванты
Предпочтительные иммуногенные композиции согласно изобретению включают в себя адъювант, и этот адъювант, предпочтительно, включает в себя одну или более солей алюминия, и, в частности, адъювант из фосфата алюминия и/или адъювант из гидроксида алюминия.
Антигенные компоненты, используемые в способе согласно изобретению, предпочтительно, должны включать в себя алюминиевые адъюванты до использования в способе, т.е. они 'предварительно смешиваются' или 'предварительно адсорбируются' с адъювантом(ами).
В композициях, включающих в себя HBsAg и дифтерийный анатоксин, дифтерийный анатоксин может быть адсорбирован на адъюванте из гидроксида алюминия.
В композициях, включающих в себя HBsAg и столбнячный анатоксин, столбнячный анатоксин может быть адсорбирован на адъюванта гидроксида алюминия, но это не является обязательным (например, может быть использован с адсорбцией между 0-10% от общего количества столбнячного анатоксина).
В композициях, включающих в себя HBsAg и цельноклеточный коклюшный антиген, антиген wP, предпочтительно, объединен с адъювантом из гидроксида алюминия и/или адъювантом из фосфата алюминия.
В композициях, включающих в себя HBsAg и ацеллюлярный коклюшный антиген(ы), коклюшный антиген(ы) может быть адсорбирован на один или более адъювантов из солей алюминия, или может быть добавлен в неадсорбированном состоянии.
В случае, если пертактин присутствует в композиции, то, предпочтительно, он должен быть адсорбирован на адъюванте из гидроксида алюминия до использования в способе согласно изобретению. PT и FHA могут быть адсорбированы на адъюванте из гидроксида алюминия или фосфата алюминия до использования в способе согласно изобретению. В предпочтительных вариантах выполнения изобретения, FHA PT5 и пертактин отдельно предварительно адсорбируются на гидроксиде алюминия до использования в способе согласно изобретению.
В композициях, включающих в себя HBsAg и антигены Hib, конъюгат Hib может быть неадсорбированным, но, предпочтительно, он адсорбирован на адъюванте из фосфата алюминия [64]. Такая адсорбция часто используется в вакцинах, включающих в себя антигены D-T-Pw-Hib-HBsAg. Другие конъюгированные антигены (т.е. менингококки, пневмококки), аналогично могут быть адсорбированы на соли алюминия (например, фосфате) или могут быть неадсорбированы [65].
Антигены IPV обычно не адсорбируют на адъюванты до использования в способе согласно изобретению, но они могут адсорбироваться на алюминиевых адъюванте(ах) других компонентов.
В композиции HBsAg может быть адсорбирован на фосфате алюминия методами, описанными в документе 66. Адсорбция на фосфате алюминия не используется в известном продукте ENGERIX-B™ (в котором HBsAg адсорбирован на гидроксиде алюминия), но присутствует в продуктах HEPACCINE™ и RECOMBIVAX™. Как указано в документе 61, в качестве адъюванта для HBsAg, фосфат алюминия может быть лучше, чем гидроксид алюминия. Хотя в конечной вакцине HBsAg может быть адсорбирован на адъюванте из гидроксида алюминия (как в известном продукте ENGERIX-B™), или может быть неадсорбированным, он, как правило, будет адсорбирован на адъюванте из фосфата алюминия. Кроме того, предпочтительно, его предварительно адсорбируют на фосфате алюминия до использования в способе согласно изобретению.
В случае, если в способе согласно изобретению используется компонент, в котором дифтерийные и столбнячные анатоксины смешаны до объединения с HBsAg, то эта D-T смесь, предпочтительно, содержит адъювант из гидроксида алюминия, на который адсорбированы антигены D и T.
В случае, если в способе согласно изобретению используется компонент, в котором дифтерийный анатоксин, столбнячный анатоксин и цельноклеточный коклюшный антиген смешаны до объединения с HBsAg, то эта D-T-Pw