Способ очистки воздуха от паров аммиака
Иллюстрации
Показать всеИзобретение относится к области очистки воздуха от токсичных летучих веществ и может быть использовано в медицине, ветеринарии, в животноводческих помещениях по обеспечению благоприятного микроклимата, на химических и деревообрабатывающих предприятиях, преимущественно в условиях техногенных аварий. Способ очистки воздуха от паров аммиака заключается в нейтрализации паров аммиака водным раствором 20%-ной лимонной кислоты под давлением 2 атм в течение 2 мин 6-8 раз подряд через каждые 15 минут. Изобретение позволяет очистить воздух от паров аммиака, сохраняя экологию окружающей среды. 5 ил., 16 табл.
Реферат
Изобретение относится к области очистки воздуха от токсичных летучих веществ и может быть использовано в медицине, ветеринарии, в животноводческих помещениях по обеспечению благоприятного микроклимата, на химических и деревообрабатывающих предприятиях, преимущественно в условиях техногенных аварий.
Одним из наиболее аварийно-опасных химических веществ признан аммиак. В масштабах Российской Федерации доля аммиака составляет до 50% химической опасности всего промышленного потенциала.
В случаях аварийных выбросов аммиака поражение людей и животных, оказавшихся в очаге, преимущественно ингаляционное. Аммиак обладает раздражающим и глубоким прижигающим действием. Влияние паров аммиака приводит к нарушению барьерной и транспортной функций легких. Большая площадь всасывательной поверхности легких, малая толщина альвеолярных мембран и интенсивный кровоток обеспечивают быстрое токсическое действие. Через легкие аммиак попадает в малый круг кровообращения, а затем, минуя барьеры печени, в большой круг кровообращения, и разноситься к органам и тканям (Жамгоцев Г.Г. Медицинская помощь пораженным сильнодействующими ядовитыми веществами (СДЯВ) / Г.Г.Жамгоцев, М.Б.Предтеченский. - М.: Медицина, 1993. - 206 с.; Литвинов Н.Н. Проблема острых ингаляционных воздействий аммиака при промышленных авариях / Н.Н.Литвинов, В.И.Казачков, З.П.Григорьевская и др. // Пульмонология. - 1995. - №22. - С.68-72; Лопатин Б.С. Оказание неотложной и квалифицированной медицинской помощи при поражении верхних дыхательных путей аммиаком / Б.С.Лопатин, Т.А.Голубева // Вестник оториноларингологии. - 1995. - №22. - С.44-46).
Высокие концентрации аммиака вызывают обильное слезотечение, ожог конъюнктивы и роговицы, возможна потеря зрения. Возникает ожог слизистой оболочки верхних дыхательных путей с некрозом, отек гортани, ларингоспазм, бронхит, бронхоспазм. В тяжелых случаях развивается геморрагический отек легких. Скрытый период может составлять несколько часов.
В настоящее время для осаждения газа в основном применяется распыление воды (водяная завеса). Местность обеззараживается большим количеством воды (Жамгоцев, Г.Г. Медицинская помощь пораженным сильнодействующими ядовитыми веществами (СДЯВ) / Г.Г.Жамгоцев, М.Б.Предтеченский. - М.: Медицина, 1993. - 206 с.).
Однако предлагаемый способ дает неполную очистку воздуха от паров аммиака, кроме того, при смешивании аммиака с водой образуется щелочь, которая вызывает химический ожог слизистых оболочек и кожи и, как следствие, смывные воды могут попасть в водоем и вызвать его заражение.
Отсутствие эффективных мер по защите населения, животных и окружающей среды стало предпосылкой для создания способа повышенной очистки воздуха от паров аммиака с сохранением экологии окружающей среды.
Поставленная задача решается тем, что в способе очистки воздуха от паров аммиака пары аммиака нейтрализуют водным раствором 20%-ной лимонной кислоты под давлением 2 атм в течение 2 мин 6-8 раз подряд через каждые 15 минут. В результате химического взаимодействия происходит реакция нейтрализации, вследствие которой образуется нетоксичное соединение - цитрат аммония, являющийся безвредной солью лимонной кислоты. Цитрат аммония широко применяется в медицине, фармации, пищевой промышленности.
Лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) (C6H8O7) - кристаллическое вещество белого цвета, температура плавления 153°С. Благодаря наличию спиртового гидроксила лимонная кислота хорошо растворяется в воде, причем растворимость возрастает с повышением температуры, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Слабая трехосновная кислота проявляет общие для всех карбоновых кислот свойства. При нагревании выше 175°С разлагается на углекислый газ и воду. В водном растворе образует хелатные комплексы с ионами кальция, магния, меди, железа и др. Соли и эфиры лимонной кислоты называются цитратами (ГОСТ 908-2004).
Лимонная кислота применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен (в цикле Кребса). Он очищает организм от вредных отравляющих веществ, выводит соли, шлаки, улучшает деятельность органов пищеварения, стимулирует деятельность поджелудочной железы, возбуждает аппетит, способствует усвоению пищи, повышает остроту зрения, улучшает сжигание углеводов в анаэробных условиях, обладает противоопухолевым свойством. Лимонная кислота снижает повышенную кислотность желудочного сока, увеличивает выведение токсинов через кожу, повышает иммунитет, способствует увеличению содержания кальция в организме, нормализует деятельность психо-, нейро-, эндокринной и иммунной систем.
В организме лимонная кислота является главным промежуточным продуктом метаболического цикла трикарбоновых кислот, играет важную роль в системе биохимических реакций клеточного дыхания.
Лимонная кислота и ее соли легко поддаются микробиологической деградации при очистке канализационных вод, что имеет важное экологическое значение.
Способ осуществляли следующим образом.
Исследования по изучению эффективности 20%-ного раствора лимонной кислоты проводили на 32 белых крысах живой массой 180-200 г; 33 кроликах живой массой 2,5-3,0 кг; 20 овцах породы «Прекос» живой массой 20-30 кг, предварительно разделив их поровну на группы: контрольные, опытные и биологического контроля. Животные всех групп на протяжении всего периода исследования находились в одинаковых зоотехнических условиях.
Опыты по затравке животных проводили в специализированной камере объемом 2,3 м3, имеющей систему вытяжной вентиляции, оборудованной 4 испарителем аммиака, установкой для генерирования аэрозоля нейтрализатора (САГ-1) и вентилятором для перемешивания паров аммиака.
Для получения паров аммиака действующее вещество в виде 25%-ного водного раствора вносили в испаритель и подогревали до 60°С. Условия, создаваемые в камере, были максимально приближены к таковым в животноводческих помещениях.
Отбор проб воздуха из камеры проводили через каждые 10 минут в течение 2-х часов. Определение концентрации паров аммиака проводили в различные периоды времени от начала его испарения при помощи универсального газоанализатора УГ-2 и газожидкостного хроматографа «Кристалл 5000.2».
Способ иллюстрируется графиком и гистопрепаратами, представленными на фиг.1-5.
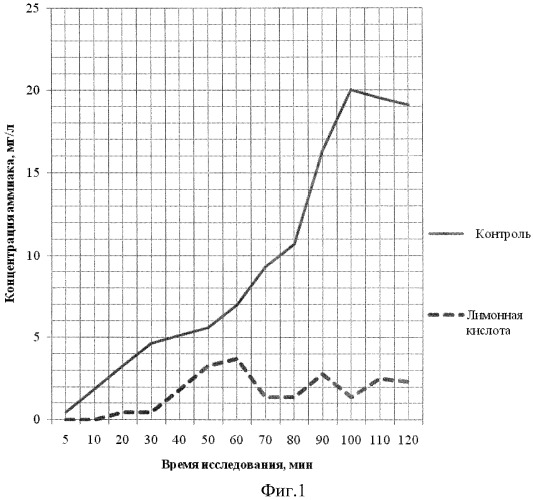
На фиг.1 - представлена зависимость концентрации паров аммиака при применении лимонной кислоты.
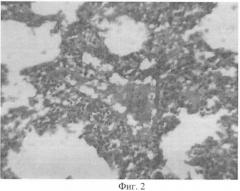
На фиг.2 - представлен гистологический препарат легкого кролика, затравленного парами аммиака в абсолютно смертельной дозе.
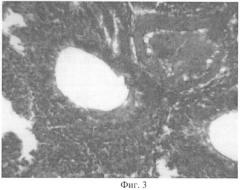
На фиг.3 - представлен гистологический препарат легкого кролика, затравленного парами аммиака в абсолютно смертельной дозе с применением лимонной кислоты.
На фиг.4 - представлен гистологический препарат легкого овцы, затравленной парами аммиака в абсолютно смертельной дозе.
На фиг.5 - представлен гистологический препарат легкого овцы, затравленного парами аммиака в абсолютно смертельной дозе с применением лимонной кислоты.
Экспериментами в контрольном опыте было установлено, что максимальное количество паров аммиака накапливалось на 100 мин испарения и составляло 20 мг/л. В дальнейшем происходило постепенное снижение концентрации паров аммиака.
Для нейтрализации, аэрозоль 20% раствора лимонной кислоты начали генерировать одновременно с испарением аммиака, а затем по 2 мин каждые 15 мин 8 раз.
Как видно из фиг.1, в первые 20 мин концентрация аммиака не высокая и он связывается почти полностью. Затем отмечены колебания его концентраций в пределах 4 мг/л.
Таким образом, в результате проведенных исследований показано, что разработанный способ позволяет почти полностью нейтрализовать пары аммиака.
Исследования по изучению эффективности растворов лимонной кислоты проводили на кроликах породы «Серый великан» массой 2,5-3,0 кг, которые были разделены по принципу аналогов на 5 групп.
| Таблица 1 | ||||
| Эффективность растворов лимонной кислоты при отравлении кроликов парами аммиака в абсолютно смертельной дозе | ||||
| Концентрация, % | Животные, гол. | Выживаемость, % | ||
| Всего | Пало | Выжило | ||
| 50% раствор лимонной кислоты | 5 | 0 | 5 | 100 |
| 40% раствор лимонной кислоты | 5 | 0 | 5 | 100 |
| 30% раствор лимонной кислоты | 5 | 0 | 5 | 100 |
| 20% раствор лимонной кислоты | 5 | 0 | 5 | 100 |
| 15% раствор лимонной кислоты | 5 | 2 | 3 | 60 |
Согласно полученным данным в качестве нейтрализатора паров аммиака в воздухе наиболее эффективными оказались 20-50% водные растворы лимонной кислоты, которые защищали всех опытных животных от смертельной концентрации паров аммиака, превышающих в 800 раз ПДК аммиака в воздухе производственных помещений.
При дегазации паров аммиака 15% раствором лимонной кислоты на 7-е сутки отмечался падеж 2-х кроликов на фоне развития отека легких, истощения, животные неохотно потребляли корм.
Пример 1. Изучение дегазирующей эффективности лимонной кислоты в опытах на крысах. Опыты проводили на белых крысах массой 180-200 г, которые были разделены по принципу аналогов, с учетом живой массы, возраста и пола на 4 группы по 8 голов в каждой. Первая группа служила контролем отравления аммиаком. Животных второй группы отравляли абсолютно смертельной дозой аммиака и для нейтрализации использовали в качестве дегазатора водопроводную воду, которую применяли в виде аэрозоля при помощи струйного аэрозольного генератора (САГ-1). Дегазация проводилась одновременно с началом испарения аммиака в течение 2 мин и через каждые 15 мин 8 раз. При отравлении животных третьей группы в качестве дегазатора использовали 20% раствор лимонной кислоты по аналогичной схеме. Четвертая группа являлась биологическим контролем. Наблюдение за животными вели в течение 20 суток. Результаты опытов представлены в таблице 2.
| Таблица 2 | ||||
| Дегазирующая эффективность лимонной кислоты при отравлении белых крыс абсолютно смертельной дозой аммиака | ||||
| Группа | Животные, гол. | Сроки гибели | ||
| Всего | Выжило | Пало | ||
| Затравка аммиаком | 8 | 0 | 8 | 1,5-8 часов |
| Аммиак + Вода | 8 | 0 | 8 | 2-12 |
| Аммиак + лимонная кислота | 8 | 8 | 0 | --- |
| Биологический контроль | 8 | 8 | 0 | --- |
У крыс контрольной группы признаки интоксикации проявлялись через 2-4 мин в виде беспокойства, чихания. В дальнейшем, через 7-10 мин, животные начинали усиленно «протирать» глаза, нос, хаотично передвигались по камере. Далее признаки интоксикации усиливались, животные забивались в угол, у них проявлялись бронхоспазм, саливация, хрипы, атаксия, тремор, клонико-тонические судороги. Гибель всех животных наступала в течение 1,5-8 часов.
У крыс при отравлении парами аммиака с применением воды первые признаки интоксикации проявлялись через 5-8 мин в виде беспокойства, чихания. В дальнейшем, через 10-15 мин, животные начинали усиленно «протирать» глаза, нос. В дальнейшем признаки интоксикации усиливались, животные забивались в угол, у них проявлялось затрудненное дыхание, саливация, хрипы, атаксия, тремор, клонико-тонические судороги. Гибель всех животных наступала в течение 2-12 часов.
У крыс третьей группы с использованием лимонной кислоты клиническая картина отравления проявлялась через 30-40 мин в виде беспокойства, чихания. Через 50-70 мин животные начинали беспорядочно передвигаться по камере, у них учащалось дыхание. Дальнейшее проявление клинических признаков интоксикации в течение опыта не наблюдалось. Животные через 4-6 час после окончания эксперимента начинали принимать корм и воду. Они адекватно реагировали на внешние раздражители. Случаев гибели не отмечалось.
Общее состояние крыс группы биологического контроля в течение всего срока исследований было удовлетворительным. Они адекватно реагировали на внешние раздражители, активно передвигались по клетке, хорошо поедали корм. Случаев гибели не наблюдалось.
Пример 2. Изучение дегазирующей эффективности лимонной кислоты при затравке кроликов парами аммиака. Животные были разделены по принципу аналогов с учетом возраста, живой массы и пола на 3 группы по 4 головы в каждой. Животные первой группы служили контролем затравки. Кроликов второй группы ингаляционно отравляли парами аммиака, раствор лимонной кислоты использовали одновременно с испарением паров и через каждые 15 мин по 2 мин 8 раз. Третья группа являлась биологическим контролем. Результаты опытов представлены в таблице 3.
| Таблица 3 | ||||
| Нейтрализующая эффективность лимонной кислоты при отравлении кроликов парами аммиака в абсолютно смертельной дозе | ||||
| Группа | Животные, гол. | Сроки гибели | ||
| Всего | Выжило | Пало | ||
| Затравка аммиаком | 4 | 0 | 4 | В течение 2 часов |
| Аммиак + Лимонная кислота | 4 | 4 | 0 | --- |
| Биологический контроль | 4 | 4 | 0 | --- |
Из таблицы 3 видно, что все опытные животные выжили, а контрольные кролики пали.
У контрольных животных через 5-7 мин учащалось дыхание, в дальнейшем, наоборот, происходило снижение ритмов дыхания. Отмечалось раздражение верхних дыхательных путей и роговицы глаз; изо рта и носа выделялась пенистая жидкость, иногда с примесью крови. В дальнейшем, через 25-35 мин, клинические признаки интоксикации усиливались, проявлялись атаксия, тремор, саливация. Гибель всех кроликов на фоне судорог и паралича дыхательного центра наступала в течение 2 часов.
При использовании лимонной кислоты клиническая картина отравления животных проявлялась через 20-30 мин в виде беспокойства, чихания. Через 40-60 мин кролики начинали беспорядочно передвигаться по камере, у них учащалось дыхание, появлялись легкие хрипы. Дальнейшее проявление клинических признаков интоксикации в течение опыта не наблюдалось. Животные через 6-7 ч после окончания эксперимента начинали принимать корм и воду. Они адекватно реагировали на внешние раздражители. Случаев гибели не наблюдалось.
Общее состояние кроликов группы биологического контроля в течение всего срока исследования было удовлетворительным.
Для изучения влияния лимонной кислоты на организм отравленных кроликов исследовали лейкоформулу, количество эритроцитов, лейкоцитов, гемоглобина, скорость оседания эритроцитов, содержание глюкозы, общего белка и его фракций, активность ацетилхолинэстеразы, щелочной фосфатазы, аспартатаминотрансферазы и аланинаминотрансферазы, температуру тела. Результаты исследований представлены в таблицах 4-6.
Из данных, представленных в таблице 4, видно, что у кроликов, отравленных парами аммиака с применением для дегазации лимонной кислоты, количество эритроцитов, лейкоцитов, содержание гемоглобина, скорость оседания эритроцитов оставались в пределах физиологических колебаний.
Показания лейкограммы достоверно не изменялись на всем протяжении опыта.
| Таблица 4 | |||||||
| Гематологические показатели кроликов при отравлении парами аммиака в дозе ЛД100 с использованием дегазатора (n=3) | |||||||
| Показатель | Срок исследования, сут | ||||||
| Исходные значения | 1 | 3 | 7 | 10 | 15 | 20 | |
| Эритроциты, 1012/л | 6,23±1,09 | 6,07±0,76 | 6,18±1,35 | 6,31±0,17 | 6,27±0,15 | 6,24±1,14 | 6,22±1,32 |
| Лейкоциты, 109/л | 8,68±0,65 | 8,45±0,95 | 8,49±0,77 | 8,74±0,86 | 8,71±0,39 | 8,68±0,21 | 8,69±0,48 |
| Гемоглобин, г/л | 116,67±4,72 | 110,88±6,18 | 112,45±4,32 | 115,90±1,01 | 117,20±4,14 | 117,05±2,9 | 116,72±3,15 |
| СОЭ, мм/ч | 1,67±0,41 | 1,85±0,54 | 1,77±0,60 | 1,62±0,20 | 1,63±0,20 | 1,65±0,50 | 1,66±0,58 |
| Палочкоядерные нейтрофилы, % | 7,00±0,00 | 6,67±0,82 | 6,63±0,41 | 6,69±0,82 | 6,97±0,41 | 7,01±0,01 | 6,98±0,68 |
| Сегментоядерные нейтрофилы, % | 36,33±2,68 | 36,67±2,16 | 37,97±3,49 | 36,33±2,49 | 36,27±2,64 | 36,36±3,14 | 36,37±3,05 |
| Эозинофилы, % | 1,67±0,41 | 1,53±2,48 | 1,67±1,08 | 1,77±2,45 | 1,78±3,08 | 1,70±0,41 | 1,68±1,78 |
| Базофилы, % | 1,33±0,82 | 1,33±0,41 | 1,33±0,82 | 1,47±0,41 | 1,40±0,71 | 1,37±0,41 | 1,36±0,62 |
| Моноциты, % | 2,33±0,41 | 2,43±0,41 | 2,34±0,52 | 2,52±0,41 | 2,48±0,62 | 2,35±0,41 | 2,32±0,58 |
| Лимфоциты, % | 51,34±3,49 | 51,37±1,08 | 50,06±3,16 | 51,22±3,12 | 51,10±3,98 | 51,21±4,02 | 51,29±3,67 |
| Таблица 5 | |||||||
| Содержание общего белка и его фракций в сыворотке крови кроликов при отравлении парами аммиака в дозе ЛД100 с использованием дегазатора (n=3) | |||||||
| Показатель | Срок исследования, сут | ||||||
| Исходные значения | 1 | 3 | 7 | 10 | 15 | 20 | |
| Общий белок, г/л | 71,27±3,20 | 67,18±3,59 | 66,75±2,78 | 69,76±2,41 | 71,11±3,96 | 71,29±3,21 | 71,26±3,56 |
| Альбумины, % | 59,73±2,26 | 59,53±2,59 | 58,33±2,86 | 58,87±3,08 | 59,19±2,86 | 59,95±2,71 | 59,82±3,76 |
| α-глобулины, % | 9,67±0,94 | 9,90±1,55 | 11,18±1,18* | 11,13±0,49* | 10,13±0,42 | 10,02±1,26 | 9,79±1,13 |
| β-глобулины, % | 7,90±3,87 | 8,08±5,71 | 8,85±2,91 | 8,93±4,61 | 8,00±0,39 | 7,68±1,60 | 7,53±0,23 |
| γ-глобулины, % | 22,70±4,12 | 22,49±3,08 | 21,64±3,77 | 21,07±1,02 | 22,68±2,89 | 22,35±5,26 | 22,86±2,45 |
| Примечание: * - р≤0,05 |
| Таблица 6 | |||||||
| Биохимические показатели крови кроликов при отравлении парами аммиака в дозе ЛД100 с использованием дегазатора (n=3) | |||||||
| Показатель | Срок исследования, сут | ||||||
| Исходные значения | 1 | 3 | 7 | 10 | 15 | 20 | |
| АХЭ, ммоль/(ч·л) | 34,36±1,81 | 34,07±1,06 | 35,40±0,49 | 35,77±1,58 | 34,94±1,02 | 34,78±1,12 | 34,42±2,65 |
| Щелочная фосфатаза, ед./л | 213,95±17,83 | 238,21±17,68 | 242,48±16,37 | 225,38±21,16 | 221,95±15,85 | 218,37±11,29 | 215,48±12,32 |
| Глюкоза, ммоль/л | 4,87±1,65 | 4,82±1,33 | 5,26±1,72 | 5,23±0,33 | 4,61±0,58 | 4,85±0,55 | 4,86±0,44 |
| АЛТ, ед./л | 38,04±3,87 | 45,07±3,30* | 42,19±3,32 | 41,38±3,62 | 40,23±3,92 | 38,77±3,87 | 39,60±2,78 |
| ACT, ед./л | 32,16±3,79 | 40,51±1,33* | 38,17±4,23 | 37,08±3,30 | 36,79±3,96 | 34,48±2,88 | 33,27±3,37 |
| Примечание: * - р≤0,05 |
Содержание общего белка, альбуминов, β-глобулинов, γ-глобулинов на всем протяжении опыта оставались на уровне фона и достоверно не изменялись (таблица №5).
Увеличение количества α-глобулинов на 3-и сут составило 15,6%, на 7-е сут - 15,1% по сравнению с фоновыми значениями. Восстановление исследуемого показателя начиналось с 10-х сут эксперимента.
Активность ацетилхолинэстеразы, щелочной фосфатазы оставались в пределах физиологической нормы на протяжении всего периода исследования.
Активность фермента аланинаминотрансферазы на 1-е сут повысилась на 18,5%. Восстановление данного показателя наблюдалось на 3-и сут эксперимента.
Увеличение активности аспартатаминотрансферазы регистрировали на 1-е сут на 25,9% с последующим снижением с 3-х сут эксперимента.
Исследования по изучению влияния паров аммиака в среднесмертельной дозе и лимонной кислоты на организм проводили на кроликах породы «Серый великан» массой 2,5-3,0 кг, которые были разделены по принципу аналогов на 3 группы. Кроликов контрольной группы (5 гол.) отравляли аммиаком в среднесмертельной дозе - 11,8 мг/л. Опытных животных (3 гол.) отравляли среднесмертельной дозой аммиака и использовали для дегазации 20% раствор лимонной кислоты. Третья группа (3 гол.) являлась биологическим контролем. Наблюдение за животными вели в течение 20 дней.
В контрольной группе два кролика пали на фоне клонических и клонико-тонических судорог через 12 часов.
У выживших животных опытной и контрольной групп до (исходные значения) и на 1, 7, 10, 15 и 20-е сут опыта определяли количество эритроцитов, лейкоцитов, гемоглобина, скорость оседания эритроцитов, лейкоформулу, активность ферментов аланинаминотрансферазы, аспартатаминотрансферазы, ацетилхолинэстеразы, щелочной фосфатазы, содержание глюкозы, общего белка, белковых фракций. Данные исследований представлены в таблицах 7-9.
При анализе данных таблицы 7 видно, что в течение опыта количество эритроцитов, лейкоцитов, содержание гемоглобина в крови контрольных животных оставались в пределах физиологической нормы.
Скорость оседания эритроцитов увеличивалась на 3-и сут на 61,7%, на 7-е сут - на 74,3%, на 10-е сут - 65,7%, на 15-е сут - на 62,9% относительно исходных значений. Восстановление показателя отмечалось к 20-м сут исследования.
Количество палочкоядерных нейтрофилов увеличивалось на 3-й сут на 15,4% относительно фонового значения. Восстановление до исходного уровня происходило на 15-е сут эксперимента.
Отмечалось увеличение количества сегментоядерных нейтрофилов на 3-и сут исследования на 25,5% по сравнению с фоновым показателем с последующим незначительным снижением их количества к 7 суткам.
Количество эозинофилов повышалось на 1-е сут в 2,3 раза, на 3 и 7-е сут - в 2,9 и 3,3 раза соответственно, на 10 и 15-е сут этот показатель увеличился в 2,8 и 2,6 раз соответственно, на 20-е сут исследования - в 1,9 раза относительно фоновых показателей.
На 15-е сут отмечалась моноцитопения на 22,2% относительно фоновых значений с восстановлением на 20-е сут эксперимента.
Содержание лимфоцитов уменьшалось на 1 и 3-и сут на 17,3% и 28,1% соответственно. На 10-е сут эксперимента их содержание соответствовало уровню фона.
Концентрация общего белка в сыворотке крови была с небольшими колебаниями в пределах физиологической нормы (таблица №8).
При исследовании белковых фракций наблюдалось незначительное снижение альбуминов, вследствие чего отмечалось увеличение α-глобулинов на 7, 10 и 15-е сут эксперимента на 22,3%, 20,3% и 16% соответственно.
Содержание α-глобулинов к 20-м сут исследований приближалось к исходным значениям. Увеличение количества β-глобулинов отмечалось на 7-е сут на 15,2%, на 10-е сут - на 14,1% относительно фонового значения.
| Таблица 7 | ||||||||
| Гематологические показатели кроликов при отравлении парами аммиака в дозе ЛД50 без дегазации и с применением лимонной кислоты (n=3) | ||||||||
| Показатель | Группа | Сроки исследования, сут | ||||||
| Исходные значения | 1 | 3 | 7 | 10 | 15 | 20 | ||
| Эритроциты,1012/л | 1 | 6,90±0,48 | 6,72±0,94 | 6,80±1,33 | 7,57±0,45 | 7,43±1,02 | 7,11±1,05 | 6,98±1,07 |
| 2 | 6,13±0,36 | 6,70±0,25 | 6,92±0,26 | 6,54±0,87 | 6,21±0,08 | 6,17±0,08 | 6,15±0,37 | |
| Лейкоциты, 109/л | 1 | 7,42±0,62 | 7,25±1,09 | 7,27±1,01 | 7,65±1,04 | 7,45±1,49 | 7,44±2,96 | 7,41±2,78 |
| 2 | 7,49±0,33 | 7,54±0,53 | 7,56±0,37 | 7,55±0,12 | 7,50±0,31 | 7,49±0,20 | 7,46±0,53 | |
| Гемоглобин, г/л | 1 | 111,70±0,80 | 107,30±3,79 | 108,90±0,80 | 112,50±0,49 | 112,19±2,86 | 112,05±1,08 | 111,90±5,65 |
| 2 | 111,90±2,29 | 112,40±0,38 | 112,50±1,54 | 112,30±0,92 | 112,10±0,94 | 111,97±0,93 | 111,88±0,72 | |
| СОЭ, мм/ч | 1 | 1,75±0,71 | 1,93±0,41 | 2,83±0,42* | 3,05±0,20* | 2,90±0,25* | 2,85±0,46* | 2,07±0,38 |
| 2 | 1,70±0,12 | 1,70±0,19 | 1,64±0,08 | 1,68±0,02 | 1,66±0,39 | 1,70±0,07 | 1,69±0,19 | |
| Палочкоядерные нейтрофилы, % | 1 | 5,97±1,08 | 6,67±1,47 | 6,89±0,41* | 6,29±0,00 | 6,15±0,71 | 5,98±0,92 | 5,96±0,50 |
| 2 | 7,29±0,12 | 7,18±0,14 | 7,18±0,12 | 7,29±0,07 | 7,29±0,07 | 7,18±0,07 | 7,29±0,19 | |
| Сегментоядерные нейтрофилы, % | 1 | 38,00±3,08 | 43,33±6,72 | 47,70±3,74* | 38,50±2,45 | 35,20±7,35 | 34,80±4,26 | 34,50±3,45 |
| 2 | 36,97±0,94 | 38,57±0,67 | 39,07±0,21 | 37,22±0,37 | 36,93±0,86 | 36,97±0,19 | 37,12±0,19 | |
| Эозинофилы, % | 1 | 2,00±1,22 | 4,50±0,71* | 5,70±2,12* | 6,67±1,63* | 5,67±0,82* | 5,33±1,08* | 3,81±2,13* |
| 2 | 1,43±0,07 | 1,67±0,07 | 1,67±0,07 | 1,63±0,12 | 1,43±0,21 | 1,33±0,21 | 1,43±0,21 | |
| Базофилы, % | 1 | 1,33±0,41 | 1,33±0,41 | 1,34±0,82 | 1,33±0,41 | 1,34±1,22 | 1,34±0,71 | 1,33±0,48 |
| 2 | 1,07±0,07 | 1,07±0,07 | 1,19±0,07 | 1,07±0,12 | 1,07±0,19 | 1,19±0,07 | 1,07±0,07 | |
| Моноциты, % | 1 | 1,67±0,41 | 1,75±0,41 | 1,67±0,41 | 1,40±0,71 | 1,50±1,22 | 1,30±0,71* | 1,42±1,25 |
| 2 | 1,93±0,35 | 2,19±0,07 | 1,93±0,19 | 1,93±0,19 | 1,82±0,12 | 1,93±0,31 | 2,12±0,07 | |
| Лимфоциты, % | 1 | 51,03±3,94 | 42,22±7,82* | 36,7±5,52* | 45,61±2,45 | 50,14±5,31 | 51,25±6,36 | 52,98±4,45 |
| 2 | 51,31±1,08 | 49,32±2,47 | 48,96±0,93 | 50,86±0,38 | 51,49±1,33 | 51,40±2,53 | 50,97±0,19 | |
| Примечание: * - р≤0,05 |
| Таблица 8 | ||||||||
| Содержание общего белка и его фракций в сыворотке крови кроликов при отравлении парами аммиака в дозе ЛД50 без дегазации и с применением лимонной кислоты (n=3) | ||||||||
| Показатель | Группа | Сроки исследования, сут | ||||||
| Исходные значения | 1 | 3 | 7 | 10 | 15 | 20 | ||
| Общий белок, % | 1 | 65,27±6,53 | 61,12±5,51 | 59,21±3,00 | 59,87±1,67 | 59,91±0,45 | 63,43±1,50 | 64,87±2,37 |
| 2 | 64,94±1,32 | 63,96±1,46 | 64,35±2,58 | 64,87±1,50 | 64,90±1,52 | 65,00±1,24 | 65,47±2,13 | |
| Альбумины, % | 1 | 57,61±1,77 | 57,24±2,78 | 57,32±2,73 | 56,21±1,18 | 57,36±0,24 | 57,48±2,09 | 57,62±1,41 |
| 2 | 61,37±0,82 | 61,25±0,91 | 61,32±0,72 | 61,39±0,75 | 61,37±0,68 | 61,40±0,72 | 61,38±0,81 | |
| α-глобулины, % | 1 | 11,02±4,00 | 11,45±4,23 | 12,31±1,63 | 13,48±0,79* | 13,26±1,26* | 12,78±1,27* | 12,56±0,98 |
| 2 | 10,45±0,78 | 10,50±0,31 | 11,15±0,75 | 11,05±0,90 | 10,47±0,39 | 10,40±0,31 | 10,44±0,12 | |
| β-глобулины, % | 1 | 7,30±3,00 | 7,56±3,56 | 7,84±0,50 | 8,41±0,90* | 8,33±1,19* | 8,18±3,14 | 7,96±2,76 |
| 2 | 9,00±0,35 | 9,47±0,64 | 9,50±0,19 | 9,40±0,24 | 9,00±0,12 | 9,10±0,46 | 9,05±0,41 | |
| γ-глобулины, % | 1 | 24,07±4,98 | 23,75±0,75 | 22,53±4,77 | 21,9±4,53 | 21,05±4,98 | 21,56±0,32 | 21,86±2,41 |
| 2 | 19,18±0,32 | 18,78±0,35 | 18,03±0,28 | 18,16±0,38 | 19,16±0,51 | 19,10±0,39 | 19,13±0,41 | |
| Примечание: * - р≤0,05 |
| Таблица 9 | ||||||||
| Биохимические показатели крови кроликов при отравлении парами аммиака в дозе ЛД50 без дегазации и с применением лимонной кислоты (n=3) | ||||||||
| Показатель | Группа | Сроки исследования, сут | ||||||
| Исходные значения | 1 | 3 | 7 | 10 | 15 | 20 | ||
| АХЭ, ммоль/(ч·л) | 1 | 35,19±2,32 | 34,86±7,35 | 34,17±2,98 | 34,27±1,18 | 34,90±0,53 | 35,20±1,71 | 35,18±0,34 |
| 2 | 36,87±0,73 | 36,47±0,77 | 36,35±0,54 | 36,40±0,62 | 36,80±0,25 | 36,88±0,70 | 36,85±0,82 | |
| Щелочная фосфатаза, ед/л | 1 | 233,86±37,96 | 251,64±20,36 | 280,72±6,95* | 246,08±14,11 | 245,00±16,93 | 240,00±0,71 | 238,01±7,67 |
| 2 | 235,80±2,29 | 246,50±0,86 | 248,70±2,55 | 237,80±3,17 | 236,40±1,32 | 236,00±2,38 | 235,20±0,85 | |
| Глюкоза, ммоль/л | 1 | 5,63±0,21 | 5,51±0,58 | 5,83±1,56 | 5,80±0,61 | 5,19±0,58 | 5,18±0,25 | 5,24±0,35 |
| 2 | 5,30±0,33 | 5,41±0,90 | 5,80±0,24 | 5,62±0,31 | 5,50±0,50 | 5,42±0,34 | 5,41±0,77 | |
| АЛТ, ед./л | 1 | 36,66±2,88 | 65,88±6,96* | 67,18±2,61* | 56,96±2,64* | 48,18±1,98* | 44,65±2,29* | 40,35±1,67 |
| 2 | 35,70±2,09 | 40,98±1,00 | 38,57±2,09 | 37,40±0,88 | 36,40±1,22 | 35,80±1,03 | 35,60±0,89 | |
| ACT, ед./л | 1 | 32,57±5,20 | 64,80±1,74* | 65,17±1,75* | 55,33±4,62* | 45,04±2,64* | 41,87±3,30* | 36,86±2,78 |
| 2 | 30,15±1,76 | 31,65±0,29 | 31,05±0,98 | 30,85±1,11 | 30,55±1,20 | 30,38±1,72 | 30,13±1,54 | |
| Примечание: * - р≤0,05 |
Восстановление этого показателя до физиологической нормы происходило на 20-е сутки.
Количество γ-глобулинов на протяжении всего эксперимента оставалось в пределах физиологических норм.
При изучении биохимических показателей крови кроликов, отравленных среднесмертельной дозой аммиака (таблица 9), отмечалось небольшое понижение активности ацетилхолинэстеразы до 10-х сут исследования, однако эти изменения были в пределах физиологических колебаний. Наблюдалось увеличение активности щелочной фосфатазы на 3-и сут на 20% относительно фона. Восстановление этого показателя до исходного уровня происходило на 20-е сут исследования.
Содержание глюкозы на 1-е сут исследования незначительно понижалось, на 3 и 7-е сут отмечалось повышение этого показателя, на 10, 15 и 20-е сут вновь снижение, но в пределах физиологической нормы.
Наблюдалось повышение активности ферментов аланинаминотрансферазы и аспартатаминотрансферазы с 1 до 15-х сут эксперимента. Активность аланинаминотрансферазы увеличилась на 1 и 3-и сут на 79,7% и 83,3% соответственно, на 7 и 10-е сут - на 55,3% и 31,4% соответственно, на 15-е сут исследования увеличение составило 21,8% соответственно по сравнению с фоновыми значениями.
Активность фермента аспартатаминотрансферазы также увеличивалась на 1 и 3-и сут на 98,9% и 100,1%, на 7 и 10 сут - на 69,9% и 38,3% соответственно, на 15-е сут исследования - на 28,6% относительно фона.
В опытной группе кроликов достоверных изменений в исследованных параметрах обнаружено не было.
При гистологическом исследовании органов кроликов, отравленных абсолютно смертельной дозой паров аммиака, наблюдались венозное полнокровие внутренних органов, сепарация плазмы. Нарушение проницаемости сосудов сопровождалось периваскулярными и мелкоочаговыми кровоизлияниями в головном мозге, легких, печени, надпочечниках, почках, тимусе. В легких бронхи содержали эозинофильные массы, участки ателектаза чередовались с дистелектазами, очаговой эмфиземой, межальвеолярные перегородки были инфильтрированы единичными лейкоцитами, лимфоцитами, в просветах части альвеол определялись эозинофильные массы, единичные лимфоидные клетки и альвеолоциты. В просветах сосудов имелись единичные лимфоциты, пристеночно определялись оптические пустоты, целостность стенок некоторых сосудов была нарушена, оптические пустоты примыкали к участкам дефекта, периваскулярно определялись лимфоидные клетки (фиг.2).
В коре больших полушарий головного мозга определялся периваскулярный, перицеллюлярный отек, нейроны преимущественно имели эозинофильную окраску, нечеткие контуры, угловатую форму, некоторые были безъядерные, в подкорковой области признаки отека были более выраженными в сравнении с корой, в стволовых отделах отек достигал максимальной выраженности, имелось разрежение глии с образованием губчатых структур бледной окраски, дистрофия нейронов по типу тяжелых изменений в виде резкого набухания нервных клеток с нарушением контуров, отростки были сглажены, тигроидное вещество растворено, в цитоплазме появлялась патологическая зернистость, а также вакуоли, окраска цитоплазмы бледно эозинофильная. Контуры некоторых нейронов были искажены, нечеткие, определялись участки с неразличимой клеточной оболочкой. Ядро деформировалось, окрашивалось неравномерно бледно, ядрышко смещалось, деформировалось, в некоторых клетках цитоплазма становилась сотовой. Нейроны наряду со стиранием контуров, бледной эозинофилией, могли иметь резко увеличенные, смещенные, светлые, вакуолизированные ядра и гиперхромные ядрышки. Определялись налипания клеток микроглии, лизис некоторых нейронов. Некоторые подобные гистологические изменения внутренних органов были отмечены другими авторами.
У опытных кроликов (с дегазацией) были обнаружены незначительные отклонения от нормы. В легких определялись небольшие пристеночные скопления эозинофильных масс и единичных лимфоцитов, не заполняющие просвет. Перибронхиально определялись единичные лимфоидные клетки. В просветах некоторых сосудов легких определялись пристеночно расположенные мелкие округлые оптические пустоты (фиг.3).
В головном мозге определялся слабо выраженный отек в стволовых отделах, строение коры не отличалось от нормы. Нейроны имели сохранную структуру с небольшим набуханием единичных клеток. Строение почек не отличалось от нормы. В печени проявления дистрофии и кровоизлияний отсутствовали.
Пример 3. Изучение дегазирующей эффективности лимонной кислоты при затравке овец парами аммиака.
Овцы живой массой 20-30 кг были разделены на 3 группы по принципу аналогов с учетом живой массы, возраста и пола по 3 головы в каждой. Овцы первой группы служили контролем для определения абсолютно смертельной дозы аммиака. Животных второй группы отравляли аммиаком с применением лимонный кислоты. Третья группа являлась биологическим контролем.
Результаты опытов представлены в таблице 10.
| Таблица 10 | ||||
| Нейтрализующая эффективность лимонной кислоты при отравлении овец парами аммиака в абсолютно смертельной дозе | ||||
| Группа | Животные, гол. | Сроки гибели | ||
| Всего | Выжило | Пало | ||
| Затравка аммиаком | 3 | 0 | 3 | 1-1,5 час |
| Аммиак + лимонная кислота | 3 | 3 | 0 | --- |
| Биологический контроль | 3 | 3 | 0 | --- |
Признаки интоксикации у овец контрольной группы, в виде облизывания, беспокойства проявлялись через 6-8 мин от начала испарения яда. В дальнейшем, через 30-40 мин отмечались атаксия, бронхоспазм. Через 50-55 мин животные принимали боковое положение, проявлялись саливация, хрипы. Гибель на фоне судорог наступала через 1-1,5 часа.
Клиническая картина отравления животных в опытной группе проявлялась через 15-25 мин в виде беспокойства, учащенного дыхания. Через 40-60 мин животные начинали беспорядочно передвигаться по камере, у них отмечалось нарушение координации движения, проявлялись легкие хрипы. Дальнейшего развития клинических признаков интоксикации не отмечалось. Через 6-7 ч по окончании эксперимента животные начинали принимать корм и воду, они адекватно реагировали на внешние раздражители.
Общее состояние овец группы биологического контроля в течение всего срока исследования было удовлетворительным.
Таким образом, проведенными экспериментами было установлено, что все животные опытных групп, с использованием лимонной кислоты, выжили, при 100% гибели контрольных (без использования дегазатора) овец.
Для изучения влияния совместного применения аммиака и дегазатора у животных до опыта (исходные значения) и на 1, 3, 7, 10, 15 и 20-е сут исследовали гематологические и биохимические показатели крови.
Результаты исследований представлены в таблицах 11-13.
Как видно из данных таблицы 11, у овец, отравленных парами аммиака в абсолютно смертельной дозе, с применением для дегазации лимонной кислоты, количество эритроцитов и лейкоцитов, содержание гемоглобина, скорость оседания эритроцитов достоверно не изменялись в течение всего эксперимента.
При исследовании лейкограммы количество сегментоядерных нейтрофилов, эозинофилов, моноцитов и лимфоцитов на протяжении всего опыта оставалось на уровне фоновых показателей.
Наблюдалось уменьшение количества палочкоядерных нейтрофилов на 3-и сут на 25,7% относительно показателя фона. Восстановление происходило на 7-е сут эксперимента.
Содержание общего белка, альбуминов, α-глобулинов, β-глобулинов и γ-глобулинов оставались в пределах физиологических колебаний.
| Таблица 11 | |||||||
| Гематологические показатели овец при отравлении абсолютно смертельной дозой паров аммиака с использованием дегазатора (n=3) | |||||||
| Показатель | Срок исследования, сут | ||||||
| Исходные значения | 1 | 3 | 7 | 10 | 15 | 20 | |
| Эритроциты, 1012/л | 11,20±1,10 | 10,84±1,10 | 10,97±0,80 | 11,35±0,82 | 11,33±0,37 | 11,26±0,44 | 11,22±0,24 |
| Лейкоциты, 109/л | 13,0±0,31 | 12,57±0,93 | 12,68±0,82 | 12,83±0,77 | 12,94±1,39 | 13,20±1,59 | 13,15±1,25 |
| Гемоглобин, г/л | 116,25±0,63 | 114,33±3,66 | 115,43±2,12 | 116,30±1,05 | 116,27±0,80 | 116,25±1,44 | 116,26±0,67 |
| СОЭ, мм/ч | 1,30±0,12 | 1,41±0,25 | 1,47±0,29 | 1,35±0,12 | 1,33±0,11 | 1,31±0,08 | 1,32±0,07 |
| Палочкоядерные нейтрофилы, % | 3,00±0,14 | 2,57±0,08 | 2,23±0,04* | 2,59±0,07 | 2,87±0,25 | 2,98±0,28 | 3,01±0,35 |
| Сегментоядерные нейтрофилы, % | 46,50±0,48 | 47,15±0,65 | 48,30±0,92 | 47,15±1,10 | 46,25±0,83 | 46,56±0,54 | 46,52±0,72 |
| Эозинофилы, % | 2,50±0,07 | 2,16±0,12 | 2,80±0,25 | 2,83±0,34 | 2,84±0,36 | 2,53±0,10 | 2,49±0,24 |
| Базофилы, % | 0,75±0,18 | 0,64±0,51 | 0,69±0,12 | 0,89±0,07 | 0,85±0,13 | 0,77±0,17 | 0,75±0,30 |
| Моноциты, % | 3,20±0,25 | 3,30±0,35 | 3,21±0,24 | 3,55±0,30 | 3,63±0,28 | 3,23 |