Топлива для генерирующих водород баллончиков
Иллюстрации
Показать всеИзобретения относятся к области химии и могут быть использованы для получения водорода. Для получения водорода используют состав, содержащий твердый гидрид металла и жидкий реагент, содержащий воду и кислоту и имеющий рН ниже примерно 1,5. Согласно первому варианту газогенерирующее устройство содержит корпус, твердый гидрид металла и жидкий реагент, содержащий воду. Твердый гидрид металла и жидкий реагент помещены в корпус. Массовое отношение гидрида металла и жидкого реагента составляет менее примерно 1:10,0. Согласно второму варианту в газогенерирующем устройстве гидрид металла и жидкий реагент разделены мембраной, причем мембрана разрушается. Гидрид металла и жидкий реагент реагируют с образованием газообразного водорода. Согласно третьему варианту газогенерирующее устройство содержит несколько топливных капсул. Каждая топливная капсула содержит гидрид металла и жидкий реагент, которые разделены мембраной. Изобретения позволяют увеличить количество водорода, образующегося при реакциях между гидридом металла и жидким реагентом, уменьшить объем генерирующего водород баллончика. 4 н. и 21 з.п. ф-лы, 11 ил.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0001] Топливные элементы - это устройства, непосредственно преобразующие химическую энергию реагентов, т.е. топлива и окислителя, в электрическую энергию постоянного тока. Для растущего числа применений топливные элементы являются более эффективными, чем обычное генерирование энергии, например, при сгорании ископаемого топлива, и более эффективными, чем портативное аккумулирование энергии, например ионно-литиевые батареи.
[0002] Обычно технология топливных элементов включает самые разные топливные элементы, например щелочные топливные элементы, топливные элементы с полимерным электролитом, фосфорнокислые топливные элементы, топливные элементы с плавленым карбонатом, топливные элементы на твердом оксиде и ферментные топливные элементы. Сегодняшние представляющие большую важность топливные элементы можно разбить на три общие категории, а именно: (1) топливные элементы, в которых в качестве топлива используется сжатый водород (H2), (2) топливные элементы с протонообменной мембраной (ПОМ), в которых в качестве топлива используются спирты, например метанол (СH3ОH), гидриды металлов, например борогидрид натрия (NaBH4), углеводороды или другие топлива, риформированные в водородное топливо, которые могут работать непосредственно на не водородном топливе, или топливные элементы с прямым окислением и (4) топливные элементы на твердом оксиде (ТЭТО), которые при высокой температуре непосредственно преобразуют углеводородные топлива в электрическую энергию.
[0003] Сжатый водород обычно поддерживается под высоким давлением, и поэтому с ним трудно обращаться. Кроме того, обычно требуются большие емкости для хранения, которые невозможно сделать достаточно малогабаритными для использования в потребительских электронных устройствах. Обычные топливные элементы на продуктах риформинга требуют риформинг-установок и иных испарительных и вспомогательных систем для преобразования топлив в водород для реакции с окислителем в топливном элементе. Последние достижения делают топливные элементы на продуктах риформинга перспективными для потребительских электронных устройств. Наиболее распространенными топливными элементами с прямым окислением являются метаноловые топливные элементы с прямым окислением или МТЭПО. К числу других топливных элементов с прямым окислением относятся этаноловые топливные элементы с прямым окислением и топливные элементы с прямым окислением на тетраметилортокарбонате. МТЭПО, в котором метанол реагирует непосредственно с окислителем в топливном элементе, представляет собой простейший и потенциально наименьший топливный элемент и является наиболее перспективным в энергетическом отношении для использования в потребительских электронных устройствах. ТЭТО при высокой температуре преобразует углеводородные топлива, например бутан, в электрическую энергию. Для реакции в топливном элементе ТЭТО требует относительно высокой температуры порядка 1000°С.
[0004] Химические реакции, в результате которых образуется электрическая энергия, отличаются для каждого типа топливного элемента. В случае МТЭПО электрохимическая реакция на каждом электроде и общая реакция для метанолового топливного элемента с прямым окислением описываются следующим образом:
[0005] Полуреакция на аноде:
СН3ОН+Н2О→СО2+6H++6е-
[0006] Полуреакция на катоде:
1,5O2+6H++6e-→3H2O
[0007] Общая реакция топливного элемента:
CH3OH+1,5O2→CO2+2H2O
[0008] Из-за миграции ионов водорода (Н+) через ПОМ с анода на катод и из-за неспособности свободных электронов (е-) проходить через ПОМ, эти электроны протекают по внешней цепи, тем самым создавая во внешней цепи электрический ток. Внешняя цепь может использоваться для питания многих потребительских электронных устройств, таких как, например, мобильные или сотовые телефоны, калькуляторы, персональные цифровые ассистенты, дорожные компьютеры и механизированные инструменты.
[0009] МТЭПО описан в патентах США №5992008 и 5945231, описания из которых полностью включаются ссылкой в эту заявку. Обычно ПОМ изготовлена из полимера, например, Nafion®, выпускаемого корпорацией DuPont, который представляет собой полимер перфторированной сульфоновой кислоты толщиной примерно 0,05-0,50 мм, или других приемлемых мембран. Анод обычно выполнен в виде опоры из обработанной тефлоном (политетрафторэтиленом) копировальной бумаги с осажденным на ней тонким слоем катализатора, например платины-рутения. Катодом обычно служит газодиффузионный электрод, в котором с одной стороной мембраны связаны частицы платины.
[0010] Химические топлива из гидрида металла являются перспективными ввиду их относительно высокой плотности энергии, т.е. количества водорода на единицу массы или объема топлива. В топливном элементе на химическом топливе из гидрида металла борогидрид натрия риформируется и реагирует следующим образом:
NaBH4+2H2O→(тепло или катализатор)→4(Н2)+(NaBO2)
[0011] Полуреакция на аноде:
Н2→2H++2е-
[0012] Полуреакция на катоде:
2(2H++2е-)+О2→2H2O
[0013] К числу приемлемых катализаторов относятся платина и рутений, а также другие металлы. Водородное топливо, полученное риформингом борогидрида натрия, реагирует в топливном элементе с окислителем, например O2, с получением электрической энергии (или потока электронов) и побочного продукта - воды. В процессе риформинга получается также побочный продукт - борат натрия (NaBO2). Топливный элемент на борогидриде натрия рассмотрен в патенте США №4261950, описание из которого ссылкой включается в настоящую заявку.
[0014] Несмотря на потенциальные выгоды повышенной плотности энергии, химические топлива из гидрида металла не достигли требуемой плотности энергии для использования в переносных электронных устройствах, включая количество водорода, которое может высвобождаться из топлива. Поэтому сохраняется необходимость в увеличении плотности энергии и максимальном повышении высвобождения водорода в химических топливах из гидрида металла.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0015] Настоящее изобретение увеличивает количество водорода, образующегося или высвобождающегося из химических топлив из гидрида металла.
[0016] Кроме того, настоящее уменьшает объем генерирующего водород баллончика.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
[0017] На прилагаемых чертежах, которые являются неотъемлемой частью настоящего описания и должны рассматриваться вместе с ним, для обозначения одинаковых деталей используются одинаковые позиции.
[0018] Фиг.1 представляет собой разрез устройства, которое может использоваться с высвобождением водорода из топлив из гидрида металла.
[0019] Фиг.2 представляет собой разрез еще одного устройства в соответствии с настоящим изобретением.
[0020] Фиг.3 представляет собой разрез устройства на фиг.2 по линии 3-3.
Фиг.4 представляет собой график изменения давления во времени (первый пример).
Фиг.5 представляет собой график изменения массы во времени (первый пример).
Фиг.6 представляет собой график изменения скорости образования массы во времени (первый пример).
Фиг.7 представляет собой график времени работы (первый пример).
Фиг.8 представляет собой график изменения давления во времени (второй пример).
Фиг.9 представляет собой график изменения массы во времени (второй пример).
Фиг.10 представляет собой график изменения скорости образования массы во времени (второй пример).
Фиг.11 представляет собой график времени работы (второй пример).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0021] Как показано на прилагаемых чертежах и подробно описывается ниже, настоящее изобретение относится к способам и составам, способным максимально увеличить высвобождение водорода из химических гидридных топлив, таких как борогидрид натрия (NaBH4), и воды. Кроме того, настоящее изобретение относится к устройству, которое максимально увеличивает высвобождение водородных топлив при реакции химических гидридных топлив и воды.
[0022] Приемлемые известные генерирующие водород устройства, в которых используются топлива из гидрида металла, раскрыты в совместно рассматриваемых патентной заявке США 10/679756, поданной 6 октября 2003 г., патентной заявке США 10/854540, поданной 26 мая 2004 г., патентной заявке США 11/067167, поданной 25 февраля 2005 г., и патентной заявке США 11/066 573, поданной 25 февраля 2005 г. Описания из этих заявок ссылкой полностью включаются в настоящее описание.
[0023] Примеры приемлемых химических топлив из гидрида металла могут включать среди прочих гидриды элементов групп Ia-IVa периодической таблицы элементов и их смеси, такие как гидриды щелочных металлов или их смеси. Кроме того, могут использоваться и другие соединения, такие как гидриды щелочных металлов-алюминия (аланаты) и борогидриды щелочных металлов. Более конкретные примеры гидридов металлов включают среди прочих гидрид лития, гидрид лития алюминия, борогидрид лития, гидрид натрия, борогидрид натрия, гидрид калия, борогидрид калия, гидрид магния, гидрид кальция и их соли и (или) производные. Предпочтительными гидридами являются борогидрид натрия, борогидрид магния, борогидрид лития и борогидрид калия. Предпочтительно, содержащее водород топливо представляет собой твердую форму NaBH4 или Mg(BH4)2. В твердой форме NaBH4 не гидролизуется при отсутствии воды и поэтому продлевает срок годности баллончика. Однако в настоящем изобретении может использоваться и водная форма содержащего водород топлива, например водный NaBH4. При использовании водной формы NaBH4 камера, содержащая водный NaBH4, содержит и стабилизатор. К примерным стабилизаторам могут относиться среди прочих металлы и гидроксиды металлов, например гидроксиды щелочных металлов. Примеры этих стабилизаторов описаны в патенте США №6683025, описание из которого ссылкой полностью включается в настоящее описание. Предпочтительно, стабилизатором является NaOH.
[0024] Твердая форма содержащего водород топлива является предпочтительней жидкой формы. Обычно твердые топлива преимущественнее жидких топлив, поскольку жидкие топлива содержат пропорционально меньше энергии, чем твердые топлива, и жидкие топлива менее устойчивы, чем их аналоги твердые топлива. Соответственно, наиболее предпочтительным топливом для настоящего изобретения является твердый борогидрид натрия в виде таблеток, гранул, порошка или агломерированного порошка.
[0025] В соответствии с настоящим изобретением, жидкий реагент реагирует с химическим топливом из гидрида металла в присутствии факультативного катализатора с выделением водорода. Предпочтительно, к числу приемлемых жидких реагентов относятся среди прочих вода, спирты и (или) разведенные кислоты. Наиболее обычным жидким реагентом является вода. Как уже отмечалось выше и указано в формуле ниже, вода может реагировать с содержащим водород топливом, например NaBH4, в присутствии факультативного катализатора, кислот и добавок с выделением водорода:
Х(ВН4)y+2Н2O→Х(ВО)2+4Н2,
где Х включает среди прочих Na, Mg, Li и все щелочные металлы, а y - целое число.
[0026] Кроме того, реагент может включать факультативные добавки, снижающие или повышающие рН раствора. рН реагента можно использовать для определения скорости, с которой образуется водород. Например, присутствие добавок, снижающих рН реагента, приводит к более высокой скорости образования водорода. К таким добавкам относятся среди прочих кислоты, такие как хлористоводородная (соляная) кислота (НСl), азотная кислота (НNО3), уксусная кислота (НС2Н3О2), серная кислота (Н2SO4), лимонная кислота (Н3С6Н5О7), карбоновая кислота (Н2СО3), фосфорная кислота (Н3РO4) и щавелевая кислота (Н2С2O4). С другой стороны, добавки, повышающие рН, могут замедлить скорость реакции до точки, в которой водород почти не выделяется. Предлагаемый раствор может иметь любое значение рН ниже 7, например примерно 0,1-6, предпочтительно примерно 0,1-3,0. Влияния снижения рН рассматриваются ниже.
[0027] В некоторых примерных вариантах осуществления реагент факультативно включает катализатор, который может инициировать получение газа-водорода и (или) способствовать этому, повышая скорость, с которой реагент реагирует с топливным компонентом. Этот факультативный катализатор может иметь любую форму или размер и может быть в любом состоянии (жидкость, твердое вещество или пар). Например, катализатор может быть достаточно мелким в виде порошка или настолько крупным, как реакционная камера. В некоторых примерных вариантах осуществления катализатор может образовывать слой катализатора. Катализатор может находиться в реакционной камере, пока по меньшей мере один из реагентов - реагент или топливный компонент - может вступать в контакт с этим катализатором.
[0028] Предлагаемый катализатор может включать один или несколько переходных металлов из группы VIIIб периодической таблицы элементов. Например, катализатор может включать переходные металлы, такие как железо (Fe), кобальт (Со), никель (Ni), рутений (Ru), родий (Rh), платина (Pt), палладий (Pd), осмий (Os), иридий (Ir). Дополнительно, в предлагаемом катализаторе могут использоваться и переходные металлы в группе Iб, т.е. медь (Сu), серебро (Ag) и золото (Au), и в группе IIб, т.е. цинк (Zn), кадмий (Сd) и ртуть (Hg). К числу других переходных металлов, которые могут использоваться как катализатор, относятся среди прочих скандий (Sc), титан (Ti), ванадий (V), хром (Сr) и марганец (Мn). Катализаторы из переходных металлов, которые могут использоваться в предлагаемых системах катализатора, описаны в патенте США №5804329, описание из которого ссылкой полностью включается в настоящее описание.
[0029] Некоторые из предлагаемых катализаторов можно, в общем, описать следующей формулой:
[0030] где М - катион переходного металла, Х - анион, и "a" и "b" - целые числа от 1 до 6, которые необходимы для уравновешивания зарядов комплекса переходного металла.
[0031] К числу подходящих катионов переходных металлов относятся среди прочих железо (II) (Fe2+), железо (III) (Fe3+), кобальт (Со2+), никель (II) (Ni2+), никель (III) (Ni3+), рутений (III) (Ru3+), рутений (IV) (Ru4+), рутений (V) (Ru5+), рутений (VI) (Ru6+), рутений (VIII) (Ru8+), родий (III) (Rh3+), родий (IV) (Rh4+), родий (VI) (Rh6+), палладий (Pd2+), осмий (III) (Os3+), осмий (IV) (Os4+), осмий (V) (Os5+), осмий (VI) (Оs6+), осмий (VIII) (Os8+), иридий (III) (Ir3+), иридий (IV) (Ir4+), иридий (VI) (Ir6+), платина (II) (Pt2+), платина (III) (Pt3+), платина (IV) (Pt4+), платина (VI) (Pt6+), медь (I) (Cu+), медь (II) (Сu2+), серебро (I) (Ag+), серебро (II) (Ag2+), золото (I) (Аu+), золото (III) (Аu3+), цинк (Zn2+), кадмий (Cd2+), ртуть (I) (Hg+), ртуть (II) (Hg2+) и т.п.
[0032] К числу подходящих анионов относятся среди прочих гидрид (Н-), фторид (F-), хлорид (Cl-), бромид (Br-), йодид (I-), оксид (O2-), сульфид (S2-), нитрид (N3-), фосфид (P4-), гипохлорит (СlO-), хлорит (ClO2 -), хлорат (ClO3 -), перхлорат (СlO4 -), сульфит (SO3 2-), сульфат (SO4 2-), сульфат водорода (HSO4 -), гидроксид (ОН-), цианид (CN-), тиоцианат (SCN-), цианат (OCN-), пероксид (О2 2-), манганат (МnO4 2-), перманганат (МnO4 -), дихромат (Сr2O7 2-), карбонат (СО3 2-), карбонат водорода (НСО3 -), фосфат (РO4 2-), фосфат вторичный кислый (НРO4 -), фосфат первичный кислый (Н2РO4 -), алюминат (Аl2O4 2-), арсенат (AsO4 3-), нитрат (NО3 -), ацетат (СН3СОО-), оксалат (С2O4 2-) и т.п.
[0033] Предпочтительным катализатором является хлорид кобальта CoCl2.
[0034] В некоторых примерных вариантах осуществления факультативная добавка может включаться в реагент и (или) реакционную камеру. Этой факультативной добавкой является любой состав, способный практически предотвратить замерзание или снизить точку замерзания реагента и (или) топливного компонента. В некоторых примерных вариантах осуществления, этой добавкой может быть состав на основе спирта, например антифриз. Предпочтительно, предлагаемой добавкой является метанол (СН3ОН). К числу других приемлемых антифризов относятся среди прочих этанол (СН3СН2ОН) и пропанол (такой, как 1-пропанол (СН3СН2СН2ОН) или 2-пропанол (СН3СНОНСН3)). Могут использоваться и высшие спирты, но они менее предпочтительны из-за более низкой растворимости в воде. К числу этих высших спиртов относятся бутанол (СН3СН2СН2СН2ОН), пентанол (СН3CH2СН2CH2CH2OH) и гексанол (СН3CH2СН2CH2CH2CH2ОН). Однако, как отмечалось выше, можно использовать любую добавку, способную снизить точку замерзания снизить точку замерзания реагента и (или) топливного компонента. Могут использоваться и добавки для повышения или снижения температуры парообразования или температуры кипения.
[0035] В приведенном ниже описании борогидрид натрия используется только в целях иллюстрации. Настоящее изобретение может применяться к любому топливу, включая топлива из гидрида металла, описанные выше. Стехиометрическое уравнение, описывающее реакцию борогидрида натрия и воды, выглядит следующим образом:
1 моль NaBH4+2 моля Н2О →4 моля (H2)+1 моль (NaBO2) (катализатор)
[0036] Это уравнение можно преобразовать в уравнение массового баланса, при котором для одного грамма NaBH4 может быть получено идеальное количество водородного топлива, в следующем виде:
1 грамм NaBH4+0,952 грамма Н2О→0,213 грамма Н2+1,74 грамма NaBO2 (катализатор)
[0037] Преобразование стехиометрического уравнения в уравнение массового баланса можно выполнить путем приведения массы каждого моля компонентов в стехиометрическом уравнении к 1 грамму борогидрида натрия. Общая масса на левой стороне уравнения должна быть такой же, как и общая масса на правой стороне уравнения в соответствии с принципом сохранения массы. Для приведенного выше уравнения массового баланса это, несомненно, так и есть, за исключением неопределенности, связанной с округлением. Кроме того, можно заметить, что идеальное весовое (или массовое) соотношение для твердого борогидрида натрия и воды равно 1:0,952 или близко 1:1.
[0038] Следовательно, для того чтобы максимально увеличить высвобождение водорода в борогидриде натрия, подходящие способы высвобождения должны обеспечить приближение к 0,213 г водорода для 1,0 г борогидрида натрия или для 0,952 г воды. Для проверки эффективности реакции борогидрида натрия и воды были проведены опыты. Вначале приготовили жидкий реагент с использованием воды в качестве основного реагента, хлорида кобальта в качестве катализатора и метанола в качестве антифриза в следующих количествах:
Дистиллированная Н2О: 14,58 г
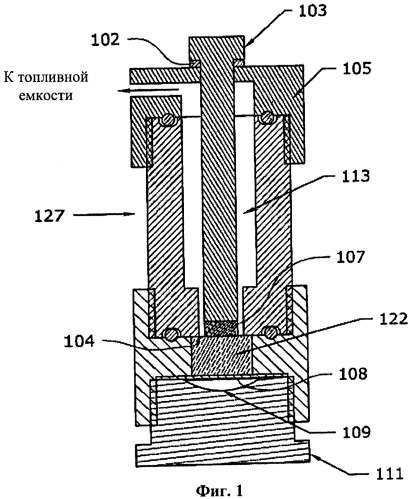
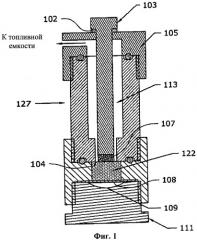
СН3ОН: 2,06 г
СoСl2: 0,686 г
Итого: 17,326 г
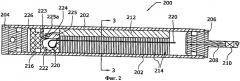
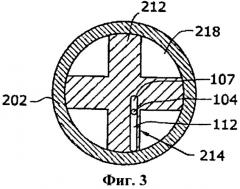
[0039] Этот приготовленный жидкий реагент имеет рН примерно 5,4.
[0040] В двух описанных ниже примерах в первом примере небольшое количество твердого борогидрида натрия добавляется к намного большему количеству приготовленного жидкого реагента, а во втором примере небольшое количество приготовленного жидкого реагента добавляется большее количество твердого борогидрида натрия. В этих примерах меньшие количества реагента или топлива реагируют полностью.
ПЕРВЫЙ ПРИМЕР
[0041] К 17,6 мл (17,326 г) приготовленного жидкого реагента добавили дозу 0,1 г твердого реагента - твердого борогидрида натрия. Массовое отношение борогидрида натрия к жидкому реагенту равно примерно 1:173, а к воде - примерно 1:146. В нижеприведенных расчетах используются массовые отношения между твердым борогидридом натрия и общим количеством жидкого реагента вместо отношений между твердым борогидридом натрия и водой, поскольку генерирующее водород устройство или баллончик может, кроме того, содержать катализаторы, кислоты и антифризы.
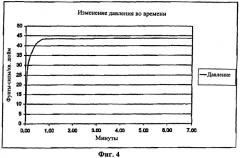
[0042] В этом примере объем жидкости был выбран таким образом, чтобы обеспечить реакцию всего имеющегося борогидрида натрия, и выбранный объем превышает объем, необходимый для стехиометрического уравнения / уравнения массового баланса, рассмотренных выше. Реагенты поместили в емкость объемом 87,4 мл. Следовательно, объем, имеющийся для водорода, равен практически разности между объемом емкости и объемами реагентов, который составляет примерно 69,8 мл. После того как борогидрид натрия добавили и он прореагировал с приготовленным жидким реагентом, датчиком давления измерили внутреннее давление в емкости. Измеренное давление показано на Фиг.4.
[0043] Максимальное давление в емкости 43,8 фунтов-сил/кв. дюйм было достигнуто через одну минуту после начала реакции. Подобная кривая, показывающая массу образованного водорода в зависимости от времени, показанная на Фиг.5, также показывает, что наибольшая часть массы образовалась в течение первой минуты.
[0044] Масса рассчитывается по кривой давления с использованием уравнения идеального газа, как показано ниже:
PV=mRHT,
где Р - давление;
V - объем;
m - масса водорода;
RH - газовая постоянная водорода = универсальная газовая постоянная ÷ молекулярный вес Н2;
Т - абсолютная температура.
[0045] Скорость образования массы в зависимости от времени - это производная кривой изменения массы во времени, показанная на Фиг.6.
[0046] Это показывает, что наибольшая часть массы водорода образовалась почти сразу же после того, как началась реакция. Поскольку образовавшийся водород используется топливными элементами для питания электрического оборудования, другой используемый измерительный прибор предназначен для установления количества водородного топлива, имеющегося для питания топливных элементов после реакции между реагентами. Три вышеприведенные графика показывают, что водород быстро образовывается после первоначальной реакции, и, кроме того, что после этого реакция относительно быстро практически прекращается. Быстрое образование водорода снижает необходимость хранить полученный водород или повышать его давление до того, как топливный элемент сможет потреблять топливо. Способность останавливать быстро реакцию позволяет уменьшить нарастание давления, особенно после остановки системы. Кроме того, при использовании меньших доз топлива можно также уменьшить размеры реакционной камеры.
[0047] В одном примере, принимая обычную скорость расходования топливного элемента, время работы топливного элемента и, соответственно, время работы электронного устройства, за счет вышеуказанной реакции показано на Фиг.7.
[0048] Кривая времени работы показывает, что через одну минуту после того, как началась реакция, время работы топливного элемента или устройства равно примерно 4,8 минут; через три минуты после реакции время работы топливного элемента или устройства равно примерно 3,6 минут. Эту кривую можно рассматривать как нечто вроде топливомера, показывающего остающееся водородное топливо. В этом примере спустя примерно шесть минут необходима еще одна реакция для обеспечения непрерывной подачи топлива для топливного элемента или электронного устройства.
[0049] Объем или масса жидкого реагента может уменьшаться, пока кривая давления, кривая скорости образования массы и (или) кривая времени работы значительно не изменяются в соответствии с раскрытием настоящего изобретения. Альтернативно, скорость создания давления, скорость образования массы и время работы можно сбалансировать с необходимостью уменьшения объема. Иными словами, скорость создания давления, скорость образования массы и время работы можно уменьшить до точки, в которой объем генерирующего водород устройства минимизирован. В соответствии с одним вариантом осуществления настоящего изобретения, плотность энергии можно повысить до максимума без достижения наивысшего возможного кпд реакции.
ВТОРОЙ ПРИМЕР
[0050] В отличие от первого примера, дозу приготовленного жидкого реагента добавляли в большую дозу твердого борогидрида натрия. Дозу 0,31 г приготовленного жидкого реагента добавляли к 2 г борогидрида натрия. Эти количества были выбраны для обеспечения непосредственного контакта всего приготовленного жидкого реагента с борогидридом натрия. Большее количество борогидрида натрия не требуется, поскольку с большим количеством твердого реагента жидкость просто физически не может контактировать. Приведенные ниже результаты ограничены этим составом, и другие составы могут дать улучшенные или лучшие результаты и полезность. Кривые давления, массы, скорости образования массы и времени работы были получены с использованием методики, аналогичной описанной выше, и приведены на Фиг.8-11.
[0051] Как видно из графиков, уходит приблизительно 70 минут, что значительно дольше, чем в первом варианте осуществления, для достижения максимального давления примерно 19,1 фунтов-сил / кв. дюйм - давления, значительно ниже, чем в первом примере. Через 20 минут, а также через 40 минут скорость образования массы остается значительной. Важным моментом является то, что сразу же после того, как началась реакция, время работы составляет лишь примерно 0,2 минуты, а после начальной реакции общее время работы составляет менее полуминуты. Эти результаты показывают, что добавление небольшого количества жидкого реагента к твердому борогидриду натрия приводит к высвобождению лишь малого количества водорода, и для того чтобы адекватно питать топливный элемент или электронное устройство, жидкий реагент необходимо непрерывно добавлять.
[0052] Еще один результат, полученный в этих двух примерах, свидетельствует о том, что - для первого примера - исходя из уравнения идеального газа максимальное достижимое давление 43,8 фунтов-сил/кв. дюйм соответствует общему количеству полученного водорода примерно 0,01737 г на 0,1 г борогидрида натрия. Иными словами, на 0,1 г борогидрида натрия получается 0,01737 г водорода или примерно 81,5% идеально высвобожденного водорода по вышеприведенному уравнению массового баланса. Для второго примера, исходя уравнения идеального газа, максимальное достижимое давление 19,1 фунтов-сил/кв. дюйм соответствует примерно 0,00759 г водорода на 0,31 г подготовленного жидкого реагента или воды. Следовательно, исходя из вышеприведенного уравнения массового баланса, в идеальном случае 0,31 г воды должны обеспечить 0,069 г водорода. 0,00759 г водорода, полученные во втором примере, соответствуют кпд примерно лишь 11%.
[0053] Таким образом, продемонстрировано, что кпд при добавлении твердого борогидрида натрия к большему количеству воды значительно выше, чем кпд при добавлении воды к большему количеству твердого борогидрида натрия - 81,5%:11% или примерно 7,4:1.
[0054] В соответствии с еще одним аспектом настоящего изобретения, массы и объемы реагентов, содержащихся в генерирующем водород устройстве, уменьшены до минимума, чтобы увеличить плотность высвобожденного водорода на количество реагентов, содержащихся в генерирующем водород устройстве. Это достигается путем уменьшения массового отношения твердого борогидрида натрия и жидкого реагента ближе к идеальному отношению 1:0,952. Массовое отношение можно уменьшить, если рН жидкого реагента более кислое.
[0055] В соответствии с еще одним аспектом настоящего изобретения, при реакции двух жидких реагентов, имеющих разные значения рН, с одним и тем количеством борогидрида натрия, реакция с жидким реагентом с меньшим рН при прочих практически одинаковых факторах должна быть быстрее, чем реакция с жидким реагентом с более высоким рН.
[0056] Установлено, что если жидкий реагент является нейтральным, т.е. вода при рН, равном 7, реакция между борогидридом натрия и водой для своего полного завершения может потребовать до недели. При уменьшении рН жидкого реагента примерно до 5,4, реакция для своего полного завершения может потребовать примерно до 20 минут. Если жидкий реагент имеет рН примерно 1,5, реакция для своего практически полного или полного завершения может потребовать менее примерно 1 минуты.
[0057] Кроме того, при уменьшении рН ниже 1,0 кпд водорода, высвобожденного при реакции, повышается, как показано в приведенных ниже примерах.
ТРЕТИЙ ПРИМЕР
[0058] В этом примере жидкий реагент приготовлен следующим образом:
Дистиллированная Н2О: 7,25 г
СН3ОН: 1,00 г
СоСl2: 0,34 г
H2SO4: 0.90 г (концентрация 90-92%)
Итого: 9,49 г
[0059] Этот приготовленный жидкий реагент имеет измеренное значение рН примерно 0,15. Приготовленная жидкость имеет объем примерно 9,18 мл исходя из известных удельных масс жидкостей. Подготовили и в смесительной камере объемом примерно 70 мл смешали с 0,1 г борогидрида натрия дозы 1 мл (1,03 г), 0,75 мл (0,78 г) и 0,5 мл (0,52 г) приготовленного жидкого реагента. Были получены следующие результаты:
| NaBH4, г | Жидкий реагент, г | Макс.давление, фунты-силы/кв. дюйм | Полученный H2 (идеальный = 0,0123 г), г | кпд, % |
| 0,1 | 1,03 | 55 | 0,02233 | ~100 |
| 0,1 | 0,78 | 55 | 0,02233 | ~100 |
| 0,1 | 0,52 | 50 | 0,02018 | ~90 |
[0060] Результаты в вышеприведенной таблице говорят о том, что высвободилось больше водорода, чем количество водорода, содержавшегося в борогидриде натрия и воде. Это могло быть вызвано возможной погрешностью эксперимента, внесенной измерительным приборами или лабораторным оборудованием. Кроме того, вносить водород во время реакции и тем самым увеличивать общий выход водорода могли соединения в добавках, а именно:
метанол и серная кислота.
[0061] Как показано, при уменьшении рН ниже 1,5 или, предпочтительно, до значения примерно 0,15, оптимальное массовое отношение борогидрида натрия и жидкого реагента для эффективного получения водорода находится в пределах 1:5,2-1:7,8 (при сравнении с получение идеального водорода). Эти отношения значительно ближе к идеальному отношению 1:0,92, чем отношение 1:173, показанное в первом примере.
[0062] Кроме того, в третьем примере одинаковые результаты можно получить как при добавлении твердого реагента к жидкому, так и vice versa (наоборот - лат.).
[0063] Как уже отмечалось, плотность водорода, который может восстанавливаться или высвобождаться, на объем реагентов, содержащихся в баллончике или генерирующем водород устройстве, является важным фактором при разработке баллончика. Иными словами, необходимо уменьшение объема реагентов при одновременном поддержании высокого кпд получения водорода, т.е. максимально возможное увеличение плотности энергии.
[0064] Показано, таким образом, что уменьшение рН жидкого реагента может увеличить плотность высвобождаемого водорода на объем реагентов при одновременном поддержании высокого кпд получения водорода.
[0065] На фиг.1 представлен примерное генерирующее водород устройство 127. Устройство или баллончик 127 содержит часть твердого топливного компонент 107, находящегося в камере рядом камерой, заполненной жидким топливным компонентом 122. Любой из этих топливных компонентов может быть любым топливным компонентом, описанным выше, например, в качестве твердого топливного компонента 107 может использоваться борогидрид натрия, а в качестве жидкого топливного компонента 122 могут использоваться вода, катализатор и добавки. Твердый топливный компонент 107 и жидкий топливный компонент 122 разделены тонкой хрупкой мембраной 104. Шток 103 находится в контакте с твердым топливным компонентом 107, проходит через топливный канал 113 и выступает из устройства 127 через колпачок 105. При ударе по нему с достаточным усилием шток 103 может на небольшое расстояние перемещаться в направлении твердого топливного компонента 107. Уплотнительное кольцо 102 смягчает удар и уплотняет отверстие. При ударе по штоку 103 шток 103 проталкивает твердый топливный компонент через хрупкую мембрану 104 в жидкий топливный компонент 122. Кроме того, ниже жидкого топливного компонента 122 может находиться и отделяться от него гибкой мембраной 108, например тонким листом из каучука или уретана, пустота 109. При введении твердого топливного компонента 107 пустота 109 позволяет адекватно вытеснять больший объем жидкого топливного компонента. При реакции топливных компонентов 107, 122 образуется топливный газ. Топливо проходит по топливному каналу 113 и выходит в топливную емкость (не показанную) для пополнения топливного газа в нем. Кроме того, устройство 127 содержит часть-основание 111.
[0066] Другие подходящие газогенерирующие устройства, которые могут работать на топливах, описываемых в настоящем описании, рассмотрены в 2 (двух) совместно рассматриваемых патентных заявках того же заявителя, обе озаглавленные «Генерирующие водород баллончики топливных элементов», имеющие номера 60/689538 и 60/689539, поданные 13 июня 2005 г. Предварительные заявки №60/689538 и 60/689539 были поданы в тот же день, что предварительная заявка, озаглавленная «Топлива для производящих водород баллончиков», имеющая номер 60/689572, также поданная 13 июня 2005 г. Настоящая заявка претендует на приоритет по предварительной заявке №60/689572. Описания из этих предварительных заявок полностью включаются ссылкой в настоящее описание.
[0067] К числу других подходящих газогенерирующих устройств относятся устройства, описанные в заявке того же заявителя номер 2005/0074643 и в патентной заявке США, озаглавленной «Генерирующие водород баллончики топливных элементов», номер 11/067167, поданной 25 февраля 2005 г., и в патентной заявке США, озаглавленной «Водород-генерирующие баллончики топливных элементов», номер 11/327580, поданной 6 января 2006 г. Описания из этих предварительных заявок полностью включаются ссылкой в настоящее описание.
[0068] Еще одно подходящее газогенерирующее устройство представлено на фиг.2 и 3. Как показано, газогенерирующее устройство 200 имеет корпус 202, который обычно является цилиндрическим. Однако корпус 202 может иметь любую форму. На одном конце корпус 202 соединен с уплотнительным торцевым колпачком 204, а на другом - с уплотнительным торцевым колпачком 206, как показано. Торцевой колпачок имеет канал для потока 208, через который газообразный водород, полученный в устройстве 200, может протекать в топливный элемент (не показан). Канал 208 сообщается по текучей среде с отсечным клапаном 210, предназначенный для регулирования потока водорода из устройства. Когда клапан 210 закрыт, устройство 200, герметично закрыто.
Использоваться может любой отсечной клапан. К числу подходящих отсечных клапанов относятся клапаны, описанные в патентных заявках США того же заявителя №2005/0022883 и 2005/0116190 и в патентных заявках США того же заявителя №10/978 949, поданной 1 ноября 2004 г., №10/958 574, поданной 5 октября 2004 г., и 60/699 865, поданной 19 июля 2005 г.Описания из этих заявок полностью включаются ссылкой в настоящее описание.
[0069] В корпусе 202 расположен носитель топлива 212, который в предпочтительном варианте осуществления закреплен неподвижно относительно корпуса 202. Носитель топлива 212, как показано на фиг.3, имеет крестообразный профиль, причем в одном из его четырех ортогональных сегментов содержатся несколько топливных капсул или ампул 214. Носитель топлива 212 может иметь любую форму или профиль, лишь бы носитель топлива 212 имел отверстия, чтобы позволить полученному газообразному водороду протекать в сторону торцевого колпачка 206 и канала 208 и позволить полученному газу прикладывать давление на автоматический отсечной механизм 216, как описано ниже. Эти отверстия могут образовываться пространствами 218 между ортогональными сегментами крестообразного профиля, показанного на фиг.3. Кроме того, как показано, топливные капсулы 214 находятся только в одном из четырех ортогональных сегментов. Однако топливные капсулы могут находиться в любой части топливного носителя 212, в том числе могут находиться во всех четырех сегментах топливного носителя 212.
[0070] Каждая топливная капсула 214 содержит твердый топливный компонент 107 и жидкий топливный компонент 122, разделенные мембраной 104, подобные компонентам и мембране газогенерирующего устройства 127, пок