Новые антибактериальные соединения
Иллюстрации
Показать всеИзобретение относится к новому очищенному соединению РМ 181104 формулы (I) (с молекулярной массой 1514 и молекулярной формулой C69H66N18O13S5), его фармацевтически приемлемым солям, способам получения, ферментацией микроорганизма, принадлежащего видам Kocuria (ZMA В-1 / МТСС 5269), фармацевтическим композициям и его применению для приготовления лекарственного средства для лечения бактериальной инфекции. 6 н. и 14 з.п. ф-лы, 4 ил., 4 табл., 17 пр.
Реферат
Данное изобретение касается нового соединения РМ 181104, обладающего антибактериальной активностью, которое получено ферментацией микроорганизма, принадлежащего видам Kocuria (ZMA В-1 / МТСС 5269). Данное изобретение также включает все стереоизомерные формы и все таутомерные формы РМ 181104, фармацевтически приемлемые соли и его производные. Данное изобретение далее касается способов получения нового антибактериального соединения(й), получения микроорганизма, принадлежащего видам Kocuria (ZMA В-1 / МТСС 5269), фармацевтическим композициям, содержащим новое соединение(я) как активный ингредиент, и его/их применения в медицине для лечения и предупреждения болезней, вызванных бактериальными инфекциями.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Возникновение бактериальной устойчивости к ряду противомикробных средств, таких как бета-лактамные антибиотики, макролиды, хинолоны и ванкомицин, становится главной проблемой здравоохранения во всем мире (Trends In Microbiology, 1994, 2, 422-425). Самой значительной проблемой в клинической практике является расширение инфекций, устойчивых к метициллину Staphylococcus aureus (MRSA). В настоящее время эффективно лечит инфекции с множественной устойчивостью MRSA только ванкомицин. Тем не менее, существует ряд сообщений о возникновении устойчивости к ванкомицину у некоторых изолятов MRSA (Antimicrobial Agents и Chemotherapy, 1998, 42, 2188-2192). Другой группой бактерий, устойчивых к нескольким клинически релевантным лекарственным средствам, появившейся недавно, является Enterococci, некоторые из членов которой также проявляют устойчивость к ванкомицину. Появление устойчивых к ванкомицину Enterococci (VRE) инфекций ставит терапевтов в затруднительное положение. Комбинации линезолида, оксазолидинонового соединения, и стрептограмина являются новыми лекарственными средствами выбора для лечения инфекций MRSA. Тем не менее, устойчивость к комбинации оксазолидинона (Clinical Infectious Diseases, 2003, 36, supplement I, S11-S23; Annals of Pharmacotherapy, 2003, 37, 769-74) и стрептограмина (Current Drug Targets Infectious Disorders, 2001, 1,215-25) и различным гликопептидам (Clinical Infectious Diseases, 2003, 36, supplement 1, S11-S23) требует расширения средств с альтернативными целями или способами действия. Возрастающая устойчивость важного сообщества приобретенного патогена Streptococcus pneumoniae к пенициллину и другим антибактериальным средствам также становится глобальной проблемой здравоохранения. В некоторых странах появились штаммы Mycobacterium tuberculosis с устойчивостью к нескольким лекарственным средствам. Появление и распространение устойчивых внутрибольничных и приобретенных патогенов представляет угрозу здоровью людей во всем мире.
Срочно необходимо открытие новых соединений, которые можно применять как лекарственные средства для лечения пациентов, инфицированных бактериями, особенно бактериями, устойчивыми к нескольким лекарственным средствам, такими как MRSA и VRE.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение касается нового очищенного соединения (обозначенного здесь РМ 181104), выделенного из ферментационной питательной среды микроорганизма, принадлежащего видам Kocuria (ZMA В-1 / МТСС 5269), обладающего антибактериальной активностью.
Данное изобретение также касается всех стереоизомерных форм, всех таутомерных форм РМ 181104, фармацевтически приемлемой соли(ей), его производного(ых) сложного эфира и простого эфира, представленных формулой I (как описано здесь).
Соединение РМ 181104, изомеры, фармацевтически приемлемая соль(и) и его производное(ые) сложного эфира и простого эфира, применяют для лечения и предупреждения болезней, вызванных бактериями, особенно устойчивыми к ряду лекарственных средств бактериями, такими как MRSA и VRE.
Данное изобретение далее касается фармацевтических композиций, включающих новое соединение РМ181104, изомер, фармацевтически приемлемую соль(и), его производное(ые) сложного эфира и простого эфира, как активный ингредиент, для лечения медицинских состояний, вызванных бактериями, особенно устойчивыми к ряду лекарственных средств бактериями, такими как MRSA и VRE.
Данное изобретение далее касается способов получения соединения РМ 181104 и/или его изомера(ов) из микроорганизма, принадлежащего видам Kocuria (ZMA В-1 / МТСС 5269).
Данное изобретение также касается способов получения микроорганизма, принадлежащего видам Kocuria (ZMA B-1 / МТСС 5269), при культивации которого продуцируется соединение РМ 181104 и его изомеры.
Данное изобретение также касается способов получения производных сложного эфира и простого эфира соединения РМ 181104.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1 показывает спектр ультрафиолетовой абсорбции (УФ) РМ 181104.
Фигура 2 показывает спектр инфракрасной абсорбции (ИК) РМ 181104.
Фигура 3 показывает 1H-ЯМР спектр (500 MHz) РМ 181104 в DMSO-d6 (диметилсульфоксид-d6).
Фигура 4 показывает 13С-ЯМР спектр (125 MHz) PM 181104 в DMSO-d6.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение представляет новое антибактериальное соединение РМ 181104, а также включает все стереоизомерные формы, все таутомерные формы РМ 181104, фармацевтически приемлемые соли и его производные, такие как сложные эфиры и простые эфиры.
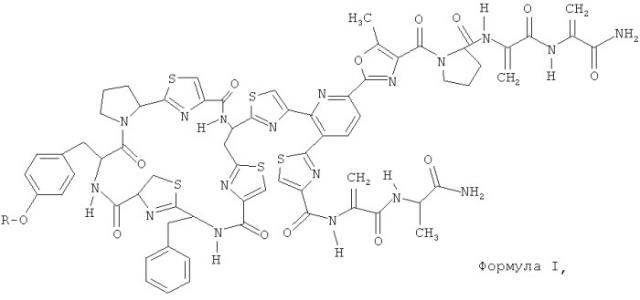
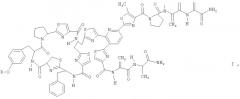
Следовательно, данное изобретение касается новых антибактериальных соединений следующей формулы I
где R=Н (РМ 181104), алкил, алкилкарбонил, (НО)2РО-, алкил-ОРО(ОН)-, (алкил-O)2РО-, циклоалкил, циклоалкилкарбонил, арил, арилкарбонил, гетероциклил и гетероциклил карбонил.
Как применяется здесь, выражение "алкил" или используется отдельно, или как часть замещающей группы, означает радикал насыщенных алифатических групп, включая алкильные группы с прямой или разветвленной цепью. Более того, если не заявлено иначе, выражение "алкил" включает незамещенные алкильные группы, а также алкильные группы, которые замещены одним или более различными заместителями. В предпочтительных вариантах осуществления алкил с прямой или разветвленной цепью имеет 20 или меньше атомов углерода в своем скелете (например, C1-C20 для прямой цепи, С3-С20 для разветвленной цепи). Примерами алкильных остатков, содержащих от 1 до 20 атомов углерода, являются метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, тетрадецил, гептадецил и эйкозил, n-изомеры всех этих остатков; изопропил, изобутил, 1-метилбутил, изопентил, неопентил, 2,2-диметилбутил, 2-метилпентил, 3-метилпентил, изогексил, 2,3,4-триметилгексил, изодецил, сек-бутил или трет-бутил. Замещенный алкил означает алкильный остаток, в котором один или более атом водорода, например 1, 2, 3, 4 или 5 атомов водорода, замещены заместителями, например галогеном, гидроксилом, сульфонилом, алкоксилом, циклоалкилом, циано, азидо, амино, ацилокси, гетероцикло, аралкилом, арилом или флуоресцентными группами, такими как NBD [N-(7-нитробенз-2-окса-1,3-диазол-4-ил)амино] или BODIPY [4,4-дифтор-5,7-диметил-4-бора-3а,4а-диаза-s-индацен] группа.
Как применяется здесь, выражение "циклоалкил" означает насыщенную моно- или бициклическую кольцевую систему, содержащую 3-10 атомов углерода и более предпочтительно имеющую 3, 4, 5, 6 или 7 атомов углерода в кольцевой структуре. Примерами циклоалкильных остатков, содержащих 3, 4, 5, 6 или 7 кольцевых атомов углерода, являются циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. Более того, если не заявлено иначе, выражение "циклоалкил" включает незамещенный циклоалкил и циклоалкил, замещенный одним или более идентичными или различными группами, выбранными из галогена, гидроксила, алкоксила, алкила, циклоалкила, циано, амино, аминоалкила, ацилокси, гетероцикло, аралкила и/или арильной группы.
Как применяется здесь, выражение "арил" означает моноциклическую или полициклическую углеводородную группу, имеющую до 10 кольцевых атомов углерода, в которой, по меньшей мере, одно карбоциклическое кольцо имеет конъюгированную систему π-электронов. Приемлемые примеры С6-С10-арильных остатков включают фенил, нафтил или бифенил, особенно фенил и нафтил. Арильные остатки, например, фенил или нафтил, обычно могут быть необязательно замещены одним или более заместителями, до пяти идентичных или различных заместителей, выбранных из групп, включающих галоген, алкил, гидроксил, ацилокси, амино, замещенный амино, циано.
Выражение "гетероциклил" означает насыщенную, частично ненасыщенную или ароматическую моноциклическую или полициклическую гетероциклическую кольцевую систему, содержащую 5, 6, 7, 8, 9 или 10 кольцевых атомов, из которых 1, 2 или 3 являются идентичными или различными гетероатомами, выбранными из азота, кислорода и серы. Приемлемыми примерами таких гетероциклильных групп являются пиридинил, пиперазинил, пиперидинил, имидазолил, пирролидинил и морфолинил. В полициклической гетероциклической кольцевой системе гетероциклил может включать либо слитые кольца, в которых два или более углеродов являются общими для двух соседних колец, или соединенные кольца, в которых кольца соединены через несмежные атомы. В полициклической гетероциклической кольцевой системе гетероциклил предпочтительно включает два слитых кольца (бициклическая), по меньшей мере, одно из которых является 5- или 6-членным гетероциклическим кольцом. Примерные бициклические гетероциклические группы включают бензоксазолил, хинолил, изохинолил, карбазолил, индолил, изоиндолил, феноксазинил, бензотиазолил, бензимидазолил, бензоксадиазолил и бензофуразанил. Гетероциклильные остатки обычно могут быть необязательно замещены одним или более идентичными или различными заместителями, выбранными из групп, включающих галоген, алкил, гидроксил, ацилокси, амин, замещенный амин, циано.
Согласно предпочтительному варианту осуществления данного изобретения группа R в формуле I может представлять собой Н, СН3СН2СН2СО, СН3(СН2)15СН2СО или
.
Согласно более предпочтительному варианту осуществления новое соединение РМ 181104, представленное выше формулой I (где R=Н), выделено из ферментационной питательной среды микроорганизма, принадлежащего видам Kocuria (ZMA В-1 / MTCC 5269), и затем очищено.
Новое соединение РМ 181104 имеет молекулярную формулу С69Н66N18O13S5 (молекулярная масса 1514) и может быть охарактеризовано какой-либо одной или более из его физико-химических и спектральных особенностей, таких как спектроскопические данные высокоэффективной жидкостной хроматографии (ВЭЖХ), масс-спектра (МС), ультрафиолетового излучения (УФ), инфракрасного излучения (ИК) и ядерного магнитного резонанса (ЯМР), как обсуждается ниже.
Объяснили строение нового соединения РМ 181104 и выполнили его полную характеристику с помощью спектроскопических данных ВЭЖХ, МС, УФ, ИК и ЯМР. Строение подтвердили трехмерным (3D) ЯМР исследованием биоактивного 15N и 13С-меченного РМ 181104.
Соединение РМ 181104 и его производные сложного эфира и простого эфира являются новыми антибиотиками, активными против бактерий, особенно устойчивых к ряду лекарственных средств бактерий, таких как MRSA и VRE.
Микроорганизмом, который можно применять для получения соединения РМ 181104, является штамм видов Kocuria (ZMA B-1 / MTCC 5269), далее по тексту называется культурой ZMA B-1, выделенный из морского образца, собранного в Палк Бэй, побережье Тамил Наду, Индия.
Данное изобретение далее представляет способ получения соединения РМ 181104 из культуры ZMA B-1, его мутантов и вариантов, при котором выращивают культуру ZMA B-1 при погруженных аэробных условиях в питательной среде, содержащей один или более источник углерода, один или более источник азота и необязательно питательные неорганические соли и/или следовые элементы; выделяют соединение РМ 181104 из культуральной питательной среды; очищают соединение РМ 181104 с помощью методик очистки, обычно применяемых в данной области.
Как применяется здесь, выражение "мутант" означает организм или клетку, несущую мутацию, которая является фенотипом, альтернативным дикому типу.
Как применяется здесь, выражение "вариант" означает отдельный организм, который заметно отличается от произвольного стандартного типа в этих видах.
Предварительную идентификацию культуры ZMA В-1, которая продуцирует РМ 181104, выполнили путем обследования морфологии его колонии, наблюдениями влажных препаратов и реакцией на окрашивание по методу Грамма. Микроскопические исследования штамма выделенной культуры ZMA В-1 выполняли в питательной среде Zobell Marine 2216 (морская питательная среда 2216), содержащей 1,5% агара, и наблюдения выполняли в 1, 2 и 3 дни инкубации при 25°С.
Рост в питательной среде Zobell Marine 2216 (морская питательная среда 2216), содержащей 1,5% агара, проявился в виде образования колонии диаметром 2 мм с гладкой поверхностью, желто-оранжевой пигментацией, правильной границей и мягкой консистенцией. Способные диффундировать пигменты в этой среде не наблюдались. При контрастно-фазовой световой микроскопии при увеличении 400 х наблюдались кокки. Кокки хорошо отделяются и выделяются. Они являются грамположительными и неподвижными. По наблюдаемой морфологии классифицировали этот организм как член семейства Micrococcaceae. Идентификацию изолятов выполняли путем сравнения их 16S рРНК полимеразной цепной реакции (ПЦР) с существующими последовательностями, доступными на сайте Национального Центра Биотехнологической Информации (NCBI) (URL: http://www.ncbi.nlm.nih.qov/). Культура ZMA В-1 депонирована в микробиологической коллекции типичных культур (МТСС) Института Микробиологической Технологии, сектор 39-А, Чандигарх - 160 036, Индия, Международного Депозиторного Органа (IDA), признанного Международной Организацией Интеллектуальной Собственности (WIPO), и был присужден номер МТСС 5269.
В добавок к специфическому микроорганизму, описанному здесь, следует понимать, что мутанты, такие как полученные применением химических или физических мутагенов, включая Х-лучи, УФ-лучи и т.д., и организмы, генетически модифицированные методиками молекулярной биологии, можно также культивировать для получения соединения РМ 181104.
Обследование приемлемых мутантов и вариантов, которые могут продуцировать соединение по данному изобретению, можно выполнить с помощью ВЭЖХ и/или определения биологической активности активных соединений, накопленных в культуральной питательной среде, например анализируя соединения по антибактериальной активности.
Среда и/или питательная среда, применяемая для выделения и культивирования культуры ZMA В-1, которая продуцирует соединение РМ 181104, предпочтительно содержит источники углерода, азота и питательные неорганические соли. Источниками углерода являются, например, один или более из крахмала, глюкозы, сахарозы, декстрина, фруктозы, мелассы, глицерола, лактозы или галактозы. Предпочтительным источником углерода является глюкоза. Источниками азота являются, например, один или более из соевой муки, арахисовой муки, дрожжевого экстракта, говяжьего экстракта, пептона, солодового экстракта, кукурузного экстракта, желатина или казаминовых кислот. Предпочтительными источниками азота являются пептон и дрожжевой экстракт. Питательными неорганическими солями являются, например, один или более из натрия хлорид, калия хлорид, кальция хлорид, магния хлорид, стронция хлорид, калия бромид, натрия фторид, натрия кислый фосфат, калия кислый фосфат, динатрия фосфат, кальция карбонат, натрия бикарбонат, натрия силикат, аммония нитрат, калия нитрат, натрия сульфат, аммония сульфат, магния сульфат, трехвалентного железа цитрат или борной кислоты. Кальция карбонат, натрия хлорид и магния хлорид являются предпочтительными.
Поддерживание культуры ZMA B-1 можно осуществлять в температурном диапазоне от 21°С до 35°С и рН от около 6,5 до 8,5. Обычно культуру ZMA B-1 поддерживают при 27°С-29°С и рН около 7,4-7,8. Хорошо растущие культуры можно хранить в холодильнике при 4°С-8°С.
Культивацию высеянной культуры ZMA В-1 можно осуществлять в температурном диапазоне от 25°С до 35°С и рН от около 6,5 до 8,5 в течение 20-55 часов при 200-280 rpm. Обычно высеянную культуру ZMA B-1 культивируют при 29°С-31°С и рН от около 7,4 до 7,8 в течение 24-48 часов при 230-250 rpm.
Получение соединения РМ 181104 можно осуществлять путем культивирования культуры ZMA B-1 ферментацией в температурном диапазоне от 26°С до 36°С и рН от около 6,5 до 8,5 в течение 24-96 часов при 60-140 rpm и аэрации 100-200 литров в минуту. Обычно культуру ZMA B-1 культивируют при 30°С-32°С и рН 7,4-7,8 в течение 40-72 часов при 90-110 rpm и аэрации 140-160 литров в минуту.
Получение соединения РМ 181104 можно выполнить путем культивирования культуры ZMA B-1 в приемлемой питательной среде в описанных здесь условиях, предпочтительно в погруженных аэробных условиях, например во взбалтываемых колбах, а также в лабораторных ферментаторах. Развитие ферментации и получение соединения РМ 181104 можно выявить высокоэффективной жидкостной хроматографией (ВЭЖХ) и измерением биоактивности культуральной питательной среды по видам Staphylococci и/или Enterococci известным способом микробиологического анализа диффузии в агар в чашках Петри. Предпочтительной культурой является Staphylococcus aureus 3066, представляющая собой штамм, устойчивый к метициллину, β-лактамовый антибиотик, сообщения о котором имеются в литературе, и Enterococcus faecium R2 (VRE), устойчивая к ванкомицину. В полученной культуральной питательной среде соединение РМ 181104 присутствует в культуральном фильтрате, а также в клеточной массе и может быть выделено известными методиками разделения, такими как экстракция растворителем и колоночная хроматография. Таким образом, соединение РМ 181104 можно выделить из культурального фильтрата экстракцией при рН от около 5 до 9 с несмешивающимся с водой растворителем, таким как петролейный эфир, дихлорметан, хлороформ, этилацетат, диэтиловый эфир или бутанол, или хроматографией гидрофобного взаимодействия с использованием полимерных смол, таких как "Diaion HP-20®" (Mitsubishi Chemical Industries Limited, Япония), "Amberlite XAD®" (Rohm и Haas Industries U.S.A.), активированным углем, или ионообменной хроматографией при рН 5-9. Активный материал можно выделить из клеточной массы экстракцией со смешиваемым с водой растворителем, таким как метанол, ацетон, ацетонитрил, n-пропанол, или изопропанол, или с несмешивающимся с водой растворителем, таким как петролейный эфир, дихлорметан, хлороформ, этилацетат или бутанол. Другой вариант заключается в экстракции цельной питательной среды с растворителем, выбранным из петролейного эфира, дихлорметана, хлороформа, этилацетата, метанола, ацетона, ацетонитрила, n-пропанола, изопропанола или бутанола. Обычно активный материал экстрагируют с этилацетатом из цельной питательной среды. Концентрация и лиофилизация экстрактов дает активный неочищенный материал.
Соединение РМ 181104 данного изобретения можно выделить из неочищенного материала фракционированием с помощью какой-либо из следующих методик: нормально-фазовая хроматография (с использованием оксида алюминия или силикагеля в качестве стационарной фазы; элюентов, таких как петролейный эфир, этилацетат, дихлорметан, ацетон, хлороформ, метанол или их комбинации; и добавок аминов, таких как NEt3); обратно-фазовая хроматография (с использованием обратно-фазового силикагеля, такого как диметилоктадецилсилилсиликагель (RP-18), или диметилоктилсилилсиликагель (RP-8), в качестве стационарной фазы; и элюентов, таких как вода, буферы (например, фосфат, ацетат, цитрат (рН 2-8)), и органических растворителей (например, метанол, ацетонитрил, ацетон, тетрагидрофуран или комбинации этих растворителей)); гельпроникающая хроматография (с использованием смол, таких как Sephadex LH-20® (Pharmacia Chemical Industries, Швеция), TSKgel® Toyopearl HW (TosoHaas, Tosoh Corporation, Япония) в растворителях, таких как метанол, хлороформ, ацетон, этилацетат или их комбинации, или Sephadex® G-10 и G-25 в воде); или противоточная хроматография (с использованием двухфазной системы элюента, выполненной из двух или более растворителей, таких как вода, метанол, этанол, изопропанол, n-пропанол, тетрагидрофуран, ацетон, ацетонитрил, метилен хлорид, хлороформ, этилацетат, петролейный эфир, бензол и толуол). Эти методики можно применять повторно, отдельно или в комбинации. Типичным способом является хроматография на обратно-фазовом силикагеле (RP-18).
Соединение РМ 181104 и его изомеры можно превратить в их фармацевтически приемлемые соли, которые предусмотрены данным изобретением. Соли можно получить стандартными методами, известными специалисту в данной области, например, соли, такие как соли натрия и калия, можно получить обработкой соединения РМ 181104 и его изомеров приемлемыми основаниями натрия или калия, например, натрия гидроксид, калия гидроксид.
Сложные эфиры и простые эфиры соединения РМ 181104, представленного формулой I, можно получить способами, приведенными в литературе (Advanced Organic Chemistry, 1992, 4й Edition, J. March, John Wiley & Sons). Сложные эфиры также можно получить способом, описанным в литературе (J. Med. Chemistry, 1992, 35, 145-151). В предпочтительном варианте осуществления данного изобретения соединения формулы I, где R является алкилом, циклоалкилом, арилом или гетероциклилом, получают реакцией РМ 181104 с соответствующей кислотой формулы RCOOH; где R представляет собой алкил, циклоалкил, арил или гетероциклил, в присутствии связывающего средства, такого как дициклогексил карбодимид (DCC) и каталитических количеств основания, такого как диметиламинопиридин (DMAP).
Фосфатные эфиры можно получить способом, известным из литературы (Bioorganic & Medicinal Chemistry Letters, 1994, vol.4, No. 21, 2567-2572). Простые эфиры можно получить способом, описанным в патенте США 7022667, который включен в данное описание ссылкой.
Соединение РМ 181104 обладает антибактериальной активностью против широкого ряда бактериальных штаммов. Соединение РМ 181104, стереоизомеры, фармацевтически приемлемые соли и производные, такие как их сложные эфиры и простые эфиры, отдельно или вместе, можно вводить животным, таким как млекопитающие, включая людей, как фармацевтические препараты и в форме фармацевтических композиций. Следовательно, данное изобретение также касается соединения РМ 181104, его стереоизомеров, его фармацевтически приемлемых солей и его производных сложного эфира и простого эфира для применения как фармацевтических препаратов и применения соединения РМ 181104, стереоизомеров, фармацевтически приемлемых солей и его производных сложного эфира и простого эфира для получения лекарственных средств, обладающих антибактериальной активностью.
Данное изобретение далее касается фармацевтических композиций, которые содержат эффективное количество соединения РМ 181104 и/или стереоизомеров и/или одну или более фармацевтически приемлемых солей и/или производных особенно его сложных эфиров и простых эфиров, вместе с фармацевтически приемлемым носителем. Эффективное количество соединения РМ 181104, или его стереоизомеров, или его фармацевтически приемлемых солей, или его производных как активного ингредиента в фармацевтических препаратах обычно составляет от около 0,01 мг до 100 мг.
Данное изобретение также касается способа получения лекарственного средства, содержащего соединение РМ 181104, и/или стереоизомеры, и/или одну или более фармацевтически приемлемых солей, и/или производные его сложного эфира и простого эфира, для лечения и предупреждения болезней, вызванных бактериальными инфекциями.
Соединения данного изобретения особенно применимы как антибактериальные средства. Данное изобретение, следовательно, касается применения соединения РМ 181104, и/или стереоизомеров, и/или одной или более фармацевтически приемлемых солей, и/или его производных, для получения лекарственного средства для предупреждения или лечения болезней, вызванных бактериальными инфекциями. Бактериальные инфекции, для лечения которых применяют соединения данного изобретения, могут быть вызваны бактериями, принадлежащими видам Staphylococcus, Streptococcus, Enterococcus и Bacillus.
Выражение "виды Staphylococcus" означает грамположительные бактерии, которые под микроскопом выглядят как грозди винограда, а при выращивании в чашках Петри на кровяном агаре - как большие, круглые, золотисто-желтые колонии, часто с β-гемолизом. Staphylococcus aureus, принадлежащий к видам Staphylococcus, вызывает ряд гнойных (пиогенных) инфекций, таких как поверхностные повреждения кожи, например, фурункулы, ячмени на веках и фурункулез; более тяжелые инфекции, такие как пневмония, мастит, флебит, менингит и инфекции мочевого тракта; и глубокие инфекции, такие как остеомиелит и эндокардит. Staphylococcus aureus является главной причиной приобретенной в больнице (внутрибольничной) инфекции хирургических ран и инфекций, населяющих медицинские устройства. Staphylococcus aureus вызывает отравление пищи выделением энтеротоксинов в пищу и синдром токсического шока из-за выделения суперантигенов в кровяное русло.
Выражение "виды Streptococcus" означает род сферических грамположительных бактерий, принадлежащий типу Firmicutes. Streptococci являются молочнокислыми бактериями. Виды Streptococcus вызывают инфекционные болезни, такие как менингит, бактериальная пневмония, эндокардит, рожистое воспаление и некротический фасцит ("плотоядные" бактериальные инфекции).
Выражение "виды Enterococcus" означает род молочнокислых бактерий типа Firmicutes. Это грамположительные кокки, которые часто встречаются парами (диплококки). Enterococci являются факультативными анаэробными организмами. Enterococci среди наиболее частых причин внутрибольничных инфекций. Enterococci развивают устойчивость к антибиотикам, таким как гентамицин и ванкомицин.
Выражение "виды Bacillus" означает большое число различных палочковидных грамположительных бактерий, которые перемещаются благодаря ресничкам, и являются аэробными. Они также принадлежат типу Firmicutes. Члены этого рода способны образовывать эндоспоры, которые высоко устойчивы к неблагоприятным условиям окружающей среды. Bacillus cereus, принадлежащая видам Bacillus, вызывает два типа пищевых интоксикаций. Один тип характеризуется симптомами тошноты, рвоты и спазмов живота. Второй тип проявляется, прежде всего, в спазмах живота и диареи. Инфекции, вызываемые Bacillus subtilis, которая принадлежит видам Bacillus, включают бактериемию, эндокардит, пневмонию и сепсис у пациентов с компрометированными иммунными статусами.
Соединения данного изобретения можно вводить орально, назально, местно, подкожно, внутримышечно, внутривенно или другими способами введения.
Фармацевтические композиции, содержащие РМ 181104, или стереоизомер, или фармацевтически приемлемую соль, или его производные сложного эфира или простого эфира, с другим фармацевтически активными веществами можно получить смешиванием активных соединений с одним или более фармакологически переносимым вспомогательным веществом и/или формообразующим средством, таким как увлажняющие средства, растворяющим средством, таким как сурфактанты, основы, тонические средства, наполнители, красители, средства, маскирующие вкус, смазывающие вещества, средства, вызывающие дезинтеграцию, разбавители, связывающие вещества, пластификаторы, эмульгаторы, мазевые основы, размягчающие средства, сгустители, полимеры, липиды, масла, сорастворители, средства комплексообразования или буферные вещества, и превращением смеси в приемлемую фармацевтическую форму, такую как, например, таблетки, покрытые таблетки, капсулы, гранулы, порошки, крема, мази, гели, сиропы, эмульсии, суспензии или растворы, приемлемые для парентерального введения.
Примерами вспомогательных веществ и/или наполнителей, которые могут быть упомянуты, являются кремофор, полоксамер, бензалкониум хлорид, натрия лаурилсульфат, декстроза, глицерин, магния стеарат, полиэтиленгликоль, крахмал, декстрин, лактоза, целлюлоза, карбоксиметилцеллюлоза натрия, тальк, агар-агар, минеральное масло, животное масло, растительное масло, органические и минеральные воски, парафин, гели, пропиленгликоль, бензиловый спирт, диметилацетамид, этанол, полигликоли, твин 80, солютол HS 15 и вода.
Также возможно применение активных веществ, как таковых, без основ или разбавителей в приемлемой форме, например в капсулах.
Как является общепринятым, галеная формуляция и способ введения, а также диапазон дозировки, которые приемлемы в специфическом случае, зависят от видов, подлежащих лечению, и уровня соответствующего состояния или болезни, и могут быть оптимизированы применением способов, известных в данной области. В среднем дневная доза активного соединения у пациента составляет от 0,0005 мг до 15 мг на кг, обычно от 0,001 мг до 7,5 мг на кг.
Далее приводятся иллюстративные примеры данного изобретения, не ограничивающие его объем.
Пример 1
Выделение культуры ZMA В-1 из морского источника
a) Композиция среды выделения
Питательная среда Zobell Marine 2216 (агарифицирована 1,5% агар-агара)
Продуктов переваривания пепсином животных тканей 5,0 г, дрожжевого экстракта 1,0 г, трехвалентного железа цитрата 0,1 г, натрия хлорида 19,45 г, магния хлорида 8,8 г, натрия сульфата 3,24 г, кальция хлорида 1,8 г, калия хлорида 0,55 г, натрия бикарбоната 0,16 г, калия бромида 80,0 мг, стронция хлорида 34,0 мг, борной кислоты 22,0 мг, натрия силиката 4,0 мг, натрия фторат 2,4 мг, аммония нитрата 1,6 мг, динатрия фосфата 8,0 мг, порошка агара 15,0 г, дважды дистиллированной воды 1,0 л, окончательная рН (при 25°С) 7,4-7,8.
b) Методика
Образец губки Spirastrella inconstans var. digitata (Dendy) отобрали в Палк Бэй, побережье Тамил Наду, Индия, с помощью акваланга на трехметровой глубине. Образец губки ополоснули в стерильной морской воде и немедленно перенесли в стерильные полиэтиленовые контейнеры. Контейнеры хранили при -20°С и перевозили, поддерживая температуру ниже 0°С, в лабораторию для дальнейших исследований. При попадании в лабораторию образцы губки хранили при температуре ниже 0°С, а позже отогрели до комнатной температуры (25±2°С) только перед выделением культуры. Образец губки разрезали в стерильных условиях на кусочки 2 х 2 см и суспендировали в 5 мл стерильной морской воды в 25 мл стерильной пробирке. Пробирку встряхивали 30 секунд; морскую воду слили и добавили свежую морскую воду. Эти действия повторили три раза. Окончательно слили морскую воду, а кусочки губки поместили в чашки Петри, содержащие вышеупомянутую среду выделения [питательная среда Zobell Marine 2216 (агарифицированная 1,5% агар-агара); HiMedia]. Чашки Петри инкубировали при комнатной температуре (25±2°С), пока в них не проявился рост. Колонии, выросшие в чашках Петри, выделили на основании особенностей колоний и сделали посев штрихом в чашки Петри, содержащие вышеупомянутую среду выделения [питательная среда Zobell Marine 2216 (агарифицированная 1,5% агар-агара); HiMedia]. Изоляты повторно пересеяли до получения чистой культуры ZMA В-1. Культура ZMA В-1, таким образом, выделена из выращенных микроорганизмов как отдельный изолят.
Пример 2
Очистка культуры ZMA В-1
а) Композиция среды выделения
Питательная среда Zobell Marine 2216 (агарифицированная 1,5% агар-агара)
Пептона 5,0 г, дрожжевого экстракта 1,0 г, трехвалентного железа цитрата 0,1 г, натрия хлорида 19,45 г, магния хлорида 8,8 г, натрия сульфата 3,24 г, кальция хлорида 1,8 г, калия хлорида 0,55 г, натрия бикарбоната 0,16 г, калия бромида 0,08 г, стронция хлорида 34,0 мг, борной кислоты 22,0 мг, натрия силиката 4,0 мг, натрия фтората 2,4 мг, аммония нитрата 1,6 мг, динатрия фосфата 8,0 мг, агара 15,0 г, деминерализованной воды 1,0 л, рН 7,4-7,8.
b) Методика
Культуру получили на питательной среде Zobell Marine 2216 (агарифицированная 1,5% агар-агара) в чашке Петри диаметром 15 мм. Культуру, растущую на чашке Петри, пересеяли штрихом на скошенную питательную среду Zobell Marine 2216 (агарифицированную 1,5% агар-агара). Скошенную среду инкубировали 2 дня при 25°С. Одну из отдельных колоний в верхней части скошенной среды перенесли на свежие скошенные среды. Скошенные среды инкубировали 2 дня при 25°С. Затем их использовали для ферментации во взбалтываемых колбах для первичного противоинфекционного обследования.
Пример 3
Поддерживание продуцирующего штамма - культуры ZMA В-1
a) Композиция среды (питательная среда Zobell Marine 2216)
Пептона 5,0 г, дрожжевого экстракта 1,0 г, трехвалентного железа цитрата 0,1 г, натрия хлорида 19,45 г, магния хлорида 8,8 г, натрия сульфата 3,24 г, кальция хлорида 1,8 г, калия хлорида 0,55 г, натрия бикарбоната 0,16 г, калия бромида 0,08 г, стронция хлорида 34,0 мг, борной кислоты 22,0 мг, натрия силиката 4,0 мг, натрия фтората 2,4 мг, аммония нитрата 1,6 мг, динатрия фосфата 8,0 мг, агара 15,0 г, деминерализованной воды 1,0 л, рН 7,4-7,8.
b) После полного растворения ингредиентов путем нагревания полученный раствор распределили в пробирки и стерилизовали при 121°С в течение 30 минут. Пробирки охладили и среде позволили затвердеть в скошенном положении. Скошенный агар засеяли штрихом растущей культурой ZMA В-1 с помощью проволочной петли и инкубировали при 27-29°С до проявления хорошего роста. Хорошо растущие культуры хранили в холодильнике при 4-8°С.
Пример 4
Ферментация культуры ZMA В-1 во взбалтываемых колбах
a) Композиция среды посева (питательная среда Zobell Marine 2216)
Пептона 5,0 г, дрожжевого экстракта 1,0 г, трехвалентного железа цитрата 0,1 г, натрия хлорида 19,45 г, магния хлорида 8,8 г, натрия сульфата 3,24 г, кальция хлорида 1,8 г, калия хлорида 0,55 г, натрия бикарбоната 0,16 г, калия бромида 0,08 г, стронция хлорида 34,0 мг, борной кислоты 22,0 мг, натрия силиката 4,0 мг, натрия фтората 2,4 мг, аммония нитрата 1,6 мг, динатрия фосфата 8,0 мг, деминерализованной воды 1,0 л, рН 7,4-7,8.
b) Вышеупомянутую среду распределили по 40 мл в 500 мл колбы Эрленмейера и автоклавировали при 121°С 30 минут. Колбы охладили до комнатной температуры, каждую колбу инокулировали с помощью петли хорошо растущим штаммом (культура ZMA B-1) на скошенной среде и взбалтывали на ротационной мешалке в течение 24-48 часов при 230-250 rpm при 30°С (±1°С) для получения культуры засева.
c) Композиция среды продуцирования
Пептона 5,0 г, дрожжевого экстракта 1,0 г, трехвалентного железа цитрата 0,1 г, натрия хлорида 19,45 г, магния хлорида 8,8 г, натрия сульфата 3,24 г, кальция хлорида 1,8 г, калия хлорида 0,55 г, натрия бикарбоната 0,16 г, калия бромида 0,08 г, стронция хлорида 34,0 мг, борной кислоты 22,0 мг, натрия силиката 4,0 мг, натрия фтората 2,4 мг, аммония нитрата 1,6 мг, динатрия фосфата 8,0 мг, деминерализованной воды 1,0 л, рН 7,4-7,8.
d) 40 мл среды продуцирования в колбах Эрленмейера емкостью 500 мл автоклавировали при 121°С 30 минут, охладили до 29-30°С и засеяли 2 мл культуры засева, упомянутой в примере 4b.
e) Параметры ферментации
Температура 29-30°С; взбалтывание 230-250 rpm; время сбора 48-72 часов.
Продуцирование соединения РМ 181104 в ферментационной питательной среде определили, анализируя биоактивность по сравнению с Enterococcus faecium R2 (VRE) и/или S. aureus 3066 MRSA штаммом способом диффузии в агар. Показатель рН культуральной питательной среды составил 7,0-8,0. Культуральную питательную среду собрали, и всю ее использовали для анализа биоактивности, которая показывает присутствие соединения РМ 181104 в ферментационной питательной среде.
Пример 5
Получение культуры засева во взбалтываемых колбах для ферментации
a) Композиция среды
Пептона 5,0 г, дрожжевого экстракта 1,0 г, трехвалентного железа цитрата 0,1 г, натрия хлорида 19,45 г, магния хлорида 8,8 г, натрия сульфата 3,24 г, кальция хлорида 1,8 г, калия хлорида 0,55 г, натрия бикарбоната 0,16 г, калия бромида 0,08 г, стронция хлорида 34,0 мг, борной кислоты 22,0 мг, натрия силиката 4,0 мг, натрия фтората 2,4 мг, аммония нитрата 1,6 мг, динатрия фосфата 8,0 мг, деминерализованной воды 1,0 л, рН 7,4-7,8.
b) Вышеупомянутую среду распределили по 200 мл в 1 л колбы Эрленмейера и автоклавировали при 121°С 30 минут. Колбы охладили до комнатной температуры, каждую колбу инокулировали с помощью петли хорошо растущим штаммом (культура ZMA В-1) на скошенной среде и взбалтывали на ротационной мешалке в течение 24-48 часов при 230-250 rpm при 29-31°С для получения культуры засева.
Пример 6
Культивирование культуры ZMA В-1 в ферментаторе
а) Композиция среды продуцирования
Глюкозы 50,0 г, дрожжевого экстракта 11,0 г, пептона 4,0 г, говяжьего экстракта 4,0 г, кальция карбоната 5 г, натрия хлорида 2,5 г, деминерализованной воды 1 л, рН 7,6 (перед стерилизацией).
b) 250 л среды продуцирования в 300 л ферментаторе с 80 мл десмофена как противопенного средства стерилизовали in situ в течение 30 минут при 121°С, охладили до 29-31°С и засеяли 6 л культуры засева, упомянутой в примере 5b.
c) Параметры ферментации
Температура 30-32°С; взбалтывание 100 rpm; аэрация 150 л в минуту; время сбора 44-66 часов.
Продуцирование соединения РМ 181104 в ферментационной питательной среде определил