Рекомбинантный спидроиновый белок главной ампулярной железы, способный к полимеризации, рекомбинантный слитый белок, способный к управляемой полимеризации, полимер спидроинового белка главной ампулярной железы, композиция для управляемой полимеризации, рекомбинантная молекула нуклеиновой кислоты (варианты), способ получения растворимого слитого белка, способ получения полимера спидроинового белка главной ампулярной железы и способ культивирования эукариотических клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению белков паука, и может быть использовано в медицине. Рекомбинантным путем получают спидроиновый белок главной ампулярной железы, который состоит из 150-420 аминокислотных остатков и описывается формулой REP-CT, где REP - это фрагмент белка из 80-300 аминокислотных остатков, выбранный из L(AG)nL, L(AG)nAL, L(GA)nL или L(GA)nGL, где n - целое число от 4 до 8. Каждый индивидуальный сегмент А состоит из 8-18 аминокислотных остатков, где от 0 до 3 аминокислотных остатков не являются Ala, а остальные - представляют собой Ala. Каждый отдельный сегмент G состоит из 12-30 аминокислотных остатков, где по меньшей мере 40% аминокислотных остатков являются Gly. Каждый индивидуальный сегмент L является линкерной аминокислотной последовательностью из 0-20 аминокислотных остатков. СТ - это фрагмент от 70 до 120 аминокислотных остатков С-концевого фрагмента спидроинового белка главной ампулярной железы. Изобретение позволяет получить спидроиновый белок главной ампулярной железы, способный к полимеризации, а также на его основе получить слитый белок, способный к управляемой полимеризации. 9 н. и 6 з.п. ф-лы, 1 табл., 9 ил., 13 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области рекомбинантного получения белков. Более подробно, настоящее изобретение относится к рекомбинантному получению белков шелка паука. В настоящем изобретении предоставляются новые выделенные спидроиновые белки главной ампулярной железы и слитые белки главной ампулярной железы, а также способы получения таких белков и молекулы полинуклеиновых кислот для их получения. Кроме того, предоставляются полимеры спидроиновых белков главной ампулярной железы и способы получения таких полимеров.
УРОВЕНЬ ТЕХНИКИ
Паучьи шелка представляют собой природные полимеры с высокими характеристиками, обладающие исключительной крепкостью благодаря комбинации прочности и эластичности. Пауки имеют до семи специализированных желез, которые вырабатывают множество видов шелковой нити с различными механическими свойствами и функциями. Канатный шелк, вырабатываемый главной ампулярной железой, представляет собой очень прочное волокно и в весовом соотношении оно превосходит созданные человеком материалы, такие как высокопрочная сталь и кевлар. Свойства канатного шелка являются привлекательными для создания новых материалов для медицинских или технических целей.
Канатный шелк состоит из двух основных полипептидов, обычно называемых спидроинами главной ампулярной железы (MaSp) 1 и 2, но полипептиды из Araneus diadematus называются ADF-3 и ADF-4. Указанные белки имеют кажущуюся молекулярную массу в диапазоне 200-720 кДа, в зависимости от возраста образца и условий анализа, но не было публикаций о полноразмерном гене канатного шелка паука. Свойства полипептидов канатного шелка описаны в Huemmerich, D. et al. Novel assembly properties of recombinant spider dragline silk proteins. Curr. Biol. 14, 2070-2074 (2004). Известные спидроины канатного шелка состоят из многократно повторяющихся блоков чередующихся сегментов, богатых аланином, которые образуют кристаллические β-листы в волокне, и сегментов, богатых глицином, которые являются более гибкими и в основном лишены упорядоченной структуры. С-концевой участок не имеет повторов, является высоко консервативным в разных видах и принимает конформацию α-спирали. N-концевой участок белков канатного шелка был охарактеризован совсем недавно, причем показано, что N-концевой участок является высоко консервативным в различных спидроинах и также у различных видов пауков (Rising, A. et al. N-terminal nonrepetitive domain common to dragline, flagelliform, and cylindriform spider silk proteins. Biomacromolecules 7, 3120-3124 (2006)).
Механические свойства канатного шелка отличаются у различных видов пауков; канатный шелк Euprosthenops sp. является более жестким, прочным (требует большего усилия для разрыва) и менее гибким, чем канатный шелк, например Araneus diadematus или Nephila clavipes. Канатный шелк Euprosthenops sp., по-видимому, содержит большую количественную долю кристаллической β-листовой структуры, чем канатный шелк Araneus diadematus, скорее всего по этой причине MaSp из Euprosthenops sp. имеет самое высокое содержание полиаланина среди всех исследованных до настоящего времени видов (Pouchkina-Stantcheva, N. N. & McQueen-Mason, S. J. Molecular studies of a novel dragline silk from a nursery web spider, Euprosthenops sp. (Pisauridae). Comp Biochem Physiol B Biochem Mol Biol 138, 371-376 (2004)).
В опытах по получению искусственных волокон паутины использовались фрагменты натуральных или синтетических генов, кодирующих белки канатного шелка, потому что полноразмерный ген еще не описан. Рекомбинантные белки канатного шелка экспрессированы в различных системах, включая бактерии, дрожжи, клетки млекопитающих, растения, клетки насекомых, трансгенного тутового шелкопряда и трансгенных коз. Для примера, см. Lewis, R. V. et al. Expression and purification of a spider silk protein: a new strategy for producing repetitive proteins. Protein Expr. Purif. 7, 400-406 (1996); Fahnestock, S. R. & Irwin, S. L. Synthetic spider dragline silk proteins and their production in Escherichia coli. Appl. Microbiol. Biotechnol. 47, 23-32 (1997); Arcidiacono, S. et al. Purification and characterization of recombinant spider silk expressed in Escherichia coli. Appl. Microbiol. Biotechnol. 49, 31-38 (1998); Fahnestock, S. R. & Bedzyk, L. A. Production of synthetic spider dragline silk protein in Pichia pastoris. Appl. Microbiol. Biotechnol. 47, 33-39 (1997); and Lazaris, A. et al. Spider silk fibers spun from soluble recombinant silk produced in mammalian cells. Science 295, 472-476 (2002).
В международном патенте WO 2004/016651 (Университет Йорка) раскрыты последовательности нуклеиновых кислот, кодирующих внутренние повторяющиеся части белков MaSp1 из Euprosthenops sp. Белок не экспрессирован.
В публикации Huemmerich, D. et al. Primary structure elements of spider dragline silks and their contribution to protein solubility. Biochemistry 43, 13604-13612 (2004) раскрывается искусственный ген, "(AQ)12NR3", кодирующий повторяющиеся фрагменты, богатые Ala, и фрагменты, богатые Gly/Gln, и неповторяющийся фрагмент, которые получены из ADF3 Araneus. Ген экспрессирован с образованием растворимого белка (59,8 кДа, >528 aa), который агрегирует, но не образует полимеров или волокон. Содержание аланина в белке составляет 10-15%.
В международном патенте WO 03/057727 раскрыта экспрессия растворимых рекомбинантных полипептидов шелка в клеточных линиях млекопитающих и животных. Один экспрессированный полипептид шелка (ADF-3; 60 кДа, 652 aa) состоит из повторяющейся единицы и неповторяющегося гидрофильного домена. Другой экспрессированный полипептид шелка (ADF-3 His; 63 кДа, 677 aa) состоит из повторяющейся единицы, неповторяющегося гидрофильного домена, эпитопа c-myc и тага из шести гистидинов. Повторяющаяся единица имеет низкое содержание Ala (10-20%). Полученные полипептиды шелка имеют низкую растворимость в водных средах и/или образуют преципитаты. Поскольку полученные полипептиды шелка не полимеризуются самопроизвольно, то для получения полимеров или волокон необходимо формование.
Несколько факторов затрудняют экспрессию белков канатного шелка. Из-за многократной повторяемости генов, которая сопровождается ограниченным аминокислотным составом белков, происходят ошибки транскрипции и трансляции. Другой причиной может быть истощение пулов тРНК в микробных системах экспрессии с последующей разобщенной трансляцией, приводящей к преждевременной терминации синтеза белка. В качестве других причин прерывания синтеза белка обсуждаются строение вторичной структуры мРНК и рекомбинация генов. Показано, что нативные гены MaSp длиной больше чем 2,5 т.п.н. являются нестабильными в бактериальных хозяевах. Кроме того, существуют сложности в поддержании рекомбинантных белков шелка в растворимой форме, поскольку как фрагменты канатного шелка природного происхождения, так и созданные блочные сополимеры, особенно белки, полученные из MaSpl/ADF-4, легко образуют аморфные агрегаты, вызывающие осаждение и потерю белка. См. Huemmerich, D. et al. Primary structure elements of spider dragline silks and their contribution to protein solubility. Biochemistry 43, 13604-13612 (2004) and Lazaris, A. et al. Spider silk fibers spun from soluble recombinant silk produced in mammalian cells. Science 295, 472-476 (2002).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предоставление нового белка шелка паука, из которого могут быть получены волокна шелка паука.
Другой целью настоящего изобретения является предоставление водорастворимого белка шелка паука, который при простом воздействии самополимеризуется в волокна. Это дает возможность для уникальных применений, таких как культивирование эукариотических клеток на волокнах. Кроме того, данное свойство делает возможным проведение всех последующих стадий при физиологических условиях, что снижает риск токсичности и денатурации белка.
Целью настоящего изобретения также является предоставление волокон нового белка шелка паука.
Одной целью настоящего изобретения является предоставление белков шелка паука в большом количестве, которые после простой обработки могут легко самополимеризоваться с образованием волокна.
Также целью изобретения является предоставление способов получения белков шелка и волокон белков шелка паука.
Для данных и других целей, которые становятся очевидными из последующего раскрытия, в настоящем изобретении по одному аспекту предоставляется выделенный спидроиновый белок главной ампулярной железы, где белок состоит из 150-420 аминокислотных остатков и описывается формулой REP-CT, где REP представляет собой фрагмент белка, имеющий 80-300 аминокислотных остатков, где указанный фрагмент выбран из группы L(AG) n L, L(AG) n AL, L(GA) n L, L(GA) n GL, где n представляет собой целое число от 4 до 8; каждый индивидуальный сегмент A представляет собой аминокислотную последовательность из 8-18 аминокислотных остатков, где от 0 до 3 аминокислотных остатков не являются Ala, и остальные аминокислотные остатки представляют собой Ala; каждый индивидуальный сегмент G является аминокислотной последовательностью из 12-30 аминокислотных остатков, где по меньшей мере 40% аминокислотных остатков являются Gly; и каждый индивидуальный сегмент L является линкерной аминокислотной последовательностью из 0-20 аминокислотных остатков; и CT представляет собой фрагмент белка, имеющий от 70 до 120 аминокислотных остатков, фрагмент которого является C-концевым фрагментом, полученным из спидроинового белка главной ампулярной железы или из его производных.
Настоящее изобретение основано на идентификации белкового мотива, которого достаточно для формирования волокон, подобных шелку, и на применении указанного мотива для построения рекомбинантных белков MaSp, которые возможно вырабатывать в подходящих хозяевах, таких как бактерии, предпочтительно E. coli.
В определенных воплощениях согласно изобретению каждый индивидуальный сегмент А имеет, по меньшей мере, 80% идентичности с аминокислотной последовательностью, выбранной из группы аминокислотных остатков 7-19, 43-56, 71-83, 107-120, 135-147, 171-183, 198-211, 235-248, 266-279, 294-306, 330-342, 357-370, 394-406, 421-434, 458-470, 489-502, 517-529, 553-566, 581-594, 618-630, 648-661, 676-688, 712-725, 740-752, 776-789, 804-816, 840-853, 868-880, 904-917, 932-945, 969-981, 999-1013, 1028-1042 и 1060-1073 SEQ ID NO: 3; аминокислотных остатков 31-42, 61-75, 90-104, 122-135 и 153-171 SEQ ID NO: 9; аминокислотных остатков 12-25, 46-60, 75-88, 112-119, 150-158 и 173-180 SEQ ID NO: 13; аминокислотных остатков 31-42 SEQ ID NO: 14; и аминокислотных остатков 122-135 SEQ ID NO: 15. В специфических воплощениях каждый индивидуальный сегмент А является аминокислотной последовательностью, выбранной из данной группы аминокислотных последовательностей.
В некоторых воплощениях согласно изобретению каждый индивидуальный сегмент G имеет, по меньшей мере, 80% идентичности с аминокислотной последовательностью, выбранной из группы аминокислотных остатков 20-42, 57-70, 84-106, 121-134, 148-170, 184-197, 212-234, 249-265, 280-293, 307-329, 343-356, 371-393, 407-420, 435-457, 471-488, 503-516, 530-552, 567-580, 595-617, 631-647, 662-675, 689-711, 726-739, 753-775, 790-803, 817-839, 854-867, 881-903, 918-931, 946-968, 982-998, 1014-1027, 1043- 1059 и 1074-1092 SEQ ID NO: 3; SEQ ID NO: 5; SEQ ID NO: 6; SEQ ID NO: 7; аминокислотных остатков 11-30, 43-60, 76-89, 105-121 и 136-152 SEQ ID NO: 9; и аминокислотных остатков 1-11, 26-45, 61-74, 89-111, 120-149 и 159-172 SEQ ID NO: 13. В специфических воплощениях каждый индивидуальный сегмент G является идентичным аминокислотной последовательности, выбранной из данной группы аминокислотных последовательностей.
В определенных воплощениях согласно изобретению указанный фрагмент СТ имеет по меньшей мере 50% идентичности с SEQ ID NO: 8 или по меньшей мере 80% идентичности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 4, аминокислотных остатков 172-269 SEQ ID NO: 9, аминокислотных остатков 181-276 SEQ ID NO: 13, и аминокислотных остатков 172-269 SEQ ID NO: 16, а также с любой аминокислотной последовательностью фигуры 3, особенно с последовательностями MaSp1 фигуры 3. В определенных воплощениях указанный фрагмент СТ представляет собой аминокислотную последовательность, выбранную из данной группы аминокислотных последовательностей.
В определенных воплощениях согласно настоящему изобретению содержание липополисахаридов (LPS) и других пирогенов в выделенном спидроиновом белке главной ампулярной железы составляет 1 единицу эндотоксина (ЭЕ)/мг белка или меньше.
Согласно другому аспекту в настоящем изобретении предоставляется выделенный слитый белок, состоящий из первого белкового фрагмента, который представляет собой спидроиновый белок главной ампулярной железы и второго белкового фрагмента, отличающегося тем, что указанный второй белковый фрагмент содержит партнер по слитию и участок узнавания расщепляющего агента, где указанный первый белковый фрагмент соединяется через указанный участок узнавания расщепляющего агента с указанным партнером по слитию.
В настоящем изобретении предоставляется выделенный слитый белок, выбранный из группы X-REP-CT, и REP-CT-X, где REP и CT являются белковыми фрагментами согласно изобретению; и X является белковым фрагментом, содержащим партнер по слитию и участок узнавания расщепляющего агента; где комбинированный белковый фрагмент REP-CT соединяется через указанный участок узнавания расщепляющего агента с указанным партнером по слитию.
В определенных воплощениях согласно изобретению содержание LPS и других пирогенов в выделенном спидроиновом белке составляет 1 ЭЕ/мг белка или меньше.
Согласно еще одному аспекту в настоящем изобретении предоставляется способ получения спидроинового белка главной ампулярной железы согласно изобретению, включающий в себя стадии: (i) предоставления раствора слитого белка согласно изобретению в жидкой среде, (ii) добавления к указанной жидкой среде подходящего расщепляющего агента для расщепления слитого белка в участке узнавания расщепляющего агента и получения благодаря этому спидроинового белка главной ампулярной железы; и, если надо, (iii) выделения спидроинового белка главной ампулярной железы, полученного на стадии (ii) из указанной жидкой среды.
Настоящее изобретение также предоставляет способ получения полимера спидроинового белка главной ампулярной железы согласно изобретению, включающий в себя стадии: (i) предоставления раствора слитого белка согласно изобретению в жидкой среде, (ii) добавления к указанной жидкой среде подходящего расщепляющего агента для расщепления слитого белка в участке узнавания расщепляющего агента, и получения благодаря этому спидроинового белка главной ампулярной железы; (iii) вызывания полимеризации спидроинового белка главной ампулярной железы, полученного на стадии (ii) в жидкой среде; и, если надо, (iv) выделения полимера, полученного на стадии (iii) из указанной жидкой среды. В предпочтительном способе указанная стадия (iii) далее включает в себя создание границы раздела между указанной жидкой средой и другой фазой, выбранной из группы, состоящей из газовой фазы, жидкой фазы и твердой фазы, где указанная полимеризация вызывается в указанной границе раздела или в области, окружающей границу раздела. В предпочтительном способе указанная жидкая среда является водной средой и указанную другую фазу выбирают из группы, состоящей из органических растворителей, несмешиваемых с воздухом и водой.
Согласно другому аспекту в настоящем изобретении предоставляется выделенная молекула полинуклеиновой кислоты, включающая в себя последовательность нуклеиновой кислоты, которая кодирует спидроиновый белок главной ампулярной железы согласно изобретению или комплементарную ей последовательность нуклеиновой кислоты.
Согласно еще одному аспекту в настоящем изобретении предоставляется выделенная молекула полинуклеиновой кислоты, включающая в себя последовательность нуклеиновой кислоты, которая кодирует слитый белок согласно изобретению или комплементарную ей последовательность нуклеиновой кислоты.
Другой аспект изобретения относится к способу получения растворимого слитого белка согласно изобретению, который включает в себя стадии: (i) экспрессии молекулы полинуклеиновой кислоты, кодирующей растворимый слитый белок согласно изобретению, в подходящем хозяине; и (ii) выделения растворимого слитого белка, полученного на стадии (i). Если надо, указанная стадия (ii) выделения растворимого слитого белка включает в себя удаление LPS и других пирогенов.
В настоящем изобретении также предоставляется способ производства спидроинового белка главной ампулярной железы согласно изобретению, включающий в себя стадии: (i) экспрессии молекулы полинуклеиновой кислоты, кодирующей растворимый слитый белок согласно изобретению, в подходящем хозяине; и (ii) выделения растворимого слитого белка, полученного на стадии (i); (iii) предоставления раствора указанного растворимого слитого белка, полученного на стадии (ii) в жидкой среде, (iv) добавления к указанной жидкой среде подходящего расщепляющего агента для расщепления слитого белка в сайте узнавания расщепляющего агента, и получения благодаря этому спидроинового белка главной ампулярной железы; и, если надо, (v) выделения спидроинового белка главной ампулярной железы, полученного на стадии (iv) из указанной жидкой среды. Далее по желанию указанная стадия (ii) выделения растворимого слитого белка и по желанию указанная стадия (v) выделения спидроинового белка главной ампулярной железы включают в себя удаление LPS и других пирогенов.
Далее в настоящем изобретении предоставляется способ получения полимера спидроинового белка главной ампулярной железы согласно изобретению, включающий в себя стадии: (i) экспрессии молекулы полинуклеиновой кислоты, кодирующей растворимый слитый белок согласно изобретению, в подходящем хозяине; и (ii) выделения растворимого слитого белка, полученного на стадии (i); (iii) предоставления раствора указанного растворимого слитого белка, полученного на стадии (ii) в жидкой среде, (iv) добавления к указанной жидкой среде подходящего расщепляющего агента для расщепления слитого белка в сайте узнавания расщепляющего агента, и получения благодаря этому спидроинового белка главной ампулярной железы; (v) вызывание полимеризации спидроинового белка главной ампулярной железы, полученного на стадии (iv) в жидкой среде; и, если надо, (vi) выделение полимера, полученного на стадии (v) из указанной жидкой среды. В предпочтительном способе указанная стадия (v) далее включает в себя создание границы раздела между указанной жидкой средой и другой фазой, выбранной из группы, состоящей из газовой фазы, жидкой фазы и твердой фазы, где указанная полимеризация вызывается в указанной границе раздела или в области, окружающей границу раздела. В предпочтительном способе указанная жидкая среда является водной средой, и указанная другая фаза выбрана из группы, состоящей из органических растворителей, несмешиваемых с воздухом и с водой.
Согласно другому аспекту в настоящем изобретении предоставляется полимер спидроинового белка главной ампулярной железы согласно изобретению. В настоящем изобретении также предоставляется полимер спидроинового белка главной ампулярной железы, полученный по способу согласно изобретению. В предпочтительном воплощении указанный полимер является волокном. В других предпочтительных воплощениях указанный полимер образует структуру, выбранную из группы, состоящей из пены, геля, сетки или пленки.
Согласно еще одному аспекту в настоящем изобретении предоставляется новое применение белкового фрагмента, включающего в себя партнера по слитию и участок узнавания расщепляющего агента для производства слитого белка, включающего в себя указанный белковый фрагмент, соединенный через указанный участок узнавания расщепляющего агента с фрагментом белка шелка паука. В предпочтительных воплощениях указанный фрагмент белка шелка паука состоит из 150-420 аминокислотных остатков.
Согласно последнему аспекту в настоящем изобретении предоставляется выделенная молекула полинуклеиновой кислоты, включающая в себя последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1 и последовательностей нуклеиновых кислот, кодирующих SEQ ID NO: 2-16, или комплементарных им последовательностей нуклеиновых кислот. В настоящем изобретении предоставляется применение выделенной молекулы полинуклеиновой кислоты для производства искусственного гена, кодирующего белок шелка паука.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
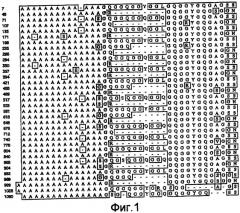
На фигуре 1 показано выравнивание сегментов внутри повторяющейся части белка MaSp1 Euprosthenops australis, т.e. SEQ ID NO: 3.
На фигуре 2A проиллюстрирована в виде схемы предсказанная структурная организация повторяющейся части белка MaSp1 Euprosthenops australis (SEQ ID NO: 3).
На фигуре 2B проиллюстрированы в виде схем предсказанные структурные организации спидроиновых белков, построенных согласно примерам 5-8 (SEQ ID NO: 9-13).
На фигуре 3 показано выравнивание C-концевых участков MaSp1 и MaSp2, которое иллюстрирует их консервативную природу.
На фигуре 4 проиллюстрирован макроскопический внешний вид волокон, сформированных из спидроиновых белков, которые построены согласно примерам 5-8. (A): волокна белка 6Gly/Ala-CThyb (SEQ ID NO: 13), полоска 0,5 см; (B): волокна белка 5Gly/Ala-CTnat (SEQ ID NO: 9), полоска 1 см; (C): волокна белка 5Gly/Ala-CTnat (SEQ ID NO: 9), полоска 1 см.
На фигуре 5 представлены полученные с помощью сканирующего электронного микроскопа (SEM) микрофотографии волокон, сформированных из спидроиновых белков, которые построены согласно примерам 5-8. Одиночные волокна (а) и гель-фаза (b, с) из 6Gly/Ala-CThyb (SEQ ID NO: 13). Волокна 5Gly/Ala-CTnat (SEQ ID NO: 9), вытянутые в 75% метаноле, высушенные на воздухе и нанесенные на целики SEM (d, e, f). Волокно, скрученное перед высушиванием на воздухе (е); конец волокна (f).
На фигуре 6 показан спектр кругового дихроизма (CD) волокна 6Gly/Ala-CThyb (SEQ ID NO: 13).
На фигуре 7 проиллюстрированы результаты цитотоксического исследования на тучных клетках мышей, которые показывают число живых и мертвых клеток через три дня культивирования в присутствии и в отсутствии шелковых волокон, полученных in vitro.
На фигуре 9 представлена кривая зависимости между напряжением и деформацией, которая показывает прочность при растяжении дважды вытянутых волокон из 5Gly/Ala-CTnat (SEQ ID NO: 9).
На фигуре 10 представлены SEM-микрофотографии рекомбинантных волокон из 5Gly/Ala-CTnat (SEQ ID NO: 9). (a, b) Спонтанно образованные волокна. На изображении (b) крупным планом показана фибриллярная субструктура. Тонкая выступающая фибрилла (отмечена стрелкой) имеет ширину около 300 нм. (c-f) Волокна после двух циклов растяжения-расслабления. На (с) и (d) показано одно и то же волокно в различных увеличениях. На (е) показан срезанный конец волокна, и на (f) показана точка разрыва после теста на растяжение.
ПОДРОБНОЕ РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом основано на идентификации мотива спидроинового белка, который является достаточным для рекомбинантного получения волокон шелка паука. Мотив основан на расшифрованной аминокислотной последовательности в результате клонирования и секвенирования частичной кДНК спидроина 1 (MaSp1) главной ампулярной железы Euprosthenops australis. Из этого следует, что выделенная кДНК MaSp1 является полезной в качестве точки старта для построения новых генов спидроинов, таких как гены, представленные в настоящем описании. Полимеры, которые созданы из белков, полученных из новых спидроиновых кДНК, являются полезными благодаря своим физическим свойствам, и особенно полезной является комбинация высокой прочности, эластичности и малого веса. Они также являются полезными благодаря своей способности поддерживать клеточную адгезию и рост. Свойства канатного шелка являются привлекательными для разработки новых материалов для медицинских и технических целей. В частности, паучьи шелка согласно изобретению могут быть полезны в медицинских устройствах, таких как импланты, и в медицинских продуктах, таких как системы для ушивания ран, пластыри, шовный материал, повязки на рану, и в каркасных структурах для инженеринга тканей и для направленной клеточной регенерации. Паучьи шелка согласно изобретению также являются особенно полезными для применения в качестве ткани или материала, такого как материал для парашютов, для пуленепробиваемой одежды, для ремней безопасности и т.п.
Термин "волокно", использованный в настоящем описании, относится к полимерам, имеющим толщину, по меньшей мере, 1 мкм, предпочтительными являются макроскопические полимеры, которые видимы человеческим глазом, например, имеющие толщину, по меньшей мере, 1 мкм, и которые имеют значительное растяжение в длину, по сравнению с их толщиной, предпочтительно, приблизительно 5 мм. Термин "волокно" не включает в себя неструктурированные агрегаты или преципитаты.
Термины "спидроиновые белки главной ампулярной железы", "спидроиновые белки" используются взаимозаменяемо в описании и включают в себя все известные спидроиновые белки главной ампулярной железы, обычно обозначаемые аббревиатурой "MaSp" или "ADF" в случае Araneus diadematus. Данные спидроиновые белки главной ампулярной железы обычно бывают двух типов, 1 и 2. Указанные термины, кроме того, включают в себя новые белки согласно изобретению, как описано в приложенной формуле изобретения, и другие искусственные белки с высокой степенью идентичности и/или сходства с известными спидроиновыми белками главной ампулярной железы.
Авторы настоящего изобретения использовали идентифицированный мотив спидроинового белка для создания новых генных конструкций, кодирующих искусственные спидроиновые белки. Было обнаружено, что спидроиновый белок главной ампулярной железы, состоящий из 150-420 аминокислотных остатков, т.е. больше или равно 150, предпочтительно больше или равно 220, предпочтительно больше или равно 250, и меньше или равно 420, предпочтительно меньше или равно 380 аминокислотных остатков, предпочтительно меньше или равно 320 аминокислотных остатков, предпочтительно меньше или равно 280 аминокислотных остатков, а именно 220-360 аминокислотных остатков, может быть получен рекомбинантно, например, в бактериях или в других подходящих продукционных организмах. Полученные спидроиновые белки спонтанно образуют макроскопические шелковые волокна согласно изобретению. Это удивительный результат, природные спидроиновые белки и ранее известные рекомбинантные, образующие волокна спидроиновые белки являются значительно более длинными, чем белки согласно изобретению. Кроме того, природные спидроиновые белки и ранее известные рекомбинантные, образующие волокна спидроиновые белки, как правило, содержат большое число внутренних повторов и требуют центрифугирования и/или жестких растворителей для полимеризации.
В настоящем описании впервые показано, что спидроиновые белки могут спонтанно образовывать волокна in vitro. Данные, представленные в настоящем описании, также показывают, что для запуска образования волокон необходимо только присутствие фракции последовательности спидроина. Кроме того, видовой гибрид, содержащий повторяющийся домен Euprosthenops и неповторяющийся C-концевой домен Nephila (перенесенный в пример 6C) также образует волокна, проявляя сильный потенциал к образованию волокон у данного мотива.
В общем виде спидроиновый белок главной ампулярной железы согласно изобретению описывается формулой REP-CT. Белковый фрагмент REP и белковый фрагмент CT соединены ковалентно, обычно с помощью пептидной связи.
Белковый фрагмент REP имеет повторяющийся характер, с чередованием участков, богатых аланином и богатых глицином. Фрагмент REP обычно содержит более чем 80, а именно более чем 140 и менее чем 300, предпочтительно менее чем 240, а именно менее чем 200, аминокислотных остатков, и может быть разделен на несколько сегментов L (линкерных), сегментов A (богатых аланином) и сегментов G (богатых глицином), как будет подробно объяснено далее. Обычно указанные линкерные сегменты, которые являются произвольными, расположены на концах фрагмента REP, в то время как остальные сегменты представляют собой чередующиеся богатые аланином и богатые глицином сегменты. Таким образом, фрагмент REP может иметь в целом любую из следующих структур, где n является целым числом:
L(AG) n L, а именно LA 1 G 1 A 2 G 2 A 3 G 3 A 4 G 4 A 5 G 5 L;
L(AG) n AL, а именно LA 1 G 1 A 2 G 2 A 3 G 3 A 4 G 4 A 5 G 5 A 6 L;
L(GA) n L, а именно LG 1 A 1 G 2 A 2 G 3 A 3 G 4 A 4 G 5 A 5 L; или
L(GA) n GL, а именно LG 1 A 1 G 2 A 2 G 3 A 3 G 4 A 4 G 5 A 5 G 6 L.
Из этого следует, что не имеет особой важности, какой из двух сегментов, богатый аланином или богатый глицином, граничит с N-концевыми или C-концевыми линкерными сегментами. Предпочтительно n является целым числом от 4 до 8, более предпочтительно от 4 до 6, например n=4, n=5 или n=6.
В предпочтительных воплощениях содержание аланина в фрагменте REP согласно изобретению составляет выше 20%, предпочтительно выше 25%, наиболее предпочтительно выше 30%, и ниже 50%, предпочтительно ниже 40%, более предпочтительно ниже 35%. Это является преимуществом, поскольку предполагается, что более высокое содержание аланина дает более жесткое, и/или более крепкое, и/или менее растяжимое волокно. Причиной этого явления по-видимому является то, что более высокое содержание аланина ассоциировано с более высоким содержанием β-листовых структур в волокне. Таким образом, в предпочтительном воплощении, содержание β-листовых структур в полимере, таком как волокно, спидроинового белка главной ампулярной железы согласно изобретению составляет более 50%, т.е. более чем 50% вторичной структуры белка имеет β-листовую форму.
В определенных воплощениях фрагмент REP лишен остатков пролина, т.е. во фрагменте REP нет остатков Pro.
Далее, обращаясь к сегментам, из которых построен фрагмент REP согласно изобретению, следует подчеркнуть, что каждый сегмент является индивидуальным, т.е. любые два сегмента A, любые два сегмента G или любые два сегмента L специфического фрагмента REP могут быть идентичными или могут не быть идентичными. Таким образом, общей особенностью изобретения является то, что каждый тип сегмента не является одинаковым внутри специфического фрагмента REP. Скорее, последующее раскрытие обеспечивает специалиста в данной области техники рекомендациями, как создать индивидуальные сегменты и собрать их во фрагмент REP, который является частью функционального спидроинового белка согласно изобретению.
Из представленных в настоящем описании экспериментальных данных было сделано заключение, что каждый индивидуальный сегмент A представляет собой аминокислотную последовательность, имеющую от 8 до 18 аминокислотных остатков. Предпочтительно, каждый индивидуальный сегмент A содержит от 13 до 15 аминокислотных остатков. Также возможно, что большинство или более чем два сегмента A содержат от 13 до 15 аминокислотных остатков, и что меньшинство, а именно один или два сегмента A, содержат от 8 до 18 аминокислотных остатков, а именно 8-12 или 16-18 аминокислотных остатков. Значительное большинство аминокислотных остатков являются остатками аланина. Более подробно, от 0 до 3 аминокислотных остатков являются неаланиновыми остатками и остальные аминокислотные остатки являются остатками аланина. Таким образом, все аминокислотные остатки в каждом индивидуальном сегменте A являются остатками аланина, без исключения или за исключением одного, двух или трех аминокислотных остатков, которые могут быть любой аминокислотой. Предпочтительно, аланин-замещающая аминокислота (аминокислоты) является (являются) природными аминокислотами, предпочтительно индивидуально выбранными из группы из серина, глутаминовой кислоты, цистеина и глицина, более предпочтителен серин. Конечно, возможно, что один или более сегментов A являются полностью аланиновыми сегментами, в то время как остальные сегменты A содержат 1-3 неаланиновых остатка, таких как серин, глутаминовая кислота, цистеин или глицин.
В предпочтительном воплощении каждый сегмент A содержит 13-15 аминокислотных остатков, включая 10-15 остатков аланина и 0-3 неаланиновых остатка, как описано выше. В более предпочтительном воплощении каждый сегмент A содержит 13-15 аминокислотных остатков, включая 12-15 остатков аланина и 0-1 неаланиновых остатков, как описано выше.
Предпочтительно, каждый индивидуальный сегмент A имеет, по меньшей мере, 80% идентичности с аминокислотной последовательностью, выбранной из группы аминокислотных остатков 7-19, 43-56, 71-83, 107-120, 135-147, 171-183, 198-211, 235-248, 266-279, 294-306, 330-342, 357-370, 394-406, 421-434, 458-470, 489-502, 517-529, 553-566, 581-594, 618-630, 648-661, 676-688, 712-725, 740-752, 776-789, 804-816, 840-853, 868-880, 904-917, 932-945, 969-981, 999-1013, 1028-1042 и 1060-1073 SEQ ID NO: 3. Каждая последовательность данной группы соответствует сегменту природной последовательности белка MaSp1 Euprosthenops australis, которая расшифрована с помощью клонирования соответствующей кДНК, см. примеры 1-2 и фигуры 1-2A. Альтернативно каждый индивидуальный сегмент A имеет, по меньшей мере, 80% идентичности с аминокислотной последовательностью, выбранной из группы аминокислотных остатков 31-42, 61-75, 90-104, 122-135 и 153-171 SEQ ID NO: 9, аминокислотных остатков 12-25, 46-60, 75-88, 112-119, 150-158 и 173-180 SEQ ID NO: 13, аминокислотных остатков 31-42 SEQ ID NO: 14 и аминокислотных остатков 122-135 SEQ ID NO: 15. Каждая последовательность данной группы соответствует сегменту экспрессированных, искусственных спидроиновых белков согласно изобретению, белки которого обладают способностью образовывать шелковые волокна при определенных условиях. См. примеры 5-8, 12 и фигуру 2B. Вне связи с какой-либо теорией, авторы изобретения предусматривают, что сегменты A согласно изобретению образуют спиральные структуры или бета-листы.
Термин "% идентичности", применяемый в настоящем описании и в прилагаемой формуле изобретения, вычисляется следующим образом. Тестируемую последовательность выравнивают с целевой последовательностью с помощью алгоритма CLUSTAL W (Thompson, J. D., Higgins, D. G. and Gibson, T.J., Nucleic Acids Research, 22: 4673-4680 (1994)). Сравнивают аминокислотные остатки в каждом положении и процентное содержание положений в тестируемой последовательности, которые имеют идентичные соответствия в исследуемой последовательности, описывают как % идентичности.
Термин "% сходства", применяемый в настоящем описании и в прилагаемой формуле изобретения, рассчитывается так же, как описано для "% идентичности", за исключением того, что сходными являются гидрофобные остатки Ala, Val, Phe, Pro, Leu, Ile, Trp, Met и Cys; сходными являются основные остатки Lys, Arg и His; сходными являются кислые остатки Glu и Asp; и сходными являются гидрофильные, незаряженные остатки Gln, Asn, Ser, Thr и Tyr. Оставшаяся природная аминокислота Gly является не сходной ни с одной аминокислотой в данном контексте.
В настоящем описании альтернативные воплощения согласно изобретению соответствуют вместо указанного процентного значения идентичности, соответствующему процентному значению сходства. Другие альтернативные воплощения отвечают соответствующему процентному значению идентичности, а также другому, более высокому процентному значению сходства, выбранному из группы предпочтительных процентных значений идентичности для каждой последовательности. Например, последовательность может быть на 70% сходной с другой последовательностью; или она может быть на 70% идентична другой последовательности; или она может быть на 70% идентичной и на 90% сходной с другой последовательностью.
В предпочтительных воплощениях согласно изобретению каждый индивидуальный сегмент A имеет, по меньшей мере, 90%, более предпочтительно 95%, наиболее предпочтительно 100% идентичности с аминокислотной последовательностью, выбранной из группы аминокислотных остатков 7-19, 43-56, 71-83, 107-120, 135-147, 171-183, 198-211, 235-248, 266-279, 294-306, 330-342, 357-370, 394-406, 421-434, 458-470, 489-502, 517-529, 553-566, 581-594, 618-630, 648-661, 676-688, 712-725, 740-752, 776-789, 804-816, 840-853, 868-880, 904-917, 932-945, 969-981, 999-1013, 1028-1042 и 1060-1073 SEQ ID NO: 3; аминокислотных остатков 31-42, 61-75, 90-104, 122-135 и 153-171 SEQ ID NO: 9; аминокислотных остатков 12-25, 46-60, 75-88, 112-119, 150-158 и 173-180 SEQ ID NO: 13; аминокислотных остатков 31-42 SEQ ID NO: 14; и аминокислотных остатков 122-135 SEQ ID NO: 15. Таким образом, в определенных воплощениях согласно изобретению каждый индивидуальный сегмент A является идентичным аминокислотной последовательности, выбранной из упомянутых выше аминокислотных сегментов.
Кроме того, из представленных в настоящем описании экспериментальных данных было сделано заключение, что каждый индивидуальный G сегмент представляет собой аминокислотную последовательность из 12-30 аминокислотных остатков. Предпочтительно каждый индивидуальный сегмент G состоит из 14-23 аминокисло