Моноклональные антитела против il-31 и способы применения
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описано моноклональное антитело против IL-31. Предложен способ лечения млекопитающего, страдающего воспалительным заболеванием, в котором участвует IL-31, включающий введение описанного антитела. Предложены способы снижения, ингибирования или минимизации зуда у млекопитающего, включающие введение описанного антитела. Изобретение расширяет арсенал противовоспалительных средств. 13 н. и 26 з.п. ф-лы, 4 табл., 16 пр.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Иммунная система включает в себя широкий диапазон определенных типов клеток, в том числе лимфоциты. Лимфоциты определяют специфичность иммунной реакции в организме и включают в себя два класса: B-лимфоциты, которые являются предшественниками антителопродуцирующих клеток, и T-лимфоциты, которые необходимы для определенных регуляторных функций, таких как развитие специфичного иммунного ответа.
Зрелые T-клетки могут быть активированы, в частности, антигеном или другими стимулами и могут продуцировать, например, цитокины, молекулы биохимической передачи сигнала или рецепторы, которые далее влияют на судьбу популяции T-клеток.
Активация B-клеток может происходить через рецепторы на их клеточной поверхности, включая B-клеточный рецептор, и другие вспомогательные молекулы для осуществления вспомогательных клеточных функций, таких как продукция цитокинов.
Активация моноцитов/макрофагов и T-клеток может происходить через рецепторы на их клеточной поверхности, и они играют центральную роль в иммунном ответе посредством представления антигена лимфоцитам, а также выступают в качестве вспомогательных клеток для лимфоцитов посредством секреции ряда цитокинов.
Естественные киллерные (NK) клетки имеют общую с T-клетками и B-клетками клетку-предшественник и участвуют в иммунологическом надзоре. NK-клетки, которые составляют вплоть до 15% лимфоцитов крови, не экспрессируют рецепторы для антигенов и, таким образом, не используют распознавание MHC как необходимый фактор для связывания клетки-мишени. NK-клетки вовлечены в распознавание и уничтожение определенных опухолевых клеток и инфицированных вирусом клеток. Полагают, что in vivo NK-клеткам необходима активация, однако было показано, что in vitro NK-клетки вызывают гибель некоторых типов опухолевых клеток баз активации.
Интерлейкины представляют собой семейство цитокинов, опосредующих иммунологический ответ, в том числе воспаление. Интерлейкины опосредуют разнообразные воспалительные патологии. Основную роль в иммунном ответе играют T-клетки, которые продуцируют множество цитокинов и осуществляют адаптивный иммунитет против антигенов. Цитокины, продуцируемые T-клетками, классифицируют как цитокины 1 типа и 2 типа (Kelso, A. Immun. Cell Biol. 76:300-317, 1998). Цитокины 1 типа включают в себя IL-2, IFN-γ, LT-α, и они вовлечены в воспалительный ответ, вирусный иммунитет, иммунитет против внутриклеточных паразитов и отторжение аллотрансплантата. Цитокины 2 типа включают в себя IL-4, IL-5, IL-6, IL-10 и IL-13, и они вовлечены в гуморальный ответ, иммунитет против гельминтов и аллергический ответ. Общие для 1 и 2 типа цитокины включают в себя IL-3, GM-CSF и TNF-α. Существуют некоторые данные, подтверждающие, что продуцирующие 1 тип и 2 тип популяции T-клеток преимущественно мигрируют в различные типы воспаленной ткани.
Кожа играет важную роль в иммунной системе и состоит из слоев. Эпидермис представляет собой поверхностный слой. Под эпидермисом расположена дерма, слой соединительной ткани. Под дермой расположена гиподерма, слой из большого количества жировой ткани. Циркулирующие T-лимфоциты мигрируют в кожу в норме и в условиях воспаления. Кожный лимфоцитарный антиген (CLA) считают "хоминг"-рецептором для T-клеток, тропных к коже. Santamaria-Babi, L., Eur. J. Dermatol. 14:13-18, 2004.
Известно, что при некоторых заболеваниях кожи выявляются высокие уровни CLA+ T-клеток, включая атопический дерматит, контактный дерматит, индуцируемые лекарственным средством аллергические реакции, тропные к коже вирусы и ассоциированный с вирусом зуд, витилиго, кожную T-клеточную лимфому, очаговую алопецию, красные угри, обыкновенные угри, узловатую почесуху и буллезный пемфигоид. Существует необходимость в лечении таких кожных опосредуемых T-клетками заболеваний.
Демонстрируемые in vivo виды активности семейства цитокинов иллюстрируют огромный клинический потенциал и необходимость других цитокинов, агонистов цитокинов и антагонистов цитокинов. IL-31 представляет собой недавно идентифицированный цитокин. При сверхэкспрессии у мышей IL-31 приводит к подобным дерматиту симптомам. В патологию кожных заболеваний у человека вовлечены как направленные в кожу T-клетки, так и эпидермальные кератиноциты. Настоящее изобретение удовлетворяет эти потребности, предоставляя антагонисты провоспалительного цитокина IL-31. Такие антагонисты согласно изобретению, которые могут блокировать, ингибировать, снижать, оказывать антагонистическое воздействие или нейтрализовать активность IL-31, включают в себя растворимые рецепторы IL-31RA и нейтрализующие антитела против IL-31. Кроме того, это изобретение относится к их применению при воспалительном заболевании, а также к связанным с ним композициям и способам.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед подробным изложением этого изобретения, для его понимания может быть целесообразным определение следующих терминов:
Здесь термин "антитела" включает в себя поликлональные антитела, очищенные аффинными способами поликлональные антитела, моноклональные антитела и антигенсвязывающие фрагменты, такие как протеолитические фрагменты F(ab')2 и Fab. Также определение включает в себя полученные способами генетической инженерии целые антитела или фрагменты, такие как химерные антитела, Fv-фрагменты, одноцепочечные антитела и т.п., а также синтетические антигенсвязывающие пептиды и полипептиды. Не являющиеся человеческими антитела могут быть гуманизированы посредством пересадки не являющихся человеческими CDR в каркасную область и константные участки человека, или посредством встраивания целых не являющихся человеческими вариабельных доменов (необязательно "маскируя" их подобной человеческой поверхностью посредством замены экспонированных остатков с получением в результате "гиперхимеризованного" антитела). В некоторых случаях в гуманизированных антителах могут быть сохранены не являющиеся человеческими остатки в каркасных доменах вариабельного участка человека для усиления необходимых свойств, касающихся связывания. С помощью гуманизации антител может быть повышено биологическое время полужизни, и при введении человеку возможность неблагоприятных иммунных реакций снижается.
Термин "химерное антитело" или "химерные антитела" относится к антителам, гены легкой и тяжелой цепей которых были сконструированы, главным образом, с помощью генетической инженерии, из генов вариабельного и константного участка иммуноглобулинов, принадлежащих другому виду. Например, вариабельные сегменты генов из моноклонального антитела мыши могут быть присоединены к константным сегментам человека, таким как гамма 1 и гамма 3. Таким образом, типичное терапевтическое химерное антитело представляет собой гибридный белок, состоящий из вариабельного или антигенсвязывающего домена из антитела мыши и константного домена из антитела человека, хотя могут использоваться другие виды млекопитающих.
Здесь термин "иммуноглобулин" относится к белку, состоящему из одного или нескольких полипептидов, главным образом, кодируемых генами иммуноглобулинов. Одна форма иммуноглобулина представляет собой основной структурный элемент антитела. Эта форма представляет собой тетрамер и состоит из двух идентичных пар цепей иммуноглобулинов, где каждая пара обладает одной легкой и одной тяжелой цепями. В каждой паре вариабельные участки легкой и тяжелой цепей совместно отвечают за связывание с антигеном, и константные участки отвечают за эффекторные функции антитела.
Полноразмерные "легкие цепи" иммуноглобулина (приблизительно 25 кДа или 214 аминокислот) кодируются геном вариабельного участка на NH2-конце (приблизительно 110 аминокислот) и геном константного участка каппа или лямбда на COOH-конце. Полноразмерные "тяжелые цепи" иммуноглобулина (приблизительно 50 кДа или 446 аминокислот), аналогично кодируются геном вариабельного участка (приблизительно 116 аминокислот) и одним из других вышеупомянутых генов константных участков (приблизительно 330 аминокислот). Тяжелые цепи классифицируют как гамма, мю, альфа, дельта или эпсилон, и они определяют изотип антитела IgG, IgM, IgA, IgD и IgE, соответственно. В легкой и тяжелой цепях вариабельные и константные участки соединены участком "J" приблизительно из 12 или более аминокислот, а тяжелая цепь также включает в себя участок "D" приблизительно из 10 или более аминокислот. (Смотрите, главным образом, Fundamental Immunology (Paul, W., ed., 2nd ed. Raven Press, N.Y., 1989), Ch. 7 (включенная в качестве ссылки в полном объеме для любых целей).
Вариабельный участок легкой или тяжелой цепи иммуноглобулина состоит из "каркасного" участка, прерывающегося тремя гипервариабельными участками. Таким образом, термин "гипервариабельный участок" относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельный участок содержит аминокислотные остатки из "определяющего комплементарность участка" или "CDR" (т.е. остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)) и/или эти остатки из "гипервариабельной петли" (т.е. остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk, 1987, J. Mol. Biol. 196: 901-917) (обе из которых включены в настоящее описание в качестве ссылок). Остатки "каркасной области" или "FR" представляют собой те остатки вариабельного домена, которые отличаются от остатков гипервариабельного участка, как определено в настоящем описании. Последовательности каркасных областей различных легких и тяжелых цепей являются относительно консервативными в пределах вида. Таким образом, "каркасная область человека" представляет собой каркасную область, которая является по существу идентичной (приблизительно на 85% или более, как правило, на 90-95% или более) каркасной области встречающегося в природе иммуноглобулина человека. Каркасная область антитела, которая представляет собой комбинированные каркасные области из составляющих ее легкой и тяжелой цепей, служит для локализации и выравнивания CDR. CDR, главным образом, отвечают за связывание с эпитопом антигена.
Таким образом, термин "гуманизированный" иммуноглобулин относится к иммуноглобулину, содержащему каркасную область человека и один или несколько CDR из иммуноглобулина, не являющегося человеческим (как правило, мыши или крысы). Не являющийся человеческим иммуноглобулин, предоставляющий CDR, называют "донором", а иммуноглобулин человека, предоставляющий каркасную область, называют "акцептором". Нет необходимости в наличии константных участков, однако в случае их наличия они должны быть по существу идентичными константным участкам иммуноглобулина человека, т.е. по меньшей мере приблизительно на 85-90%, предпочтительно приблизительно на 95% или более идентичными. Таким образом, все части гуманизированного иммуноглобулина, за исключением, возможно, CDR, являются по существу идентичными соответствующим частям природных последовательностей иммуноглобулина человека. "Гуманизированное антитело" представляет собой антитело, содержащее иммуноглобулин с гуманизированной легкой цепью и гуманизированной тяжелой цепью. Например, гуманизированное антитело не включает в себя типичное химерное антитело, как определено выше, например, вследствие того, что целый вариабельный участок химерного антитела является нечеловеческим.
Термин "генетически измененные антитела" означает антитела, где аминокислотная последовательность отличается от последовательности природного антитела. Вследствие значения способов рекомбинантных ДНК при получении антител, нет необходимости в ограничении последовательностями аминокислот, встречающимися в природных антителах; антитела можно переконструировать для получения требуемых характеристик. Возможные изменения многочисленны и варьируют от изменения только одной или нескольких аминокислот до полного переконструирования, например, вариабельного или константного участка. Изменения в константном участке, как правило, проводят в целях улучшения или изменения характеристик, таких как связывание комплемента, взаимодействие с мембранами и другие эффекторные функции. Изменения в вариабельном участке проводят в целях улучшения характеристик, касающихся связывания антигена.
В дополнение к антителам, иммуноглобулины могут существовать во множестве других форм, включая, например, одноцепочечные антитела или Fv, Fab и (Fab')2, а также димеры, линейные антитела, поливалентные или полиспецифичные гибридные антитела (как описано выше и подробнее в: Lanzavecchia et al., Eur. J. Immunol. 17, 105 (1987)) и в форме отдельных цепей (например, Huston et al., Proc. Natl. Acad. Sci. U.S.A., 85, 5879-5883 (1988), и Bird et al., Science, 242, 423-426 (1988), которые включены в настоящее описание в качестве ссылок). (Смотрите, главным образом, Hood et al., "Immunology", Benjamin, N.Y., 2nd ed. (1984), и Hunkapiller and Hood, Nature, 323, 15-16 (1986), которые включены в настоящее описание в качестве ссылок).
Здесь термины "одноцепочечные Fv", "одноцепочечные антитела", "Fv" или "scFv" относятся к фрагментам антител, которые содержат вариабельные участки как из тяжелой, так и из легкой цепей, однако лишены константных участков, но в пределах одной полипептидной цепи. Как правило, одноцепочечное антитело между доменами VH и VL дополнительно содержит полипептидный линкер, который позволяет им формировать требуемую структуру, которая обеспечивает возможность связывания антигена. Одноцепочечные антитела подробно описаны Pluckthun в The Pharmacology of Monoclonal Antobodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994); смотрите также публикацию международной патентной заявки № WO 88/01649 и патенты США №№ 4946778 и 5260203, описания которых включены в качестве ссылок для любой цели. В конкретных вариантах осуществления, одноцепочечные антитела также могут быть биспецифичными и/или гуманизированными.
"Fab-фрагмент" содержит одну легкую цепь и C.sub.H1 и вариабельные участки одной тяжелой цепи. Тяжелая цепь молекулы Fab не может образовывать дисульфидную связь с другой молекулой тяжелой цепи.
"Fab'-фрагмент" содержит одну легкую цепь и одну тяжелую цепь, которая между доменами CН1 и CH2 содержит большую часть константного участка, так что между двумя цепями может образоваться межцепочечная дисульфидная связь с образованием молекулы F(ab')2.
"F(ab')2-фрагмент" содержит две легкие цепи и две тяжелые цепи, содержащие часть константного участка между доменами CH1 и CH2, так что между двумя тяжелыми цепями образуется межцепочечная дисульфидная связь.
Понятно, что молекулярные массы и длины полимеров, определенные неточными аналитическими способами (например, гель-электрофорез), представляют собой приблизительные значения. Когда такое значение выражают как "приблизительно" X или "приближенно" X, следует понимать, что указанное значение X является точным на ±10%.
Все приведенные в настоящем описании ссылки включены в качестве ссылок в полном объеме.
В основе настоящего изобретение отчасти лежит открытие, связанное с применением антител в качестве антагонистов IL-31, ингибирующих, таким образом, воспаление в целом и симптомы дерматита и связанных с зудом заболеваний. Это изобретение относится к применению моноклональных антител для ингибирования, уменьшения, предотвращения или минимизации эффектов дерматита и связанных с зудом заболеваний, как описано далее в настоящем описании. В одном варианте осуществления дерматит представляет собой атопический дерматит. В другом варианте осуществления дерматит представляет собой узловатую почесуху. В другом варианте осуществления дерматит представляет собой экзему. IL-31 представляет собой недавно открытый T-клеточный цитокин, который при сверхэкспрессии у мышей приводит к подобным дерматиту симптомам. Смотрите также Dillon, et al., Nature Immunol. 5:752-760, 2004. В патологию кожных заболеваний у человека вовлечены как направленные в кожу T-клетки, так и эпидермальные кератиноциты. Экспрессия мРНК и белка IL-31 как у пациентов с атопическим дерматитом (AD), так и у здоровых индивидуумов ограничивается направленной в кожу популяцией CLA+ T-клеток, в то время как анализ рецептора для IL-31, IL-31RA, посредством иммуногистохимии (IHC) подтверждает несколько более высокие уровни экспрессии IL-31RA на кератиноцитах кожи в биоптатах кожи пациентов, страдающих острым и хроническим AD, по сравнению со здоровыми индивидуумами.
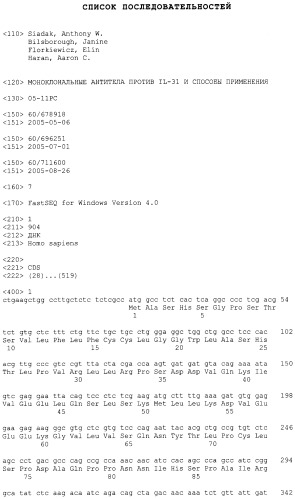
IL-31 также имеет название HUGO, которое было присвоено цитокину, который ранее был описан как Zcyto17rlig в опубликованной патентной заявке США (смотрите публикацию номер 20030224487, Sprecher, Cindy et al., 2003, включенную в качестве ссылки). Смотрите также Dillon, et al., Nature Immunol., выше. Гетеродимерный рецептор для IL-31 также описан в 20030224487 в качестве zcytor17 (название HUGO, IL-31RA), который образуют гетеродимер с бета-рецептором онкостатина М (OSMRbeta). IL-31 был выделен из библиотеки кДНК, полученной из активированных клеток периферической крови человека (hPBC), среди которых была проведена селекция на CD3. CD3 представляет собой клеточный поверхностный маркер клеток исключительно лимфоидного происхождения, в частности, T-клеток. Полинуклеотидная и полипептидная последовательности IL-31 человека представлены в SEQ ID NO:1 и 2, соответственно. Полинуклеотидная и полипептидная последовательности IL-31 мыши представлены в SEQ ID NO:10 и 11, соответственно. Как используют в настоящем описании, термин IL-31 означает IL-31, как используют в патентной публикации США номер 20030224487, как показано выше. Секреторная сигнальная последовательность IL-31 содержит аминокислотные остатки от 1 (Met) до 23 (Ala), и зрелый полипептид содержит аминокислотные остатки от 24 (Ser) до 164 (Thr) (как показано в SEQ ID NO:2). Дополнительный анализ с N-концевым секвенированием очищенного IL-31 из T-клеток 293 показал локализацию N-конца в положении 27 (Leu), как представлено в SEQ ID NO:2, и зрелый полипептид содержал аминокислотные остатки от 27 (Leu) до 164 (Thr) (как показано в SEQ ID NO:2).
Полипептидная последовательность IL-31RA (рецептор для IL-31) представлена в SEQ ID NO:5, и полипептидная последовательность бета-рецептора онкостатина М (OSMRbeta) представлена в SEQ ID NO:7.
Рецепторы IL-31RA и OSMRbeta принадлежат классу I подсемейства рецепторов цитокинов, который включает в себя, но не ограничивается ими, рецепторы для IL-2, IL-4, IL-7, Lif, IL-12, IL-15, EPO, TPO, GM-CSF и G-CSF (для обзора смотрите Cosman, "The Hematopoietin Receptor Superfamily" в Cytokine 5(2): 95-106, 1993). Субъединица IL-31RA полностью описана в совместной патентной заявке PCT № US01/20484 (публикация WIPO № WO 02/00721). Анализ распределения мРНК субъединицы IL-31RA в тканях выявил экспрессию в активированных T-клетках подтипов CD4+ и CD8+, CD14+ моноцитах, и более слабую экспрессию в CD19+ B-клетках. Более того, мРНК была представлена как в покоящихся, так и в активированных моноцитарных клеточных линиях THP-1 (ATCC № TIB-202), U937 (ATCC № CRL-1593.2) и HL60 (ATCC № CCL-240).
Ингибирование, нейтрализацию, блокирование передачи сигнала посредством антагонистов IL-31, описанных в настоящем описании, можно определить с помощью ряда способов анализа, известных специалисту в данной области. Например, анализы для определения снижения пролиферации включают в себя анализы восстановления красителя, такого как AlamarBlue™ (AccuMed International, Inc. Westlake, Ohio), бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия (Mosman, J. Immunol. Meth. 65: 55-63, 1983); 3,(4,5-диметилтиазол-2-ил)-5-3-карбоксиметоксифенил-2H-тетразолий; гидроксид 2,3-бис(2-метокси-4-нитро-5-сульфофенил)-5-[(фениламино)карбонил]-2H-тетразолия; и хлорид цианодитолилтетразолия (которые являются коммерчески доступными от Polysciences, Inc., Warrington, PA); анализы митогенеза, такие как измерение встраивания 3H-тимидина; анализы вытеснения красителя с использованием, например, нафталинового черного или трипанового синего; захват красителя с использованием диацетилфлуоресцеина; и высвобождение хрома. Смотрите, главным образом, Freshney, Culture of Animal Cells: A Manual of Basic Technique, 3rd ed., Wiley-Liss, 1994, которая включена в настоящее описание в качестве ссылки. В дополнение к указанным выше смотрите опубликованную патентную публикацию США номер 20030224487 (Sprecher, Cindy et al., 2003) в качестве примера клеток BaF3, экспрессирующих IL-31RA и полноразмерный OSMRbeta.
Как правило, цитокины предположительно обладают структурой из четырех альфа-спиралей, где спирали A, C и D являются наиболее важными для взаимодействия лиганд-рецептор и наиболее высоко консервативными среди членов семейства. Указание на аминокислотную последовательность IL-31 человека, представленную в SEQ ID NO:2, выравнивание IL-31 человека, IL-3 человека и аминокислотные последовательности цитокинов человека предполагает, что спираль A в IL-31 определяется аминокислотными остатками 38-52; спираль B определяется аминокислотными остатками 83-98; спираль C определяется аминокислотными остатками 104-117; и спираль D определяется аминокислотными остатками 137-152, как представлено в SEQ ID NO:2. Структурный анализ позволяет предположить, что петля A/B является длинной, петля B/C является короткой и петля C/D является длинной. Эта структура петель приводит к организации спирали вверх-вверх-вниз-вниз. Исходя из структуры глобулы из 4 спиралей, остатки цистеина в IL-31, которые являются консервативными, соответствуют аминокислотным остаткам 72, 133, и 147 в SEQ ID NO:2; и 74, 137 и 151 в SEQ ID NO:11, как описано в настоящем описании. Соответствующее расположение цистеина является дополнительным подтверждением структуры глобулы из четырех спиралей. Также в IL-31 высоко консервативным является остаток Glu, как представлено в SEQ ID NO:2, в положении 43. Эти спирали IL-31 могут представлять собой специфичные мишени для ингибирования, снижения или нейтрализации посредством антител, описанных в настоящем описании, для блокирования эффектов передачи сигнала IL-31 через узнающий его рецептор.
Исходя из сравнения последовательностей IL-31 человека и мыши, обнаружили консервативные остатки в участках, предположительно кодирующих альфа-спирали C и D. Соответствующие полинуклеотиды, кодирующие полипептидные участки, домены, мотивы, остатки и последовательности IL-31 человека, описанные в настоящем описании, представлены в SEQ ID NO:1. Эти спирали IL-31 могут представлять собой специфичные мишени для ингибирования, снижения или нейтрализации с помощью антител, описанных в настоящем описании, для блокирования эффектов передачи сигнала IL-31 через узнающий его рецептор.
В то время как спираль D является относительно консервативной в IL-31 человека и мыши, спираль C является наиболее консервативной. Несмотря на то, что у обоих видов в этом участке преобладают кислые аминокислоты, их различия могут быть причиной видовой специфичности во взаимодействии между IL-31 и его рецептором, IL-31RA, включающим в себя мономерные, гетеродимерные или мультимерные рецепторы. Петля A/B и спираль B IL-31 являются мало консервативными, и спираль C с петлей C/D и спиралью D являются наиболее консервативными между видами; консервативность в этом участке позволяет предположить, что он является функционально значимым. D-спирали IL-31 человека и мыши также являются консервативными. Антагонисты рецептора IL-31RA можно сконструировать посредством мутаций в D-спирали IL-31. Они могут включать в себя укорочение белка от остатка Thr156 (SEQ ID NO:2), или сохранение остатков, которые обеспечивают связывание лиганда с рецептором, но уменьшают активность передачи сигнала.
Способы получения полинуклеотидов, кодирующих антитела, описанные в настоящем описании (включая ДНК и РНК), хорошо известны в данной области. Тотальную РНК можно получать с использованием экстракции с изотиоцианатом гуанидиния с последующим выделением центрифугированием в градиенте CsCl (Chirgwin et al., Biochemistry 18:52-94, 1979). Поли-(A)+ РНК получают из тотальной РНК с использованием способа Aviv and Leder (Proc. Natl. Acad. Sci. USA 69:1408-12, 1972). Комплементарную ДНК (кДНК) получают из поли(A)+ РНК с использованием известных способов. Альтернативно, можно выделять геномную ДНК. Полинуклеотиды, кодирующие антитела против IL-31, затем идентифицируют и выделяют, например, посредством гибридизации или ПЦР.
Полинуклеотидная последовательность мышиного ортолога IL-31 была идентифицирована и представлена в SEQ ID NO:3. Зрелая последовательность IL-31 мыши предположительно начинается с Met1; как представлено в SEQ ID NO:4, который соответствует Met1, как представлено в SEQ ID NO:2, в последовательности человека. Тканевой анализ выявил, что экспрессия IL-31 мыши обнаруживается в семенниках, головном мозге, клетках CD90+, клетках простаты, слюнных железах и коже. Дополнительный анализ с N-концевым секвенированием очищенного IL-31 из T-клеток 293 показал расположение N-конца в остатке 31 (Ala), как представлено в SEQ ID NO:4, и зрелый полипептид содержит аминокислотные остатки от 31 (Ala) до 163 (Cys) (как представлено в SEQ ID NO:4).
Можно получать профиль гидрофильности Хоппа/Вудса для белковой последовательности IL-31, как представлено в SEQ ID NO:2 (Hopp et al., Proc. Natl. Acad. Sci.78:3824-3828, 1981; Hopp, J. Immun. Meth. 88:1-18, 1986 и Triquier et al., Protein Engineering JU: 153-169, 1998). В основе профиля лежит перемещающееся окно из шести остатков. Углубленные остатки G, S и T и экспонированные остатки H, Y и W не учитывают. Например, в IL-31 человека, гидрофобные участки включают в себя аминокислотные остатки 54-59 в SEQ ID NO:2, аминокислотные остатки 129-134 в SEQ ID NO:2, аминокислотные остатки 53-58 в SEQ ID NO:2, аминокислотные остатки 35-40 в SEQ ID NO:2 и аминокислотные остатки 33-38 в SEQ ID NO:2. Например, в IL-31 мыши гидрофобные участки включают в себя аминокислотные остатки 34-39 в SEQ ID NO:11, аминокислотные остатки 46-51 в SEQ ID NO:11, аминокислотные остатки 131-136 в SEQ ID NO:11, аминокислотные остатки 158-163 в SEQ ID NO:11 и аминокислотные остатки 157-162 в SEQ ID NO:11.
Специалисты в данной области поймут, что гидрофильность или гидрофобность будут учтены при разработке модификаций в аминокислотной последовательности полипептида IL-31 так, чтобы не нарушать общий структурный и биологический профили. Особый интерес для замещения представляют собой гидрофобные остатки, выбранные из группы, состоящей из Val, Leu и Ile, или группы, состоящей из Met, Gly, Ser, Ala, Tyr и Trp. Например, остатки, допускающие замену, могут включать в себя Val, Leu и Ile или группу, состоящую из остатков Met, Gly, Ser, Ala, Tyr и Trp, как представлено в SEQ ID NO:2. Консервативные остатки цистеина в положениях в SEQ ID NO:2 и SEQ ID NO:11 являются относительно не допускающими замену.
Настоящее изобретение также относится к антителам, которые связывают функциональные фрагменты полипептидов IL-31, и к молекулам нуклеиновых кислот, кодирующим такие функциональные фрагменты. "Функциональный" IL-31 или его фрагмент, как определено в настоящем описании, характеризуется его активностью в отношении пролиферации или дифференцировки, его способностью индуцировать или ингибировать специализированные клеточные функции, или его способностью специфически связываться с антителом против IL-31 или с IL-31RA или с антителом или гетеродимерами IL-31RA/OSMRbeta этих рецепторов (либо растворимыми, либо иммобилизованными). Как описано в настоящем описании выше, IL-31 характеризуется структурой глобулы с четырьмя спиралями, содержащей спираль A (аминокислотные остатки 38-52), спираль B (аминокислотные остатки 83-98), спираль C (аминокислотные остатки 104-117) и спираль D (аминокислотные остатки 137-152), как представлено в SEQ ID NO:2. Таким образом, настоящее изобретение далее относится к слитым белкам, включающим в себя: (a) полипептидные молекулы, содержащие одну или несколько спиралей, как описано выше; и (b) функциональные фрагменты, содержащие одну или несколько из этих спиралей. Другая полипептидная часть слитого белка может быть представлена другим цитокином в виде глобулы с четырьмя спиралями, таким как IL-15, IL-2, IL-4 и GM-CSF, или неприродным и/или неродственным секреторным сигнальным пептидом, который облегчает секрецию слитого белка.
Настоящее изобретение также относится к антителам, которые связываются с полипептидными фрагментами или пептидами, содержащими часть полипептида IL-31 с эпитопом, описанного в настоящем описании. Такие фрагменты или пептиды могут содержать "иммуногенный эпитоп", который является частью белка, который вызывает антительный ответ, когда в качестве иммуногена используют целый белок. Иммуногенные обладающие эпитопом пептиды можно идентифицировать с использованием стандартных способов (смотрите, например, Geysen et al., Proc. Nat'l Acad. Sci. USA 81:3998 (1983)). Связывание антител с этими функциональными фрагментами приводит к ингибированию, блокированию, нейтрализации и/или снижению передачи сигнала IL-31 на узнающий его рецептор.
В противоположность этому полипептидные фрагменты или пептиды могут содержать "антигенный эпитоп", который представляет собой участок молекулы белка, с которой может специфически связываться антитело. Определенные эпитопы состоят из линейных или непрерывных участков из аминокислот, и антигенность такого эпитопа не нарушается денатурирующими веществами. В данной области известно, что для стимуляции продукции антител против белка можно использовать относительно короткие синтетические пептиды, которые могут имитировать эпитопы белка (смотрите, например, Sutcliffe et al., Science 219:660 (1983)). Таким образом, антигенные обладающие эпитопом пептиды и полипептиды согласно изобретению являются пригодными для индукции антител (например, нейтрализующих антител), которые связываются с полипептидами, описанными в настоящем описании. Для определения участков, которые обладают наибольшим антигенным потенциалом, можно использовать профили гидрофильности Хоппа/Вудса (Hopp et al., 1981, там же, и Hopp, 1986, там же). Например, в IL-31 человека, гидрофильные участки включают в себя аминокислотные остатки 54-59 в SEQ ID NO:2, аминокислотные остатки 129-134 в SEQ ID NO:2, аминокислотные остатки 53-58 в SEQ ID NO:2, аминокислотные остатки 35-40 в SEQ ID NO:2 и аминокислотные остатки 33-38 в SEQ ID NO:2. Например, в IL-31 мыши гидрофильные участки включают в себя аминокислотные остатки 34-39 в SEQ ID NO:11, аминокислотные остатки 46-51 в SEQ ID NO:11, аминокислотные остатки 131-136 в SEQ ID NO:11, аминокислотные остатки 158-163 в SEQ ID NO:11 и аминокислотные остатки 157-162 в SEQ ID NO:11.
Имеющие эпитоп антигенные пептиды и полипептиды предпочтительно содержат по меньшей мере от четырех до десяти аминокислот, по меньшей мере от десяти до четырнадцати аминокислот или приблизительно от четырнадцати до приблизительно тридцати аминокислот SEQ ID NO:2 или SEQ ID NO:4. Такие обладающие эпитопом пептиды и полипептиды можно получать посредством фрагментации полипептида IL-31 или химического синтеза пептидов, как описано в настоящем описании. Более того, отбор эпитопов можно проводить с помощью фагового дисплея библиотек случайных пептидов (смотрите, например, Lane and Stephen, Curr. Opin. Immunol. 5:268 (1993); и Cortese et al, Curr. Opin. Biotechnol. 7:616 (1996)). Стандартные способы идентификации эпитопов и получения антител на основе небольших пептидов, которые содержат эпитоп, описаны, например, Mole, "Epitope Mapping," в Methods in Molecular Biology, Vol. 10, Manson (ed.), страницы 105-116 (The Humana Press, Inc. 1992); Price, "Production and Characterization of Synthetic Peptide-Derived Antibodies", в Monoclonal Antibodies: Production, Engineering, and Clinical Application, Ritter и Ladyman (eds.), страницы 60-84 (Cambridge University Press 1995), и Coligan et al. (eds.), Current Protocols in Immunology, страницы 9.3.1-9.3.5 и страницы 9.4.1-9.4.11 (John Wiley & Sons 1997).
Активность антител, как описано в настоящем описании, можно определять по их способности ингибировать или снижать пролиферацию с использованием множества способов анализа, в которых определяют пролиферацию и/или связывание с клетками, экспрессирующими рецептор IL-31RA. Особый интерес представляют изменения в IL-31-зависимых клетках. Пригодные клеточные линии для создания IL-31-зависимых клеточных линий включают в себя IL-3-зависимую клеточную линию BaF3 (Palacios and Steinmetz, Cell 41: 727-734, 1985; Mathey-Prevot et al., Mol Cell. Biol. 6: 4133-4135, 1986), FDC-P1 (Hapel et al., Blood 64: 786-790, 1984), и MO7e (Kiss et al., Leukemia 7: 235-240, 1993). Зависимые от фактора роста клеточные линии можно получать в соответствии с опубликованными способами (например, Greenberger et al., Leukemia Res. 8: 363-375, 1984; Dexter et al., Baum et al. Eds., Experimental Hematology Today, 8th Ann. Mtg. Int. Soc. Exp. Hematol. 1979, 145-156, 1980).
Активность антител против IL-31, описанных в настоящем описании, можно определять с помощью биосенсорного микрофизиометра на основе силикона, который измеряет скорость внеклеточного закисления или экскрецию протонов, ассоциированную со связыванием рецептора и последующими физиологическими клеточными ответами. Иллюстративное устройство представляет собой микрофизиометр Cytosensor™, производимый Molecular Devices, Sunnyvale, CA. Этим способом можно определить множество клеточных ответов, таких как пролиферация клеток, транспорт ионов, выработка энергии, воспалительный ответ, активация регулятора и рецептора, и т.п. Смотрите, например, McConnell, H.M. et al., Science 257:1906- 1912, 1992; Pitchford, S. et al., Meth. Enzymol. 228:84-108, 1997; Arimilli, S. et al., L Immunol. Meth. 212:49-59, 1998; Van Liefde, I. et al., Eur. J. Pharmacol. 346:87-95, 1998.
Также в качестве реагентов для исследования с целью охарактеризации участков взаимодействия лиганд-рецептор пригодны антагонисты. Антагонисты пригодны для ингибирования размножения, пролиферации, активации и/или дифференцировки клеток, вовлеченных в регуляцию гемопоэза. Ингибиторы активности IL-31 (антагонисты IL-31) включают в себя антитела против IL-31 и растворимые рецепторы для IL-31, а также другие пептидные и непептидные вещества (включая рибозимы).
Ингибирование активности IL-31 можно определять с помощью ряда способов анализа. В дополнение к способам анализа, описанным в настоящем описании, образцы можно тестировать на ингибирование активности IL-31 с помощью множества анализов, разработанных для определения связывания рецептора, стимуляции/ингибирования IL-31-зависимых клеточных ответов или пролиферации экспрессирующих рецептор IL-31RA клеток.
IL-31-связывающий полипептид также можно использовать для очистки лиганда. Полипептид иммобилизуют на твердой подложке, такой как гранулы из агарозы, поперечносшитой агарозы, стекла, целлюлозных смол, смол на основе диоксида кремния, полистирола, поперечносшитого полиакриламида или сходных материалов, которые являются стабильными в условиях применения. Способы связывания полипептидов с твердыми подложками известны в данной области и включают в себя химические группы аминов, активацию цианоген-бромидом, активацию N-гидроксисукцинимидом, активацию эпоксидом, сульфгидрильную активацию и активацию гидразидом. Полученному материалу, как правило, придают форму колонки, и жидкости, содержащие лиганд, пропускают через колонку один или несколько раз для обеспечения связывания лиганда с рецепторным полипептидом. Затем лиганд элюируют с использованием изменения концентрации соли, хаотропных веществ (гуанидин-HCl), или pH для нарушения связывания лиганд-рецептор.
Преимущественно может быть использована система анализа, в которой используют связывающий лиганд рецептор (или антитело, один член пары комплемент/антикомплемент) или его связывающий фрагмент, и коммерчески доступное биосенсорное устройство (BIAcore, Pharmacia Biosensor, Piscataway, NJ). Такой рецептор, антитело, член пары комплемент/антикомплемент или фрагмент иммобилизуют на поверхности рецепторного чипа. Применение этого устройства описано в Karlsson, J. Immunol. Methods 145:229-40, 1991 и Cunningham and Wells, J. Mol. Biol. 234:554-63, 1993. Рецептор, антитело, член или фрагмент ковалентно присоединяют, с использованием химической группы амина или сульфгидрила, к декстрановым волокнам, которые прикрепляют к пленке из золота на проточной ячейке. Тестируемый образец пропускают через ячейку. В случае наличия лиганда, эпитопа или противоположного члена пары комплемент/антикомплемент в образце, он будет связываться с иммобилизованным рецептором, антителом или членом, соответственно, вызывая изменения коэффициента рефракции среды, который определяют по изменению поверхностного плазмонного резонанса пленки из золота. Эта система дает возможность определения скоростей ассоциации и диссоциации, из которых можно вычислять аффинность связывания, и оценки стехиометрии связывания. Альтернативно связывание лиганд/рецептор можно анализировать с использованием технологии SELDI™ (Ciphergen, Inc., Palo Alto, CA).
Антитела против IL-31 можно использовать для блокирования биологического действия провоспалительного IL-31, и они являются пригодными в качестве противовоспалительных лекарственных средств от множества заболеваний, как описано в настоящем описании. Специалист в данной области поймет, что антигенные обладающие эпитопом полипептиды содержат последовательность по меньшей мере от 6, предпочтительно по меньшей мере от 9 и более предпочтительно по меньшей мере от 15 до приблизительно 30 последовательных аминокислотных остатков полипептида IL-31 (например, SEQ ID NO:2). Также в их число входят полипептиды, содержащие фр