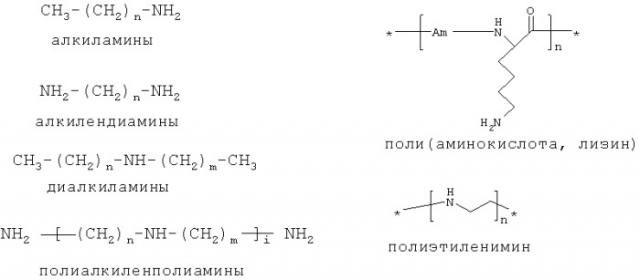
Нанокомпозиты диоксида титана для инактивации вирусного генома внутри клеток, способ их получения
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии, биоорганической химии и медицины. Предлагаются нанокомпозиты, обладающие противовирусной активностью и предназначенные для инактивации вирусного генома внутри клеток. Данные нанокомпозиты состоят из наночастиц диоксида титана, на которые иммобилизованы полиаминовые производные олигонуклеотидов (PA-oligo). Полиамины содержат от 3 до 1000 аминогрупп в молекуле и преимущественно представляют собой полилизин, полиэтиленимин и спермин. Наночастицы диоксида титана могут находиться как в аморфном состоянии, так и в окристаллизованном (анатаз, брукит). Данные нанокомпозиты могут проникать в клетки путем обычного эндоцитоза, без применения электропорации и других методов, нарушающих целостность клеточной мембраны. Кроме того, предлагается способ приготовления нанокомпозитов диоксида титана, на которые иммобилизованы конъюгаты олигонуклеотида с линкером. Метод позволяет получать конъюгаты олигонуклеотидов с полиаминами с выходом 90-100%. Изобретение значительно упрощает процесс приготовления нанокомпозитов при сохранении высокой плотности иммобилизации олигонуклеотидных конъюгатов на наночастицы диоксида титана и при высокой прочности их связывания с поверхностью. 2 н. и 10 з.п. ф-лы, 5 ил., 2 табл.
Реферат
Изобретение относится к области молекулярной биологии, биоорганической химии и медицины. Нанокомпозиты состоят из наночастиц диоксида титана, на которые иммобилизуются полиаминовые производные олигонуклеотидов (PA-oligo) и предназначены для воздействия на вирусный геном внутри клеток и подавления его дальнейшего функционирования.
Воздействие на внутриклеточные нуклеиновые кислоты является одной из важнейших проблем современной биологии и фундаментальной медицины и по праву принадлежит к числу стратегических направлений развития науки, в случае решения этой проблемы открывается широкое использование этого подхода в практической медицине. Первые работы в этом направлении были сделаны в России [Belikova A.M., Zarytova V.F., Grineva N.I. Tetrahedron Lett., 1967, 3557-3562]. В настоящее время такие исследования проводятся во всех развитых странах мира. Магистральным направлением этих исследований является использование антисенс- и антиген-подходов. В первом варианте используют антисенс-олигонуклеотиды, их производные, малые интерферирующие РНК (siRNA), направленные на подавление функций мРНК. В рамках антиген-подхода, активно развиваемого в последние десятилетия, используют синтетические триплексформирующие олигонуклеотиды (ТФО), способные взаимодействовать непосредственно с двухцепочечными участками ДНК. Возможность реализации этих подходов продемонстрирована в ряде публикаций, например [Crooke S.T., Ann. Rev. Med., 2004, v.55, p.61-95; Giuseppina M. Carbone et al. Nucl.Acids Res. 2004, v.32, p.4358-4367]. Однако в полной мере эти подходы пока не реализованы. Одной из наиболее значимых, но пока до конца не решенных проблем является слабая проницаемость олигонуклеотидов, их аналогов и siRNA в клетки.
В свете последних данных [например, Mario Ferrari, Nature Reviews Cancer, 2005, v.5, p.161-171; Paunesku Т. Nano Lett. 2007, v.7, p.596-601] проблема проницаемости может быть решена с помощью нанобиотехнологии, которая нацелена, в первую очередь, на разработку принципиально новых методов лечения, на создание новых лекарств и способов их доставки.
Мы предлагаем создать нанокомпозиты, состоящие из наночастиц TiO2, способных проникать в клетки, и олигонуклеотидов, способных взаимодействовать с нуклеиновыми кислотами, в частности с вирусным геномом.
Следует отметить, что ТiO2-наночастицы в составе нанокомпозитов могут выступать в качестве фотоактивируемого лиганда. В работах [Kim В., Kim D., Cho D., Cho S. Bactericidal effect of ТiO2 photocatalyst on selected food-borne pathogenic bacteria. (2003) Chemosphere, 52, 277-281 <> Suketa N., Sawase Т., Kitaura H., Naito M., Baba K., Nakayama K., Wennerberg A., Atsuta M. An antibacterial surface on dental implants, based on the photocatalytic bactericidal effect. (2005) Clin. Implant Dent Relat Res. 7, 105-111] показан фотокаталитический бактерицидный эффект ТiO2-наночастиц для патогенных бактерий и подавление роста раковых опухолей на культуре клеток чловека Ls-174-t [Zhang A.P., Sun Y.P. Photocatalytic killing effect of TiO2 nanoparticles on Ls-174-t human colon carcinoma cells. (2004) World J.Gastroenterol. 10, 3191-3193].
Наиболее близкой к заявляемому объекту изобретения является работа Paunesku Т., Rajh Т., Wiederrecht G., Maser J., Vogt S., Stojicevic N., Protic M., Lai В., Oryhon J., Thumauer M. and Woloschak G. Biology of TiO2-oligonucleotide nanocomposites. (2003) Nature materials, 2, 343-346. В работе обнаружена способность наночастиц TiO2-олигонуклеотид проникать в клетки млекопитающих, а также возможность отщепления связанного олигонуклеотида от частиц под действием света.
Наночастицы диоксида титана, используемые авторами для приготовления нанокомпозитов с олигонуклеотидами, получали путем гидролиза тетрахлорида титана в кислой среде при рН 3.5 в газовой атмосфере аргона или азота. Полученный коллоид с рН 3.5 и концентрацией 0.1-0.6 М по TiO2 разбавляли до концентрации 0.015 М и смешивали с глицидилизопропиловым эфиром для предотвращения нежелательных реакций гидроксильных групп TiO2 с фосфатными группами олигонуклеотида. Коллоидный раствор диоксида титана обрабатывали раствором LiOH до рН 9.5. Размер частиц диоксида титана составлял 45 Å (1500 молекул TiO2 в одной частице). Затем коллоид подвергали диализу против раствора NaH2PO4 до достижения рН 6.5.
Конъюгат олигонуклеотида с допамином получали по реакции активированной N-гидроксисукцинимидным эфиром карбоксильной группы на 5'-конце олигонуклеотида с аминогруппой допамина. Для удаления свободного несвязанного с олигонуклеотидом допамина раствор подвергали диализу против воды. Затем конъюгат допамин-олигонуклеотид связывали с частицами TiO2, модифицированными глицидилизопропиловым эфиром. При связывании допамина (свободного или в составе конъюгата с олигонуклеотидом) с коллоидными частицами TiO2 при 8>pH>2.5 образуется комплекс с переносом заряда между допамином и ТiO2. В результате получены нанокомпозиты, в которых, как правило, к одной частице ТiO2 присоединяется 2 олигонуклеотида. Трансфекцию клеток нанокомпозитами проводили с помощью SuperFect или электропорации.
Недостатком метода является сложная методика приготовления нанокомпозитов, включающая метод получения наночастиц диоксида титана в инертной газовой атмосфере реакционной среды, требующий специального аппаратурного оформления и длительной операции диализа для нейтрализации наночастиц. Связь допамин-ТiO2 в конъюгате олигонуклеотид-допамин-ТiO2 достаточно прочная в выбранных условиях, однако она частично разрушается в более жестких условиях (например, при отмывке нанокомпозитов растворами с высокой ионной силой). Отсутствует возможность введения дополнительных реакционноспособных групп в нанокомпозиты. Использование трансфектанта SuperFect или электропорации для трансфекции клеток также нежелательно, т.к. эти методы сопровождаются нарушением целостности клеточной мембраны.
Изобретение решает задачу упрощения метода приготовления нанокомпозитов при сохранении высокой плотности иммобилизации олигонуклеотидных конъюгатов на наночастицы диоксида титана и высокой прочности их связывания с поверхностью и повышения функциональных возможностей нанокомпозитов в отношении проникновения их в клетки, а также в отношении получения нанокомпозитов, содержащих дополнительные, в том числе множественные, метки (флуоресцеин, феназиний), необходимые для детектирования нанокомпозитов.
Нанокомпозиты состоят из наночастицы диоксида титана, на которые иммобилизуют конъюгаты - полиаминовые производные олигонуклеотидов (PA-oligo), и предназначены для инактивации вирусного генома внутри клеток.
Наночастицы диоксида титана, используемые для приготовления нанокомпозитов, представляют собой коллоидные растворы, в которых диоксид титана присутствует в виде отдельных частиц размером 3-10 нм, преимущественно 3-5 нм, или агрегатов из этих частиц в кристаллической модификации анатаз или анатаз и брукит, или в аморфном состоянии. В качестве полиаминовых линкеров в конъюгатах PA-oligo используют полилизин, спермин и другие полиамины. В некоторых случаях в полилизиновом компоненте аминогруппы блокируют ацетатными группами во избежание неспецифического взаимодействия аминогрупп с ДНК и РНК-мишенями. Длинный полиаминовый линкер обеспечивает прочное необратимое связывание олигонуклеотида с поверхностью наночастицы. При этом обеспечивается достаточное расстояние между олигонуклеотидом и поверхностью частиц, для того чтобы иммобилизованные олигонуклеотиды могли взаимодействовть с молекулами ДНК или РНК, находящимися в растворе. Соотношение аминогрупп полиамина и олигонуклеотида составляет 100:1.
Для приготовления нанокомпозитов синтезируют отдельно наночастицы диоксида титана путем гидролиза тетрахлорида титана или тетраизопропоксида титана и конъюгаты, затем проводят иммобилизацию конъюгатов на наночастицы.
Гидролиз тетрахлорида титана проводят на воздухе:
1) добавлением тетрахлорида титана в воду в условиях постоянного значения рН, равного 3-4, 6-7 и 9-10, которое поддерживается добавлением НСl и NH4OH (или NaOH) при температуре 4-70°С;
2) добавлением раствора NaOH к водному раствору тетрахлорида титана в условиях переменного значения рН до нейтральной среды.
Гидролиз тетраизопропоксида титана проводят на воздухе:
1) добавлением его смеси с изопропиловым спиртом в воду, содержащую кислотный катализатор, при температуре 20-95°С;
2) смешением ацетилацетонатного комплекса тетраизопропоксида титана с водой, содержащей кислотный катализатор, при температуре 40-70°С. В качестве кислотного катализатора используют 70%-ную азотную кислоту в количестве [H+]/[Ti]=0.2.
Полученные коллоидные растворы содержат 0.2-0.55 М ТiO2, которые перед иммобилизацией конъюгата PA-oligo разбавляют до концентрации 0.0125 М и нейтрализуют с помощью 0.5 М NaOH.
Синтез конъюгатов PA-oligo проводят по известному методу (патент РФ 2236467, C12Q 1/68, 20.09.04), основанном на активации 5'- или 3'-концевой фосфатной группы незащищенного олигонуклеотида с помощью пары трифенилфосфин-дипиридилдисульфид в присутствии нуклеофильного катализатора в абсолютном органическом растворителе. После этого образующееся активное производное инкубируют с полиамином в подходящем растворителе (диметилсульфоксид, диметилформамид или вода). В качестве нуклеофильного катализатора используют преимущественно метилимидазол, диметиламинопиридин или N-окись диметиламинопиридина. В качестве полиамина используют различные полиамины, содержащие от 3 до 1000 аминогрупп в молекуле. Полученный раствор конъюгата PA-oligo разбавляют до необходимой концентрации, равной 1·10-7-1·10-4 М, добавляют NaOH до конечной концентрации 0.01-0.001 М. Предложенный метод позволяет получать конъюгаты олигонуклеотидов с полиаминами с выходом 90-100%.
Иммобилизацию конъюгатов PA-oligo на наночастицы диоксида титана проводят следующим образом. Конъюгаты PA-oligo в концентрации 10-5 М (по олигонуклеотиду) смешивают с наночастицами ТiO2 в соотношении 1-50 нмоль PA-oligo на 1 мг наночастиц и выдерживают смесь при перемешивании в течение 1 (или более) часа при 20-50°С. Несвязавшийся конъюгат PA-oligo отмывают последовательно растворами 0.1-0.5 М КН2РO4 и NaCl с концентрацией не менее 0.1 М. Наночастицы диоксида титана используют как в аморфной, так и в кристаллической (анатаз, брукит) форме.
Доставку нанокомпозитов в клетки осуществляют путем обычного эндоцитоза.
Задача решается составом нанокомпозитов для инактивации внутриклеточного генетического материала, содержащим наночастицы диоксида титана, на которые иммобилизованы конъюгаты олигонуклеотидов с линкером, в качестве линкера используют полиамины, содержащие от 3 до 1000 аминогрупп в молекуле, преимущественно полилизин, полиэтиленимин или спермин.
Наночастицы диоксида титана имеют размер 3-10 нм, преимущественно 3-5 нм, и находятся в аморфном состоянии или в кристаллической модификации анатаз и/или брукит.
В качестве олигонуклеотидного компонента в конъюгатах используют олигонуклеотиды длиной 10-40 звеньев.
Задача решается также способом приготовления нанокомпозитов для инактивации вирусного генома внутри клеток, который включает синтез наночастиц диоксида титана, синтез конъюгатов олигонуклеотида с соответствующим линкером, иммобилизацию конъюгатов на наночастицы диоксида титана, иммобилизацию конъюгатов олигонуклеотида с полиаминовым линкером проводят в водном растворе при комнатной температуре, а несвязавшийся с частицами конъюгат отмывают последовательно растворами КН2РO4 и NaCl.
Наночастицы диоксида титана имеют размер 3-10 нм, преимущественно 3-5 нм, и находятся в аморфном состоянии или в кристаллической модификации анатаз и/или брукит.
В качестве линкера используют полиамины, содержащие от 3 до 1000 аминогрупп в молекуле, преимущественно полилизин, полиэтиленимин или спермин.
В качестве олигонуклеотидного компонента в конъюгатах используют олигонуклеотиды длиной 10-40 звеньев.
Иммобилизацию конъюгатов проводят в течение не менее 1 ч.
Концентрация раствора КН2РO4 составляет 0.1-0.5 М, концентрация раствора NaCl составляет не менее 0.1 М.
Наночастицы диоксида титана получают гидролизом тетрахлорида титана в присутствии НСl и NH4ON или NaOH в условиях переменного или постоянного значения рН 3-10, при температуре 4-70°С на воздухе или гидролизом тетраизопропоксида титана при температуре 20-95°С на воздухе. Гидролиз тетраизопропоксида титана проводят в присутствии комплексообразователя, ацетилацетона.
Синтез наночастиц диоксида титана из различных предшественников (тетрахлорид титана, тетраизопропоксид титана), позволяет получать наночастицы с требуемым размером 4-5 нм на воздухе в различной кристаллической модификации, что является важным для проникающей способности нанокомпозитов и их дальнейшего использования для адресной инактивации внутриклеточного генетического материала, в том числе для инактивации вирусного генома.
Синтез конъюгатов олигонуклеотидов с полиаминовыми линкерами и разработка способа их иммобилизации на наночастицы диоксида титана (аморфные, анатаз, брукит), не требует трудоемкой операции диализа коллоидных растворов и предварительной модификации поверхности диоксида титана глицидилизопропиловым эфиром.
Сущность изобретения иллюстрируется следующими примерами.
Примеры 1-15 иллюстрируют способ приготовления наночастиц диоксида титана.
Примеры 16-29 иллюстрируют способ приготовления нанокомпозитов.
Примеры 30, 31 иллюстрируют проникновение нанокомпозитов в клетки.
Пример 32 иллюстрирует противовирусную активность предлагаемых нанокомпозитов.
Пример 1
Коллоидный диоксид титана получают при температуре 4°С и постоянном значении рН=3-4. К 50 мл воды по каплям добавляют смесь 5.34 г TiCl4 в 28 мл НСl (5 М). Одновременно из другой капельной воронки по каплям добавляют аммиак, смешанный с дистиллированной водой в соотношении 1:1. Скорость смешения двух растворов подбирают таким образом, чтобы в реакционном сосуде поддерживался рН=3-4. Реакцию проводят при постоянном интенсивном перемешивании электрической мешалкой до полного расходования смеси, содержащей TiCl4. По окончании реакции коллоидный раствор перемешивают в течение 1 ч и подвергают старению в течение 5 ч при комнатной температуре. В результате получают коллоидный раствор белого цвета с концентрацией 0.23 М в пересчете на TiO2
Пример 2
Способ аналогичен примеру 1, отличается тем, что синтез проводят при комнатной температуре. Концентрация TiO2 в коллоидном растворе составляет 0.25 М.
Пример 3
Способ аналогичен примеру 1, отличается тем, что синтез проводят при температуре 70°С. Концентрация TiO2 в коллоидном растворе составляет 0.25 М.
Пример 4
Коллоидный диоксид титана получают при температуре 4°С и постоянном значении рН=6-7. К 50 мл воды по каплям добавляют смесь 5.75 г TiCl4 и 23 мл НСl (2.5 М). Одновременно из другой капельной воронки по каплям добавляют концентрированный аммиак, смешанный с дистиллированной водой в соотношении 1:1. Скорость смешения двух растворов подбирают таким образом, чтобы в реакционном сосуде поддерживался рН=6-7. Реакцию проводят до полного расходования смеси, содержащей TiCl4, при постоянном интенсивном перемешивании электрической мешалкой. По окончании реакции коллоидный раствор перемешивают в течение 1 ч и подвергают старению в течение 5 ч при комнатной температуре. Концентрация TiO2 в коллоидном растворе составляет 0.23 М.
Пример 5
Способ аналогичен примеру 4, отличается тем, что синтез проводят при комнатной температуре. Концентрация TiO2 в коллоидном растворе составляет 0.22 М.
Пример 6
Способ аналогичен примеру 4, отличается тем, что синтез проводят при температуре 70°С. Концентрация TiO2 в коллоидном растворе составляет 0.25 М.
Пример 7
Коллоидный диоксид титана получают при температуре 4°С и постоянном значении рН=9-10. К 50 мл воды по каплям добавляют смесь 5.9 г TiCl4 и 24 мл НСl (1 М). Одновременно из другой капельной воронки по каплям добавляют концентрированный аммиак, смешанный с дистиллированной водой в соотношении 1:1. Скорость смешения двух растворов подбирают таким образом, чтобы в реакционном сосуде поддерживалось рН=9-10. Реакцию проводят до полного расходования смеси, содержащей TiCl4, при постоянном интенсивном перемешивании электрической мешалкой. По окончании реакции коллоидный раствор перемешивают в течение 1 ч и подвергают старению в течение 5 ч при комнатной температуре. Концентрация TiO2 в коллоидном растворе составляет 0.22 М.
Пример 8
Способ аналогичен примеру 7, отличается тем, что синтез проводят при комнатной температуре. Концентрация TiО2 в коллоидном растворе составляет 0.23 М.
Пример 9
Способ аналогичен примеру 7, отличается тем, что синтез проводят при температуре 70°С. Концентрация ТiO2 в коллоидном растворе составляет 0.26 М.
Пример 10
Коллоидный диоксид титана получают при комнатной температуре. Вначале осторожно смешивают 7.2 г TiCl4 с 7 мл НСl (5 М) и добавляют 60 мл дистиллированной воды. Смесь перемешивают в течение 10 мин. Затем в реакционный сосуд по каплям добавляют водный раствор NaOH с концентрацией 2.5 М до достижения рН=6.7. По окончании реакции коллоидный раствор перемешивают в течение 1 ч и подвергают старению в течение 5 ч при комнатной температуре. Концентрация ТiO2 в коллоидном растворе составляет 0.32 М.
Пример 11
Коллоидный диоксид титана получают при комнатной температуре смешением 11.9 г тетраизопропоксида титана (TIP) с 2 мл изопропилового спирта. При интенсивном перемешивании в смесь по каплям добавляют в 150 мл дистиллированной воды, содержащей 1.4 мл 70%-ной НNО3. В процессе синтеза появляются крупные хлопья осадка, которые исчезают после перемешивания смеси в течение ночи. В результате получают прозрачный коллоидный раствор (золь) с концентрацией 0.27 М в пересчете на ТiO2.
Пример 12
Способ аналогичен примеру 11, отличается тем, что гидролиз проводят при 50°С в течение 6 ч. Концентрация TiO2 в коллоидном растворе составляет 0.3 М.
Пример 13
Способ аналогичен примеру 11, отличается тем, что гидролиз проводят при 75°С в течение 6 ч. Концентрация TiO2 в коллоидном растворе составляет 0.35 М.
Пример 14
Способ аналогичен примеру 11, отличается тем, что гидролиз проводят при 95°С в течение 6 ч. Концентрация TiO2 в коллоидном растворе составляет 0.4 М.
Пример 15
Коллоидный диоксид титана получают смешением 6.9 мл ацетилацетона (АсАс) с 5 мл изопропилового спирта. К смеси по каплям добавляют 9.5 г тетраизопропоксида титана [AcAc]/[Ti]=2. Образовавшийся комплекс ярко-желтого цвета перемешивают при комнатной температуре в течение 30 мин. Затем к комплексу по каплям добавляют 60 мл дистиллированной воды, в которой растворено 0.5 мл 70%-ной HNO3, [H+]/[Ti]=0.2; [H2O]/[Ti]=100. Смесь перемешивают при комнатной температуре в течение 1 ч, затем нагревают до 60°С и перемешивают смесь при этой температуре в течение 7 ч. В конце получают прозрачный золь желтого цвета с концентрацией 0.55 М в пересчете на TiO2.
Размер частиц диоксида титана и его фазовое состояние по примерам 1-15 приведены в таблице 1.
Размер частиц диоксида титана определяют с использованием методов малоуглового рентгеновского рассеяния (МУРР), рентгенофазового анализа (РФА), просвечивающей электронной микроскопии высокого разрешения (ПЭМВР). Фазовый состав диоксида титана исследуют методами РФА и ПЭМВР.
Все измерения рентгенограмм МУРР от анализируемых образцов проводят на малоугловом рентгеновском дифрактометре совместного производства фирм Siemens (Германия), Anton Paar и Hecus-Braun (Австрия) с малоугловой камерой Кратки, дающей возможность термостатирования жидких образцов от 0 до 70°C с точностью до ±0.1°С. Используют рентгеновскую трубку с медным анодом (λCuКα=1.54 Å). Для анализа образец коллоидного раствора TiO2 помещают в специальную герметичную кювету из кварцевого капилляра с толщиной слоя образца 1.0 мм и со стенками 0.01 мм. В качестве фонового рассеяния измеряют рассеяние от кювет, заполненных жидкой фазой, по составу близкой к маточному раствору исследуемого образца. Измерения рентгенограмм МУРР проводят в интервале углов 2Θ=0.17÷2.34° при 24°С. Из полученных экспериментальных данных МУРР от образцов после процедур аппаратной коррекции вычисляют значения функций распределений наночастиц (неоднородностей электронной плотности) на основе TiO2 по размерам (Dv(R)) в образцах (как решения обратных задач рассеяния) в виде усредненных значений интегральных дисперсных характеристик распределений наночастиц.
Рентгенографические исследования (РФА) проводят на приборе HZG-4 (производства Германии) на монохроматизированном кобальтовом излучении. Фазовый анализ проводят с использованием рентгенографической базы данных Международного союза кристаллографов (JCPDS). Размер частиц оценивают в соответствии с формулой Шеррера:
D=kλ/β cos θ, где k - коэффициент формы, λ - длина волны (1.79021 Å, β - полуширина линии, θ - положение линии.
Снимки просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) получают на электронном микроскопе JEM 2010 (JEOL, Япония) с разрешением по решетке 0.14 нм при ускоряющем напряжении 200 кВ. Образцы для исследований наносят ультразвуковым диспергатором на стандартные медные сетки с углеродным покрытием, которые помещают в держатель и вводят в камеру образцов электронного микроскопа.
| Таблица 1 | |||||||
| Дисперсные и структурные свойства наночастиц диоксида титана | |||||||
| Образцы | Условия синтеза | Размер частиц TiO2, нмпо данным метода | Фазовый состав | ||||
| МУРР | РФА | ПЭМ | |||||
| По примеру 1 | TiCl4 | pH=3-4 | T=4°C | 5 | 5 | 5 | анатаз |
| По примеру 2 | TiCl4 | pH=3-4 | T=20°C | 5 | 5 | 5 | анатаз |
| По примеру 3 | TiCl4 | pH=3-4 | T=70°C | 6 | 5 | 5 | анатаз |
| По примеру 4 | TiCl4 | pH=6-7 | T=4°C | 7 | р/ам | рентгеноаморфн. | |
| По примеру 5 | TiCl4 | pH=6-7 | T=20°C | 6 | р/ам | рентгеноаморфн. | |
| По примеру 6 | TiCl4 | pH=6-7 | T=70°C | 5 | р/ам | рентгеноаморфн. | |
| По примеру 7 | TiCl4 | pH=9-10 | T=4°C | 6 | р/ам | рентгеноаморфн. | |
| По примеру 8 | TiCl4 | pH=9-10 | T=20°C | 5 | р/ам | рентгеноаморфн. | |
| По примеру 9 | TiCl4 | pH=9-10 | T=70°C | 5 | р/ам | рентгеноаморфн. | |
| По примеру 10 | TiCl4 | pH переменный | Т=20°С | 3 | р/ам | аморфный | рентгеноаморфн. |
| По примеру 11 | TIP | T=20°C | 3 | 3 | 3 | анатаз | |
| По примеру 12 | TIP | T=50°C | 4 | 4 | 4 | анатаз | |
| По примеру 13 | TIP | T=75°C | 5 | 5 | 5 | анатаз | |
| По примеру 14 | TIP | T=95°C | 5 | 5 | 6 | анатаз+брукит | |
| По примеру 15 | TIP+ACAC | T=60°C | 3 | 3 | 3 | анатаз |
Пример 16
Синтез конъюгата олигонуклеотида с полиламинами, содержащими первичную аминогруппу общей формулы R-NH2 (где R-NH2 - алкиламины, алкилендиамины, полиаминокислоты с лизиновьми звеньями, полиалкиленполиамины) или вторичную аминогруппу общей формулы R',R''-NH (где R',R''-NH - диалкиламины, полиэтиленимин) (см. схему 1), осуществляют следующим образом. К раствору олигонуклеотида, содержащего фосфатную группу на 3' или 5'-конце (10-100 нмоль), в 40 мкл диметилсульфоксида (DMSO) добавляют по 10 мг трифенилфосфина (Рh3Р) и дипиридилдисульфида (Ру2S2) и 20 мкл раствора DMSO, содержащего 1 мг N-окиси диметиламинопиридина (DMAPO). Реакционную смесь перемешивают при 37°С в течение 15 мин, после чего активированный олигонуклеотид осаждают эфиром и переосаждают 2 раза эфиром из DMSO. Остаток растворяют в DMSO (100-1000 мкл) и добавляют соответственно 10-100 мкл 0.1 М раствора PA-oligo в DMSO (концентрации полиамина рассчитывается на мономерное звено, содержащее одну аминогруппу). Реакционную смесь оставляют на 1 ч при комнатной температуре. Образование конъюгата полиамин-олигонуклеотид (PA-oligo) проверяют с помощью ТСХ в системе изопропанол-аммиак-вода (6:1:3). Продукт имеет меньшую подвижность по сравнению с исходным олигонуклеотидом (в случае протяженных полиаминов - нулевую подвижность). Концентрация конъюгата PL-oligo в конечном растворе составляет 0.5-1.0·10-4 М по олигонуклеотиду. Реакционную смесь, содержащую конъюгат PL-oligo, используют для иммобилизации на наночастицы диоксида титана. Раствор PL-oligo может храниться в течение нескольких месяцев перед использованием.
Пример 17
Синтез конъюгата олигонуклеотида с полиаминами (PA-oligo) аналогичен примеру 16, отличается тем, что в качестве полиамина используют полилизин (PL), полиэтиленимин (PEI), поли(лизин, фенилаланин) (PLPh), спермин (Sp), спермидин (Sd) или олигонуклеотид, несущий аминопропиленовый линкер (NH2). Молярное отношение аминогрупп к олигонуклеотиду в конъюгате PA-oligo составляет 100:1, 100:1, 100:1, 3:1, 2:1 и 1:1 соответственно.
Пример 18
Получение нанокомпозита TiO2-PL-oligo, состоящего из наночастиц диоксида титана в кристаллической форме (анатаз), проводят, добавляя 10 мкл 10-5 М раствора полилизинсодержащего олигонуклеотида CAATTCCATGTGCCATp-PL (1 нмоль) к 0.5 мл суспензии наночастиц (2 мг/мл). Смесь выдерживают при встряхивании в течение 1 ч при комнатной температуре, после чего центрифугируют и отделяют супернатант. К осадку нанокомпозита добавляют 0.5 мл 0.5 М КН2РO4 (рН 7), выдерживают 5-10 мин при встряхивании и снова центрифугируют. Процедуру повторяют, используя в качестве раствора 0.1 М NaCl. Осадок суспендируют в 0.5 мл 0.1 М NaCl. Количество конъюгата PA-oligo, присоединившегося к наночастицам диоксида титана, определяют по разности оптического поглощения раствора конъюгата перед добавлением к частицам и промывных растворов после иммобилизации. Концентрация частиц в суспензии нанокомпозита 2 мг/мл, соотношение PL-oligo/TiO2=~0.9 нмоль/мг.
Схема 1
Пример 19
Способ аналогичен примеру 16, отличается тем, что к 0.1 мл суспензии наночастиц (10 мг/мл) добавляют 0.4 мл 10-5 М раствора PL-oligo (40 нмоль). Концентрация частиц в суспензии нанокомпозита 2 мг/мл, соотношение PL-oligo/TiO2=35-40 нмоль/мг.
Пример 20
Способ аналогичен примеру 16, отличается тем, что в качестве наночастиц используют диоксид титана в аморфном состоянии. Концентрация частиц в суспензии нанокомпозита 2 мг/мл, соотношение PL-oligo/TiQ2=~0.9 нмоль/мг.
Пример 21
Способ аналогичен примеру 17, отличается тем, что в качестве наночастиц используют диоксид титана в аморфном состоянии. Концентрация частиц в суспензии нанокомпозита 2 мг/мл, соотношение PL-oligo/TiO2=35-40 нмоль/мг.
Пример 22
Способ аналогичен примеру 16, отличается тем, что вместо PL-oligo используют полиэтилениминсодержащий олигонуклеотид (PEI-oligo). Концентрация частиц в суспензии нанокомпозита 2 мг/мл, соотношение PEI-oligo/TiO2=~0.6 нмоль/мг.
Пример 23
Способ аналогичен примеру 16, отличается тем, что вместо PL-oligo используют сперминсодержащий олигонуклеотид (Sp-oligo). Концентрация частиц в суспензии нанокомпозита 2 мг/мл, соотношение Sp-oligo/TiO2=~0.1 нмоль/мг.
Пример 24
Способ аналогичен примеру 16, отличается тем, что вместо PL-oligo используют олигонуклеотид, несущий аминопропиленовый линкер (NH2-oligo). Концентрация частиц в суспензии нанокомпозита 2 мг/мл, соотношение NH2-oligo/TiO2=~0.1 нмоль/мг.
Пример 25
Способ аналогичен примеру 16, отличается тем, что иммобилизацию проводят, упаривая реакционную смесь до минимального объема при 45°С. Концентрация частиц в суспензии нанокомпозита 2 мг/мл, соотношение PL-oligo/TiO2=~0.9 нмоль/мг.
Пример 26
Способ аналогичен примеру 16, отличается тем, что иммобилизацию проводят, выдерживая реакционную смесь при встряхивании в течение 16 ч при комнатной температуре. Концентрация частиц в суспензии нанокомпозита 2 мг/мл, соотношение PL-oligo/TiO2=~0.9 нмоль/мг.
Пример 27
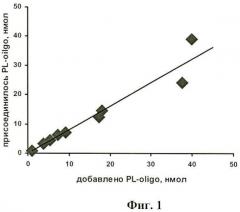
Способ аналогичен примеру 16, отличается тем, что вместо PL-oligo используют радиоактивно меченный [32P]PL-oligo. Для синтеза [32P]PL-oligo в качестве исходного олигонуклеотида использовали [32P]-меченный по 5'-концевому фосфату олигонуклеотид [32P]pCAATTCCATGTGCCATp. К 10 мкл суспензии наночастиц (5 мг/мл) добавляют различное количество [32P]PL-oligo (0.05-2 нмоль), что соответствует соотношению PL-oligo к TiO2 от 1 до 40 нмоль/мг. После отмывания частиц, как описано в примере 17, радиоактивность частиц и промывных растворов измеряют по Черенкову в воде на счетчике Mark II (Nuclear Chicago, США). Количество присоединившегося PL-oligo линейно зависит от количества добавленного конъюгата (Фиг.1). Выход иммобилизации, рассчитанный как отношение Ip/(Ip+Iw), где Iр и Iw - радиоактивности частиц и промывок, соответственно, составляет 90-100%. На Фиг.2 представлена гистограмма иммобилизации различных полиаминсодержащих олигонуклеотидов (PA-oligo) на наночастицы диоксида титана в кристаллической форме (анатаз) при использовании радиоактивно меченных конъюгатов [32P]-PA-oligo. Соотношение добавленного [32P]-PA-oligo к ТiO2 составляло 1 нмоль/мг (1) или 5 нмоль/мг (2). PA=PL (остаток полилизина), PEI (остаток полиэтиленимина), Sp (остаток спермина), Sd (остаток спермидина), NH2 (аминопропил).
Пример 28
Нанокомпозит TiO2-PL-oligo(Flu) (0.1 мг в 200 мкл 0.1 М NaCl), содержащий остаток флуоресцеина на 3'-конце олигонуклеотидного фрагмента, полученный, как описано в примере 20, центрифугируют, отделяют супернатант, к частицам добавляют раствор флуоресцеинизотиоцианата (FITC, 0.7 мг в 20 мкл 0.2 М Nа2СО3) и смесь выдерживают при встряхивании в течение 1 ч при 60°С. Нанокомпозит с присоединившимися остатками флуоресцеина (TiO2-PL(Flu)n-oligo(Flu) отмывают от избытка FITC с помощью 0.2 М Na2СО3 (3×100 мкл). Частицы суспендируют в 0.1 М NaCl, сканируют на сканере PowerLook 1000 (UMAX, USA) (Фиг.3а) и записывают спектры электронного поглощения. Отношение поглощения суспензий TiO2-PL(Flu)n-oligo(Flu) и TiO2-PL-oligo(Flu) на 493 нм (максимум для флуоресцеина) составляет 10:1.
Пример 29
Нанокомпозит TiO2-PL-oligo(Phn) (0.1 мг в 200 мкл 0.1 М NaCl), содержащий остаток N-(2-оксиэтил)феназиния на 3'-конце олигонуклеотидного фрагмента, полученный, как описано в примере 20, центрифугируют, отделяют супернатант, к частицам добавляют раствор хлорида N-(2-оксиэтил)феназиния 0.5 мг в 20 мкл 0.2 М Nа2СО3) и смесь выдерживают при встряхивании в течение 10 мин при комнатной температуре. Нанокомпозит с присоединившимися остатками Phn (TiO2-PL(Phn)n-oligo(Phn) отмывают от избытка Phn с помощью 0.2 М Na2CO3 (3×100 мкл). Частицы суспендируют в 0.1 М NaCl, сканируют на сканере PowerLook 1000 (UMAX, USA) (Фиг.3б) и записывают спектры электронного поглощения. Отношение поглощения суспензий TiO2-PL(Phn)n-oligo(Phn) и TiO2-PL-oligo(Phn) на 530 нм (максимум для Phn) составляет 25:1.
Пример 30
Для проведения экспериментов по проникновению в клетки наночастиц ТiO2 и нанокомпозитов, приготовленных на их основе по примерам 18-21, используют клетки линий Vero, KCT, MDCK. Клетки получают из коллекции культур клеток ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора (п.Кольцово, Новосибирская обл.). Клетки выращивают на среде Игла ДМЕМ в присутствии 5% фетальной сыворотки крупного рогатого скота (КРС) с добавлением пенициллина (100 МЕ/мл) и стрептомицина (100 мкг/мл). Клетки инкубируют с нанокомпозитами-наночастицами диоксида титана, на которых иммобилизованы конъюгаты полилизин-олигонуклеотид.
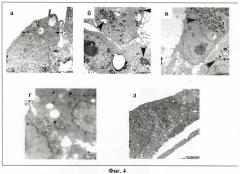
Проникновение нанокомпозитов в клетки контролируют методом просвечивающей электронной микроскопии (ПЭМ). Для ПЭМ исследований образцы готовят следующим образом. После инкубации с нанокомпозитами клетки отмывают от среды и фиксируют 2.5% раствором глутарового альдегида в буфере PBS, рН 7.2, в течение 1 ч на льду. Дофиксацию проводят 1% раствором четырехокиси осмия в буфере PBS, рН 7.2, в течение 1 ч при комнатной температуре. После дегидратации в этаноле клетки заключают в эпоксидную смолу Аралдит. Ультратонкие срезы готовят на ультрамикротоме Leica UCT, контрастируют уранилацетатом и цитратом свинца и исследуют на электронном микроскопе LEO 910 (Zeiss). Результаты экспериментов по проникновению ТiO2-наночастиц приведены на Фиг.4 (а, на клетках VERO; б, на клетках КСТ; в, на клетках MDCK), на которых проиллюстрировано, что наночастицы попадают в клетку и локализуются в ней в виде скоплений в вакуолях, фагосомах и в цитоплазме. Фиг.4г демонстрирует проникновение нанокомпозита TiO2-PL-oligo в клетки MDCK. На Фиг.4д представлен контроль - клетки Vero без обработки нанокомпозитами. Я - ядро клетки, Ядр - ядрышко, М - митохондрии. Стрелками на рисунках показаны единичные частицы или их скопления.
Пример 31
Для визуализации нанокомпозитов с использованием лазерной конфокальной микроскопии синтезируют нанокомпозиты TiO2-PL(Flu)n-oligo(Flu) (см. пример 28), меченные флуоресцентной меткой.
Эксперименты с культурами клеток проводят на клетках линий Vero, КСТ, MDCK и MDBK. Клетки получают из коллекции культур клеток ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора (п.Кольцово, Новосибирская обл.). Клетки выращивают на среде Игла ДМЕМ в присутствии 5% фетальной сыворотки крупного рогатого скота (КРС) с добавлением пенициллина (100 МЕ/мл) и стрептомицина (100 мкг/мл).
Клетки, растущие на покровных стеклах, инкубируют с нанокомпозитами TiO2-PL(Flu)n-oligo(Flu) в течение суток; затем клетки фиксируют смесью 0.4% формалина и 0.1% Triton X-100 (10 мин), обрабатывают 0.5% Triton X-100 (10 мин) и дофиксируют 2% формалином (10 мин). Все растворы готовят в буфере PBS, рН 7.2. Стекла с клетками помещают на предметные стекла клетками вниз в заключающую среду с антифейдом и DAPI. Препараты исследуют на лазерном сканирующем микроскопе LSM 510 МЕТА (Zeiss). Для обнаружения метки используют две лазерные линии с длиной волны 405 (для DAPI - ядра клеток) и 488 (для нанокомпозитов, меченных флуоресцеином). На Фиг.5 приведена фотография образца клеток MDCK после инкубации с нанокомпозитом TiO2-PL(Flu)n-oligo(Flu).
Пример 32
Для определения противовирусной активности препаратов используют культуру клеток КСТ (коронарные сосуды теленка), полученную из коллекции культур клеток Института экспериментальной ветеринарии Сибири и Дальнего Востока СО РАСХН и которая культивировалась с использованием сыворотки лошадей. Монослой клеток КСТ инфицируют вирусом BVDV, штамм БК-1, с множественностью 0.01 БОЕ/клетку. После адсорбции в течение 1 ч инокулят удаляют, монослой клеток отмывают двукратно, вносят поддерживающую культуральную среду без сыворотки, наносят препараты TiO2-наночастиц и облучают УФ с расстояния 1.5 см в течение 16 мин (расчетная удельная мощность светового потока 4 мВт/см2.
Полученные данные по определению противовирусной активности препаратов на основе ТiO2-наночастиц приведены в таблице 2.
| Таблица 2 | ||||
| Противовирусная активность конъюгатов ТiO2-наночастиц с олигонуклеотидами | ||||
| Препараты | Оптическая плотность монослоя клеток при УФ-облучении (365 нм) после инфицирования вирусом через определенные временные интервалы | |||
| 1 час | 2 часа | 3 часа | 4 часа | |
| Конъюгат TiO2-PL-oligo | 0.167±0.002 | 0.227±0.002 | 0.216±0.037 | 0.212±0.004 |
| Контроль TiO2-PL | 0.134±0.002 | 0.143±0.001 | 0.176±0.003 | 0.162±0.008 |
| Контроль TiO2 | 0.139±0.005 | 0.148±0.002 | 0.173±0.001 | 0.170±0.001 |
| Контроль вируса | 0.136±0.005 | 0.145±0.002 | 0.171±0.012 | 0.162±0.010 |
Можно видеть, что оптическая плотность монослоя клеток, инфицированных вирусом, при использовании конъюгатов на основе аморфных наночастиц TiO2-PL-oligo имеет явно выраженную тенденцию к повышению и через 2-3 часа после инфицирования превышает оптическую плотность контролей примерно в 1.5 раза, то есть данные конъюгаты обладают противовирусной активностью, тогда как контрольные препараты без олигонуклеотидов такой активностью не обладали. Противовирусная активность конъюгатов наиболее выражена при УФ облучении в период образования репликативных комплексов, через 2-3 часа после инфицирования.
Предложен более эффективный и удобный способ получения полиаминсодержащих олигонуклеотидов (PA-oligo), основанный на активации концевой фосфатной группы с помощью Рh3Р/Ру2S2 в присутствии нуклеофильного катализатора с последующей реакцией