Способ получения высокодисперсных катодных материалов lixfeymzpo4/c со структурой оливина
Иллюстрации
Показать всеИзобретение относится к технологии получения катодных материалов для литий-ионных аккумуляторов. Техническим результатом изобретения является улучшение электрохимических свойств катодных материалов LixFeyMzPO4/C со структурой оливина, а также на упрощение и удешевление процесса их получения. Согласно изобретению синтез катодных материалов LixFeyMzPO4/C со структурой оливина проводят путем карботермического восстановления Fe2O3 с применением высоконапряженного механохимического активатора, а поверхностное модифицирование углеродом осуществляют высокопроводящими сажами и/или органическими соединениями с температурой пиролиза ниже 700°С, используемыми одновременно в качестве восстановителя и покрывающего агента. 15 з.п. ф-лы, 7 ил., 11 пр., 1 табл.
Реферат
Изобретение относится к химической технологии и может быть использовано для получения катодных материалов для литий-ионных аккумуляторов. В качестве электродных материалов в литий-ионных аккумуляторах применяют материалы, способные обратимо интеркалировать ионы лития. Наиболее широкое распространение получил кобальтат лития LiCoO2 со слоистой структурой, преимуществами которого являются высокий потенциал разряда, относительная простота синтеза, способность циклировать при высоких плотностях тока и др. [1]. Недостатки кобальтата лития заключаются в его дороговизне, токсичности, невысокой практической емкости, которая составляет 1/2 от теоретической, низкой термической и структурной устойчивости в заряженном состоянии и др. Помимо кобальтата лития находит применение и никелат лития LiNiO2, однако его отличает более сложный синтез. В последние годы большой интерес получили твердые растворы LiNi1-yCoyO2, LiNi1-x-yCoxMnyO2 и LiNi1-yMnyO2, практическая емкость которых почти в 1,5 раза превосходит емкость LiCoO2. Все указанные выше катодные материалы имеют слоистую структуру (пространственная группа R-3m) и циклируют в интервале напряжений 3-4,3 B.
Другим классом катодных материалов являются оксиды со шпинельной структурой. Основной его представитель литий-марганцевая шпинель LiMn2O4 [2]. Структура шпинели обеспечивает 3-мерную диффузию ионов лития. Однако маленький размер ионов O2- ограничивает свободный объем, доступный для ионов лития, и тем самым мощностные возможности электродов. Замещение O2- на S2- увеличивает свободный объем для диффузии ионов лития, но при этом снижает рабочее напряжение ячейки.
В последние годы в области литий-ионных аккумуляторов широко проводятся работы, направленные на поиск новых катодных материалов, отличающихся высокой удельной разрядной емкостью и мощностью, структурной и химической устойчивостью при циклировании, дешевизной и низкой токсичностью, а также простых и экономичных методов их получения.
Мощность аккумулятора определяется по уравнению:
P=I·V, где I - ток, а V - напряжение.
Таким образом, чтобы увеличить мощность аккумулятора, т.е. достичь его работоспособности при высоких скоростях (больших плотностях тока), необходимо использовать соединения со структурой, обеспечивающей максимальный объем для диффузии ионов лития, и содержащие в своем составе ионы кислорода, обеспечивающие высокое напряжение. В последние годы большой интерес уделяется исследованию катодных материалов на основе кислородсодержащих солей лития и переходных металлов (Fe, Mn, Co, Ni) с каркасной структурой.
Ортофосфаты лития и d-металлов со структурой оливина LiMPO4 (M=Fe, Mn, Co, Ni) обратили на себя внимание из-за высокого потенциала окислительно-восстановительной пары M2+/M3+ относительно пары Li/Li+, который на 1,5-2 B выше по сравнению с потенциалом соответствующих оксидов вследствие «индуктивного эффекта» Fe-O-P, обусловленного сильной ковалентностью связи P-O в полианионе PO4 3- [3-6]. Наибольший интерес получил железо-фосфат лития LiFePO4. Среднее напряжение разряда LiFePO4, равное 3,4 B, является оптимальным с целью предотвращения разложения электролита, с одной стороны, и сохранения высокой плотности энергии, с другой. Теоретичесая емкость составляет 170 мА·ч/г и может быть при определенных условиях практически полностью реализована на практике (в случае LiCoC2 реализуется только Ѕ часть теоретической емкости). LiFePO4 отличается высокой химической устойчивостью по отношению к влаге, воде и растворам электролитов, не содержащим протонные группы, даже при повышенных температурах, а также термической устойчивостью. Он характеризуется невысокой стоимостью по сравнению со слоистыми катодами, низкой токсичностью и безопасностью. LiFePO4 превосходит по своим ценовым характеристикам и практически не уступает по электрохимическим показателям известные катодные материалы кобальт лития LiCoO2, никелат лития LiNiO2 и литий-марганцевую шпинель LiMn2O4. LiFePO4 обеспечивает более высокую волюмометрическую плотность энергии, чем LiMn2O4, и более высокую гравиметрическую плотность энергии, чем LiCoO2 (Таблица 1). Данный катодный материал привлекателен для использования в крупногабаритных аккумуляторах для электромобилей и гибридных энергетических системах, где большое значение имеют цена и безопасность. LiMnPO4, LiCoPO4 и LiNiPO4 имеют окислительно-восстановительные потенциалы 4.1; 4,8 и >5,0 В соответственно, что требует использования электролитов с более высокой окислительной стабильностью.
| Таблица 1 | ||||
| Сравнительная характеристика катодных материалов (с графитовым анодом) | ||||
| Характеристика | LiCoO2 | LiNiO2 | LiMn2O4 | LiFePO4 |
| Среднее напряжение (В) | 3,7 | 3,6 | 3,9 | 3,4 |
| Теоретическая емкость (мА·чг-1) | 274 | 274 | 148 | 169 |
| Практическая емкость (мА·чг-1) | 140 | 170 | 105 | 150 |
| Плотность (г·мл-1) | 5,1 | 4,8 | 4,2 | 3,6 |
| Практическая энергетическая плотность (Вт·кг-1/Вт·ч·л-1) | 524/2690 | 612/2910 | 410/1680 | 470/1850 |
| Устойчивость при высоких температурах | удовл. | недост. | хор. | превосх. |
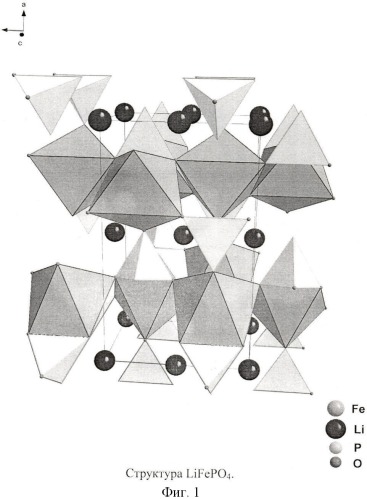
LiFePO4 имеет упорядоченную структуру оливина, т.е. отромбическую симметрию с пространственной группой Pnma, состоящую из плотной гексагональной упаковки ионов кислорода, в которой ионы Fe2+ и Li+ занимают половину октаэдров и ионы P5+ - 1/8 тетраэдров. Структуру можно представить как цепочку из октаэдров вдоль оси с, которые связаны PO4 3- тетраэдрами и образуют трехмерный каркас (Фиг.1). Октаэдры FeO6, образующие зигзагообразные цепи, соединены между собой вершинами, а не гранями, что затруднят электронный перенос. Октаэдры LiO6 образуют линейные цепочки оси b: диффузия ионов лития происходит вдоль направления 010. В процессах заряда-разряда может участвовать один ион лития на формульную единицу. Зарядовая компенсация осуществляется за счет окислительно-восстановительной пары Fe2+/Fe3+. Реализуется двухфазный механизм внедрения экстракции ионов лития. Образующаяся фазы FePO4 имеет схожую орторомбическую структуру: изменение объема составляет 6.81% [7]. На зарядно-разрядных кривых наблюдается плато.
Основным недостатком LiFePO4 является низкая электронная (σ~109 См/см) [8] и литий-ионная проводимость (σ~1010-10-11 См/см) [9], и, как следствие, неудовлетворительная никлируемость при высоких скоростях заряда-разряда. Проводится широкий поиск по оптимизации проводящих свойств LiFePO4 с целью улучшения его катодных характеристик.
Улучшения катодных характеристик LiFePO4 достигают несколькими путями:
1) уменьшением размеров частиц, что способствует сокращению расстояния для электронного и литий-ионного транспорта [7];
2) нанесением высокопроводящего углеродного покрытия [10];
3) допированием ионами другой валентности (замещение в позициях Li и Fe), чтобы улучшить проводимость за счет образования пары Fe2+/Fe3+ [11];
4) образованием поверхностных проводящих фаз Fe2P и/или Fe3P, имеющих высокую электронную проводимость, путем карботермического восстановления LiFePO4 при температурах выше 850°C [12];
5) покрытием частицами металлов, например, Ag или Ag/C [13].
Основные усилия сосредоточены на модификации метода синтеза с целью уменьшения роста частиц (для решения проблемы низкой ионной проводимости) и модификации поверхности LiFePO4 электропроводящими соединениями, которые могли бы служить связующими для снабжения электронами решетки LiFePO4 без блокирования доступа ионов лития. Катодный материал на основе LiFePO4 должен обладать низким размером частиц, узким распределением по размерам частиц, высокой кристалличностью и хорошими проводящими свойствами.
Среди известных методов получения материалов в высокодисперсном состоянии следует выделить современный, сухой и экономически чистый метод механической активации (МА), находящий широкое применение в последние годы. Данный метод - реальная альтернатива дорогим растворным методам (золь-гель, осаждение и др.). Метод МА позволяет произвести тонкое смешение реагентов с одновременным измельчением. Является экологически чистым и экономически эффективным. Для получения конечного продукта в хорошо окристаллизованном состоянии требуется стадия последующего отжига, однако продолжительность и температура при этом существенно понижаются.
Наиболее широко используемым электропроводящим покрытием является углерод, который получают из различных углеродсодержащих соединений. Применяют два основных метода его нанесения: 1) твердофазный (добавлением углерода или твердых органических соединений к LiFePO4 с последующим их пиролизом при нагревании; 2) растворный (обработкой LiFePO4 растворами органических соединений или углеродными ксерогелями с последующим нагреванием [14-16]. Температура и продолжительность нагрева должны соответствовать завершению процесса пиролиза органических соединений.
Однако потенциально низкая стоимость LiFePO4 не реализуется на практике, если в качестве исходных соединений используют достаточно дорогостоящие соли Fe2+, создающие определенные проблемы для массового производства LiFePO4. Ведется поиск условий синтеза для замены соединений Fe2+ на соединения Fe3+. Новые методы синтеза должны быть простыми, быстрыми и надежными. Предпочтительным является получение LiFePO4 твердофазным способом с минимальным числом стадий. Все используемые твердофазные методы включают стадию смешения реагентов с применением шаровых, вибрационных или планетарных мельниц. Помимо достижения однородности смешения механическая активация активирует процесс твердофазного синтеза и способствует получению продукта в дисперсном состоянии.
Недавно было предложено синтезировать LiFePO4 на основе карботермического восстановления соединений Fe3+ с применением различных углеродсодержащих прекурсоров. В качестве соединений F3+ используют его соли, а наиболее часто тетрагидрат фосфата железа FePO4·4H2O. Привлекательным является одновременное осуществление процессов синтеза и поверхностного модифицирования LiFePO4.
Известен способ синтеза LiFePO4, согласно которому смесь FePO4·4H2O и LiOH·H2O активируют в планетарной мельнице в течение 2 ч, затем смешивают с полипропиленом и нагревают 10 часов при 650°C в атмосфере азота [17]. При этом полипропилен используется как в качестве восстановителя Fe3+ до Fe2+, так и в качестве источника углеродного покрытия. Средний размер частиц LiFePO4 составляет 100-300 нм.
Известен способ синтеза LiFePO4, согласно которому Fe, FePO4·4H2O, Li3PO4·0.5H2O и сахарозу активируют в шаровой мельнице в аргоне в течение 24 часов и отжигают 30 мин при 600°С [18]. При использовании 15% избытка сахарозы по отношению к LiFePO4 получают композит с 2.71 вес.% углерода. Первичные частицы продукта объединены в крупные агломераты размером до 30 мкм.
Известен способ синтеза LiFePO4, согласно которому используют смесь FePO4, Li2CO3 и глюкозы в качестве восстанавливающего агента и проводящей добавки [19]. FePO4 получают из FePO4·2H2O путем нагревания до 700°С. Реагенты смешивают в шаровой мельнице и отжигают 9 ч при 550-750°. Средний размер частиц составляет 2-3 мкм. Наибольшая разрядная емкость (150 мА·ч/г) наблюдается для образцов, отожженных при 650°C.
Известен способ синтеза LiFePO4, согласно которому LiFePO4/С получают из фосфатов лития и железа 3+ в смеси с целлюлозой [20]. Механически активированные смеси отжигают при 575 и 800°C с различной скоростью нагрева. Первичные частицы продукта размером 100 нм образуют агломераты. Улучшение электрохимических характеристик наблюдается для образцов, полученных в условиях 15 мин отжига при 800°C, что способствует протеканию полного пиролиза целлюлозы с образованием высокопроводящего углеродного покрытия.
Недостатками указанных способов являются: 1) использование кристаллогидратов FePO4·4H2O и FePO4·2H2O, выделяющих большое количество воды в ходе МА, что приводит к прилипанию активируемой смеси к стенкам барабанов; 2) выделение большого количества газов в ходе последующего отжига в результате разложения кристаллогидратов и пиролиза органических соединений, что приводит к низкому весовому отношению продукт/реагенты; 3) необходимость подбора оптимальной температуры и проведения контроля за полнотой разложения органических соединений.
Известны способы синтеза LiFePO4 на основе карботермического восстановления Fe2O3 c использованием различных углеродсодержащих прекурсоров. Оксид железа Fe2O3 - очень дешевый и доступный реагент. Большим преимуществом Fe2O3 является высокое весовое отношение продукт/реагенты, равное 76,7%, и отсутствие образования загрязняющих газов.
В ходе процесса карботермического восстановления Fe2O3 углерод окисляется до CO2 и CO. При температурах ниже 600°С в основном образуется СО2, а при более высоких температурах - CO, что требует использования большего количества углерода. Это связано с тем, что восстановительный эффект реакции С→CO2 выше, чем реакции C→CO. В первой реакции углерод окисляется от 0 до 4+, а во второй от 0 до 2+:
Li2CO3+Fe2O3+1/2C+2(NH4)2HPO4→2LiFePO4+3H2O+4NH3+3/2CO2
Li2CO3+Fe2O3+2C+2(NH4)2HPO4→2LiFePO4+3H2O+4NH3+3CO2
Суммарная реакция:
Li2CO3+Fe2O3+C+2(NH4)2HPO4→2LiFePO4+3H2O+4NH3+CO2+CO
Для приготовления композитов LiFePO4/С, в основном, используют различные органические соединения. Предпочтительно использование соединений с невысокой температурой пиролиза (до 700°С), поскольку при температурах отжига выше 700°С резко увеличиваются размеры частиц LiFePO4. Углерод, образующийся в результате пиролиза, резко увеличивает проводимость LiFePO4/С. Выход углерода зависит от состава органического соединения. Так, пиролиз сахарозы протекает по реакции:
C12H22O11→12C+11H2O.
Теоретический выход углерода составляет 42%, а остальная часть теряется в виде газообразных продуктов (H2O). При использовании сажи в качестве покрывающего агента выход составляет ~100%. В обоих случаях присутствие углеродсодержащего соединения в реакционной смеси тормозит рост частиц в ходе синтеза LiFePO4.
Известен способ синтеза LiFePO4, согласно которому смесь LiOH·H2O, Fe2O3, (NH4)2HPO4 с ацетиленовой сажей активируют в течение 4 часов в атмосфере аргона с использованием шаровой вибрационной мельницы со скоростью вращения 1000 об/мин [21]. Активированные порошки затем отжигают при 500-900°C в течение 30 мин в трубчатой печи в вакууме 10-6 торр. Установлено, что восстановление Fe2O3 начинается при температуре 500°C и полностью завершается при 900°C. При использовании избытка углерода при отжиге происходит восстановление LiFePO4 до Fe2P. Средний размер частиц полученных образцов составляет 1,45 мкм, а электронная проводимость только 1,2·10-7 См/см.
Известен способ синтеза LiFePO4 и LiFe09Mn01O4 c помощью карботермической реакции C→CO с использованием LiH2PO4 и Fe2O3 [22]. Количество углерода составляет 125% от теоретического. Полученные смеси прессуют и отжигают в токе аргона при температуре 750°C в течение 8 часов.
Недостатком указанных методов является высокая длительность процессов активации при использовании слабоэнергонапряженных мельниц, что увеличивает длительность процесса синтеза и его энергозатраты. Использование слабоэнергонапряженных мельниц, кроме того, не позволяет получать LiFePO4 в высокодисперсном состоянии и достигать высокой фазовой однородности, особенно при использовании ионов-заместителей.
Наиболее близким по технической сущности является способ получения LiFe1-yMyPO4/C, согласно которому восстановление соединений Fe3+ (FePO4 или Fe2O3) осуществляют углеродом в смеси с соединениями лития (Li2CO3, LiOH, LiNO3, LiCH3COO, Li2C2O4, Li3PO4, LiH2PO4) и фосфатами аммония (NH4H2PO4 или (NH4)2HPO4) [23]. Исходные реагенты смешивают в шаровой мельнице, таблетируют и отжигают при температуре 750°C в токе аргона в течение 8 часов. Нагрев и охлаждение проводят при скорости 2 град/мин. Используют 100% избыток углерода.
Недостатками данного способа являются: 1) использование слабонапряженных шаровых мельниц, что увеличивает продолжительность стадии смешения и измельчения; 2) использование большого избытка углерода, поскольку увеличение его содержания в реакционной смеси приводит к образованию большого количества фосфидов железа в качестве отдельной фазы, что ухудшает катодные свойства LiFePO4. Кроме того, содержание углерода в композите выше 5% резко уменьшает волюмометрическую и гравиметрическую плотность катодного материала.
Задача изобретения - разработка простого, быстрого и дешевого способа получения высокодисперсных композиционных катодных материалов LixFeyMzPO4/C со структурой оливина для литий-ионных аккумуляторов.
Поставленная задача решается за счет того, что в способе получения высокодисперсных композиционных катодных материалов LixFeyMzPO4/C со структурой оливина, включающем тонкое смешение соединений лития с оксидом железа, а также с одним или несколькими соединениями металлов со степенью окисления 2+, 3+, 4+, 5+, являющихся поставщиками ионов-заместителей, из числа оксидов, гидроксидов или солей, соединениями фосфора, содержащими РO4 3- группы, и углеродсодержащими соединениями; термическую обработку; охлаждение; диспергирование и поверхностное модифицирование углеродом, исходные компоненты смешивают и активируют в механохимическом активаторе, после чего полученную смесь подвергают термической обработке при 650-800°C, охлаждают до комнатной температуры и диспергируют в механохимическом активаторе, при этом все процессы проводят в инертной атмосфере, а поверхностное модифицирование осуществляют с помощью углеродсодержащих соединений, которые одновременно участвуют в качестве восстановителя и покрывающего агента.
Предпочтительно, LiFePO4 получают путем карботермического восстановления оксида железа Fe2O3.
Предпочтительно, введение ионов-заместителей M осуществляют с помощью соединений металлов со степенью окисления 2+ из числа Mg, Mn, Co и др., 3+ из числа Al, Y и др., 4+ из числа Ti, Zr и др., 5+ из числа V, Nb и др. в составе оксидов, гидроксидов или солей.
Предпочтительно, мольная концентрация M составляет 0,01-0,1, при этом в зависимости от степени окисления, M замещает либо ионы Fe2+ (ионы М2+), либо ионы Li+ (M с другими степенями окисления).
Предпочтительно, в качестве соединений лития используют карбонат лития Li2CO3, гидроксид лития LiOH, оксид лития Li2O, нитрат лития LiNO3, ацетат лития LiCH3COO, оксалат лития Li2C2O4, фосфат лития Li3PO4, дигидрофосфат лития LiH2PO4.
Предпочтительно, в качестве соединений фосфора, содержащих PO4 3- группы, используют дигидрофосфат аммония NH4H2PO4 или гидрофосфат аммония (NH4)HPO4.
Предпочтительно, в качестве углеродсодержащих соединений используют высокопроводящие сажи.
Предпочтительно, в качестве углеродсодержащих соединений используют органические соединения с температурой пиролиза ниже 700°C либо органические соединения в смеси с сажей.
Предпочтительно, для создания углеродного проводящего покрытия на поверхности частиц LixFeyMzPO4 углеродсодержащие соединения используют в количестве 3-20% избытка по отношению к стехиометрическому количеству углерода, необходимого для восстановления соединения Fe2O3.
Предпочтительно, процесс смешения исходных реагентов проводят в механохимическом активаторе с удельной мощностью 10-80 Вт/г в среде инертного газа.
Предпочтительно, нагревание и охлаждение проводят в токе инертного газа со скоростью 1-2 л/мин.
Предпочтительно, термообработку осуществляют путем ступенчатого отжига при температурах 300-350°C и 650-800°C со скоростью 2-10 град/мин и выдержкой 1-4 часа на первой стадии и 0,5-4 часа на второй стадии.
Предпочтительно, охлаждение проводят в токе инертного газа со скоростью 2-10 град/мин.
Предпочтительно, активированные смеси перед нагреванием прессуют.
Предпочтительно, продукт после отжига измельчают в механохимическом активаторе с удельной мощностью 10-80 Вт/г в среде инертного газа.
Предпочтительно, в качестве инертного газа используют аргон, азот, монооксид углерода.
Использование карбоната лития в качестве литиевого соединения является предпочтительным, поскольку он имеет высокую температуру плавления (700°C) и взаимодействует с другими реагентами смеси до плавления. Напротив, гидроксид лития плавится при 400°C. Это усложняет контроль за ходом реакции. Более того, безводный гидроксид лития является чрезвычайно гигроскопичным, что вызывает выделение воды при нагревании. Оксид лития также отличается высокой гигроскопичностью, что требует проведения всех процессов в контролируемой атмосфере. При использовании нитрата лития нагрев активированной смеси сопровождается выделением в газовую фазу токсичных оксидов азота. При использовании ацетата и оксалата лития увеличивается общий объем газообразных оксидов углерода. Использование дигидрофосфата лития LiH2PO4, содержащего одновременно литий и фосфат-ионы в требуемом соотношении, уменьшает число реагентов в исходной смеси, однако данный реагент является гигроскопичным и дорогостоящим. В менее гигроскопичном фосфате лития Li3PO4 количество лития является сверхстехиометрическим.
Процессы смешения исходных реагентов и диспергирования полученных катодных материалов проводят с использованием высоконапряженных механохимических активаторов с удельной мощностью 10-80 Вт/г. Степень смешения и измельчения при этом выше, чем в обычных шаровых мельницах, что приводит к заметному сокращению времени последующего отжига, а конечные продукты получаются в высокодисперсном состоянии. Указанные пределы определяются тем, что более низкие значения мощности и времени недостаточны для тонкого измельчения и полной гомогенизации исходной смеси, что приводит в итоге к образованию неоднофазного продукта с недостаточно низким размером частиц. При более высоких параметрах происходит процесс агломерации первичных частиц и резкое увеличение степени загрязнения конечного продукта материалом мелющих тел.
Процесс смешения и диспергирования проводят в атмосфере инертного газа для предотвращения окисления углеродсодержащих соединений и устранения нежелательного загрязнения поверхности частиц продуктами взаимодействия с газами, входящими в состав воздуха: Н2О, СО2 и др.
Термическую обработку проводят при температурах 650-800°С, что обусловлено неполнотой синтеза при более низких температурах, с одной стороны, и резким ростом размеров частиц при повышенных температурах, с другой. Окончательная кристаллизация LiFePO4 происходит только при температурах ≥700°С. Использование инертной атмосферы позволяет избежать нежелательного окисления Fe2+ до Fe2+ в конечном продукте.
Количество углерода должно быть минимально возможным, поскольку при его увеличении в композиционном материале от 0 до 15% волюмометрическая плотность LiFePO4 уменьшается на 22%, а гравиметрическая - на 15%.
Степень графитизации углеродного покрытия на поверхности частиц композита LixFeyMzPO4/C должна быть высокой, поскольку, чем она выше, тем лучше электрохимические свойства катодного материала.
Указанная совокупность признаков: приготовление наноразмерных композиционных катодных материалов LixFeyMzPO4 на основе карботермического восстановления Fе2О3 с применением механохимического активатора и их поверхностное модифицирование углеродом с использованием саж с высокой электропроводностью и степенью графитизации и/или органических соединений с температурой пиролиза ниже 700°С, используемых одновременно в качестве восстановителя и покрывающего агента, является новой и обладает изобретательским уровнем, так как позволяет существенно упростить и удешевить процесс получения указанных катодных материалов.
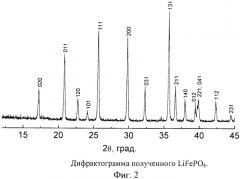
По данным рентгенофазового анализа полученные композиционные материалы являются фазовооднородными (Фиг.2). Параметры ячейки (α=10,33±0,01 Å, b=6,005±0,002 Å, с=4,690±0,002 Å) соответствуют литературным данным.
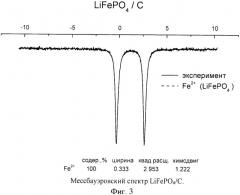
Отсутствие примесей Fe3+ подтверждается данными Мессбауэровской спектроскопии (Фиг.3).
Размер частиц получаемых материалов по данным сканирующей электронной микроскопии составляет 50 нм (Фиг.4а), а толщина углеродного покрытия по данным просвечивающей электронной микроскопии высокого разрешения ~5 нм (Фиг.4б).
На Фиг.5 приведены кривые циклирования полученных композиционных материалов LiFePO4/C. Циклирование проводилось гальваностатическим методом в полуэлементах LiFePO4+C/LiPF6+EC+DMC/Li с полипропиленовым сепаратором в интервале 2.5-4.2 V при скорости циклирования С/10 и температуре 20°С. Катоды готовили смешением активной составляющей с углеродом Super Р (TIMCAL, Ltd). Общее содержание сажи в образце составляло 20%. Видно, что удельная разрядная емкость составляет 155 мА·ч/г при С/10.
На Фиг.6 приведены значения удельной разрядной емкости LiFePO4/C в зависимости от номера цикла при скорости циклирования С/10. Наблюдается устойчивое циклирование образца. После 100 циклов его удельная разрядная емкость составляет 145 мА·ч/г.
На Фиг.7 представлена зависимость удельной разрядной емкости LiFePO4/C от скорости циклирования. При уменьшении скорости циклирования от С/10 до С емкость уменьшается до 130 мА·ч/г.
Таким образом, преимущество данного технического решения заключается в создании простого, быстрого и дешевого способа получения высокодисперсных композиционных катодных материалов LixFeyMzPO4/C со структурой оливина с использованием карботермического восстановления Fе2О3 высокопроводящими сажами и/или органическими соединениями.
Высокая дисперсность LixFeyMzPO4 достигается путем применения при синтезе механохимических активаторов, а также саж, препятствующих росту частиц LixFeyMzPO4 в процессе термической обработки. Поверхностное модифицирование частиц LixFeyMzPO4 реализуется с использованием саж и/или углерода, образующегося при пиролизе органических соединений, одновременно с процессом восстановления.
Достигаемый технический результат, получаемый благодаря заявляемому способу, заключается в получении LixFeyMzPO4/C в наноразмерном состоянии и в улучшении его катодных характеристик при использовании в литий-ионных аккумуляторах, в частности, достижении удельной разрядной емкости 155-160 мА·ч/г при скорости циклирования С/10, повышении устойчивости при циклировании, а также приводит к упрощению процесса синтеза и удешевлению получаемого продукта.
Примеры конкретного выполнения:
Пример 1. Для получения LiFePO4 взята стехиометрическая смесь карбоната лития, оксида железа, гидрофосфата аммония и сажи с удельной проводимостью 5 См/см и подвергнута смешению и активации в механохимическом активаторе АГО-2 при удельной мощности 10 Вт/г в течение 10 мин в атмосфере аргона, прессованию и последующей термической обработке в токе аргона при 300 и 700°C в течение 1 ч при каждой температуре. Охлажденный образец подвергнут диспергированию в механохимическом активаторе в течение 2 мин в атмосфере аргона. Удельная разрядная емкость полученного катодного материала составляет 139 мА·ч/г при скорости С/10.
Пример 2. В условиях примера 1 активация исходной смеси и диспергирование отожженного продукта проводят в механохимическом активаторе АГО-2 при удельной мощности 60 Вт/г в течение 5 мин и 1 мин соответственно. Удельная разрядная емкость полученного катодного материала составляет 155 мА·ч/г при скорости С/10.
Пример 3. В условиях примера 2 термическую обработку проводят в токе аргона при 300 и 650°C в течение 1 ч при каждой температуре. Удельная разрядная емкость полученного катодного материала составляет 149 мА·ч/г при скорости C/10.
Пример 4. В условиях примера 2 термическую обработку проводят в токе аргона при 300 и 800°C в течение 1 ч при каждой температуре. Удельная разрядная емкость полученного катодного материала составляет 138 мА·ч/г при скорости C/10.
Пример 5. В условиях примера 2 термическую обработку проводят в токе аргона при 800°C в течение 2 ч. Удельная разрядная емкость полученного катодного материала составляет 132 мА·ч/г при скорости C/10.
Пример 6. В условиях примера 2 для получения LiFe0,99Co0,01PO4/C используют смесь карбоната лития, оксида железа, гидроксида кобальта Co(OH)2, гидрофосфата аммония и сажи. Удельная разрядная емкость полученного катодного материала составляет 159 мА·ч/г при скорости C/10.
Пример 7. В условиях примера 2 для получения LiFe0,95Mg0,05PO4/C используют смесь карбоната лития, оксида железа, гидроксида кобальта Mg(OH)2, гидрофосфата аммония и сажи. Удельная разрядная емкость полученного катодного материала составляет 158 мА·ч/г при скорости C/10.
Пример 8. В условиях примера 2 для получения LiFePO4/C используют смесь гидроксида лития, оксида железа, гидрофосфата аммония и сажи. После МА смесь становится влажной и прибивается к стенкам барабанов.
Пример 9. В условиях примера 2 для получения LiFePO4/C используют смесь карбоната лития, оксида железа, дигидрофосфата аммония и сажи. После МА смесь становится влажной и прибивается к стенкам барабанов.
Пример 10. В условиях примера 2 для получения LiFePO4/C вместо сажи используют сахарозу. Удельная разрядная емкость полученного катодного материала составляет 147 мА·ч/г при скорости С/10.
Пример 11. В условиях примера 2 для получения LiFePO4/C в качестве углеродсодержащего соединения используют смесь сажи и сахарозы в мольном соотношении 1/0.05. Удельная разрядная емкость полученного катодного материала составляет 161 мА·ч/г при скорости С/10.
Как показывают вышеописанные примеры, заявляемое техническое решение по сравнению с прототипом позволяет получить высокодисперсные катодные материалы с высокой разрядной емкостью и устойчивостью при циклировании.
Литература
1. K.Mizushima, Р.C.Jones, P.J.Wiseman, J.В.Goodenough // Materials Research Bulletin. 1980. V.15. P.783.
2. D.Guyomard, J.M.Tarascon // Journal of Electrochemical Society. 1992. V.139. P.937.
3. C.Delmas, A.Nadiri // Materials Research Bulletin. 1988. V.23. P.63.
4. A.K.Padhi, K.S.Nanjundaswamy, J.B.Goodenough // J. Electrochem. Soc. 144 (4) (1997) 1188.
5. US Patent N5910382. Cathode materials for secondary (rechargeable) lithium batteries. Заявка от 21.04.1997. Опубл. 08.06.1999.
6. С.Masquelier, M.Tabuchi, K.Ado, R.Kanno, Y.Kobayashi, Y.Maki, O.Nakamura, J.B.Goodenough // Journal of Solid State Chemistry. 1996. V.123. P.255.
7. A.Yamada, S.C.Chung, K.Hinokuma // J. Electrochem. Soc. 148 (2001) A224.
8. S.Y.Chung, Y.M.Chiang // Electrochem. Solid-State Lett. 6 (2003) A278.
9. P.P.Prosini, M.Lisi, D.Zane, M.Pasquali // Solid State Ionics 148 (2002) 45.
10. N.Ravet, J.B.Goodenough, S Besner, M.Simoneau, P.Hovington, M. Armand // Abstract 127, The Electrochemical Society and The Electrochemical Society of Japan Meeting Abstarcts, V.99-2, Honolulu, HI, Oct 17-22, 1999.
11. S.Y.Chung, J.T.Blocking, Y.M.Chiang // Nat. Mater. 2 (2002) 123.
12. P.S.Herle, B.Ellis, N.Coombs, L.F.Nazar // Nat. Mater. 3 (2004) 147.
13. K.S.Park, J.T.Son, H.T.Chung, S.J.Kim, C.H.Lee, K.T.Kang, H.G.Kim // Solid State Commun. 129 (2004) 311.
14. US Patent N6962666. Electrode materials with high surface conductivity. Заявка от 21.06.2002. Опубл. 26.12.2002.
15. US Patent N7344659. Electrode materials with high surface conductivity. Заявка от 04.11.2005. Опубл. 18.03.2008.
16. H.Huang, S.-C. Yin, L.F. Nazar // Electrochem. Solis State lett. 4 (2001) Al70.
17. C.H.Mi, X.B.Zhao, G.S.Cao, J.P.Tu, J. Electrochem Soc, 152, A483 (2005).
18. X.Z.Liao, Z.F.Ma, Y.S.He, X.M.Zhang, L.Wang, Y.Jiang, J. Eleclrochem. Soc, 152, A1969 (2005).
19. L.Wang, G.C.Liang, X.Q.Ou, X.K.Zhi, J.P.Zhang, J.Y.Cui, J. Power Sources, 189, 423 (2009).
20. M.Maccario, L.Croguennec, F.Weill, F.Le Cras, C.Delmas, Solid State Ionics, 179, 2383 (2008).
21. C.W.Kim, M.H.Lee, W.T.Jeong, K.S.Lee, J. Power Sources, 146, 534 (2005).
22. J.Barker, M.Y.Saidi, J.L.Swoyer // Electrochem. Solid-State Lett. 6 (2003) A53.
23. US Patent N6,716,372. Lithium-containing materials. Заявка от 19.10.2001. Опубл. 06.04.2004.
1. Способ получения высокодисперсных композиционных катодных материалов LixFeyMzPO4/C со структурой оливина, включающий тонкое смешение соединений лития с оксидом железа, а также с одним или несколькими соединениями металлов со степенью окисления 2+, 3+, 4+, 5+, являющихся поставщиками ионов-заместителей из числа оксидов, гидроксидов или солей, соединениями фосфора, содержащими PO4 3- группы, и углеродсодержащими соединениями; термическую обработку; охлаждение; диспергирование и поверхностное модифицирование углеродом, отличающийся тем, что исходные компоненты смешивают и активируют в механохимическом активаторе, после чего полученную смесь подвергают термической обработке при 650-800°С, охлаждают до комнатной температуры и диспергируют в механохимическом активаторе, при этом все процессы проводят в инертной атмосфере, а поверхностное модифицирование осуществляют с помощью углеродсодержащих соединений, которые одновременно участвуют в качестве восстановителя и покрывающего агента.
2. Способ по п.1, отличающийся тем, что LiFePO4 получают путем карботермического восстановления оксида железа Fe2O3.
3. Способ по п.1, отличающийся тем, что введение ионов-заместителей М осуществляют с помощью соединений металлов со степенью окисления 2+ из числа Mg, Mn, Co и др., 3+ из числа Al, Y и др., 4+ из числа Ti, Zr и др., 5+ из числа V, Nb и др. в составе оксидов, гидроксидов или солей.
4. Способ по п.1, отличающийся тем, что мольная концентрация М составляет 0,01-0,1, при этом в зависимости от степени окисления М замещает либо ионы Fe2+ (ионы М2+), либо ионы Li (М с другими степенями окисления).
5. Способ по п.1, отличающийся тем, что в качестве соединений лития используют карбонат лития Li2CO3, гидроксид лития LiOH, оксид лития Li2O, нитрат лития LiNO3, ацетат лития LiCH3COO, оксалат лития Li2C2O4, фосфат лития Li3PO4, дигидрофосфат лития LiH2PO4.
6. Способ по п.1, отличающийся тем, что в качестве соединений фосфора, содержащих PO4 3- группы, используют дигидрофосфат аммония NH4H2PO4 или гидрофосфат аммония (NH4)2HPO.
7. Способ по п.1, отличающийся тем, что в качестве углесодержащих соединений используют высокопроводящие сажи.
8. Способ по п.1, отличающийся тем, что в качестве углеродсодержащих соединений используют пиролизы ниже 700°С, либо органические соединения в смеси с сажей.
9. Способ по п.1, отличающийся тем, что для создания проводящего покрытия на поверхности частиц LixFeyMzPO4 углеродсодержащие соединения используют в количестве 3-20% избытка по отношению к стехиометрическому количеству углерода, необходимого для восстановления Fe2O3.
10. Способ по п.1, отличающийся тем, что процесс смешения исходных реагентов проводят в механохимическом активаторе с удельной мощностью 10-80 Вт/г в среде инертного газа.
11. Способ по п.1, отличающийся тем, что нагревание и охлаждение проводят в токе инертного газа со скоростью 1-2 л/мин.
12. Способ по п.1, отличающийся тем, что термообработку проводят путем ступенчатого отжига при температурах 300-350°С и 650-800°С со скоростью 2-10 град/мин и выдержкой 1-4 ч на первой стадии и 0,5-4 ч на второй стадии.
13. Способ по п.1, отличающийся тем, что охлаждение проводят в токе инертного газа со скоростью 2-10 град/мин.
14. Способ по п.1, отличающийся тем, что активированные смеси перед нагреванием прессуют.
15. Способ по п.1, отличающийся тем, что продукт отжига измельчают в механохимическом активаторе с удельной мощностью 10-80 Вт/г в среде инертного газа.
16. Способ по п.1, отличающийся тем, что в качестве инертного газа используют аргон, азот, монооксид углерода.