Способы лечения глазного ангиогенеза, ретинального отека, ретинальной ишемии и диабетической ретинопатии с использованием избирательных ингибиторов rtk
Иллюстрации
Показать всеИзобретение относится медицине, а именно к офтальмологии, и может быть использовано для обеспечения регрессии неоваскуляризации глаза. Для этого пациенту вводят композицию, содержащую терапевтически эффективное количество ингибитора рецепторной тирозинкиназы, который блокирует аутофосфорилирование по тирозину рецептора 2 VEGF с IC50≤10 нМ, рецептора 1 VEGF с IC50≤10 нМ и PDGFR с IC50≤100 нМ. Изобретение обеспечивает сильную антиангиогенную эффективность, позволяя предотвратить потерю остроты зрения, связанную с глазной неоваскуляризацией. 6 з.п. ф-лы, 5 табл., 8 пр., 9 ил.
Реферат
По настоящей заявке испрашивается приоритет предварительной заявки, патентной заявки США, серийный номер 60/655676, поданной 23 февраля 2005 г.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
1. Область изобретения
Настоящее изобретение относится к предупреждению и лечению глазной неоваскуляризации, ангиогенеза, ретинального отека, диабетической ретинопатии и осложнения, связанного с ретинальной ишемией. В частности, настоящее изобретение относится к применению избирательных ингибиторов рецепторной тирозинкиназы (RTKi) для лечения таких расстройств.
2. Описание связанной области
Экссудативная возрастная макулярная дегенерация (AMD) и пролиферативная диабетическая ретинопатия (PDR) являются основными причинами приобретенной слепоты в развитых странах и характеризуются патологической неоваскуляризацией заднего сегмента. Патологическую неоваскуляризацию заднего сегмента (PSNV), обнаруженную при экссудативной AMD, характеризуют как патологическую хориоидальную NV, тогда как при PDR обнаруживают преретинальную NV. Патологический глазной ангиогенез, включающий в себя PSNV, происходит как каскад событий, прогрессирующий от начального стимула до формирования аномальных новых капилляров. Побуждающая причина как для экссудативной AMD, так и для PDR пока неизвестна, однако продукция различных проангиогенных факторов роста, по-видимому, является общим стимулом. Растворимые факторы роста, такие как фактор роста эндотелия сосудов (VEGF), тромбоцитарный фактор роста (PDGF), основной фактор роста фибробластов (bFGF или FGF-2), инсулиноподобный фактор роста 1 (IGF-I), ангиопоэтины, и т.д., обнаружены в тканях и жидкостях, полученных от пациентов с патологическим глазным ангиогенезом. После запуска ангиогенного каскада базальная мембрана и внеклеточный матрикс капилляров деградируют, и происходит пролиферация и миграция эндотелиальных клеток капилляров. Эндотелиальные выросты анастомозируют с формированием трубок с последующим формированием проходимого просвета. Новые капилляры обычно обладают увеличенной проницаемостью сосудов или негерметичностью из-за несформированной барьерной функции, что может приводить к отеку ткани. Дифференцировку в зрелый капилляр показывают по присутствию непрерывной базальной мембраны и нормальных эндотелиальных соединений между другими эндотелиальными клетками и перицитами; однако, этот процесс дифференцировки часто нарушен во время патологических состояний.
Хотя PSNV представляет собой угрожающую зрению патологию, ответственную за две наиболее распространенных причины приобретенной слепоты, способы лечения являются немногочисленными и в лучшем случае паллиативными. Принятые способы лечения для PSNV при экссудативной AMD включают в себя лазерную фотокоагуляцию и фотодинамическую терапию Visudyne®; оба способа лечения включают в себя индуцированную лазером окклюзию пораженной сосудистой сети и связаны с локализованным разрушением сетчатки, индуцированным лазером. Для пациентов с PDR решетчатая или панретинальная лазерная фотокоагуляция и хирургические вмешательства, такие как витреоэктомия и удаление преретинальных мембран, являются единственными доступными в настоящее время возможностями. Несколько различных соединений клинически оценивали для фармакологического лечения PSNV, включая RETAANE® (Alcon Research, Ltd.), Lucentis® (Genentech), adPEDF (GenVec), скваламин (Genaera), CA4P (OxiGENE), VEGF-ловушку (Regeneron), анти-VEGF или VEGFR RNAi (Acuity и SIRNA, соответственно) и LY333531 (Lilly). Недавно для такого использования одобрили Macugen® (Eyetech/Pfizer), аптамер анти-VEGF, инъецируемый в стекловидное тело.
Макулярный отек является основной причиной потери зрения у пациентов с диабетом, в то время как преретинальная неоваскуляризация (PDR) является основной причиной практической слепоты. Сахарный диабет характеризуют постоянной гипергликемией, которая вызывает обратимые и необратимые патологические изменения в микроциркуляторном русле различных органов. Диабетическая ретинопатия (DR), таким образом, представляет собой заболевание капилляров сетчатки, которое проявляется как каскад стадий с увеличивающимися уровнями тяжести и ухудшением прогнозов для зрения. Основные факторы риска, опубликованные для диабетической ретинопатии, включают в себя длительность сахарного диабета, качество гликемического контроля и присутствие системной гипертензии. DR широко классифицируют по 2 основным клиническим стадиям: непролиферативной диабетической ретинопатии (NPDR) и пролиферативной диабетической ретинопатии (PDR), где термин «пролиферативный» относится к присутствию преретинальной неоваскуляризации, как указано ранее.
Непролиферативная диабетическая ретинопатия (NPDR) и последующий макулярный отек связаны, частично, с ретинальной ишемией в результате ретинальной микроваскулопатии, вызванной постоянной гипергликемией. NPDR включает в себя ряд клинических подкатегорий, которые включают в себя начальную «фоновую» DR, где наблюдают от небольших многоочаговых изменений в сетчатке (например, микроаневризмы, «точечно-пятнистые» кровоизлияния и инфаркты в слое нервных волокон) до препролиферативной DR, непосредственно предшествующей развитию PNV. Гистопатологическими отличительными признаками NPDR являются ретинальные микроаневризмы, утолщение базальной мембраны капилляров, потеря эндотелиальных клеток и перицитов и возможная окклюзия капилляров, приводящая к местной ишемии. Данные, накопленные по моделям на животных и эмпирическим исследованиям на людях, показывают, что ретинальная ишемия часто связана с увеличенными местными уровнями провоспалительных и/или проангиогенных факторов роста и цитокинов, таких как простагландин E2, фактор роста эндотелия сосудов (VEGF), инсулиноподобный фактор роста-1 (IGF-I), ангиопоэтин 2, и т.д. Диабетический макулярный отек можно наблюдать либо во время NPDR, либо во время PDR, однако, часто его наблюдают на более поздних стадиях NPDR, и он является прогностическим признаком прогрессирования по направлению к наиболее тяжелой стадии, PDR.
В настоящее время не одобрено фармакологической терапии для лечения NPDR и/или макулярного отека. Современным стандартом лечения является лазерная фотокоагуляция, которую используют для стабилизации или устранения макулярного отека и замедления прогрессирования по направлению к PDR. Лазерной фотокоагуляцией можно уменьшать ретинальную ишемию посредством разрушения здоровой ткани и таким образом, уменьшения метаболических потребностей; она также может модулировать экспрессию и продукцию различных цитокинов и трофических факторов. Подобно способам лечения экссудативной AMD, лазерная фотокоагуляция у пациентов с диабетом является разрушающей клетки процедурой, и поле зрения глаза после лечения подвержено необратимой угрозе. Ретинальный отек, отличный от макулярного отека, можно наблюдать при различных заболеваниях заднего сегмента, таких как задний увеит, окклюзия ветви ретинальной вены, вызванное хирургическим вмешательством воспаление, эндофтальмит (стерильный и нестерильный), склерит и эписклерит, и т.д.
Эффективная фармакологическая терапия патологического глазного ангиогенеза, ретинального отека, DR и ретинальной ишемии будет предоставлять значительную пользу пациенту, таким образом предотвращая инвазивные хирургические или разрушающие лазерные процедуры. Эффективное лечение этих патологий будет улучшать качество жизни пациента и производительность в обществе. Кроме того, издержки для общества, связанные с предоставлением помощи и медицинского обеспечения слабовидящим, можно намного уменьшить.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение преодолевает эти и другие недостатки предшествующего уровня техники посредством предоставления сильнодействующего и эффективного предупреждения патологического глазного ангиогенеза, ретинального отека, диабетической ретинопатии и осложнения, связанного с ретинальной ишемией, так же как посредством вызывания регрессии неоваскуляризации и/или ангиогенеза заднего сегмента. В одном из аспектов способы по изобретению включают в себя лечение таких расстройств посредством введения нуждающемуся в этом пациенту композиции, содержащей терапевтически эффективное количество ингибитора рецепторной тирозинкиназы, блокирующего аутофосфорилирование по тирозину рецептора 1 VEGF (FIt-I), рецептора 2 VEGF (KDR), рецептора 3 VEGF (Flt-4), Tie-2, PDGFR, c-KIT, Flt-3 и CSF-IR. Предпочтительно, соединение, применяемое в способах по изобретению, обладает значением IC50 от 0,1 нМ до 250 нМ для каждого из этих рецепторов. Более предпочтительно, соединение обладает значением IC50 от 0,1 нМ до 100 нМ, по меньшей мере для шести из этих рецепторов. Наиболее предпочтительно, соединение обладает значением IC50 менее чем 10 нМ, по меньшей мере для четырех из этих рецепторов.
Как применяют здесь, фразы «каждый из этих рецепторов», «каждый рецептор, перечисленный в пункте формулы изобретения n», «по меньшей мере шесть (или четыре) из этих рецепторов» и «по меньшей мере шесть (или четыре) рецептора, перечисленных в пункте формулы изобретения n», описывают значение IC50 для каждого отдельного рецептора в обозначенном списке. Например, в абзаце выше фраза «от 0,1 нМ до 250 нМ для каждого из этих рецепторов» требует, чтобы рецептор 1 VEGF (FIt-I) обладал значением IC50 между 0,1 нМ и 250 нМ, чтобы рецептор 2 VEGF (KDR) обладал значением IC50 между 0,1 нМ и 250 нМ, чтобы рецептор 3 VEGF (Flt-4) обладал значением IC50 между 0,1 нМ и 250 нМ, чтобы Tie-2 обладал значением IC50 между 0,1 нМ и 250 нМ, чтобы PDGFR обладал значением IC50 между 0,1 нМ и 250 нМ, чтобы c-KIT обладал значением IC50 между 0,1 нМ и 250 нМ, чтобы FIt-I обладал значением IC50 между 0,1 нМ и 250 нМ, и чтобы CSF-IR обладал значением IC50 между 0,1 нМ и 250 нМ. Подобным образом, фраза «от 0,1 нМ до 100 нМ по меньшей мере для шести из этих рецепторов» требует, чтобы шесть из восьми рецепторов в обозначенном списке все обладали IC50 от 0,1 нМ до 100 нМ.
Иногда в этом документе фразу «одновременно блокирует аутофосфорилирование по тирозину» используют по отношению к активности связывания рецептора предпочтительными соединениями для применения в способах по изобретению. Использование этой фразы относится к тому факту, что предпочтительные соединения обладают активностью антагониста для многих подтипов рецепторной тирозинкиназы. То есть, они не являются избирательными для одного рецептора, но являются высокоэффективными антагонистами двух или более рецепторных тирозинкиназ.
Важно, что соединения для применения в способах по изобретению обладают профилем связывания рецептора, где одно соединение блокирует множество рецепторов семейства RTK. Одна предпочтительная группа рецепторов, аутофосфорилирование которых по тирозину блокируют, перечислена выше. Дополнительные предпочтительные профили связывания включают в себя следующие: a) Tie-2, PDGFR и рецептор 2 VEGF (KDR); b) рецептор 2 VEGF (KDR), рецептор 1 VEGF (FIt-I), PDGFR и Tie-2; c) рецептор 2 VEGF (KDR), рецептор 1 VEGF (FIt-I) и Tie-2; d) рецептор 2 VEGF (KDR), рецептор 1 VEGF (FIt-I) и PDGFR; e) рецептор 2 VEGF (KDR) и Tie-2; f) рецептор 2 VEGF (KDR) и PDGFR; и g) рецептор 2 VEGF (KDR), Tie-2 и PDGFR.
В одном предпочтительном аспекте для каждого распределения рецепторов по группам, перечисленным в a)-f) выше, значение IC50 для каждого рецептора в каждой группе составляет от 0,1 нМ до 200 нМ. В другом предпочтительном аспекте значение IC50 для каждого рецептора в каждой группе составляет от 0,1 нМ до 100 нМ. В другом предпочтительном варианте осуществления по меньшей мере один рецептор в каждой из предпочтительных групп рецепторов, перечисленных в a)-f) выше, обладает значением IC50 менее чем 10 нМ. В другом предпочтительном варианте осуществления, два или более рецепторов в каждой предпочтительной группе рецепторов, перечисленных в a)-f) выше, обладают значением IC50 менее чем 10 нМ.
Предпочтительные ингибиторы рецепторной тирозинкиназы для применения в способах по изобретению включают в себя в качестве неограничивающих примеров следующие соединения:
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-метилфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-[2-(трифторметил)фенил]мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(2-фтор-5-метилфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-[3-(трифторметил)фенил]мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-[2-фтор-5-(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-[2-фтор-5-(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(3-метилфенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-[3-(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(3-хлорфенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(2-фтор-5-метилфенил)мочевина;
N-{4-[3-амино-7-(4-морфолинилметил)-1,2-бензизоксазол-4-ил]фенил}-N'-[2-фтор-5-(трифторметил)фенил]мочевина;
N-{4-[3-амино-7-(4-морфолинилметил)-1,2-бензизоксазол-4-ил]фенил}-N'-[3-(трифторметил)фенил]мочевина;
N-{4-[3-амино-7-(4-морфолинилметил)-1,2-бензизоксазол-4-ил]фенил}-N'-(3-хлорфенил)мочевина;
N-{4-[3-амино-7-(4-морфолинилметил)-1,2-бензизоксазол-4-ил]фенил}-N'-(3-метилфенил)мочевина;
N-{4-[3-амино-7-(4-морфолинилметил)-1,2-бензизоксазол-4-ил]фенил}-N'-(2-фтор-5-метилфенил)мочевина;
N-{4-[3-амино-7-(4-морфолинилметил)-1,2-бензизоксазол-4-ил]фенил}-N'-(3,5-диметилфенил)мочевина;
N-{4-[3-амино-7-(4-морфолинилметил)-1,2-бензизоксазол-4-ил]фенил}-N'-(3-феноксифенил)мочевина;
N-{4-[3-амино-7-(4-морфолинилметил)-1,2-бензизоксазол-4-ил]фенил}-N'-(3-бромфенил)мочевина;
N-(4-{3-амино-7-[2-(4-морфолинил)этокси]-1,2-бензизоксазол-4-ил}фенил)-N'-[3-(трифторметил)фенил]мочевина;
N-(4-{3-амино-7-[2-(4-морфолинил)этокси]-1,2-бензизоксазол-4-ил}фенил)-N'-(2-фтор-5-метилфенил)мочевина;
N-(4-{3-амино-7-[2-(4-морфолинил)этокси]-1,2-бензизоксазол-4-ил}фенил)-N'-[2-фтор-5-(трифторметил)фенил]мочевина;
N-(4-{3-амино-7-[2-(4-морфолинил)этокси]-1,2-бензизоксазол-4-ил}фенил)-N'-(3-метилфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3,5-диметилфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-фенилмочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(4-метилфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-цианофенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-[4-фтор-3- (трифторметил)фенил]мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-бромфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-хлорфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-этилфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-[4-(трифторметил)фенил]мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-фтор-4-метилфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-фторфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3,5-дифторфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-метоксифенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(4-метоксифенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-нитрофенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(4-фторфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(2-фторфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-хлор-4-фторфенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-хлор-4-метоксифенил)мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-[4-(диметиламино)фенил]мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-[4-(трифторметокси)фенил]мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-[2-(трифторметокси)фенил]мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-[3,5-бис(трифторметил)фенил]мочевина;
N-[4-(3-амино-1,2-бензизоксазол-4-ил)фенил]-N'-(3-хлор-4-метилфенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-[3,5-бис(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-[4-(трифторметокси)фенил]мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(3-фторфенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(3-метоксифенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(3,5-дифторфенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(4-метилфенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(3-бромфенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(3,5-диметилфенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-[4-(диметиламино)фенил]мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(3-метилфенил)мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(3-хлорфенил)мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(2-фтор-5-метилфенил)мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-[2-фтор-5-(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-[3-(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(3,5-диметилфенил)мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(3-этилфенил)мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(4-метилфенил)мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-[4-(трифторметокси)фенил]мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(3-фтор-4-метилфенил)мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(3-метоксифенил)мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-фенилмочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-[3,5-бис(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(3-бромфенил)мочевина;
N-[4-(3-амино-7-метил-1,2-бензизоксазол-4-ил)фенил]-N'-(3-фторфенил)мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-[4-фтор-3-(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-метокси-1,2-бензизоксазол-4-ил)фенил]-N'-(4-фтор-3-метилфенил)мочевина;
N-[4-(3-амино-7-фтор-1,2-бензизоксазол-4-ил)фенил]-N'-[3- (трифторметил)фенил]мочевина;
N-[4-(3-амино-7-фтор-1,2-бензизоксазол-4-ил)фенил]-N'-(3-хлорфенил)мочевина;
N-[4-(3-амино-7-фтор-1,2-бензизоксазол-4-ил)фенил]-N'-[4-фтор-3-(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-фтор-1,2-бензизоксазол-4-ил)фенил]-N'-(3-метилфенил)мочевина;
N-[4-(3-амино-7-фтор-1,2-бензизоксазол-4-ил)фенил]-N'-[2-фтор-5-(трифторметил)фенил]мочевина;
N-[4-(3-амино-7-фтор-1,2-бензизоксазол-4-ил)фенил]-N'-(2-фтор-5-метилфенил)мочевина;
N-{4-[3-амино-7-(трифторметокси)-1,2-бензизоксазол-4-ил]фенил}-N'-[2-фтор-5-(трифторметил)фенил]мочевина;
N-{4-[3-амино-7-(трифторметокси)-1,2-бензизоксазол-4-ил]фенил}-N'-[3-(трифторметил)фенил]мочевина;
N-{4-[3-амино-7-(трифторметокси)-1,2-бензизоксазол-4-ил]фенил}-N'-(2-фтор-5-метилфенил)мочевина;
N-{4-[3-амино-7-(трифторметокси)-1,2-бензизоксазол-4-ил]фенил}-N'-(3-хлорфенил)мочевина;
N-{4-[3-амино-7-(трифторметокси)-1,2-бензизоксазол-4-ил]фенил}-N'-(3-бромфенил)мочевина;
N-{4-[3-амино-7-(трифторметокси)-1,2-бензизоксазол-4-ил]фенил}-N'-[4-фтор-3-(трифторметил)фенил]мочевина;
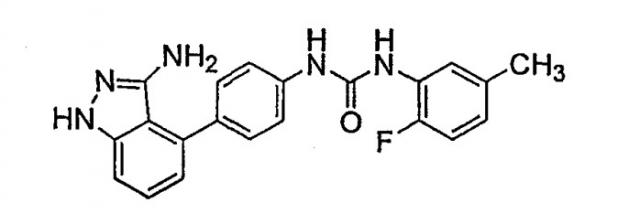
N-[4-[3-амино-1H-индазол-4-ил]фенил]-N'-(2-фтор-5-метилфенил)мочевина; и
N-{4-[3-амино-7-(трифторметокси)-1,2-бензизоксазол-4-ил]фенил}-N'-(4-фтор-3-метилфенил)мочевина.
Наиболее предпочтительным соединением для применения в способах по изобретению является N-[4-[3-амино-1H-индазол-4-ил]фенил]-N'-(2-фтор-5-метилфенил)мочевина.
Другие предпочтительные соединения для применения в описанных здесь способах можно идентифицировать с использованием описанных здесь анализов, выполнение которых является общепринятым для специалиста в данной области.
RTKi можно вводить посредством любого целесообразного способа или пути введения, однако, местное введение является предпочтительным. Предполагают, что можно использовать все местные доступы к глазу, включая местное, субконъюнктивальное, окологлазное, ретробульбарное введение, введение в субтеноново пространство, внутрикамерное введение, введение в стекловидное тело, внутриглазное, субретинальное и супрахориоидальное введение. Возможно системное или парентеральное введение, включая в качестве неограничивающих примеров внутривенное, подкожное и пероральное введение. Наиболее предпочтительным способом введения является инъекция раствора или суспензии в стекловидное тело или в субтеноново пространство; введение в стекловидное тело или помещение в субтеноново пространство биоразлагаемого или не биоразлагаемого устройства (имплантата); или местное глазное введение раствора или суспензии. В одном из предпочтительных вариантов осуществления соединение вводят посредством заднего околосклерального введения раствора, суспензии или геля. В другом предпочтительном варианте осуществления соединение вводят посредством введения в стекловидное тело биоразлагаемого имплантата. В конкретных предпочтительных аспектах биоразлагаемый имплантат вводят в стекловидное тело посредством устройства, такого как описанное в патентной заявке США серийный no 60/710046, поданной 22 августа 2005 г.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Следующие рисунки составляют часть настоящего описания и включены сюда для дополнительной иллюстрации конкретных аспектов настоящего изобретения. Изобретение можно лучше понять, исходя из этих рисунков в сочетании с подробным описанием конкретных вариантов осуществления, представленных здесь.
ФИГ.1 Избирательный RTKi, AL-39324, ингибирует преретинальную неоваскуляризацию (NV) после однократной инъекции в стекловидное тело в модели индуцированной кислородом ретинопатии (OIR) на крысах.
ФИГ.2 Избирательный RTKi, AL-39324, предотвращает преретинальную неоваскуляризацию (NV) после перорального введения через желудочный зонд в модели на крысах индуцированной кислородом ретинопатии (OIR).
ФИГ.3 Избирательный RTKi, AL-39324, ингибирует индуцированную лазером хориоидальную неоваскуляризацию (CNV) после однократной инъекции в стекловидное тело у мыши.
ФИГ.4 Избирательный RTKi, AL-39324, вызывает регрессию существующей индуцированной лазером хориоидальной неоваскуляризации (CNV) после однократной инъекции в стекловидное тело у мыши.
ФИГ.5 Сравнение очагов CNV между группами мышей после лечения AL-39324.
ФИГ.6 Избирательный RTKi, AL-39324, ингибирует индуцированную лазером хориоидальную неоваскуляризацию (CNV) после перорального введения через желудочный зонд у мыши.
ФИГ.7 Избирательный RTKi, AL-39324, ингибирует вызванную диабетом проницаемость сосудов сетчатки после однократной инъекции в стекловидное тело у крысы.
ФИГ.8 Избирательный RTKi, AL-39324, ингибирует индуцированную VEGF проницаемость сосудов сетчатки после однократной инъекции в стекловидное тело у крысы.
ФИГ.9 Избирательный RTKi, AL-39324, полностью предотвращает вызванную диабетом проницаемость сосудов сетчатки после перорального введения через желудочный зонд в модели на крысах с STZ.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Согласно способам по настоящему изобретению, композицию, содержащую ингибитор рецепторной тирозинкиназы (RTKi), обладающий профилем ингибирования киназы, подобным показанному в таблице 1, вводят пациенту, страдающему от глазной неоваскуляризации, ангиогенеза, ретинального отека, диабетической ретинопатии и/или ретинальной ишемии, чтобы предотвратить потерю остроты зрения, связанную с такими состояниями. Более конкретно, является предпочтительным, чтобы ингибитор рецепторной тирозинкиназы для применения в способах по изобретению блокировал аутофосфорилирование по тирозину рецептора 1 VEGF (FIt-I), рецептора 2 VEGF (KDR), рецептора 3 VEGF (Flt-4), Tie-2, PDGFR, c-KIT, Flt-3 и CSF-IR. Авторы настоящего изобретения неожиданно обнаружили, что соединения с таким уникальным профилем связывания ингибируют или предотвращают глазную неоваскуляризацию, ретинальный отек, диабетическую ретинопатию, и/или ретинальную ишемию значительно более активно и эффективно, чем известные в настоящее время соединения для такого применения. Более неожиданно, соединения для применения в способах по изобретению, обладающие предпочтительными профилями связывания, описанными здесь, вызывают регрессию неоваскуляризации.
| Таблица 1Профиль ингибирования киназ AL-39324 | |||||
| Родственные RTK | Неродственные TKa | Ser/Thr-киназыb | |||
| Киназа | IC50 (нМ) | Киназа | IC50 (нМ) | Киназа | IC50 (нМ) |
| KDR | 4 | SRC | > 50000 | AKT | > 50000 |
| FLT1 | 3 | IGFR | > 50000 | SGK | 940 |
| FLT4 | 190 | TNSS | > 50000 | CDC2 | 9800 |
| PDGFR β | 66 | LCK | 38000 | PKA | 5900 |
| CSP-IR | 3 | EGFR | > 50000 | ||
| KIT | 14 | HCK | > 50000 | ||
| FLT3 | 4 | CMBT | > 50000 | ||
| TIE2 | 170 | LYN | > 20000 | ||
| RBT | 1900 | FYN | > 50000 | ||
| FGFR | > 12500 | FGR | > 50000 | ||
| a) Значения IC50, определяемые при концентрации АТФ 1 нМ;b) Значения IC50, определяемые при концентрации АТФ 5-10 мкМ. |
Обратимое фосфорилирование белков является одним из важнейших биохимических механизмов, опосредующих передачу сигналов в эукариотической клетке. Эту реакцию катализируют протеинкиназы, которые переносят фосфатную группу γ из АТФ на гидроксильные группы белков-мишеней (Hunter, 2000). В геноме человека закодировано 518 таких ферментов, из которых приблизительно 90 избирательно катализируют фосфорилирование гидроксильных групп тирозина (Manning, 2002; Robinson, 2000). Эти тирозинкиназы человека организовали в формате дендрограммы на основе гомологии последовательности их каталитических доменов (http://www.cellsignal.com/retail/). Цитозольные тирозинкиназы остаются внутри клетки, в то время как рецепторные тирозинкиназы (RTK) обладают как внеклеточным, так и внутриклеточным доменами и функционируют как связанные с мембраной рецепторы поверхности клеток. Как таковые, RTK опосредуют клеточные ответы на сигналы внешней среды и облегчают широкий диапазон клеточных процессов, включая пролиферацию, миграцию и выживание.
Поскольку RTK являются одними из принципиальных компонентов сигнальной сети, которые передают внеклеточные сигналы в клетках, дисрегуляция путей передачи сигнала RTK связана с рядом расстройств человека, включая рак и заболевание глаз. Следовательно, является хорошо обоснованной применимость ингибиторов RTK (RTKi), особенно антагонистов семейства рецепторов VEGF, для ингибирования ангиогенеза во множестве тканей, включая глаз. Однако, авторы настоящего изобретения являются первыми, кто показал, что одновременное блокирование аутофосфорилирования по тирозину по меньшей мере одного рецептора VEGF вместе с другим типом рецепторных тирозинкиназ не только значительно ингибирует ангиогенез (т.е. в большей степени, чем обнаружено ранее), но также вызывает регрессию ангиогенеза.
Семейство рецепторов VEGF
Семейство рецепторов VEGF состоит из трех RTK, KDR (рецептор с доменом, содержащим киназную вставку; известный также как VEGFR2), FLT1 (Fms-подобная тирозинкиназа; известный также как VEGFR1) и FLT4 (VEGFR3) (Ferrara 2003). Эти рецепторы опосредуют биологическую функцию факторов роста эндотелия сосудов (VEGF-A, -B, -C, -D, -E и фактора роста плаценты (PlGF)), семейства гомодимерных гликобелков, которые связывают рецепторы VEGF с различными аффинностями (Wiesmann 1997; Ferrara 1997). KDR, FLT1 и FLT4 обладают тремя структурными областями: внеклеточным доменом, содержащим семь иммуноглобулинподобных мотивов, которые содержат участки связывания фактора роста, одним трансмембранным доменом, и внутриклеточным расщепляющим киназу доменом, опосредующим тирозинкиназную активность, необходимую для передачи сигнала (de Vries 1992; Terman 1992). Эти мотивы сравнивали с мотивами структурно-родственных RTK из семейств PDGF, FGF, RET и TIE в дендрограмме, показанной на http://www.cellsignal.com/retail/. Для всех обсуждаемых ниже RTK связывание лиганда с внеклеточным доменом вызывает димеризацию рецептора и аутофосфорилирование специфических внутриклеточных остатков тирозина. Эти фосфорилированные группы тирозина служат участками стыковки для других белков и в конечном счете приводят к передаче сигналов в нисходящем направлении (Schlessinger 2000).
VEGF, VEGFR-1 и -2: Фактор роста эндотелия сосудов (VEGF) связывает с высокой аффинностью связанные с мембраной рецепторные тирозинкиназы VEGFR-2 (KDR, FIk-I) и VEGFR-I (FIt-I). Эксперименты с культурой клеток и нокаутом гена показывают, что каждый рецептор вносит вклад в разные аспекты ангиогенеза.
KDR: KDR является основным медиатором митогенных, ангиогенных и увеличивающих проницаемость эффектов VEGF-A, далее в этом документе обозначенного VEGF. Множество различных типов клеток способны продуцировать VEGF, однако его биологическая активность преимущественно ограничена сосудистой сетью из-за избирательной для эндотелиальных клеток экспрессии KDR (Ferrara 2003; Terman 1992; Millauer 1993; Quinn 1993). Неудивительно, что ось VEGF/KDR является первичным медиатором ангиогенеза, пути, посредством которого новые кровеносные сосуды формируются из предсуществующих сосудов (Ferrara 2003; Griffioen 2000; Rak 1995). Роль этого пути передачи сигнала в развитии ангиогенеза соответствует летальности эмбриона и аномальному формированию кровеносных сосудов, которые наблюдают у VEGF- и KDR-нулевых мышей (Shalaby 1995; Carmeliet 1996).
FLT1: Несмотря на их структурное сходство, KDR и FLT1 выполняют несколько различные функции in vivo (Shalaby 1995; Fong 1995). FLT1 связывает VEGF с высокой аффинностью, однако увеличение киназной активности не является настолько сильным, как у KDR (Waltenberger 1994). FLT1 также связывает VEGF-B и фактор роста плаценты, два лиганда, которые KDR не связывает. Помимо эндотелиальных клеток, FLT1 экспрессирован на поверхности клеток гладких мышц, моноцитов и гематопоэтических стволовых клеток (Rafii 2002). Активация передачи сигнала FLT1 приводит к мобилизации происходящих из костного мозга эндотелиальных клеток-предшественников, которые рекрутируются в опухоли, и, возможно, в пораженные заболеванием сетчатку/хориоид, где вносят вклад в формирование новых кровеносных сосудов (Erikson, 2002; Lyden 2001; Grant 2002; Csaky 2004).
FLT4: Несмотря на его структурное сходство с KDR и FLT1, FLT4 опосредует передачу сигнала VEGF-C и VEGF-D, но не VEGF-A. Существенно, что активация FLT4 в отсутствие передачи сигнала KDR способна вызывать лимфангиогенез и метастазирование в моделях опухолей на животных (Krishnan 2003).
VEGF и его RTK вносят вклад в морфогенез сосудов и прогрессию заболевания благодаря их способности опосредовать два преобладающих механизма: рост новых сосудов (васкулогенез и/или ангиогенез) и проницаемость сосудов (Lueng 1989; Keck 1989; Hanahan 1997; Yancopoulos 2000). Что касается глаза, VEGF является критическим фактором развития во время развития сосудов в заднем сегменте (Stone 1995). Более того, ткани глаза человека отвечают на множество стимулов, таких как гипоксия, посредством индукции VEGF, что приводит к неоваскуляризации заднего сегмента и нарушению гематоретинального барьера (т.е., увеличенной проницаемости капилляров) (Shima 1995; Hartnett 2003). VEGF и VEGFR локализованы в неоваскулярных тканях, полученных от пациентов с диабетической ретинопатией и экссудативной AMD, и связаны с увеличенной тяжестью заболевания (Lutty 1996; Chen 1997; Witmer 2002; Kvanta 1996). Недавние свидетельства позволяют предполагать, что изоформа VEGF165 может являться первичным медиатором заболевания глаз, однако остается четко определить роль других изоформ (Ishida 2003; Ishida 2003).
Модели на животных для глазного ангиогенеза и диабетической ретинопатии использовали, чтобы показать критическую роль передачи сигнала VEGF в заболевании заднего сегмента. Результаты исследований фармакологической эффективности, проведенных в этих системах in vivo, использовали для подтверждения применимости различных способов лечения для человека. Более раннее определение ключевой роли, которую VEGF играет в патологическом ангиогенезе глаза, показали на модели ретинальной ишемии на не относящихся к человеку приматах, где VEGF в пространственном и временном отношении коррелировал с NV (Miller 1994; Tolentino 1996). Более того, инъекция VEGF в стекловидное тело приводит к ретинальной ишемии и микроангиопатии у тех же видов приматов (Tolentino 1996). Примечательно, что инъекция в стекловидное тело нейтрализующего моноклонального антитела анти-VEGF ингибирует NV, обнаруженную в этой модели, и предоставляет предварительное доказательство, что лечение анти-VEGF может являться многообещающим для заболевания человека (Adamis 1996). В моделях индуцированной кислородом ретинопатии (OIR) получают преретинальную NV, подобную NV, обнаруженной для заболеваний человека, ретинопатии недоношенных и PDR, и широко используют модели в анализах скрининга для антиангиогенных способов. В моделях OIR на грызунах уровни VEGF в сетчатке коррелируют с частотой возникновения и тяжестью патологии, а инъекция в стекловидное тело ингибитора RTK, блокирующего VEGFR, обеспечивает значительное снижение ретинальной NV (Werdich 2004; Unsoeld 2004). Модели индуцированной лазером хориоидальной NV на грызунах и приматах являются общепринятыми для экспериментальной имитации экссудативной AMD и, как показано, являются зависимыми от VEGF (Shen 1998; Kwak 2000; Krzystolik 2002). Результаты клинических офтальмологических исследований с макугеном (анти-VEGF аптамер, Eyetech/Pfizer) и луцентисом (rhFab против VEGF, Genentech) подтвердили, что ингибирование передачи сигнала VEGF является привлекательной офтальмологической мишенью (Eyetech Study Group 2002; Sorbera 2003; Saishin 2003).
Рецепторы ангиопоэтина
Ангиопоэтины (Ang1-4) являются лигандами для рецепторов Tie, Tie-1 и Tie-2, семейства RTK, которые избирательно экспрессированы на эндотелиальных клетках сосудов и некоторых гематопоэтических клетках (Yancopoulos 2000). Tie-2-/- мыши умирают во время эмбриогенеза на сутки 9,5-10,5, при этом сосуды являются несформированными с отсутствием организации (Asahara 1998). Ang1 и Ang2 полностью вовлечены в васкулогенез и ангиогенез, действуя через рецептор Tie-2. Регуляция Ang2 повышена в эндотелиальных клетках сетчатки посредством воздействия VEGF и гипоксии, и его экспрессия индуцирована во время физиологического и патологического ангиогенеза глаза (Oh 1999; Hackett 2000). Передача сигнала через Tie-2 может регулировать ангиогенез сетчатки согласованно с передачей сигнала VEGF и может являться критическим путем передачи сигнала при непролиферативной диабетической ретинопатии (Sarlos 2003; Hammes 2004; Ohashi 2004; Takagi 2003). Во множестве типов клеток, в хориоидальных неоваскулярных мембранах, полученных от пациентов с экссудативной AMD, регуляция Ang2 и VEGF согласованно повышена, и Tie-2 является экспрессированным (Otani 1999).
Семейство рецепторов PDGF
PDGFR-α и -β: Изоформы α и β рецепторов тромбоцитарного фактора роста (PDGF) существуют в форме гомодимеров или α/β гетеродимеров и наиболее часто их обнаруживают на поверхности фибробластов, клеток гладких мышц и клеток эндотелия сосудов (Ostman 2001; Benjamin 1998). Ремоделирование кровеносных сосудов, по-видимому, определено покрытием эндотелия перицитами, которое регулируют PDGF-B и VEGF (Benjamin 1998). Связанные с опухолью фибробласты являются источником факторов роста, включая VEGF, следовательно, считают, что паракринная передача сигнала PDGF вносит вклад в прогрессирование заболевания для этих опухолей (Ponten 1994; Skobe 1998; Fukumura 1998). PDGFR-β вносит вклад в ангиогенез опухолей через пролиферацию и миграцию перицитов, периэндотелиальных клеток, которые связаны с несформированными кровеносными сосудами и стабилизируют их (Lindahl 1997; Hellstrom 1999; Reinmuth 2001; George 2001; Wang 1999). Показано, что ингибирование передачи сигнала рецептором PDGF в фибробластах и перицитах усиливает противоопухолевые эффекты химиотерапии посредством регуляции интерстициального давления жидкости в опухоли (Pietras 2002). Подобным образом, PDGF и PDGFR могут являться важными для ретинальных нейронов и микроциркуляторного русла и модулировать ангиогенез в глазах (Mudhar 1993; Wilkinson 2004).
RTK, экспрессированные гематопоэтическими клетками-предшественниками
Несколько RTK, включая VEGFR, CSF-IR, KIT и FLT3, являются экспрессированными гематопоэтическими клетками-предшественниками (HPC) и могут быть вовлечены в патологический ангиогенез глаза. Например, показано, что HPC проникают к участкам хориоидальной неоваскуляризации (Espinosa 2003; Cousins 2004). Однако, большинство данных, связанных с этими RTKi, получено на онкологических моделях. CSF-IR кодирован клеточным гомологом ретровирусного онкогена v-fms и является основным регулятором развития макрофагов (Sherr 1985). KIT экспрессируют гематопоэтические клетки-предшественники, тучные клетки, гаметы и пейсмекерные клетки кишечника (интерстициоциты Кахаля) (Natali 1992; Turner 1992). Он вносит вклад в прогрессию опухоли по двум основным механизмам: а именно, аутокринной стимуляции его лигандом, фактором стволовых клеток (SCF), и посредством мутаций, при