Селективные антагонисты аденозинового рецептора a2a для изготовления лекарственного средства для лечения фибрилляции предсердий
Иллюстрации
Показать всеПредложено применение селективных антагонистов аденозинового рецептора А2А для получения лекарственных препаратов для лечения фибрилляции предсердий у млекопитающих, включая человека. Обнаружено, что аденозиновый рецептор А2A предсердных кардиомиоцитов участвует в патологических механизмах, лежащих в основе фибрилляции предсердий. Преимущество применения селективных антагонистов А2A (ZM214385, Н-89, SCH58261) относительно других агентов состоит в том, что антагонисты A2A специфически направлены на пациентов с фибрилляцией предсердий: снижают повышенную частоту волн кальция при их фибрилляции, т.е. участвуют в электрическом ремоделировании предсердия в состоянии фибрилляции. 10 з.п. ф-лы, 10 ил.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к области медицины и ветеринарии и, в частности, к соединениям, предназначенным для лечения сердечно-сосудистых заболеваний, в особенности для лечения фибрилляции предсердий.
Уровень техники
Фибрилляция предсердий является наиболее распространенным типом сердечной аритмии и она связана со значительным уровнем заболеваемости и смертности. Ее частота и распространение увеличиваются и она представляет собой возрастающую клиническую и экономическую нагрузку (в настоящее время распространение составляет 2% в популяции в целом). В дополнение к тяжелым клиническим симптомам, например учащенному сердцебиению, головокружению, одышке и др., фибрилляция предсердий является единственным наиболее важным фактором, приводящим к ишемическому инсульту в популяции в возрасте старше 75 лет. В целом фибрилляция предсердий является причиной более 5% госпитализаций вследствие сердечно-сосудистых заболеваний. Примерно 90% случаев фибрилляции предсердий происходит при наличии других сердечных заболеваний, таких как гипертоническая болезнь сердца, застойная сердечная недостаточность или болезни сердечных клапанов. Только в 10% случаев фибрилляция предсердий все-таки развивается в отсутствии сердечных патологий ("одинокая" фибрилляция предсердий). Различают три формы фибрилляции предсердий: (1) пароксизмальная фибрилляция предсердий, характеризующая самоограниченные эпизоды фибрилляции предсердий с длительностью, которая варьирует от секунд до дней; (2) неограниченная фибрилляция предсердий, которая продолжается неограниченное время, пока ее не останавливают посредством медицинских вмешательств; (3) постоянная фибрилляция предсердий, которую не удается остановить фармакологической или электрической кардиоверсией.
Исследования показали, что фибрилляция предсердий происходит в результате множества возвратных электрических волн малой амплитуды, которые двигаются случайным образом вокруг предсердия. Данные волны малой амплитуды инициируются электрическими импульсами, обычно в устьях миокарда, продолжающихся от левого предсердия до проксимальных частей легочных вен длиной 5-6 см. После начала фибрилляции в предсердиях возникают изменения (ремоделирование предсердий), которые воздействуют на их электрические, механические и метаболические свойства, ответственные за продолжительность аритмии. Регулирование скорости сокращений желудочков при наличии фибрилляции предсердий повышается, а если регулирование скорости не может быть понижено посредством лечения, происходит дилатация желудочков и нарушение систолической функции, которую обычно называют тахикардиомиопатией. Инсульт и тромбоэмболия являются основной причиной смертности и заболеваемости и связаны с фибрилляцией предсердий; лежащая в основе этиологии патофизиологическая база данного явления представляет собой протромботическое состояние или состояние гиперкоагуляции в сочетании с патологиями кровотока (например, предсердный стаз) и эндотелиальным или эндокардиальным повреждением.
Как и в других узких направлениях кардиологии, за последние сорок лет достигнут большой прогресс в развитии диагностики и лечения сердечных аритмий. Несмотря на многие достижения, действительное излечение сердечных аритмий и предупреждение внезапной смерти от аритмии осуществлено у меньшинства пациентов. В наши дни лечение фибрилляции предсердий охватывает уменьшение симптомов, связанных с фибрилляцией предсердий, предупреждение тромбоэмболических осложнений и прекращение аритмии соответствующим образом.
В общем, существует два подхода в лечении фибрилляция предсердий: (а) лечение самой аритмии и (б) снижение риска тромбоэмболичекого события (см. М.В.Iqbal et al., "Recent developments in atrial fibrillation" (Современные исследования в области фибрилляции предсердий), British Medical Journal, 2005, т.330, стр.238-43). Лечение аритмии охватывает регуляцию ритма (восстановление и поддержание синусового ритма) и регуляцию частоты сердечных сокращений. Фармакологически регуляцию ритма и частоты сердечных сокращений осуществляют антиаритмическими лекарственными препаратами (антиаритмические агенты класса I и класса III). Примерами данных препаратов, которые используют в настоящее время, являются флекаинид, пропафенон, амиодарон, дофетилид, ибутилид и соталол. Нефармакологически регуляцию ритма и частоты сердечных сокращений осуществляют с помощью электрической кардиоверсии, предсердной электрокардиостимуляции, имплантируемого предсердного дефибриллятора, высокочастотного катетерного удаления и комплексной хирургической процедуры.
Уменьшение риска тромбоэмболии и таким образом предупреждение инсульта имеет большую важность в стратегии лечения. Фармакологически аспирин и варфарин рекомендуют большинству пациентов для предупреждения образования предсердного тромба и тромбоэмболических событий. Объединенные данные исследований на пациентах из группы высокого риска показывают, что варфарин действует лучше, чем аспирин, в плане предупреждения инсультов, но риск обширного кровотечения при приеме варфарина в два раза выше, чем при приеме аспирина. Во всяком случае противосвертывающее лечение необходимо подбирать индивидуально на основе возраста, сопутствующих заболеваний и противопоказаний. Нефармакологически снижение риска тромбоэмболического события в настоящее время осуществляют путем удаления отростка левого предсердия или с использованием катетера (способ находится на стадии исследования).
Настоящее исследование выдвигает на первый план новые подходы как к фармакологической, так и нефармакологической стратегиям лечения. Наиболее перспективными агентами являются ингибиторы ангиотензин-превращающего фермента (АПФ) и лекарственные препараты, блокирующие рецептор ангиотензина II. Ингибиторы протеазы, фосфатазы достаточной избирательности и специфичности или антиоксиданты могут также дать новые терапевтические стратегии уменьшения или обратного развития структурных изменений, дилатации предсердий и сократительной дисфункции. Однако проблема лечения фибрилляции предсердий еще далека от удовлетворительного решения.
Раскрытие изобретения
Авторы обнаружили, что хорошо известная группа фармацевтических соединений, а именно антагонисты аденозинового рецептора А2A, эффективны для получения лекарственных средств против фибрилляции предсердий у млекопитающих, в том числе человека.
Изобретение происходит из неожиданного обнаружения того факта, что аденозиновый рецептор А2А присутствует в кардиомиоцитах предсердий человека и участвует в патологических механизмах, лежащих в основе фибрилляции предсердий. В частности, авторы обнаружили, что экспрессия гомодимерного аденозинового рецептора А2A, представляющего собой функциональный вид в плазматической мембране, повышающим образом регулируется у пациентов с фибрилляцией предсердий. Электрофизиологические эксперименты показали, что активация аденозинового рецептора А2A в миоцитах предсердий, взятых у данных пациентов, приводит к опосредованному протеинкиназой А повышению спонтанного высвобождения кальция из саркоплазматической сети, измеряемому как волны кальция.
Более того, используя два различных экспериментальных подхода (конфокальную визуализацию кальция и метод пэтч-кламп), авторы обнаружили, что антагонисты аденозинового рецептора А2A снижают повышенную частоту волн кальция при фибрилляции предсердий. В самом деле, антагонисты аденозинового рецептора А2A не только реверсируют стимулирующий эффект агонистов на волны кальция, но также снижают исходную частоту волн кальция. Вместе взятые данные результаты позволяют предположить, что опосредованное аденозиновым рецептором А2A нарушение регуляции потоков внутриклеточного кальция участвует в комплексном электрическом ремоделировании предсердия в состоянии фибрилляции. Данные факты позволяют включить антагонисты аденозинового рецептора в избирательные терапевтические агенты для лечения фибрилляции предсердий.
Ранее и в качестве наиболее близкого научного исследования авторы описали только, что миоциты, выделенные из правого предсердия у пациентов с эпизодами фибрилляции предсердий, демонстрируют более частое спонтанное высвобождение Са2+ из саркоплазматической сети, чем миоциты пациентов, не имеющих аритмии (см. статью L.Hove-Madsen et al., "Atrial fibrillation is associated with increased spontaneous calcium release from the sarcoplasmic reticulum in human atrial myocytes" (Фибрилляция предсердий ассоциирована с повышенным уровнем спонтанного высвобождения кальция из саркоплазматической сети в предсердных миоцитах человека), Circulation 2004, сентябрь, стр.1358-63).
Соответственно настоящее изобретение относится к применению антагониста аденозинового рецептора А2A для получения лекарственного средства для предупреждения и/или лечения фибрилляции предсердий у млекопитающего, в том числе человека. В дальнейшем "антагонист аденозинового рецептора А2A” будут называть "антагонист А2A" и "аденозиновый рецептор А2A" - "рецептор А2A". Данный аспект изобретения можно альтернативно сформулировать как способ предупреждения и/или лечения фибрилляции предсердий с помощью антагонистического действия в отношении рецепторов А2A, который заключается во введении нуждающемуся в этом млекопитающему (предпочтительно человеку) эффективного количества антагониста А2A вместе с соответствующими количествами приемлемых разбавителей или носителей.
Преимущество использования антагонистов А2A относительно других агентов, используемых в области техники, состоит в том, что антагонисты А2A специфически направлены на пациентов с фибрилляцией предсердий. Таким образом экспрессия функциональных димерных рецепторов А2A находится на низком уровне у пациентов с нормальным размером предсердий и без фибрилляции предсердий в анамнезе, тогда как экспрессия рецептора димерного типа в сильной степени повышающим образом регулируется у пациентов с фибрилляцией предсердий. Напротив, другие агенты, используемые в настоящее время, действуют более широко на рецепторы или каналы, которые важным образом регулируют многочисленные функции в множестве клеток. Так, антагонисты кальция не только снижают переизбыток кальция путем ингибирования кальциевых каналов L-типа, но также снижают сократительную способность сердца. Более того, ток кальция L-типа также регулирует функцию гладкой мускулатуры и секреторных клеток, что обуславливает нежелательные побочные эффекты антагонистов кальция.
Рецептор А2A
Аденозин представляет собой пуриновый нуклеозид, образуемый всеми метаболически активными клетками организма. Аденозин проявляет свое действие через четыре идентифицированных подтипа поверхностных клеточных рецепторов: A1 А2A, А2B и А3, которые принадлежат к суперсемейству рецепторов, связанных с G белком. А1 и А3 связаны с ингибирующим G белком, тогда как А2A и А2В связаны со стимулирующим G белком. Рецепторы А2A в основном обнаруживают в головном мозге, как в нейронах, так и в клетках глии (максимальный уровень в полосатом теле и прилежащем ядре, от среднего до высокого уровня - в обонятельной луковице и гипоталамусе и на участках гиппокампа). В полосатом теле рецептор регулирует высвобождение и функцию нейромедиаторов (см. статью Н.Kase et al. "Progress in pursuit of therapeutic А2A antagonists: the adenosine А2A receptor selective antagonist KW 6002: research and development toward a novel nondopaminergic therapy for Parkinson's disease" (Достижения в изыскании терапевтических антагонистов А2A, избирательный антагонист аденозинового рецептора А2A KW 6002 - поиск и подход к новому недопаминергическому препарату для лечения болезни Паркинсона), Neurology 2003, т.61, стр.97-100). Известно, что в периферических тканях рецепторы А2A присутствуют в тромбоцитах, нейтрофилах, селезенке, вилочковой железе, эндотелии и клетках гладкой сосудистой мускулатуры, где вызывают сильную коронарную вазодилатацию, которая позволяет оценить перфузию миокарда у пациентов с коронарной болезнью сердца (см. статью Z.Gao et al., "Novel short-acting А2A adenosine receptor agonists for coronary vasodilatation: inverse relationship between affinity and duration of action of А2A agonists" (Новые агонисты аденозинового рецептора А2A короткого действия для коронарной вазодилатации, обратная зависимость между аффинностью и продолжительностью действия агонистов А2A), J.Pharmacol. Exp.Ther. 2001, т.298, стр.209-18). Однако рецептор А2A никогда до настоящего времени не был локализован в предсердных кардиомиоцитах человека.
Подходящие соединения для лечения фибрилляции предсердий
Как правило, антагонист представляет собой молекулу, которая связывается с рецептором, не активируя рецептор. Он конкурирует с эндогенным лигандом(ами) или субстратом(ами) за связывание центра(ов) на рецепторе и таким образом ингибирует способность рецептора к трансдукции внутриклеточного сигнала в ответ на связывание эндогенного лиганда. Антагонист действует несколькими путями. Он может связывать или выводить аденозин с достаточной аффинностью и специфичностью для того, чтобы нарушать, блокировать или иным образом предотвращать связывание аденозина с рецептором А2A, таким образом ингибируя, подавляя или вызывая прекращение аденозин-опосредованной биологической активности.
Рецептор А2A в кардиомиоцитах в отсутствие эндогенного лиганда проявляет основную активность. Данная активность может быть обусловлена конститутивной активностью рецептора или активацией рецептора эндогенным аденозином. В данном случае лечения фибрилляции предсердий может достигаться снижением данной основной активности посредством применения антагониста или обратного агониста. Некоторые из антагонистов А2A, представленных в изобретении, могут проявлять обратный агонизм.
В соответствии с известной локализацией и функцией рецептора А2A, антагонисты А2A использовали до настоящего времени для лечения болезни Паркинсона и других заболеваний ЦНС (центральной нервной системы) (шизофрении, сенильной деменции, как при болезни Альцгеймера, психоза органической природы и т.п.). Среди них главной является болезнь Паркинсона.
Каждый антагонист А2A предназначен для применения для целей данного изобретения. Многие различные соединения глубоко исследованы как антагонисты А2A, которые можно подразделить на два больших семейства: производные ксантина и нексантиновые гетероциклы.
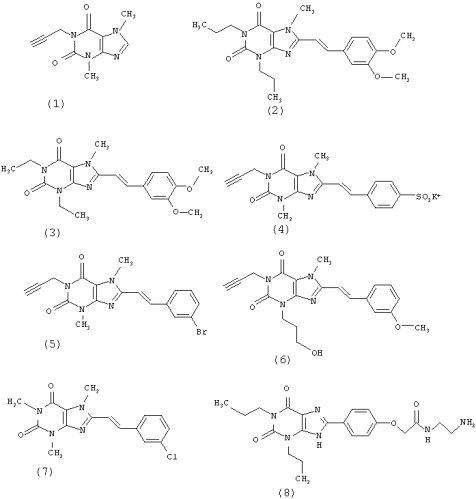
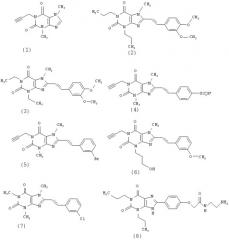
В конкретном варианте осуществления изобретения антагонист А2A представляет собой производное ксантина или его фармацевтически приемлемую соль. Различные заместители в разных положениях, а также деазо- или азо-аналоги, либо другие гетероциклические аналоги пуринового цикла либо три- или тетрациклические производные/аналоги могут иметь аналогичную антагонистическую активность в отношении А2A. Среди производных ксантина предпочтительной структурой, общей для некоторых соединений, является структура 1,3,7-триалкил-8-стририл-ксантина. В предпочтительном варианте осуществления антагонист А2A представляет собой соединение, выбранное из группы, состоящей из теобромина, известного как DMPX (см. формулу 1), KF 17837 (см. формулу 2), истрадефиллина, известного как KW 6002 (имеющий наименование 8-[(Е)-2-(3,4-диметоксифенил)этенил]-1,3-диэтил-7-метилпурин-2,6-дион согласно номенклитуре IUPAC; см. формулу 3), п-сульфостирил-DMPX (см. формулу 4), BS-DMPX (см. формулу 5), MSX-2 (имеющий наименование 3-(3-гидроксипропил)-8-[(Е)-2-(3-метоксифенил)этенил]-7-метил-1 -проп-2-инилпурин-2,6-дион согласно номенклитуре IUPAC; см. формулу 6), CSC (см. формулу 7), аминной структуры, близкой ксантину (ХАС, формула 8), и MSX-3.
В более предпочтительном варианте осуществления антагонист А2A представляет собой KW 6002. Данное соединение в настоящее время находится на фазе III клинических испытаний в плане лечения болезни Паркинсона. В другом предпочтительном варианте осуществления антагонист А2A представляет собой MSX-2. В другом предпочтительном варианте осуществления антагонист А2A представляет собой MSX-3, сложный эфир фосфорной кислоты MSX-2, пролекарственную форму MSX-2.
Известны другие соединения ксантина, проявляющие антагонистическую активность в отношении рецептора А2A, как описано, например, в патентах США №№5484920, 5587378, 5543415 и в Европейской заявке ЕР 1016407 А1.
В другом конкретном варианте осуществления изобретения антагонист А2A представляет собой нексантиновый гетероцикл. Типичные нексантиновые аденозиновые антагонисты А2A получены из аденина и представляют собой адениновые производные в самом широком смысле, включая моно-, ди-, три- и тетрациклические соединения, с различными заместителями.
Идентифицированы дополнительные гетероциклические соединения, полученные не из аденина, которые обладают антагонистической активностью в отношении А2A. Известно, что некоторые 2-аминопиридиновые соединения проявляют антагонизм в отношении рецептора А2A (см., например, международные публикации WO 02/14282 и WO 01/25210), известны также некоторые 9-аминопиримидиновые соединения (см., например, патентную заявку США №2001/0027196).
В предпочтительном варианте осуществления антагонист А2A выбран из группы, состоящей из SCH 58261 (см. формулу 9); ANR-82 (см. формулу 10); ZM 241385 (см. формулу 11); SCH 63390 (см. формулу 12), CGS 15943 (см. формулу 13), 8FB-PTP (см. формулу 14); VER-6623 (имеющий наименование 2-пропан-2-ил-4-(1,3-тиазол-2-ил)тиено [2,3-е] пиримидин согласно номенклатуре IUPAC; известный так же как V2006, см. формулу 15); (-)R,S-мефлоквин (см. формулу 16) и 7FB-PTP (см. формулу 17). В более предпочтительном варианте осуществления антагонистом А2A в группе нексантиновых соединений является VER-6623.
Другими соединениями, предпочтительными в качестве антагонистов А2A, являются пиразолопиримидиновое производное формулы 18; триазолохиноксалиновое производное формулы 19; 9-замещенное 2-амино-6-фурил-адениновое производное формулы 20 и триазолотриазиновые производные формул 21, 22 и 23.
Другие триазолопиримидиновые антагонисты описаны, например, в международных публикациях WO 04/029056, WO 95/01356, WO 98/52568, WO 01/92264, WO 97/05138, в международной заявке PCT/US02/32630 и в патенте США №5565460. В частности, замещенные пиразол[4,3-е]-1,2,4-триазоло-[1,5-с]пиримидиновые соединения описаны в международных публикациях WO 05/054245, в патентных заявках США №№2004/220194 и 2003/212059.
Другие специфические примеры подходящих антагонистов А2A включают соединения, описанные в следующих патентах, патентных заявках, международных публикациях и статьях: WO 95/01356, US 6630475, US 5935964, WO 03/032996, WO 03/048165, WO 03/048164, WO 03/048163, WO 05/042500, WO 05/058883, WO 05/040151, WO 05/039572, WO 04/092177, US 2004/138235, WO 04/019949, WO 02/14282, WO 04/016605, WO 03/082873, US 5484920, US 5703085, WO 92/06976, WO 94/01114, US 5565460, WO 98/42711, WO 00/7201, WO 99/43678, WO 99/26627, WO 01/92264, WO 99/35147, WO 00/13682, WO 00/13681, WO 00/69464, WO 01/40230, WO 01/02409, WO 01/02400, EP 1054012, WO 01/62233, WO 01/17999, WO 01/80893, WO 02/14282, WO 01/97786, WO 01/16134, WO 00/73307, US 2005/043315, US 2003/149060; Baraldi et al. "Recent developments in the field of А2A and A3 adenosine receptor antagonists " (Последние разработки в области антагонистов аденозиновых рецепторов А2A и А3), European Journal of Medicinal Chemistry, 2003, т.38, стр.367-82; E.Ongini, et al. "Selective adenosine А2A receptor antagonists" (Избирательные антагонисты аденозинового рецептора А2A, Farmaco, 2001, т.56, стр.87-90; СЕ. Muller et al., "А2A Adenosine receptor antagonists - future drugs for Parkinson's disease?" (Антагонисты аденозинового рецептора А2A - лекарства будущего для лечения болезни Паркинсона?), Drugs of the Future, 2000, т.25, стр.1043-52; L.J.Knutsen et al.,"KW-6002 (Kyowa Hakko Kogyo)", Curr. Opin. Investig. Drugs, 2001, т.2, стр.668-73; В.Cacciari et al., "Medicinal chemistry of А2A adenosine receptor antagonists" (Медицинская химия антагонистов аденозинового рецептора А2A), Curr. Top.Med. Chem., 2003, т.3, стр.403-11; G.Yao et al., "Synthesis of alkyne derivatives of novel triazolopyrazine as А2A adenosine receptor antagonists" (Синтез алкиновых производных нового триазолопиразина как антагонистов аденозинового рецептора А2A), Bioorg. Med. Chem. Lett., 2005, т.15, стр.511-5; Е. Kiselgof et al., "6-(2-furanyl)-9H-purin-2-amine derivatives as А2A adenosine antagonists" (Производные 6-(2-фуранил)-9Н-пурин-2-амина как антагонисты аденозин А2A), Bioorg. Med. Chem. Lett., 2005, т.15, стр.2119-22; S.M. Weiss et al., "Discovery of nonxanthine adenosine А2A receptor antagonists for the treatment of Parkinson's disease" (Открытие нексантиновых антагонистов аденозинового рецептора А2A. Для лечения болезни Паркинсона), Neurology, 2003, т.61 (Supp.6), стр.S101-6; С. В.Vu et al., "Novel diamino derivatives of [1,24]triazolo[1,5-a][1,3,5]triazine as potent and selective adenosine А2A receptor antagonists" (Новые диаминопроизводные [1,24]триазоло[1,5-а][1,3,5]триазина как сильные и избирательные антагонисты аденозинового рецептора А2A), J. Med. Chem., 2005, т.48, стр.2009-18; С.В.Vu et al., "Piperazine derivatives of [1,2,4]triazolo[1,5-a][1,3,5]triazine as potent and selective adenosine A2A receptor antagonists" (Пиперазиновые производные [1,24]триазоло[1,5-а][1,3,5]триазина как сильные и избирательные антагонисты аденозинового рецептора А2A), J. Med. Chem., 2004, т.47, стр.4291-9.
Компетентный специалист в области техники будет знать, является ли соединение подходящим антагонистом А2A для целей изобретения. Например, в области техники существуют подходящие способы оценки, является ли соединение подходящим антагонистом А2A. Примером является способ, основанный на анализе связывания радиолигандов, описанный в патентной заявке США № 2004/0138235, параграфы [0226]-[0240].
Для лечения фибрилляции предсердий предпочтительно когда антагонист А2A является избирательным (селективным) в отношении рецептора А2A. Все вышеописанные антагонисты А2A являются избирательными в отношении рецептора А2A, но степень избирательности среди них различна. Избирательность также может некоторым образом отличаться среди разных видов (например крыса, человек).
Антагонисты А2A получают известными способами, как описано в приведенных патентах и заявках.
Фармацевтические композиции и применение
Касательно лечения термин "эффективное количество" относится к количеству активного ингредиента, которое достаточно для получения благоприятного или желательного клинического результата: ослабления, облегчения, стабилизации, обратного развития или замедления развития заболевания или нарушения, либо, иначе, уменьшения патологических последствий заболевания или нарушения. Эффективное количество, как правило, определяет лечащий врач на основе конкретного случая.
Хотя активное соединение, предназначенное для применения при лечении в соответствии с изобретением, можно вводить в форме неочищенного химического соединения, предпочтительно введение активного ингредиента, необязательно в форме физиологически приемлемой соли, в фармацевтической композиции вместе с одним или более адъювантов, наполнителей, носителей, буферов, разбавителей и/или других принятых фармацевтических вспомогательных агентов. Компоненты можно вводить либо в однократной либо в многократной дозах любым из принятых способов введения агентов, имеющих близкое применение, включая ректальный, защечный, интраназальный и чрескожный пути, посредством интраартериальной инъекции, внутривенно, внутрибрюшинно, парентерально, внутримышечно, подкожно, перорально, местно, как ингаляционный препарат или посредством пропитанного или имеющего покрытие устройства, такого как стент, например, или введенный в артерию цилиндрический полимер.
Одним из предпочтительных способов введения является парентеральный, особенно посредством инъекции. Формы введения путем инъекции включают водные или масляные суспензии или эмульсии, а также стерильные водные растворы. Пероральное введение представляет собой другой предпочтительный путь введения. Фармацевтическая композиция может быть в форме таблеток, пилюль, порошков, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей, капсул и т.п.
Композиции, соответствующие изобретению, можно приготовить так, чтобы обеспечить быстрое, замедленное или задержанное высвобождение активного ингредиента после введения пациенту при использовании способов, известных в области техники. Системы доставки лекарственного средства с контролируемым высвобождением для перорального применения включают системы с осмотическим насосом и растворяющиеся системы, содержащие покрытые полимером резервуары или препараты, содержащие состав лекарственное средство - полимерная матрица. В другом препарате, предназначенном для применения в способах, соответствующих настоящему изобретению, используют устройства для чрескожной доставки ("пластыри"). Данные чрескожные пластыри могут быть использованы для обеспечения непрерывной или прерывистой инфузии соединения в контролируемых количествах.
Предпочтительно когда композиции получают в унифицированной лекарственной форме. Доза зависит от природы и тяжести заболевания и ее определение входит в компетенцию лечащего врача.
Пока не определено иначе, все технические и научные термины, используемые в данном контексте, имеют такое же значение, какое обычно имеет в виду обычный специалист в области техники, к которой принадлежит данное изобретение. На протяжении описания и в формуле изобретения слово "содержит (включает)" и его варианты, такие как "содержащий", не предназначены для исключения других технических признаков, дополнительных агентов, компонентов или стадий. Реферат настоящей заявки включен в данном контексте. Дополнительные объекты, преимущества и признаки изобретения будут очевидны компетентным специалистам в области техники при изучении описания или могут быть изучены при практической реализации изобретения. Следующие примеры и чертежи представлены в порядке иллюстрации и не предусматривают ограничения настоящего изобретения.
Краткое описание чертежей
Фигуры 1-3 иллюстрируют регуляцию повышающим образом экспрессии рецептора у пациентов с фибрилляцией предсердий.
На Фиг.1 представлены только что выделенные миоциты из правого предсердия человека, которые дважды окрашивают антителом к рецептору А2A (панели 1, 4, 7 и 10) и антителом к миозину (2), α-актинину (5), коннексину-43 (8) или RyR (11). Совмещение изображений с двойной иммунофлуоресценцией (панели 3, 6, 9 и 12) показывают солокализацию рецептора А2A с α-актинином и перекрывающееся распространение рецептора А2A с рианодиновым рецептором (RyR).
На Фиг.2 показаны клеточные мембраны из клеток НЕК, временно трансфецированных человеческим рецептором А2A (положительный контроль, С+) и мембраны человеческих предсердий, полученные от пациентов с синусовым ритмом (SINUS) или с фибрилляцией предсердий (AF), разделенные с помощью SDS-PAGE (электрофореза в полиакриламидном геле с использованием додецилсульфата натрия) и подвергнутые иммуноблоттингу с использованием кроличьего антитела к рецептору А2A. "Di" означает димер и "Мо" означает мономер.
На Фиг.3 показано относительное денситометрическое сканирование (RDS) иммуноблота, представленного на Фиг.2. Общее количество рецептора А2A (мономер+димер) показано черными столбиками. Относительные количества мономера рецептора А2A (белые столбики) и димера (серые столбики) нормализованы с использованием общей суммы рецептора А2A (димер+мономер) для каждой дорожки.
Фигуры 4-8 показывают агонистическую стимуляцию рецептора А2A, включающую РКА-зависимое повышение спонтанного высвобождения кальция из саркоплазматической сети у пациентов с фибрилляцией предсердий.
На Фиг.4 спонтанный INCX регистрируют с мембранным потенциалом, фиксированным при -80 мВ до (контроль), во время (CGS) и после (промывание, W) воздействия на миокардиоцит 200 нМ CGS 21680. Горизонтальные и вертикальные измерительные линейки соответствуют 30 сек и 100 пА соответственно.
На Фиг.5 показан период стимулирующего действия CGS 21680 на ряд спонтанных обменных токов Na-Ca (регистрируемых как события на каждой 30-секундной развертке, e/s). Жирная линия над столбиками показывает период применения CGS 21680.
На Фиг.6 показано, как антагонист А2A ZM 241385 (1 мкМ) способен возвращать к исходному состоянию стимулирующий эффект 200 нМ CGS 21680 на спонтанный INCX. Горизонтальные и вертикальные измерительные линейки соответствуют 30 сек и 100 пА соответственно.
На Фиг.7 представляют суммарный эффект CGS в кардиомиоцитах, полученных от 8 контрольных пациентов, не имеющих фибрилляции предсердий, и 11 пациентах с фибрилляцией предсердий. Для оценки эффекта CGS 21680 используют парный критерий Стьюдента, и р-значения приведены выше столбиков. INCX F означает частоту INCX.
На Фиг.8 показано, что добавление 10 мкМ Н-89 устраняло стимулирующий эффект 200 нМ CGS 21680 у 5 пациентов. Программа ANOVA показывает существенный эффект лечения на частоту волн (р=0,001) и повторная проверка дает р=0,03 для CGS относительно контроля, р=0,002 для CGS относительно CGS+H-89 и р=0,05 для CGS+89 относительно контроля.
На Фиг.9 показано, что антагонист А2A SCH 58261 (50 нМ) вызывает обратимое снижение частоты спонтанного INCX в образцах, полученных от пациентов с фибрилляцией предсердий. Горизонтальные и вертикальные измерительные линейки соответствуют 30 сек и 100 пА соответственно.
Фигуры 9-10 демонстрируют, что антагонисты А2A снижают исходный уровень спонтанного высвобождения кальция из саркоплазматической сети у пациентов с фибрилляцией предсердий. Эксперименты показывают спонтанный INCX при фиксируемом потенциале -80 мВ.
На Фиг.10 показано, что антагонисты А2A снижают как частоту волны спонтанного кальция (WF), измеренную посредством конфокальной визуализации кальция (левая панель, n=6) или с помощью метода пэтч-кламп (правая панель, n=7). Эффекты 50 нМ ZM 241385 и SCH 58261 сравнимы и были объединены. Статистическую достоверность с использованием непарного критерия Стьюдента для конфокальных экспериментов и парного критерия Стьюдента для экспериментов с использованием метода пэтч-кламп приводят над столбиками.
Осуществление изобретения
Экспрессия и локализация рецептора А2А в правом предсердии человека
Присутствие рецептора А2A в кардиомиоцитах из правого предсердия человека исследуют с помощью иммуноблоттинга. Результаты показывают, что рецептор присутствует в правом предсердии и что обе - мономерная и димерная - формы рецептора экспрессируются в данной ткани, причем димерная форма является неосновной в образцах, полученных из предсердий при синусовом ритме. Локализацию рецептора А2A в миокарде предсердий изучают с помощью конфокальной микроскопии в образцах, дважды помеченных антителами к рецептору и либо к миозину, α-актинину, коннексину-43, либо RyR. Рецептор А2A экспрессируется по типу поперечного пучка вдоль волокна миокарда и солокализован с ассоциированным с цитоскелетом белком α-актинином на уровне Z-линии в саркомере. Распространение рецептора А2A качественно близко в образцах, полученных от пациентов с фибрилляцией предсердий и без фибрилляции предсердий.
Регуляция повышающим образом экспрессии рецептора А2A у пациентов с фибрилляцией предсердий
Выделенные предсердные миоциты сохраняют тип пучка рецептора А2A, а также солокализацию с α-актинином и перекрывающееся с RyR распространение, видимое в образцах предсердной ткани (ср. Фиг.1). В локализации рецепторов в кардиомиоцитах, полученных от пациентов с фибрилляцией предсердий и без фибрилляции предсердий, не наблюдают никаких различий (данные не представлены). Уровень белка рецептора А2A, измеренный вестерн-блоттингом, заметно возрастает у пациентов с фибрилляций предсердий (ср. Фиг.2, С) и интересно, что тип димерного рецептора А2A, который является функциональной формой, присутствующей на клеточной поверхности, заметно повышен при фибрилляции предсердий (ср. Фиг.3). В кровеносных сосудах не наблюдается никаких существенных различий. Вследствие этого данные результаты не только впервые демонстрируют экспрессию рецептора А2A в человеческих предсердных миоцитах, но также их повышающую регуляцию, в основном в гомодимерной форме, у пациентов с фибрилляцией предсердий.
Агонистическая стимуляция рецептора А2A индуцирует РКА-зависимое (зависимое от протеинкиназы А) повышение спонтанного высвобождения кальция из саркоплазматического ретикулуума (SR) у пациентов с фибрилляцией предсердий.
Эффект агонистов рецептора А2A на спонтанное высвобождение кальция из SR анализируют на выделенных предсердных миоцитах, полученных у пациентов с синусовым ритмом и у пациентов с фибрилляцией предсердий. Анализируют как местное нераспространяющееся высвобождение кальция (вспышки кальция), так и регенеративное высвобождение кальция из SR (волны кальция). Предварительное инкубирование с агонистом рецептора А2A CGS 21680 (200 нМ) увеличивает количество волн кальция у пациентов с фибрилляцией предсердий, но не у пациентов, не страдающих аритмией.
Для того чтобы определить, является ли эффект CGS 21680 на спонтанное высвобождение кальция из SR вторичным относительно эффекта на мембранный потенциал, используют метод пэтч-кламп для фиксации мембранного потенциала при -80 мВ. Это не препятствует тому, что CGS 21680 обратимо увеличивает число спонтанных волн кальция, измеряемых как обменный ток Na-Ca (INCX), активируемый ими (ср. Фиг.4 и 5). В самом деле, данный подход подтверждает существенный стимулирующий эффект CGS 21680 у пациентов с фибрилляцией предсердий (ср. Фиг.7). Вследствие этого повышенное спонтанное высвобождение кальция из SR, индуцируемое CGS 21680, обусловлено рецептор А2A-зависимой регуляцией активности RyR. Специфический эффект CGS 21680 изменяется на противоположный двумя избирательными антагонистами А2А ZM 241385 (ср. Фиг.6) и SCH 58261.
Поскольку рецептор А2A связан с G белками, опосредованная агонистом активация рецептора должна повышать уровни сАМР (циклического аденозинмонофосфата), который, в свою очередь, приводит к активации РКА и фосфорилированию RyR. Для тестирования, проявляет ли рецептор А2A свой эффект посредством сАМР-зависимой активации РКА, используют избирательный ингибитор РКА Н-89. Стимулирующий эффект CGS 21680 в миоцитах, полученных от пациентов с фибрилляцией предсердий, устраняют с помощью Н-89 (ср. Фиг.8), подтверждая, что рецептор А2A-зависимая регуляция спонтанного высвобождения кальция из SR в действительности опосредована активацией РКА. Интересно, что Н-89 не только устраняет эффект CGS 21680, но и действительно уменьшает спонтанное высвобождение кальция до существенно более низкого уровня, чем исходный уровень, регистрируемый до применения CGS 21680. Анализ вспышек и волн кальция с помощью конфокальной микроскопии подтверждает зависимость рецептор А2A-опосредованного спонтанного высвобождения кальция от РКА.
Блокада рецептора А2A уменьшает исходный уровень спонтанного высвобождения кальция из SR
Существование исходного тонуса сАМР в человеческих предсердных миоцитах заявлено в исследованиях нейрогормональной модуляции токов кальция L-типа. Обнаружение авторами того, что блокатор РКА Н-89 уменьшает частоту волн кальция до уровня ниже исходного, кроме того, позволяет предположить, что в человеческих предсердных миоцитах имеется исходный рецептор А2A-зависимый тонус сАМР. В соответствии в данным представлением клетки, полученные от пациентов с фибрилляцией предсердий при контакте с избирательными агонистами рецептора А2A SCH 58261 или ZM 241385, демонстрируют повышенный исходный уровень высвобождения кальция из SR, существенно пониженную частоту волн кальция, измеренную либо посредством конфокальной микроскопии либо с помощью метода пэтч-кламп (ср. Фиг.9-10).
Образцы, полученные от человека
В данном исследовании используют образцы сердечной ткани, полученные в целом от 54 пациентов, подвергшихся хирургическому вмешательству на сердце. Хотя образцы предсердной ткани состояли из ткани, которую в норме отбрасывают во время хирургической операции, разрешение на использование в данном исследовании было получено от каждого пациента. Исследование одобрено Комитетом по этике больницы Сант Пау (Барселона, Испания).
Семнадцать из 54 пациентов имеют в истории болезни фибрилляцию предсердий, тогда как у остальных пациентов данная аритмия отсутствует. У двадцати пяти пациентов отсутств