Фармацевтическая композиция и способ ее ингаляционного введения
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фармакологии. Фармацевтическая композиция включает активный компонент, выбранный из группы фармакологически активных веществ: действующих на центральную нервную систему, периферические нейромедиаторные процессы, сердечно-сосудистую систему, на свертывающую систему крови, на опухолевые процессы, на метаболические процессы, обладающих антибактериальной активностью, наполнитель, циклодекстрин в качестве компонента, увеличивающего биодоступность, и компонент, модулирующий продолжительность действия фармакологически активного вещества, представляющий собой полимер. Фармацевтическая композиция выполнена в виде порошка с размером частиц от 0,4 до 2 мкм. Способ введения фармацевтической композиции предусматривает ее ингаляционное введение через рот в виде сухого или жидкого аэрозоля с масс-медианным аэродинамическим диаметром частиц от 0,8 до 2,0 мкм и степенью полидисперсности от 0,8 до 2,0. Изобретение обеспечивает эффективную доставку фармакологически активных веществ в системный кровоток и ингалирование в альвеолы не менее 75% частиц твердого или жидкого аэрозоля. 2 н. и 3 з.п. ф-лы, 5 ил., 4 пр.
Реферат
Изобретение относится к медицине, а именно к фармакологии, и предназначено для ингаляционного введения фармакологически активных веществ (ФАВ) в организм с целью лечения неотложных состояний и заболеваний, требующих постоянного курсового приема лекарственного препарата.
Для введения ФАВ в организм с целью проведения медикаментозной терапии системных заболеваний используют различные пути введения, которые предполагают попадание ФАВ в кровоток. Их подразделяют на две основные группы: без нарушения целостности кожных покровов (пероральный, ректальный, интраназальный, трансдермальный, ингаляционный, сублингвальный) и с нарушением целостности кожных покровов (подкожно, внутримышечно, внутривенно).
Наиболее часто лекарственные препараты принимают перорально. Главным достоинством этого способа является удобство, так как он не требует специальных приспособлений и квалифицированного труда медицинского персонала. К его недостаткам относят сравнительно медленное развитие фармакологического эффекта (30-60 мин), что является не пригодным для терапии неотложных состояний, и низкую биодоступность лекарственных препаратов (40-60%). Увеличение дозы препаратов при пероральном введении может сопровождаться развитием побочных эффектов со стороны желудочно-кишечного тракта.
Для преодоления указанных недостатков предложены сублингвальный и ректальный пути введения ФАВ. При этих способах введения лекарственные препараты минуют печень и сразу попадают в кровоток, а терапевтический эффект развивается достаточно быстро (через 10-20 мин), что определяет возможность их использования для экстренной терапии. Биодоступность лекарственных препаратов при рассматриваемых путях их введения выше, чем при пероральном. К существенным недостаткам сублингвального и ректального путей введения относят небольшую площадь всасывающей поверхности, возможное раздражающее действие на слизистую оболочку, невозможность введения больших доз препаратов.
Интраназально вводятся лекарственные средства, действующие либо местно на слизистую носа, либо оказывающие воздействие на центральную нервную систему (ЦНС). Такой способ не позволяет вводить большие дозы действующего вещества.
В лечебной практике широкое распространение получили инъекционные пути введения лекарственных препаратов. Зачастую они являются незаменимыми, особенно при неотложных состояниях, если требуется достижение быстрого лечебного эффекта, одновременное введение нескольких препаратов в условиях, когда состояние больного не позволяет осуществить их введение с помощью других способов. Для инъекционных путей введения характерна высокая биодоступность препаратов (до 100%), быстрое развитие терапевтического эффекта, возможность точного дозирования. Недостатками инъекционных путей введения являются большая опасность передозировки, частое развитие флебитов и тромбозов, инфекционных осложнений в виде абсцессов, возможное развитие воздушной эмболии, негативное психоэмоциональное восприятие, связанное с болезненностью инъекций. Применение указанного способа требует наличия специальных инструментов и оборудования, медицинских навыков и нередко может проводиться только в условиях стационара. Кроме того, лекарственные формы для инъекционного введения разработаны не для всех ФАВ. Для веществ, плохо растворимых в воде и фармацевтически приемлемых растворителях, зачастую инъекционный лекарственные формы отсутствуют.
Известно применение ингаляционного пути введения лекарственных препаратов. Как правило, такой способ введения используют с двумя целями: первая - оказать местное лечебное воздействие на дыхательные пути при их заболеваниях (заболевания носо- и ротоглотки, бронхиты, трахеиты, бронхиальная астма, хроническая обструктивная болезнь легких), вторая - оказать системный эффект. Второй вариант наиболее часто используют для проведения ингаляционного наркоза. Важным достоинством ингаляционного пути введения является возможность вводить в организм газы, летучие жидкости, пары, мелкодисперсные аэрозольные порошки и жидкости, что не позволяет сделать ни один другой способ. Ингаляционное введение осуществляется с помощью специальных устройств - ингаляторов, которые подразделяются на дозированные аэрозольные ингаляторы, дозированные аэрозольные ингаляторы со спейсером, ультразвуковые и компрессионные небулайзеры, порошковые ингаляторы. Ингаляционный путь введения рассматривается как перспективный для замены перорального и инъекционного путей введения в связи с удобством, высокой биодоступностью вводимого препарата, отсутствием эффекта «первого прохождения» препарата через печень, быстрым наступлением терапевтического эффекта, а также меньшим количеством сопутствующих побочных эффектов [Клиническая фармакокинетика. Практика дозирования лекарств: Спец. выпуск серии «Рациональная фармакотерапия». /Ю.Б.Белоусов, К.Г.Гуревич. - М.: Литтера, 2005. - 288 с.].
Для доставки ФАВ в системный кровоток при ингаляционном введении необходимо проникновение частиц аэрозоля в альвеолы. Известно, что частицы аэрозоля размером 5-10 мкм осаждаются в верхних дыхательных путях, 2-5 мкм - в нижних дыхательных путях, 0,5-2 мкм - в альвеолах. Частицы аэрозоля размером менее 0,5 мкм не осаждаются в легких. Помимо размера, важным параметром аэрозольных частиц является степень полидисперсности (δg). В зависимости от степени полидисперсности аэрозоли подразделяются на монодисперсные (δg=0,8-2,0) и полидисперсные (δg>2,0). Монодисперсные аэрозоли отличаются более высокой эффективностью проникновения в альвеолы. Для получения монодисперсного аэрозоля с размером частиц от 0,5 до 2,0 наиболее предпочтительными считаются порошковые и ультразвуковые ингаляторы.
Однако для проникновения в кровоток доставки аэрозольных частиц в альвеолы недостаточно. Для этого ФАВ должно преодолеть аэрогематический барьер. Известно, что многие липофильные вещества способны самостоятельно преодолевать аэрогематический барьер, однако для этого они должны находиться в растворенном состоянии для ингаляции жидкого аэрозоля или быть равномерно распределены в массе вещества-носителя для ингалирования твердого аэрозоля. Гидрофильные вещества в отличие от липофильных плохо проникают через барьер. Для повышения доставки гидрофильных ФАВ в кровоток применяют различные вспомогательные вещества и носители, среди которых наиболее часто используют фосфолипиды, жирные кислоты, сурфактанты, осмотически активные вещества, липосомы, полимерные наночастицы.
Известна композиция для ингалирования [Compositions for inhalation. - US 6632456, кл. 7 A61K 39/00, 2003 г.], включающая фармацевтически активный пептид и компонент, усиливающий абсорбцию действующего вещества в системный кровоток в нижней части респираторного тракта. Композиция представляет собой сухой порошок с размером частиц менее 10 мкм и содержит фармацевтически приемлемый негигроскопичный носитель. Соотношение компонентов в композиции составляет от 9:1 до 1:1. При применении композиции максимальная концентрация фармацевтически активного пептида в крови наблюдается через 10 мин. Она в 10-15 раз больше, чем при ингалировании фармацевтически активного пептида без агента, усиливающего абсорбцию. К недостаткам композиции следует отнести большой диаметр ингалируемых частиц (до 10 мкм), который не позволяет достичь альвеол большей части аэрозоля, и узкий спектр ингалируемых ФАВ, ограниченный веществами пептидной структуры.
Для ингаляционного введения широкого спектра ФАВ известны композиции и способы введения с помощью липосом [An inhalation system. - WO 0027359, кл. 7 A61K 9/127, 2000 г.]. Применение таких композиций позволяет ингалировать как гидрофильные, так гидрофобные вещества, предупреждает биодеградацию соединений белковой структуры, нуклеиновых кислот и генов. К недостаткам, ограничивающим их широкое применение, относят низкие емкостные свойства, быструю потерю водорастворимых веществ при приготовлении водного раствора для ингалирования, а также низкую стабильность при хранении [Nilesh, M.M. Nanoparticles-tremendous therapeutic potential: a review / M.M.Nilesh [et al.] // Int. J. PharmTech Res., 2009. - Vol.1, N.4. - P. 1020-1027].
Известны способы для ингаляционного введения лекарственных препаратов при заболеваниях ЦНС [Pulmonary delivery in treating disorders of the central nervous system. United States Patent №6514482, кл. 7 A61K 9/12, 2003 г.; Pulmonary delivery in treating disorders of the central nervous system. - United States Patent Application №20090162441, кл. 7 A61K 9/14, 2009 г.], которые предусматривают ингаляционное введение необходимого количества ФАВ, отличающиеся тем, что вещества доставляются в дыхательную систему в составе частиц, содержащих ФАВ, сахарид и вспомогательные вещества, выбранные из группы, включающей фосфолипид или комбинацию фосфолипидов, гидроксидикарбоновую кислоту, гидрокситрикарбоновую кислоту, их соли, в том числе соли мультивалентного металла. Указанные вещества вводятся в состав частиц для повышения абсорбции фармакологически активного вещества. Сахарид выполняет функцию носителя. Размер частиц составляет 1-3 мкм. Применение указанного метода позволяет снизить дозу ФАВ и обеспечивает более быстрое развитие терапевтического эффекта по сравнению с пероральным введением. К его недостаткам следует отнести недостаточную биодоступность ФАВ по сравнению с инъекционными способами введения, короткую продолжительность действия (1-6 ч), а также недостаточно быстрое проникновение действующего вещества в кровь из-за высокой вязкости фосфолипидов и их медленного растворения в альвеолах.
Наиболее близкой к заявленному изобретению является ингаляционная фармацевтическая композиция в форме сухих порошков, растворов и суспензий [Inhalatory Pharmaceutical Compositions in Form of Dry Powders, Solutions or Suspensions Obtained From the Same and Process for their Preparation. - United States Patent Application 20080226736, кл. 7 A61K 9/72, 2008 г.] и рассматривается в качестве прототипа. Эта композиция предназначена для ингаляционного введения как гидрофильных, так и гидрофобных ФАВ различных фармакологических групп и включает фармакологически активное вещество, представляющее собой соединение из группы веществ, действующих на центральную нервную систему, периферические нейромедиаторные процессы, сердечно-сосудистую систему, на свертывающую систему крови, на опухолевые процессы, на метаболические процессы, обладающие антибактериальной активностью, а также наполнитель, компонент увеличивающий биодоступность. Растворимый наполнитель присутствует в количестве более 10 и менее 100 мас.%; а весовое соотношение между поверхностно-активным веществом и ФАВ составляет от 0,01 до 10. Размер, по крайней мере, 50% частиц ингаляционной композиции составляет менее 5 мкм. В качестве растворимого наполнителя композиция включает сахар, предпочтительно лактозу, и аминокислоту, предпочтительно N-ацетилцистеин или карбоцистеин. В качестве компонента, увеличивающего биодоступность, содержит поверхностно-активные вещества из группы, включающей бензалкония хлорид, цетримид, глицерил монолаурат, полисорбаты, фосфолипиды, желчные соли. Способ ингаляционного введения указанной композиции предусматривает ингалирование композиции в виде порошка, суспензии или раствора с помощью представленных на рынке порошковых ингаляторов и небулайзеров различного типа.
Достоинством композиции является то, что она предусматривает ингалирование веществ как в жидком, так и твердом состоянии, что расширяет арсенал ФАВ, которые можно вводить ингаляционно. Использование композиции обеспечивает увеличение респирабельной фракции (<5 мкм) получаемого аэрозоля до 50-70%.
К основным недостаткам композиции относятся недостаточная биодоступность ФАВ при системном действии по причине большого диаметра аэрозольных частиц (до 5 мкм), применение органических растворителей для получения жидких аэрозолей, которые оказывают местное раздражающее действие, и необходимость проведения многократного ингалирования в течение суток для поддержания лечебного эффекта, что нередко сопровождается снижением приверженности к лечению, нерегулярному приему, самовольному отказу и, как следствие, уменьшению эффективности проводимой терапии.
Технической задачей изобретения является повышение эффективности медикаментозной терапии неотложных состояний и заболеваний, требующих постоянного курсового приема лекарственных препаратов, за счет повышения биодоступности и продолжительности действия фармакологически активных веществ при ингаляционном введении с целью их доставки в системный кровоток.
Технический результат достигается тем, что фармацевтическая композиция включает активный компонент, наполнитель, компонент, увеличивающий биодоступность, и дополнительно содержит биодеградируемый полимер, а в качестве компонента, увеличивающего биодоступность, включает циклодекстрин при следующем содержании ингредиентов, мас.%:
| активный компонент | 0,001-25,0; |
| циклодекстрин | 0,1-50,0; |
| биодеградируемый полимер | 30,0-50,0; |
| наполнитель | до 100,0. |
Заявляемая фармацевтическая композиция предназначена для введения веществ, действующих на центральную нервную систему, периферические нейромедиаторные процессы, сердечно-сосудистую систему, на свертывающую систему крови, на опухолевые процессы, на метаболические процессы, обладающие антибактериальной активностью. Для этого в качестве активного компонента заявляемая композиция содержит, по крайней мере, одно фармакологически активное вещество из группы, включающей соединения с противосудорожной активностью (диазепам, фенобарбитал, клоназепам), анальгетической активностью (фентанил, бупренорфин), противовоспалительной активностью (диклофенак, ацеклофенак, индометацин, кеторолак, ибупрофен, кетопрофен, мефенамовая кислота, пироксикам, мелоксикам, целекоксиб), противотревожной активностью (феназепам, альпрозалам, нозепам), противопаркинсонической активностью (циклодол, леводопа), противорвотной активностью (ондансетрон), реактиваторы холинэстеразы (дипироксим), соединения с антиангинальной активностью (нитроглицерин, молсидомин), с гипотензивной активностью (каптоприл, эналаприл, лизиноприл, амлодипин, нифедипин, лосартан), с противоопухолевой активностью (циклофосфамид, доксорубицин, метотрексат), антикоагулянты (гепарин, варфарин), гормоны (кальцитонин, инсулин, эстрадиол, тестостерон), соединения с антибактериальной активностью (амикацин, гентамицин, азитромицин, тобрамицин, кларитромицин, ципрофлоксацин, левофлоксацин, ломефлоксацин, гатифлоксацин, норфлоксацин, моксифлоксацин, рифампицин).
Фармацевтическая композиция в качестве циклодекстрина содержит, по крайней мере, одно соединение из группы: 2-гидроксипропил-β-циклодекстрин, гидроксипропил-γ-циклодекстрин, метил-β-циклодекстрин, 2,6-ди-О-метил-β-циклодекстрин, γ-циклодекстрин, 2-гидроксиэтил-β-циклодекстрин, бутил-β-циклодекстрин, ацетил-β-циклодекстрин, полиметилированный β-ЦД, сульфобутирилэфирное производное β-ЦД, мальтозил-β-ЦД.
Фармацевтическая композиция в качестве компонента, модулирующего продолжительность действия фармакологически активного вещества, содержит, по крайней мере, один биодеградируемый полимер из группы: полилактид-когликолиды, полилактиды, полигликолиды, поликапролактоны, полидиоксаноны, поликарбонаты, полиамиды, полиэфирамиды, полиангидриды, полиамидоэфиры, поликарбонаты, полиацетали полиуретанов, поли(яблочная кислота), полиамины, полиалкиленсукцинаты, полималеваты, хитозан, полиортоэфир, поливиниловый спирт, метилцеллюлоза, натрий карбоксиметилцеллюлоза, полисахариды, гидроксипропилметилцеллюлоза, гиалуроновая кислота, желатин, коллаген, фосфолипиды, холестерин, их сополимеры или их комбинации.
Фармацевтическая композиция в качестве наполнителя содержит, по крайней мере, одно соединение из группы: сахароза, лактоза, галактоза, фруктоза, глюкоза, мальтоза, целлюлоза, сукроза, маннитол.
Включение в состав композиции циклодекстрина позволяет равномерно распределить ФАВ в массе порошка для ингалирования твердого аэрозоля, обеспечивает образование жидких аэрозолей водонерасворимых ФАВ, повышает биодоступность для гидрофильных и гидрофобных соединений.
Включение в состав композиции указанных полимеров в качестве компонента, модулирующего продолжительность действия фармакологически активного вещества, обеспечивает возможность управления процессом высвобождения ФАВ из композиции в течение определенного времени, которое может составлять от 1 сут до нескольких недель. Таким образом достигается увеличение продолжительности действия ФАВ до 1 сут и более, что приводит к снижению кратности введения. Кроме того, благодаря управляемой биодеградации полимерных матриц поддерживается постоянная эффективная концентрация ФАВ в плазме крови и тканях-мишенях, что приводит к повышению эффективности терапии и снижению выраженности побочных эффектов.
Наполнитель представляет собой основу композиции и при доставке в альвеолы за счет выраженных осмотических свойств приводит к быстрому растворению композиции и высвобождению ФАВ и ее компонентов.
Для приготовления заявляемой фармацевтической композиции используют широко известные и доступные методы получения нано- и микроразмерных порошков, обеспечивающих иммобилизацию фармакологически активных веществ на полимерные матрицы. К таким методам относят метод со-конденсации (нанопреципитации) и метод распылительной сушки. Параметры метода приготовления, главным образом, зависят от растворимости активного компонента и полимера в полярных и органических растворителях. Алгоритм приготовления композиции при использовании гидрофильных фармакологически активного вещества и полимера включает: 1) растворение активного компонента, полимера и носителя в дистиллированной воде (раствор А); 2) растворение циклодекстрина в органическом растворителе, который смешивается с водой, в частности этанол, метанол, ацетон (раствор Б); 3) проведение со-конденсации активного компонента и полимера при покапельном добавлении раствора А в раствор Б при их соотношении 20-40:60-80 объемных % соответственно на фоне постоянного перемешивания с частотой 200-800 об/мин и температуре 40°С; 4) после проведения со-конденсации проведение распылительной сушки полученной суспензии. При использовании в качестве активного компонента и полимера гидрофобных веществ композицию изготавливают в результате выполнения следующего алгоритма действий: 1) растворение активного компонента, полимера в органическом растворителе, смешивающемся с водой, в частности ацетоне, этилацетате (раствор А); 2) растворение циклодекстрина и носителя в дистиллированной воде (раствор Б); 3) проведение со-конденсации активного компонента и полимера при покапельном добавлении раствора А в раствор Б при их соотношении 20-40:60-80 объемных % на фоне постоянного перемешивания с частотой 200-600 об/мин и температуре 40°С; 4) проведение распылительной сушки полученной суспензии.
В результате выполнения указанных алгоритмов получают сухой порошок фармацевтической композиции с размером частиц от 0,4 до 2 мкм. Полученную таким образом композицию упаковывают во флаконы или желатиновые капсулы.
Способ ингаляционного введения фармацевтической композиции предусматривает возможность введения композиции в виде твердого или жидкого аэрозоля. При ингаляционном введении композиции в виде твердого аэрозоля желатиновую капсулу, содержащую композицию, помещают в порошковый ингалятор (например, ингалятор «Аэролайзер», «ХендиХалер») и ингалируют через рот в альвеолы, при этом получают твердый аэрозоль композиции с масс-медианным аэродинамическим диаметром частиц аэрозоля от 0,8 до 2,0 мкм и степенью полидисперсности от 0,8 до 2,0 и ингалируют в альвеолы не менее 75% частиц твердого аэрозоля.
При ингаляционном введении композиции в виде жидкого аэрозоля предварительно готовят водный раствор композиции с рН от 3,0 до 8,0 и общим количеством ингредиентов, входящих в состав фармацевтической композиции менее 30 мас.%. Затем композицию в виде водного раствора помещают в ультразвуковой ингалятор с частотой ультразвука 2,4-2,8 мГц, получают жидкий аэрозоль непосредственно перед ингалированием и ингалируют через рот полученный жидкий аэрозоль в альвеолы. При таком способе ингалирования получают жидкий аэрозоль с масс-медианным аэродинамическим диаметром частиц от 0,8 до 2,0 мкм и степенью полидисперсности от 0,8 до 2,0 и ингалируют в альвеолы не менее 75% частиц жидкого аэрозоля.
Возможность достижения технической задачи изобретения поясняется следующими примерами.
Пример 1
Исследовали выраженность и скорость наступления противосудорожного эффекта диазепама в фармацевтической композиции для ингаляционного введения, в частном конкретном случае содержащей в качестве ФАВ диазепам в количестве 2,0 мас.%, циклодекстрин в количестве 40,0 мас.%, в качестве биодеградируемого полимера поливиниловый спирт в количестве 30,0 мас.% и в качестве наполнителя лактозу в количестве 28,0 мас.%. Опыты были проведены на крысах-самцах линии Wistar весом 180-220 г. Животные были разделены на 3 группы: контроль и две опытные группы. Животным опытных групп однократно ингаляционно вводили образец сравнения (прототип) и заявляемую фармацевтическую композицию соответственно. В качестве образца сравнения использовали композицию, содержащую диазепам в количестве 2,0 мас.%, твин-80 в количестве 2,0 мас.% и лактозу в количестве 96,0 мас.%. В группе контроля животным в/м вводили раствор диазепама в дозе 0,25 мг/кг из расчета 1 мл на 1 кг веса.
Исследование проводили на модели отравления крыс пентилентетразолом (PTZ). PTZ растворяли в 0,9% растворе NaCl и вводили в/м в объеме 1 мл/кг. Проводили определение среднелетальной дозы коразола на фоне предварительной аппликации диазепама. Аппликацию диазепама (в/м, либо ингаляционно) проводили за 5 мин, 10 мин, 15 мин, 30 мин, 60 мин, 360 мин и 24 ч до введения PTZ. Для определения среднелетальной дозы яда использовали не менее 4 точек (доз) по 4 животных на точку.
Для исследования эффектов образца сравнения и заявляемой композиции при ингаляционном введении крысам использовали ингаляционную камеру объемом 3 л, в которую ингалировали исследуемые композиции при помощи порошкового ингалятора «HandiHaler» и компрессора с объемной скоростью потока 80 л/мин. Размер частиц и степень полидисперсности получаемого твердого аэрозоля оценивали с помощью каскадного струйного импактора ИКС-10 (Россия). Для определения концентрации активного вещества в ингаляционной камере из камеры с помощью пробоотборника отбирали пробу, проводили экстракцию и измеряли содержание диазепама методом ВЭЖХ.
Масс-медианный аэродинамический диаметр частиц аэрозоля составил 1,3±0,24 мкм, степень полидисперсности 1,4±0,15.
Для исследований был выбран временной отрезок между 5 мин и 10 мин после начала ингаляции, когда средняя концентрация диазепама в камере составляла 0,21 мг/л.
Расчет поглощенной дозы проводили по формуле:
где D - поглощенная доза, мг/кг;
МОД - минутный объем дыхания крысы, л/кг* мин;
С - средняя концентрация токсиканта в камере за период ингаляции, мг/л;
ΔT - период ингаляции, мин.
При ингаляции прототипа или заявляемой композиции в течение 1 мин в данных условиях поглощенная доза диазепама составила 0,105 мг/кг.
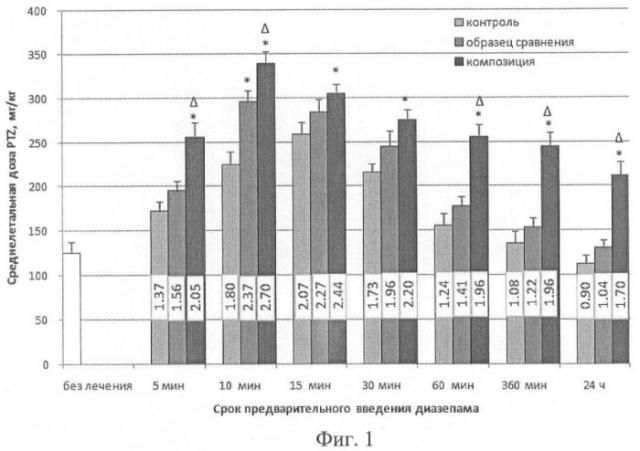
Результаты исследования противосудорожной активности диазепама на модели отравления PTZ у крыс (n=16) по изменению среднелетальной дозы яда, мг/кг, представлены на Фиг.1.
Показано, что при отравлении крыс PTZ предварительная в/м аппликация диазепама приводит к ослаблению токсичности конвульсанта. Через 15 мин после в/м введения диазепама регистрировали максимум защитного эффекта. Максимальное значение индекса защиты составляло 2,07.
Ингаляционное применение образца сравнения характеризовалось более высокой скоростью развития и большей выраженностью защитного эффекта по сравнению с в/м введением. Максимальное значение индекса защиты образца сравнения (2,37) фиксировали через 10 мин после ингаляции. В то же время по длительности защитного действия прототип практически не отличался от в/м введения.
Эффекты ингаляции композиции характеризовались высокой скоростью развития противосудорожного действия (снижение токсичности PTZ более чем в 2 раза отмечали уже через 5 мин после ингаляции, а максимум эффекта регистрировали через 10 мин). Также выявляли увеличение выраженности защитного эффекта (значение индекса защиты через 10 мин после ингаляции составило 2,7) и его длительности (достоверное (р≤0,05), различия в защитной эффективности по сравнению с в/м введением и ингаляцией образца сравнения сохранялись до 24 ч после аппликации).
Таким образом, композиция сочетала в себе свойства быстрого высвобождения активного начала (за счет действия компонента, увеличивающего проницаемость) и замедленного контролируемого высвобождения, обеспечивающего длительность поддержания терапевтической концентрации.
Пример 2
Исследовали выраженность и скорость наступления гипотензивного эффекта нифедипина в фармацевтической композиции для ингаляционного введения, в частном конкретном случае содержащей в качестве ФАВ нифедипин в количестве 5,0 мас.%, циклодекстрин в количестве 20,0 мас.%, в качестве биодеградируемого полимера желатин в количестве 30,0 мас.% и в качестве наполнителя лактозу в количестве 45,0 мас.%. Опыты проводили на бодрствующих нормотензивных крысах-самцах линии Wistar массой 250-300 г. Животные были разделены на 4 группы: интактная, контрольная и две опытные группы. Животным опытных групп однократно ингаляционно вводили образец сравнения (прототип) и фармацевтическую композицию соответственно. В качестве образца сравнения использовали композицию, содержащую нифедипин в количестве 3,0 мас.%, твин-80 в количестве 2,0 мас.% и лактозу в количестве 95,0 мас.%. Животным контрольной группы в/в в хвостовую вену вводили 0,01% раствор нифедипина в дозе 20 мкг/кг.
Под кетаминовым наркозом (100 мг/кг) крысам вживляли катетер в сонную артерию за сутки до начала эксперимента. Систолическое артериальное давление (САД) регистрировали прямым методом в спокойном состоянии животного. Для проведения ингаляции образца сравнения и композиции предварительно готовили их водные растворы с рН 7,4, в которых общее количество ингредиентов составило 10 мас. %.
Для исследования эффектов образца сравнения и композиции при ингаляционном введении крысам использовали ингаляционную камеру, в которой создавали концентрацию активного вещества при помощи ультразвукового ингалятора U-1 Med2000 (Италия) с частотой ультразвука 2,5 мГц. Размер частиц и степень полидисперсности получаемого аэрозоля оценивали с помощью каскадного струйного импактора ИКС-10 (Россия). Концентрацию активного вещества в ингаляционной камере определяли при помощи газовой хроматографии. Для исследований был выбран временной отрезок между 10 мин и 20 мин после начала ингаляции, когда средняя концентрация нифедипина в камере составляла 0,087 мг/л.
Масс-медианный аэродинамический диаметр частиц аэрозоля составил 1,43±0,17 мкм, степень полидисперсности 1,1±0,21.
Расчет поглощенной дозы проводили по формуле (1).
При ингаляции прототипа или изобретения в течение 1 мин в данных условиях поглощенная доза нифедипина составила 0,02 мг/кг.
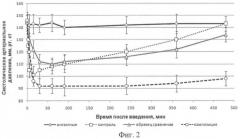
Результаты исследования динамики гипотензивного эффекта после в/в введения раствора 0,01% нифедипина, ингаляционного введения образца сравнения и заявляемой фармацевтической композиции, содержащей нифедипин, представлены на Фиг.2.
Показано, что в/в введение нифедипина в дозе 20 мкг/кг приводит к снижению САД до 100 мм рт.ст. в течение первых 5 мин с последующим постепенным восстановлением уровня САД к 240 мин наблюдения. Ингаляционное введение образца сравнения характеризовалось более медленным развитием гипотензивного эффекта. Достоверное снижение САД отмечали через 10 мин после начала ингаляции. Максимум гипотензивного действия регистрировали через 60 мин после аппликации прототипа. В промежутке времени от 60 до 240 мин после начала наблюдения образец сравнения и контрольный препарат (нифедипин, в/в) по выраженности гипотензивного действия не отличались.
Эффекты ингаляции композиции характеризовались более высокой, чем у образца сравнения, скоростью развития гипотензивного действия (достоверное снижение САД по сравнению с контролем отмечали уже через 5 мин после начала ингаляции, а максимум эффекта регистрировали через 15-30 мин). Выявляли увеличение длительности гипотензивного действия (достоверные различия в гипотензивной активности по сравнению с в/в введением и ингаляцией образца сравнения сохранялись до 480 мин после аппликации).
Пример 3
Исследовали фармакокинетику фенобарбитала в фармацевтической композиции, в частном конкретном случае содержащей в качестве ФАВ фенобарбитал натрия в количестве 12,5 мас.%, циклодекстрин в количестве 40,0 мас.%, в качестве компонента биодеградируемого полимера поливиниловый спирт в количестве 30,0 мас.% и в качестве наполнителя лактозу в количестве 17,5 мас.%. Опыты проводили на крысах-самцах линии Wistar массой 200-220 г. Животные были разделены на 3 группы: контрольную и две опытные группы. Животным опытных групп однократно ингаляционно вводили образец сравнения (прототип) и заявляемую фармацевтическую композицию соответственно. В качестве образца сравнения использовали композицию, содержащую фенобарбитал натрия в количестве 5,0 мас.%, твин-80 в количестве 3,0 мас.% и лактозу в количестве 92,0 мас.%. Животным контрольной группы в/м в дозе 12,5 мг/кг вводили фенобарбитал натрия в лекарственной форме для парентерального введения (Luminal® Sodium).
Изучение фармакокинетики у животных проводили по одинаковому алгоритму с применением стандартных экспериментальных и аналитических методик. Определяли концентрацию фенобарбитала в плазме крови крыс через 5 мин, 15 мин, 30 мин, 60 мин, 120 мин, 180 мин, 360 мин, 480 мин, 720 мин и 1140 мин после введения. Сроки отбора были выбраны таким образом, чтобы не менее трех точек приходились на фазу нарастания концентрации, не менее трех точек характеризовали ее вершину и не менее трех харастеризовали фазу снижения концентрации. Для характеристики фармако-кинетических свойств использовали показатели, которые были рассчитаны с использованием программы Thermo Kinetica 4.4.1 (Thermo Electron Corporation, США).
Для проведения ингаляции образца сравнения и композиции предварительно готовили их водные растворы с pH 8,0, в которых общее количество ингредиентов составило 10 мас.%.
Для ингалирования образца сравнения и композиции использовали ингаляционную камеру объемом 3 л, в которой создавали концентрацию активного вещества при помощи ультразвукового ингалятора U-1 Med2000 (Италия) с частотой ультразвука 2,5 мГц. Размер частиц и степень полидисперсности получаемого аэрозоля оценивали с помощью каскадного струйного импактора ИКС-10 (Россия). Концентрацию активного вещества в ингаляционной камере определяли при помощи методов газовой хроматографии. Для исследований был выбран временной отрезок между 10 мин и 20 мин, когда средняя концентрация фенобарбитала в камере составляла 10,9 мг/л.
Масс-медианный аэродинамический диаметр частиц аэрозоля составил 1,6±0,12 мкм, степень полидисперсности 1,3±0,14.
Расчет поглощенной дозы проводили по формуле (1). При ингаляции образца сравнения или композиции в течение 5 мин в данных условиях поглощенная доза фенобарбитала составила 12,5 мг/кг.
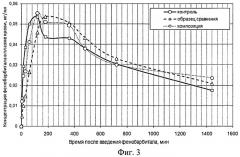
Результаты исследования концентрации фенобарбитала в плазме крови при в/м введении и при ингаляционном введении в составе образца сравнения и заявляемой фармацевтической композиции представлены на Фиг.3.
Установлено, что поступление в плазму крови активного вещества при в/м введении раствора фенобарбитала характеризовалось достижением максимальной концентрации в плазме крови через 60-120 мин после введения. Снижение концентрации происходило относительно быстро. Плато концентрации регистрировали в промежуток времени 18-360 мин после введения.
Образец сравнения при ингаляционной аппликации характеризовался наименьшей скоростью высвобождения фенобарбитала, о чем свидетельствовало низкое содержание барбитурата в плазме крови через 15-60 мин после введения. Максимум концентрации барбитурата регистрировали через 180 мин после аппликации образца сравнения, после чего следовала фаза плато длительностью до 8 ч с постепенным снижением к 24 ч.
Динамика изменения концентрации фенобарбитала в плазе крови при введении в составе композиции отличалась наступлением максимального пика концентрации в плазме через 120 мин после введения, при этом концентрация удерживалась в фазе плато до 6 ч после аппликации, затем через 12 ч регистрировали ее снижение.
Установлено, что через 1 сут после аппликации барбитурата в плазме крови сохранялась значительная концентрация фенобарбитала вне зависимости от лекарственной формы, в которой он был применен. Через 3-е сут после аппликации в плазме определяли следовые количества анализируемого препарата.
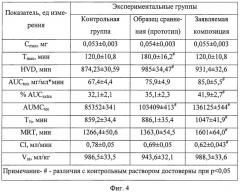
Проведенные исследования позволили рассчитать основные фармакокинетические показатели распределения фенобарбитала в плазме крови у животных экспериментальных групп (Фиг.4).
Анализ полученных фармакокинетических данных показал, что максимальная концентрация барбитурата в тест-ткани при введении образца сравнения не отличается от показателей контрольного образца. Абсорбция фенобарбитала после ингаляции образца сравнения была замедленной, время достижения максимальной концентрации барбитурата (Тmax) было наибольшим среди исследованных форм. В то же время элиминация барбитурата также была растянута во времени. Регистрировали достоверное увеличение показателей, характеризующих концентрацию и длительность сохранения фенобарбитала в тест-ткани.
При ингаляционном введении фенобарбитала в составе композиции время достижения максимальной концентрации фенобарбитала соответствовало показателю при в/м введении контрольного раствора (120 мин для обеих лекарственных форм). В то же время при ингаляционном введении композиции регистрировали увеличение периода полувыведения (Т1/2), времени удержания препарата в тест-ткани (MRT) и времени достижения половины максимальной концентрации (HVD) по сравнению с контрольным раствором, отмечали увеличение общей площади под фармакокинетическим графиком (AUCtot) и снижение клиренса (Сl) фенобарбитала.
Выявленные особенности фармакокинетики фенобарбитала при ингаляционном введении в составе композиции свидетельствуют о том, что в отличие от образца сравнения использование композиции обеспечивает более высокую биодоступность ФАВ, более быстрое достижение его максимальной концентрации в крови и более длительное сохранение терапевтической концентрации.
Пример 4
Проводили прогнозирование профиля осаждения частиц аэрозоля заявляемой композиции в зависимости от масс-медианного размера частиц и степени полидисперсности при ингалировании через рот человеку методом, предложенным Rudolf G. и соавт. [Rudolf, G. An empirical formula aerosol deposition in man for any particle size / G.Rudolf // J. aerosol. Sci. - 1986. - Vol.17, N.3. - P.350-355]. Для проведения расчетов использовали данные из примеров 1-3. Результаты определения прогнозируемого профиля осаждения частиц аэрозоля заявляемой фармацевтической композиции для человека представлены в Фиг.5.
В результате проведенных расчетов было установлено, что при применении заявляемой фармацевтической композиции и способа ее ингаляционного введения более 75% частиц получаемого аэрозоля достигают альвеолярной области легких.
Таким образом, фармацевтическая композиция и способ ее ингаляционного введения обеспечивают высокую биодоступность ФАВ и повышение продолжительности их фармакологического эффекта при ингаляционном введении.
1. Фармацевтическая композиция, выполненная в виде порошка, включающая активный компонент, выбранный из группы фармакологически активных веществ, действующих на центральную нервную систему, периферические нейромедиаторные процессы, сердечно-сосудистую систему, на свертывающую систему крови, на опухолевые процессы, на метаболические процессы, обладающих антибактериальной активностью, напо