Синтез и применение (-)-бета-элемена и (-)-бета-элеменала
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения (-)-бета-элеменала, к применению (-)-бета-элеменала в качестве противоопухолевого средства, а также к фармацевтической композиции и лекарственному средству на его основе. Способ заключается во взаимодействии смеси изомерных бета-элеменолов (2:1) с MnO2, активизированным в вакууме при 150°С, в качестве катализатора. При этом исходную смесь изомерных бета-элеменолов (2:1) получают при взаимодействии смеси диастереомерных эпоксидов (2:1) с диизопропиламином в присутствии n-BuLi. 4 н.п. ф-лы, 21 табл., 9 ил., 36 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области аналогов элемена и аналогов элеменала. В частности, данное изобретение относится к способам изготовления (-)-бета-элемена, (-)-бета-элеменала (метаболита (-)-бета-элемена в организме млекопитающих), (-)-бета-элеменола, фторида (-)-бета-элемена и их аналогов, которые могут использоваться в качестве нецитотоксичных противоопухолевых лечебных средств, и их влиянию на эффект резистентности ко множеству препаратов. Композиции и использование (-)-бета-элемена, (-)-бета-элеменала, (-)-бета-элеменола, фторида (-)-бета-элемена и их аналогов, а также производных продуктов для изготовления (-)-бета-элемена являются предметом защиты.
Данное изобретение можно использовать для лечения различных видов рака у млекопитающих, и ссылки на биохимию организма человека не должны рассматриваться как ограничительные, но только как иллюстративные. Термин больной или тело, или ссылки на организм человека используются для удобства, но включает всех больных млекопитающих и их тела.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
I. Противораковая эффективность смеси элеменов.
Смесь элеменов (смесь β (бета), λ (гамма), δ (дельта)-элеменов, где главной составляющей является форма бета) представляет собой смесь встречающихся в природе соединений, которые можно выделить из многих источников, включая: G.Cymbopogon winterianus Jowitt, цветы Zhangzhou Aglaia odorata, цветы Fuzhou Aglaia odorata, цветы Chunging Aglaia odorata, листья Chunging Aglia odorata, листья Zhangzhou Aglaia odorata, листья герани Yibin, листья герани Kunmin, Litchi chenensis cinnamomifblium, сухой лавр благородный, листья лимона, листья винограда Vitis vinifera, листья Clausena lansium, листья Fortunella margarita, Fortunella odorata, C. Wenyunjin Chen и Магнолию Зубольда. Впервые оно было выделено в 1954 году (Herout, V., Moti, О., Sorm, F., Coll. Czech. Chem. Commun 1954, 19, 990). В Китае начиная с 1983 года, смесь элеменов проходила изучение в качестве противоракового лекарственного средства. Лекарственный препарат элемена представляет собой смесь изомеров элемена, в которой главным компонентом является форма бета.
В 1993 году эмульсия из смеси элеменов (общее содержание в лекарственной композиции 0,5% β, λ, δ-элемена при чистоте 65%) была одобрена в КНР для лечения больных с плевральной жидкостью, обусловленной раком легкого. После одобрения в 1993 году эмульсия и смесь элеменов (0,5%, 65% чистоты) проявила свою эффективность вне утвержденных показаний при лечении более чем 10000 раковых больных, и его эффективность/безопасность документально отражена в китайской медицинской литературе. Его показания для лечения различных видов рака включают рак легких, рак печени, рак толстой кишки, рак молочной железы, рак простаты и др.
Терапевтические свойства элеменов еще недостаточно понятны. Действительно, неизвестно, является ли необходимым для проявления активности только один главный компонент или все главные компоненты; или второстепенный изомер, или энантиомер, одного из этих компонентов проявляет активность. В наших исследованиях эксперименты над животными показали, что (-)-бета-элемен 98% чистоты давал такой же клинический эффект, как и смесь элеменов (2% инъекционный раствор 85% чистоты).
В нашем изобретении мы впервые обнаружили, что основным активным компонентом являлся (-)-бета-элемен (C15H24, с молекулярным весом 200,4), который, кроме того, может проходить через гемато-энцефалический барьер и является идеальным средством для лечения пациентов с опухолью головного мозга.
II. Молекулярный механизм.
1) Механизм смеси элеменов (0,5% эмульсия, 65% чистоты)
По всей видимости, смесь элеменов (65% чистоты) подавляет рост/деление раковых клеток благодаря блокированию перехода клеточного цикла из фазы G0/G1 к фазе S (Xu, X.J. et al. Studies of β-Elemene's induction of human liver cancer cells, Chinese Journal of Clinical Oncology, July: 30-32, 1999). Согласно данным проточной цитометрии (элемен 20 мкг/мл клетки рака печени SMMC), элемен, очевидно, блокирует фазовый переход от G0/G1 к S.
Иммуноцитохимические данные указывают на то, что смесь элеменов вызывает экспрессию супрессора опухоли р53, который, возможно, приводит к замедлению фазового перехода от G0/G1 к S, необходимого для восстановления ДНК (Xu, X.J. et al. Studies of β-Elemene's induction of human liver cancer cells, Chinese Journal of Clinical Oncology, July: 30-32, 1999).
Смесь элеменов вызывала апоптоз клеток рака печени человека в зависимости от дозы и времени, согласно данным электронной микроскопии и фрагментации ДНК (Xu, X.J. et al. Studies of β-Elemene's induction of human liver cancer cells, Chinese Journal of Clinical Oncology, July: 30-32, 1999). Смесь элеменов вызывает также апоптоз и снижает выражение протеина Bсl-2 в клетках К562 лейкемии человека (Yuan. J et al. Elemene induces apoptosis and regulates expression of bcl-2 protein in human leukemia К562 cells, Zhongguo Yao Li Xue Bao (Chinese Pharmacology Journal), 20: 103-106, 1999). Смесь элеменов вызывает дифференциацию клеток опухоли легкого (Aip-937, A549, SPC-A1, мелкоклеточного рака легкого Н128) (Qian, J. et al. The studies of Elemene Emulsion on the Reversion of human lung cancer cells, Chinese Journal of Clinical Oncology, July: 7-10, 1999), клеток меланомы В16 (Qiang, j.Etal. The induction of Differentiation of В16 cells by Elemene Emulsion, Chinese Journal of Clinical Oncology, July: 16-19, 1999). Ультраструктура показала морфологические изменения, такие как уменьшение микроворсинок и пикнозис ядра.
Апоптоз, вызванный смесью элеменов, может происходить вследствие влияния на уровень экспрессии протеина: уменьшение Bcl-2 и C-myc и повышение р53. Bcl-2 замедляет апоптоз. В нормальных клетках печени белок Bcl-2 не выражен и высокий уровень его экспрессии может привести к выживанию клеток опухоли. C-myc представляет собой сигнальный протеин, предшествующий путям трансдукции сигнала. C-myc может вызывать деление клеток. Р53, супрессор признаков опухоли, особенно связан с апоптозом. Когда ДНК в клетках повреждается, уровень протеина р53 повышается, чтобы замедлить переход из фазы G0/G1 в фазу S для восстановления ДНК. Длительная задержка, вызванная повышенным уровнем р53, вызывает апоптоз.
В целом, смесь элеменов (65% чистоты) отличается от прочих цитотоксичных противораковых препаратов и обладает высоким IC50 (50% ингибиторной концентрации) для клеток опухоли (20-50 мкг/мл in vitro). Его клинический эффект по уменьшению размеров опухоли проявляется, очевидно, вследствие того, что данная смесь способна вызывать апоптоз, замедлить клеточный цикл и вызвать дифференциацию. Однако данный активный компонент был неизвестен до нашего открытия.
2) Механизм (-)-бета-элемена (98% чистоты)
Мы впервые установили, что активным компонентом смеси элеменов является (-)-бета-элемен. Также нами был проведен эксперимент in vitro с целью прояснить молекулярный механизм (-)-бета-элемена, обуславливающий его противораковое действие.
(-)-бета-элемен показал различную активность по подавлению роста клеток для линий клеток немелколеточного рака легких (NSCLC) и линий клеток легочной фибробластомы и бронхиального эпителия. Кроме того, было обнаружено, что (-)-бета-элемен останавливает клетки NSCLC на фазе G2-M клеточного цикла, причем эта остановка сопровождается снижением уровня циклина В1 и фосфор-Сdc2 (треозин-161) и повышением уровней p27kipl и фосфор-Сdc2 (теоксин-15). А также (-)-бета-элемен уменьшал выражение Cdc25C, который дефосфорилирует/активизирует Cdc2, но повышал выражение киназы контрольной точки, Chk2, которая фосфорилирует/инактивирует Cdc25C. Эти факты позволяют предположить, что влияние (-)-бета-элемена на задержание G2-M в клетках NSCLC осуществляется частично благодаря механизму, зависящему от Chk2. Кроме того, (-)-бета-элемен является спусковым механизмом апоптоза в клетках NSCLC. Результаты ясно показывают, что (-)-бета-элемен вызывал активность каспазы-3,-7,-9, снижал выражение Вс1-2, вызывал выделение цитохрома с и повышал уровни расщепленной каспазы-9 и поли(АDP-рибозыполимеразы) в клетках NSCLC. Эти данные указывают на то, что влияние (-)-бета-элемена на гибель клеток рака легких может осуществляться посредством митохондриального рилизинга или обусловленного цитохромом с пути апоптоза (Wang, G. et al. Antitumor effect of (-)-beta-elemene in non-small-cell lung cancer cells is mediated via induction of cell cycle arrest and apoptotic cell death. Cell. Mol. Life. Sci., 62 (2005), in press).
3) Преодоление бета-элеменом множественной лекарственной устойчивости ко многим лекарственным препаратам
Элемент не вызывает эффекта множественной лекарственной устойчивости (MDR) (Wang, B.C. et al. The Experimental Studies of Association between Elemene and Tumor Multidrug Resistance, Chinese Journal of Clinical Oncology, July: 10-13, 1999). Линия клеток BEL-7402 рака печени человека была выращена и был получен ее штамм, BEL-7402/DOX, обладающий устойчивостью к лекарствам. После шести недель введения элемена в количестве 48,9 мкг/мл устойчивые к лекарствам клетки BEL-7402 все еще не выражали MDR1 mRNA или Р-гликопротеин. Таким образом, устойчивые к лекарствам клетки опухоли оказываются чувствительными к элемену.
В связи с этим, изобретатели произвели полный синтез (-)-бета-элемена, и в результате этого разработали эффективные способы производства (-)-бета-элемена, а также его производных. Каждый их включенных способов является недостаточным для целей получения (-)-бета-элемена. В данном изобретении предлагаются также новые промежуточные продукты, полезные при синтезе (-)-бета-элемена и его аналогов, композиции, полученные из такого (-)-бета-элемена и его аналогов, очищенные соединения (-)-бета-элемена и аналогов, помимо способов использования (-)-бета-элемена и аналогов (-)-бета-элемена при лечении рака. Необходимо отметить, что предложенные в данном изобретении (-)-бета-элемен и его производные имеют исключительно высокие характеристики как противораковые средства in vivo, и они более эффективны для лечения рака и менее токсичны для нормальных клеток, чем основные химиотерапевтические средства, используемые в настоящее время, включая таксол, винбластин, адриамицин и камптотецин.
III. В области лечения опухоли головного мозга требуются новые лекарственные препараты
1) Общие сведения об опухолях головного мозга
Развитие новых эффективных способов лечения опухолей головного мозга отстает по сравнению с лечением других злокачественных новообразований, и при этом прогноз и уровень смертности аналогичен том, который был 30 лет назад. Злокачественные глиомы, самый распространенный подтип первичных опухолей головного мозга, представляют собой агрессивные, высокоинвазивные и разрушительные для нервной системы опухоли. Из них самым злокачественным проявлением является глиобластома, при которой медиана переживаемости составляет от 9 до 12 месяцев, несмотря на максимальные усилия при лечении.
В США ежегодно сообщается о 15000 случаев опухоли головного мозга. Поскольку более 50% этих опухолей представляют собой злокачественные глиомы, можно ожидать, что ежегодно возникает до 7500 новых случаев глиобластомы и анапластической астроцитомы. Опухоли головного мозга являются второй по значимости причиной смерти от рака среди детей в возрасте до 15 лет и молодых людей в возрасте до 34 лет. Опухоли головного мозга являются второй по скорости возрастания причиной смерти от рака среди людей старше 65 лет. Следовательно, имеется неотложная потребность разработать эффективные способы лечения глиобластомы с тем, чтобы продлить жизнь этих пациентов и улучшить качество их жизни.
2) Классификация опухолей головного мозга
Глиомы были определены патологически как опухоли, которые демонстрируют глиальную дифференциацию при гистологическом, иммуногистохимическом и ультраструктурном исследовании. Наиболее широко используемая схема классификации глиом и распределение их по группам была предложена Всемирной организацией здравоохранения (ВОЗ). Глиомы классифицируются согласно их предполагаемой линии дифференциации, т.е. демонстрируют ли они отличительные характеристики клеток астроцитарной глиомы, олигодендроглии или эпендимных клеток. Кроме того, они распределяются по шкале от I до IV группы, согласно степени их злокачественности, определяемой по различным гистологическим характеристикам. Опухоли первой группы являются биологически доброкачественными и могут быть излечены хирургическим путем, если это признается допустимым во время постановки диагноза; опухоли группы II проявляют низкую степень злокачественности и могут подвергаться длительным курсам лечения, но не могут быть излечены хирургическим путем; опухоли группы III являются злокачественными и приводят к смерти в течение нескольких лет; опухоли группы IV (глиобластома) проявляют высокую степень злокачественности, как правило, не поддаются химиотерапии и приводят к летальному исходу в течение 9-12 месяцев.
3) Современные способы лечения головного мозга
Основные способы лечения включают 1) хирургический, 2) лучевую терапию, 3) химиотерапию и 4) биологическую терапию. Поскольку головной мозг представляет серьезную проблему по доставке в него лекарств, химиотерапия обычно сочетается с применением блокиратора гематоэнцефалического барьера (например, маннита). Более 50% пациентов обращаются за альтернативными методами лечения в добавление к традиционным. В настоящее время в США химиотерапия включает следующие препараты:
1) Вещества, препятствующие развитию сосудов, которые прерывают снабжение опухолей кровью. Эти вещества проходят в настоящее время исследования и включают талидомит, TNP-470, тромбоцитный фактор 4 (PF4), интерферон и ангиостатин.
2) Дифференцирующие вещества представляют собой класс лекарственных препаратов, которые могут превращать незрелые делящиеся клетки опухоли в зрелые клетки, останавливая тем самым рост опухоли. К ним относятся, например, ретиноевая кислота, фенилацетат и бриостатин (bryostatin).
3) Иммунотерапевтические средства, предназначенные для повышения эффективности иммунной системы в поиске и разрушении раковых клеток. В настоящее время проводятся исследования нескольких инструментов, признанных полезными для стимулирования иммунной системы: интерферона, лимфоцитов и вакцин опухолей.
4) Другие способы лечения включают следующие лекарственные препараты: СРТ-11 (камитотецин), PCV (пенициллин), тамоксифен, талидомит, VP-16/эпотиазид и BCNU. Химиотерапия с помощью адъювантов, обычно BCNU (1,3-бис(2-хлорэтил)-1-нитрозомочевина), незначительно увеличивает выживаемость. Попытки ввести BCNU посредством внутриартериальных инъекций встретились с затруднениями, вызванными необратимой энцелофалопатией и ипсилатеральной потерей зрения, вызванной токсическим поражением сетчатки.
В настоящее время самым многообещающим препаратом для химиотерапии опухолей головного мозга является TEMODAR (темозоломид), который был одобрен Комиссией по пищевым продуктам и лекарствам (FDA) США в августе 1999 года для взрослых пациентов с рецидивирующей формой анапластической астроцитомы. TEMODAR (темозоломид) является первым химиотерапевтическим препаратом для орального приема, который, как было обнаружено, способен преодолеть гемато-энцефалический барьер. Этот цитотоксический алкилирующий препарат для орального применения является лидером в новом классе соединений, известных как имидазотетразины. Общий уровень реагирования опухоли на TEMODAR составил 22%, включая полное реагирование (9%) и частичное реагирование (13%). Полное реагирование (ПР) определяется как исчезновение опухоли, по крайней мере, на два последующих месяца по результатам измерения с помощью магниторезонансной томографии (МРТ). Уменьшение площади опухоли более чем на 50% на два месяца определяется как частичное реагирование (ЧР).
4) Эффективность использования смеси элеменов для лечения опухолей головного мозга
Элемен проходит через гематоэнцефалический барьер (ГЭБ) (Qian, J., New anti-tumor drug, Elemene's pharmacology and Clinical results, Chinese Journal of Clinical oncology, July: 1-3,1999). Элемен, помеченный изотопом 3H, вводился внутривенно или давался перорально экспериментальным животным. Радиоактивность была обнаружена в мозге животных.
Смесь элеменов для инъекций (2% инъекционный раствор, 85% чистоты) рассматривается Комиссией по пищевым продуктам и лекарствам КНР на предмет одобрения для лечения пациентов с первичными и вторичными опухолями головного мозга. Данная формула уже прошла одобрение техническим советом по лекарствам в КНР. При проведенных в Китае клинических испытаниях испытывалась эта новая формула смеси элеменов (2% инъекционный раствор, 85% чистоты), в которой содержится один и тот же активный фармацевтический ингредиент (АФИ), но различные неактивные компоненты, предназначенные для стабилизации элемена. При испытаниях на 61 пациенте смесь элеменов (2% инъекционный раствор, 85% чистоты) показала лучшие результаты, чем имеющиеся на рынке препараты (включая TEMODAR, BCNU and CCNU), при лечении больных с опухолью головного мозга, при этом в данной группе пациентов эффект уменьшения опухоли составил 35-40% (ПР+ЧР). Препарат TEMODAR имеет уровень ПР+ЧР около 20%. ПР обозначает полное реагирование, т.е. уменьшение размера опухоли после лечения до неопределяемого; ЧР обозначает частичное реагирование, т.е. уменьшение размера более чем на 50% по сравнению с размером опухоли до лечения. Самое продолжительное время переживания пациента с глиобластомой составило 62 месяца после лечения смесью элемена (2% инъекционный раствор, 85% чистоты).
IV. Бета-элеменал как метаболит бета-элемена
Как показано в статье Li, Z. et al, Даляньсая группа изучала метаболиты бета-элемена (98% чистоты, главным образом, бета-элемен) в желчи крыс. После внутривенной инъекции бета-элемена (98% чистоты) в дозе 100 мг/кг метаболит из крысиной желчи извлекался при помощи эфира. Для анализа метаболита в крысиной желчи после внутривенной инъекции бета-элемента использовались масс-спектрометрия, ядерный магнитный резонанс, инфракрасная спектрометрия и ультразвуковая спектрометрия. По результатам ядерного магнитного резонанса было высказано предложение, что метил углерода №11, соединяясь с углеродом №10 метаболита в крысиной желчи был окислен до альдегида. Молекулярный вес метаболита равнялся 218, что было определено при помощи масс-спектрометрии. Инфракрасная спектрометрия и ультрафиолетовая спектрометрия подтвердили, что в метаболите имелся альдегид. Было высказано предположение, что структура метаболита в крысиной желчи является производной от бета-элемена, возможно, бета-элеменала. Таким образом, очевидно, что биотрансформация бета-элемена существует in vivo.
Однако, в указанных выше публикациях авторы не указывали на то, какой именно стереоэнантиомер элеменала был обнаружен. И, кроме того, они не изучали активность и использование элеменала.
Согласно нашим данным, полученным при экспериментах над животными, бета-элемен, помеченный тритием, и его производные и/или его метаболиты могут проходить через гематоэнцефалический барьер (ГЭБ). Но не производились точные эксперименты, чтобы понять, проходит ли через ГЭБ сам бета-элемен или его производные или его метаболиты или их комбинация. Таким образом, остается неизвестным, каким образом действует элемен при лечении опухолей головного мозга.
V. Множественная лекарственная устойчивость, вызываемая традиционными химиотерапевтическими препаратами
1) Действие традиционных химиотерапевтических препаратов
Цисплатин, 5-FU, таксол и производные таксола являются традиционными эффективными химиотерапевтическими препаратами, но их полезные качества ухудшаются вследствие вызываемой ими множественной лекарственной устойчивости и их потенциальной цитотоксичности.
Цисплатин является хорошо изученным противораковым препаратом. Впервые Цисплатин был синтезирован в 1845 г., но его цитотоксические характеристики не были описаны до 1965 г. Был проведен эксперимент, чтобы выяснить, будет ли электрический ток подавлять репродукцию бактерий E.coli. По результатам эксперимента был сделан вывод, что продукты электролиза платинового электрода являются причиной подавления. Цисплатин проходил клинические испытания в 1971 г. Цисплатин представляет собой неорганический комплекс, образованный атомом платины, окруженным атомами хлорида и аммиака в цис-положении горизонтальной плоскости. С точки зрения внутриклеточных процессов вода замещает хлорид и образует платиновые комплексы с высокой реакционной способностью. Эти комплексы подавляют ДНК благодаря ковалентным связям, приводящим к образованию поперечных межмолекулярных связей внутри цепочек ДНК, между цепочками ДНК и в белках ДНК. Экспериментальные и клинические данные говорят о том, что Цисплатин повышает эффективность лучевой терапии. По результатам ранних исследований предполагалось, что Цисплатин является неспецифическим препаратом относительно фазы клеточного цикла, но недавние исследования показали его комплексное и изменяющееся воздействие на клеточный цикл.
Цисплатин используется, главным образом, против рака мочевого пузыря, рака яичников и рака семенников. Среди других локализаций рака лечение Цисплатином может включать такие виды рака, как рак коры надпочечников, опухоли головного мозга, рак молочной железы, рак шейки матки, внутриматочный рак, рак желудочно-кишечного тракта, герминома, гинекологическая саркома, рак головы и шеи, гепатобластома, злокачественная меланома, нейробластома, неходжкинская лимфома, остеосаркома и рак щитовидной железы.
Оба, таксол и 5-FU, являются эффективными противораковыми препаратами, но они вызывают эффект множественной лекарственной устойчивости. Таксол впервые был открыт вначале прошлого века, но клинические испытания этого препарата начались в 1983 г. Таксол воздействует на контрольную точку митоза в клеточном цикле. Таксол используется, главным образом, при лечении рака молочной железы, рака яичника, рака головы и шеи и рака легких. 5-FU был разработан в 1957 г. на основе результатов наблюдений, показывающих, что клетки опухоли используют урацил спаренных оснований для синтеза ДНК эффективнее, чем нормальные клетки микоза тонкого кишечника. Именно фторированный пиримидин метаболизируется внутриклеточно до своей активной формы фтордеоксиуридина монофосфата (FdUMP). Активная форма подавляет синтез ДНК благодаря подавлению нормальной выработки тимидина. 5-FU является специфическим для фаз клеточного цикла (S-фаза). 5-FU, используется, главным образом, для лечения рака молочной железы, рака толстой и прямой кишки, рака желудка и рака печени. Менее распространенные области применения 5-FU включают актинический кератоз, рак мочевого пузыря, рак шейки матки, внутриматочный рак, рак головы и шеи, немелкоклеточный рак легких, рак яичников, рак поджелудочной железы и рак простаты.
2) Явление множественной лекарственной устойчивости у раковых клеток
Явление множественной лекарственной устойчивости у раковых клеток является одной из главных причин неудачи при применении многих химиотерапевтических препаратов. После воздействия на раковые клетки химиотерапевтическим препаратом А, эти раковые клетки становятся не только устойчивыми к препарату А, но также устойчивыми к препаратам с отличной от препарата А химической структурой, функцией и механизмом подавления. В настоящее время считается, что избыточное выражение гликопротеина Р170 на клеточной мембране является одной из главных причин возникновения множественной лекарственной устойчивости. Гликопротеин Р170 представляет собой насос, зависящий от энергии. Р170 выкачивает лекарственные препараты из клеток с тем, чтобы клетки могли понизить концентрацию лекарственного препарата внутри клетки, что называется явлением множественной лекарственной устойчивости. К настоящему времени ученые открыли много препаратов, противодействующих явлению устойчивости, которые можно сгруппировать следующим образом: 1) блокираторы каналов кальция, 2) ингибиторы кальмодулина, 3) стероиды и гормоны, 4) иммуномодуляторы, 5) антибиотики. Перечисленные выше препараты, противодействующие устойчивости, показали свою эффективность в экспериментах in vitro, но оказались слишком токсичными для испытаний на людях.
Цисплатин вызывает экспрессию Р-гликопротеина. Согласно отчету Yang et al's р-гликопротеин выражался в линии клеток рака яичников после воздействия на них Цисплатина (Yang, X, and Page, M, P-glycoprotein expression in ovarian cancer cell line following treatment with cisplatin, Oncol. Res. 1995, 7(12): 619-24). Линия SKOV3 клеток рака яичников человека выращивалась в течение четырех месяцев в присутствии увеличивающихся концентраций Цисплатина (25-100 мкг/мл). В ходе эксперимента в клетках наблюдались значительные морфологические изменения, включая уменьшение размеров клеток, исчезновение клеточных выступов и склеивание. Это сопровождалось появлением р-гликопротеина на клеточной мембране. Новая клетка, обозначенная SKOV3/CIS, приобрела устойчивость к классическим лекарственным препаратам, вызывающим устойчивость, таким как доксорубицин, таксол, и actinomycine D. Верапамил повышал чувствительность SKOV3/CIS к доксорубицину (в 260 раз), что согласуется с предложенным механизмом влияния р-гликопротеина на устойчивость к лекарственным препаратам, но он не усиливал цитотоксичность цисплатина в клетках SKOV3/CIS.
Было показано, что некоторые лекарственные препараты снижают вызываемый цисплатином эффект множественной лекарственной устойчивости. В литературе отмечается, что SDZ PSC 833, полусинтетический ундекапептид, являющийся производным от циклоспорина D, представляет собой один из наиболее мощных и известных ингибиторов Р-гликопротеина, транспортера множества лекарств (Baekelandt, M et al.. Phase I/II trial of cisplatin and doxorubicin with SDZ PSC 833 in patients with refractory ovarian cancer, Proc. Annu. Meet. Am. Soc. Clin. Oncol 1997; 16:
A757). Отбирались больные с гистологически установленным раком яичника, если они имели клинически установленное заболевание, определяемое либо как стабильное заболевание после не менее чем трех циклов, либо как прогрессирующее заболевание после не менее чем двух циклов, при этом проводилось лечение комбинацией цисплатина и антрациклина. Затем лечение было продолжено цисплатином в дозе 50 мг/м2 и доксорубицином с добавлением PSC. Максимальная переносимая доза доксорубицина была определена равной 35 мг/м2 с PSC. При внутривенном введении SDZ PSC 833 вместе с цисплатинами и доксорубицином клиницистами наблюдалась сильная реакция у пациентов, прошедших тяжелый курс предварительного лечения с прогрессирующим заболеванием, и приемлемая токсичность.
Применение препаратов, препятствующих возникновению множественной лекарственной устойчивости, является принципиальным методом, который побеждает клиническую устойчивость к лекарственным препаратам и усиливает эффективность химиотерапии. Хотя за прошедшие два десятилетия было обнаружено много противодействующих соединений, клиническое применение этих препаратов ограничено вследствие их высокой токсичности и наличия побочного действия.
Мы являемся первыми изобретателями, которые обнаружили, что (-)-бета-элемен может противодействовать явлению множественной лекарственной устойчивости, вызываемому цисплатином, 5-FU или таксолом (или производными таксола). (-)-бета-элемен или его аналоги можно использовать как препарат для сочетанной терапии вместе с цисплатином, 5-FU или таксолом (или производными таксола), поскольку он представляет собой нецитотоксичный противораковый препарат. Клинические испытания продемонстрировали, что смесь бета-элемена (главным активным ингредиентом является (-)-бета-элемен) не оказывала отрицательного действия на сердце, печень или почки и не оказывала подавляющего действия на костный мозг.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Во всех следующих параграфах (-)-бета-элеменал, (-)-бета-элеменол и (-)-бета-элемен-фторид являются аналогами (-)-бета-элемена.
1) Одной из целей данного изобретения является создание способов приготовления (-)-бета-элемена и его аналогов, используемых в качестве противораковых терапевтических средств.
2) Еще одной целью данного изобретения является создание различных соединений, используемых в качестве промежуточных продуктов при приготовлении (-)-бета-элемена, а также его аналогов.
3) Еще одной целью данного изобретения является создание способов синтеза для приготовления подобных промежуточных продуктов.
4) Еще одной целью данного изобретения является создание рецептур, которые можно использовать при лечении пациентов, страдающих от рака, включающих любые аналоги (-)-бета-элемена, которые можно получить согласно способам приготовления, предложенным в данном изобретении, возможно, в сочетании с фармацевтическими носителями.
5) Еще одной целью данного изобретения является создание способов лечения больных, страдающих от рака, используя любой из аналогов (-)-бета-элемена, который можно получить согласно способам приготовления, предложенным в данном изобретении, возможно, в сочетании фармацевтическими носителями.
6) Еще одной целью данного изобретения является использование (-)-бета-элемена и его аналогов в сочетанной терапии рака различных локализаций совместно с цисплатином или таксолом (или его производными) или 5-FU. (-)-бета-элемен и его аналоги являются эффективными не только в качестве средства противодействия множественной лекарственной устойчивости в раковых клетках, как in vitro, так и in vivo, но также была установлена их активность как вспомогательных чувствительных препаратов, которые проявляют большую цитотоксичность по отношению к клеткам со множественной лекарственной устойчивостью, чем к нормальным клеткам, и их синергистическое действие, проявляющееся в их большей активности в сочетании с другими цитотоксичными препаратами, такими как цисплатин, чем при их индивидуальном применении при тех же концентрациях, (-)-бета-элемен или его аналоги могут снизить IC50 цисплатина или таксол (или его аналогов), или 5-FU, необходимую для подавления роста опухоли в линиях раковых клеток, и они могут снизить дозу цисплатина или таксола (или его аналогов), назначаемую раковым больным, и, тем самым, снизить побочное действие этих цитотоксичных препаратов.
(-)-бета-элеменал, метаболит (-)-бета-элеменала, является более мощным противораковым средством, чем (-)-бета-элемен
Авторы данного изобретения однозначно осуществили синтез (-)-бета-элеменала и в результате этого разработали эффективные способы получения (-)-бета-элеменала, а также его аналогов. В данном изобретении также предлагается новая функция (-)-бета-элеменала и его аналогов. Неожиданными оказались обнаруженные возможности применения, (-)-бета-элеменал оказался обладающим более мощной противораковой активностью, чем (-)-бета-элемен. Кроме того, (-)-бета-элеменал, представляющий собой метаболит (-)-бета-элемена, потенциально может иметь более длительный период полувыведения из организма человека и, тем самым, упростить схему дозировки лекарственного препарата.
Другие аналоги (-)-бета-элемена
Авторы данного изобретения провели синтез (-)-бета-элеменола и в результате этого разработали эффективный способ получения (-)-бета-элеменола, а также его аналогов, (-)-бета-элеменол более растворим, чем (-)-бета-элемен, что дает ему потенциальные преимущества. В качестве противоракового средства (-)-бета-элеменол является таким же мощным препаратом, как и (-)-бета-элемен.
Авторы данного изобретения также осуществили синтез (-)-бета-элемена-фторида, нового соединения, и в результате этого разработали эффективный способ получения (-)-бета-элемена-фторида, а также его аналогов, (-)-бета-элемен-фторид (имеющий в своем составе радиоактивный фтор-18) является соединением, которое возможно использовать для получения рентгеновских изображений, например мозга, и в качестве терапевтического средства при лучевой терапии. В качестве противоракового средства (-)-бета-элемен-фторид является таким же мощным препаратом, как и (-)-бета-элемен.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
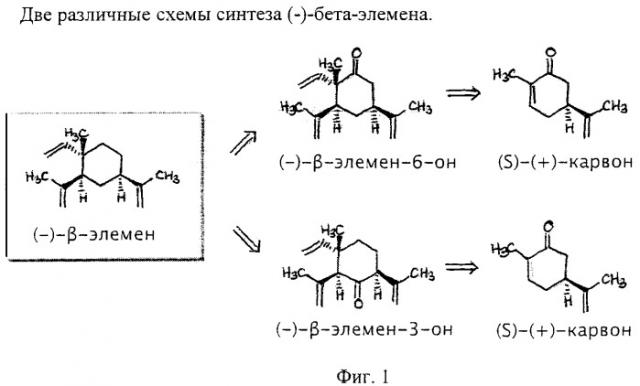
Фиг.1 - две различных схемы синтеза (-)-бета-элемена.
Фиг.2 - предлагаемые в заявке структуры, подобные элемену, или их производные.
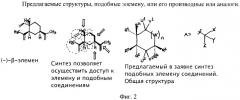
Фиг.3 - подробное описание двух новых путей синтеза (-)-бета-элемена из (S)-(+)-Carvone (Карвона).
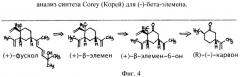
Фиг.4 - анализ синтеза Corey (Корей) для (-)-бета-элемена.
Фиг.5 - приготовление производного элемена (+)-Fuscol из (R)-(-)-Carvone.
Фиг.6 - структуры десяти синтезированных производных (-)-бета-элемена.
Фиг.7 - химические структуры β, γ, δ - элемена.
Фиг.8 - химические структуры трех аналогов (-)-бета-элемена.
Фиг.9 - предлагаемые в заявке структуры-аналоги элеменола, элеменала и элемена-фторида.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1) Предлагаемые в заявке пути синтеза и рецептуры (-)-бета-элемена и его аналогов
Авторы данного изобретения утверждают об обнаружении неожиданного эффективного, безопасного и не вызывающего множественной лекарственной устойчивости, нетоксичного действия и возможности широкого применения (-)-бета-элемена в качестве противовирусного, противомикробного, антибиотического и особенно в качестве противоракового химиотерапевтического средства; кроме того, предлагаются (-)- структуры-аналоги бета-элемена, а также способы получения указанных структур и способы получения (-)-бета-элемена. Также предлагается использование (-)-бета-элемена и аналогов (-)-бета-элемена в чистом виде или в сочетании в качестве противовирусного, противомикробного и противоракового средства.
Синтез (-)-бета-элемена
Интересно отметить, что (-)-бета-элемен не был до настоящего времени синтезирован в энантиомерно чистой форме. Энантиомерная чистота является критической для правильной оценки лекарственного препарата. Например, энантиомеры Thalidimide (Талидимида) могут быть либо высокоэффективными лекарствами, либо ужасно уродующими тератогенами, в зависимости от энантиомера. Основные результаты наших последних исследований (-)-бета-элемена, сформулированные отдельно или совместно с другими, позволили авторам изобретения предложить синтез (-)-бета-элемена и аналогов (-)-бета-элемена. Ниже представлены четыре плана синтеза.
Часть 1: Во-первых, предлагаются два новых синтеза (-)-бета-элемена и широкого спектра подобных (-)-бета-элемену соединений из (S)-(+)-карвона (Carvone). Предлагается следующее:
A) Начиная с (S)-(+)-Carvone, производное соединение SC-1 (-)-бета-элемена может быть легко получено путем реакции присоединения со звеном 2-пропенила, например, посредством купрата лития-ди-2-пропенила (реагент Гильмана) и захвата энолата, например, посредством триэтилсилилхлорида, чтобы образовать силилэноловый эфир. Превращение SC-1 в SC-2 делает возможным образование (-)-бета-элемена-6-один в результате короткой последовательности следующим образом: окисление энолового эфира SC-1 до энола SC-2 [используя палладий II]. Последующая реакция присоединения конъюгата 1,4 с гидридом, проводимая, например, с медным реагентом, с последующим захватом метилйодида образует α,α-диметилкетон. Активация связей С-Н в экваториальном метиле (при использовании, например, оксима, полученного из кетона) может сопровождаться дальнейшим окислением полученного в результате этого спирта до альдегида, за которым следует олефинация, дающая (-)-бета-элемен-6-один. В качестве окислителя в связи С-Н может использоваться, например, палладий (0) или платина (II). Превращение (-)-бета-элемена-6-один в (-)-бета-элемен может быть осуществлено путем реакции восстановления (например, гидразином, гидроксидом калия, теплом - реакция восстановления Вольфа-Кишнера).
B) Второй путь с использованием (S)-(+)-Карвона также обрисован в общих чертах, и он подобен описанному выше плану А, но, однако, этот второй путь обеспечивает доступ к некоторым другим молекулам, подобным (-)-бета-элемену: избирательное окисление (S)-(+)-Карвона в позиции 3 [используя нумерацию (-)-бета-элемена], с последующей подходящей защитой, в том случае, если она необходима, даст SC-3 (в данном примере защита 3-гидроксила дается в виде триэтилсилилэфира). Следуя тем же путем, что и в описанном выше способе (A), SC-4 можно легко получить путем реакции присоединения конъюгата со звеном 2-пропенил, например, посредством купрата лития-ди-2-пропенила (реагент Гильмана) и захвата энолата в виде энолового эфира (например, с триэтил силил хлоридом), как показано. Превращение этого аддукта в (-)-бета-элемен-3-один можно кратко описать следующим образом: Окисление SC-4 до энона можно осуществить, используя, например, палладий (II); за ним следует реакция присоединения конъюгата 1,4 с гидридом (проводимая, например, с медным реагентом), с последующим захватом метилйодида образует α,α-диметилкетон. Активация связи С-Н в экваториальном метиле при использовании оксима, полученного из кетона, сопровождается окислением до альдегида и последующей олефинацией этого альдегида. Оставшийся карбонил можно удалить посредством реакции восстановления. Удаление триэтилсилилэфира с целью получения алкоголя и по