Способ получения транс-урокановой кислоты
Иллюстрации
Показать всеНастоящее изобретение относится к области органической химии, в частности к способу получения транс-урокановой кислоты, который заключается в обрабатывании D-глюкозы водным аммиаком и формалином при мольном соотношении D-глюкоза : водный аммиак : формалин, равном 1:24:2,7, в воде в присутствии основного карбоната меди при температуре 85-90°С в течение 3 часов с образованием (1S,2S,3S)-1-(1Н-имидазол-4-ил)-бутан-1,2,3,4-тетраола, выделяемого в виде гидрохлорида. Последующее периодатное расщепление в воде полученного (1S,2S,3S)-1-(1Н-имидазол-4-ил)-бутан-1,2,3,4-тетраола при комнатной температуре превращает его в 1Н-имидазол-4-карбальдегид, конденсация которого в уксусном ангидриде в присутствии безводного ацетата калия при температуре 120°С в течение 2 часов приводит к образованию транс-урокановой кислоты с последующим выделением ее из реакционной массы. Технический результат: разработан новый способ получения транс-урокановой кислоты, основанный на использовании недорогих и легкодоступных исходных реагентов.
Реферат
Изобретение относится к органической химии, конкретно к способу получения транс-урокановой кислоты [(2Е)-3-(1Н-имидазол-4-ил)проп-2-еновой кислоты] (1).
транс-Урокановая кислота (1), обладающая разносторонней биологической активностью, образуется в живых организмах в результате метаболизма гистидина. Она проявляет иммуносупрессивный эффект, что находит применение в хирургических операциях по трансплантации органов и тканей, а также лечении кожных заболеваний. Кроме того, при изучении E/Z фотоизомеризации урокановой кислоты выявлена возможность использования ее для защиты кожи человека от солнечной радиации [S.Franceschi, V.Andrew, N.Viguerie, М.Riviere, A.Lattes, A.Moisand, Synthesis and aggregation behaviour of two-headed surfactants containing the urocanic acid moiety // New J.Chem., 1998, p.225]. N-Метилпроизводное транс-урокановой кислоты входит в структуру дитерпеновых эфиров элеутеробина и саркодиктиинов - метаболитов мягких кораллов Eleutherobia sp и Sarcodictyon roseum, обладающих таксолоподобным механизмом цитотоксического действия [R. Britton, М. Roberge, Н. Berisch, J. Andersen, Antimitotic diterpenoids from Erythropodium caribaeorum: isolation artifacts and putative biosynthetic intermediates // Tet. Lett. 2001, v.42, р.2953]. В ходе создания комбинаторной библиотеки саркодиктиинов установлено, что удаление остатка N-метилурокановой кислоты или замена ее имидазольного цикла на оксазольный, тиазольный или фенильный критически сказывается на цитотоксической активности соединения [К.С.Nicolaou, N.Winssinger, D.Vourlomis, Т.Ohshima, S.Kim, J. Pfefferkorn, Solid and Solution Phase Synthesis and Biological Evaluation of Combinatorial Sarcodictyin Libraries // J.Am. Chem. Soc. 1998, v.l20, p.l0814].
Результаты изобретения могут быть использованы в химии, биологии и медицине.
Известные способы получения транс-урокановой кислоты основаны на дезаминировании гистидина.
транс-Урокановую кислоту получают как под действием микроорганизмов [Т. Shibatani, N. Nishimura, К. Nabe, Т. Kakimoto, I. Chibata. Enzymatic Production of Urocanic Acid by Achromobacter liquidum II Appl. Microbiol. 1974, v.27 №4, p.688], так и химически.
Химический синтез транс-урокановой кислоты [S. Edlbacher, Н. Bidder // Z. Physiol. Chem. 1942, v.276, p.126 (The preparation of urocanic acid, CA. 1943, v.37, p.5404)] осуществлен путем диазотирования гистидина в концентрированной соляной кислоте в присутствии NaNO2 и дегидрохлорированием полученной α-хлор-β-имидазолпропионовой кислоты триэтиламином в автоклаве при 60°С. Общий выход составил 31% в пересчете на дигидрат транс-урокановой кислоты.
Другой более эффективный метод получения транс-урокановой кислоты [Ш.М.Салихов, О.Ю.Краснослободцева, Б.Т. Шарипов, Ф.А. Валеев, Г.А. Толстиков, Синтез N-метилуроканатов гидроксипроизводных изоцемброла // Химия природных соединений, 2007, №2 с.119] основан на расщепление гистидина по Гофману. В данном случае обработка гистидина четырехкратным избытком йодистого метила с КОН в метаноле с последующим элиминированием триметиламина приводит к транс-урокановой кислоте в две стадии с общим выходом 66%.
Основными недостатками рассмотренных способов является высокая стоимость исходного гистидина. Кроме этого во втором случае для дезаминирования используется большое количество дорогого йодистого метила.
Задача, на решение которой направлено заявленное изобретение, заключается в удешевлении процесса получения транс-урокановой кислоты.
В заявленном способе получения транс-урокановой кислоты в качестве исходного соединения используется легкодоступная D-глюкоза. Результатом изобретения является получение транс-урокановой кислоты в три стадии с общим выходом 23% исходя из D-глюкозы.
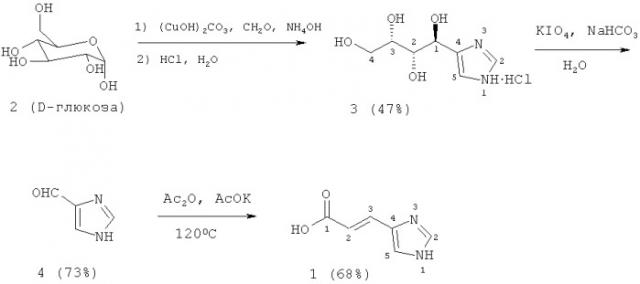
Сущность изобретения состоит в следующем. Необходимое имидазольное кольцо с заместителем в 4-положении формируется обработкой D-глюкозы (2) водным аммиаком и формалином при мольном соотношении компонентов 1:24:2,7 в воде при 85-90°С в присутствии основного карбоната меди в течение 3 часов, в результате которого с выходом 47% образуется (1S,2S,3S)-1-(1Н-имидазол-4-ил)бутан-1,2,3,4-тетраол в виде гидрохлорида. Полученный тетраол (3) периодатным расщеплением с KIO4 (или NalO4) в воде при комнатной температуре переводится в 1Н-имидазол-4-карбальдегид (4). Дальнейшая конденсация альдегида (4) при 120°С в уксусном ангидриде в присутствии безводного ацетата калия в течение 2 часов приводит к транс-урокановой кислоте с общим выходом 23%.
Таким образом, предлагаемый способ позволяет удешевить процесс получения транс-урокановой кислоты за счет использования недорогих и легкодоступных реагентов.
Сущность изобретения подтверждается следующими примерами.
Пример 1. Синтез (1S,2S,3S)-1-(1Н-имидазол-4-ил)бутан-1,2,3,4-тетраол гидрохлорида (3).
В колбу помещают 222 г (1 моль) основной углекислой меди и приливают к ней 1500 мл воды и 800 мл (12 молей) 28%-ного водного аммиака. Затем к содержимому колбы прибавляют 100 мл (1.35 моля) 37%-ного формалина и 90 г (0.5 моля) глюкозы (2). Раствор тщательно перемешивают и нагревают в течение 3 часов при 90°С. Смесь охлаждают, после чего отфильтровывают оливково-бурый осадок плохо растворимого медного комплекса производных имидазола. Осадок промывают холодной водой, суспендируют еще во влажном состоянии в 1250 мл разбавленной соляной кислоты (1:4). Затем при перемешивании через суспензию пропускают сероводород до полного осаждения меди. После этого осадок отфильтровывают и промывают горячей водой. Выпавшие кристаллы после упаривания светло-бурого раствора заливают 200 мл этанола и взвесь кипятят 1 час, затем осадок отфильтровывают, промывают 100 мл горячего этанола. Оставшийся осадок растворяют в минимальном количестве воды, добавляют трехкратное количество изопропанола, раствор нагревают до полного растворения осадка. При охлаждении раствора до -5°С выпадают кристаллы, которые отфильтровывают, промывают изопропанолом.
Маточный раствор упаривают и еще два раза повторяют кристаллизацию. После трех кристаллизаций выделяют 53 г (47%) солянокислого 1,2,3,4-тетрагидроксибутилимидазола (3).
Rf 0.30 (ЕtOН:Н2O, 5:1). Т.пл. 179-181°С. [α]D 20-18.6° (с 1.0, Н2O). ИК-спектр (ν, cм-1): 3315, 3230, 3136, 2922, 2852, 1624, 1458, 1051, 623. Спектр ЯМР 1Н (D2O, δ, м.д.): 3.60-3.90 м (4Н, С2Н, С3Н, С4Н), 5.21 с (1Н, С1Н), 7.45 с (1Н, С5Н), 8.69 с (1Н, С2Н). Спектр ЯМР 13С (D20, δ, м.д.): 65.42 (С4), 66.42 (С1), 72.88 (С3), 74.96 (С2), 118.23 (С5), 135.76 (С2), 136.02 (С4). Масс-спектр: m/z 189 [М-С1]+. Найдено (%): С 37.62; Н 5.48; С1 15.65; N 12.49. C7H13ClN2O4. Вычислено (%): С 37.43; Н 5.83; С1 15.78; N 12.47.
Пример 2. Синтез 1H-имидазол-4-карбальдегида (4).
25 г (0.11 моль) солянокислого 1,2,3,4-тетрагидроксибутилимидазола (3) растворяют в 50 мл воды и при перемешивании постепенно добавляют 11 г (0.13 моль) NaHCO3, затем прибавляют 50 г (0.22 моль) KIO4. После этого реакционную смесь перемешивают 1 час, добавляют 50 мл изопропанола и осадок неорганических солей отфильтровывают, промывают 50 мл горячего изопропанола. Для отделения неорганических солей маточный раствор упаривают, полученный осадок разбавляют 50 мл изопропанола, осадок отфильтровывают и промывают 30 мл горячего изопропанола. Маточный раствор упаривают, оставшийся осадок растворяют в 10-15 мл горячего метанола, при охлаждении раствора до -10°С выпадают кристаллы 4-(5)-карбальдегидимидазола (4). Далее маточный раствор упаривают, остаток хроматографируют на SiO2 (EtOAc), выделяют дополнительно небольшое количество альдегида. Выход 7.8 г (73%).
Rf 0.30 (СНСl3:EtOН, 10:1). Т. пл. 170-172°С. ИК-спектр (ν, cм-1): 3118, 2940, 2729, 1699, 1635, 1450, 1373, 1101, 775. Спектр ЯМР 1Н (DMFA-D7, δ, м.д.): 8.05 с (1Н, С2Н), 8.09 с (1Н, C5H), 9.88 с (1Н, СНО). Спектр ЯМР 13С (DMFA-D7, δ, м.д.): 124.60 (С2), 134.48 (С5), 135.00 (С4), 179.31 (СНО). Масс-спектр: m/z 97 [МН]+. Найдено (%): С 50.15; Н 4.15; N 29.27. C4H4N2O. Вычислено (%): С 50.0; Н 4.20; N 29.15.
Пример 3. Синтез транс-урокановой кислоты [(2Е)-3-(1Н-имидазол-4-ил)проп-2-еновой кислоты] (1).
Смесь 7.8 г (0.081 моль) альдегида (4), 7.9 г (0.081 моль) безводного ацетата калия и 40 мл (0.42 моль) уксусного ангидрида нагревают при температуре 120°С 2 часа. Затем добавляют 100 мл воды и раствор кипятят 1 час, упаривают, откачивают при пониженном давлении до исчезновения запаха уксусной кислоты. Полученный осадок растворяют в 15 мл воды и 7.15 мл (8.4 г) 35%-ного НСl, раствор охлаждают до 0°С. Выпавшие кристаллы транс-урокановой кислоты отфильтровывают, промывают холодной водой. Для дальнейшего выделения транс-урокановой кислоты маточный раствор упаривают, остаток разбавляют 15 мл раствора 20%-ного водного NH3 в EtOН (1:7), нерастворимый осадок неорганических солей отфильтровывают и промывают раствором 20%-ного водного NH3 в EtOН (1:7). Маточный раствор упаривают, добавляют воду и повторно упаривают, откачивают при пониженном давлении до исчезновения запаха аммиака. Оставшийся осадок транс-урокановой кислоты перекристаллизовывают из воды. транс-Урокановую кислоту после первой и второй кристаллизации объединяют. Дополнительную очистку проводят повторной кристаллизацией из воды. Полученную транс-уроктовую кислоту (1) откачивают при пониженном давлении 3 час при температуре 90-100°С. Выход 7.62 г (68%).
Rf 0.30 (EtOH). Т. пл. 210-212°С, разл. ИК-спектр (ν, cм-1): 3311, 3143, 2940, 2609, 1653, 1456, 1340, 1114, 974. Спектр ЯМР 1Н (D2O, δ, м.д.): 6.50 д (1Н, J 16.14 Гц, С2Н), 7.46 д (1Н, J 16.14 Гц, С3Н), 7.71 с (1Н, С2Н), 8.74 с (1Н, С5Н). Масс-спектр: m/z 139 [МН]+. Найдено (%): С 52.08; Н 4.42; N 20.16. С6 H6N2О2. Вычислено (%): С 52.17; Н 4.38; N 20.28.
Способ получения транс-урокановой кислоты, отличающийся тем, что D-глюкозу обрабатывают водным аммиаком и формалином при мольном соотношении D-глюкоза: водный аммиак: формалин, равном 1:24:2,7, в воде в присутствии основного карбоната меди при температуре 85-90°С в течение 3 ч с образованием (1S,2S,3S)-1-(1Н-имидазол-4-ил)-бутан-1,2,3,4-тетраола, выделяемого в виде гидрохлорида, который периодатным расщеплением в воде при комнатной температуре превращают в 1Н-имидазол-4-карбальдегид, конденсация которого в уксусном ангидриде в присутствии безводного ацетата калия при температуре 120°С в течение 2 ч приводит к образованию транс-урокановой кислоты с последующим выделением ее из реакционной массы.