Способ диагностики лейкоза крупного рогатого скота методом полимеразной цепной реакции
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, молекулярно-генетической диагностики вирусных болезней животных, молекулярной биологии. Способ заключается в том, что используют прямой и обратный олигонуклеотидные праймеры для выявления фрагмента гена pol провируса лейкоза крупного рогатого скота. Проводят электрофоретическое определение размера амплифицируемого фрагмента нуклеотидной последовательности. В качестве праймеров используют олигонуклеотиды следующей структуры - PF2: 5'-TGA ACG GAC AAA TGG ACT GCT C-3'; РR2: 5'-CCG АСА GAG AGC GAG GAG AG-3', у которых отсутствуют самокоплементарные участки внутри каждого праймера и между прямым и обратным, температура отжига составляет 66°С для обоих олигонуклеотидов, GC состав - 50% для РF2 и 65% для PR2, и которые фланкируют область консервативного гена роl вируса лейкоза крупного рогатого скота размером 438 пар нуклеотидов. Данный способ является достоверным, высокочувствительным и высокоспецифичным способом, при помощи которого можно выявить фрагмент провирусной ДНК ВЛКРС в биологическом материале. 3 ил., 3 табл., 3 пр.
Реферат
Предлагаемое изобретение относится к области биотехнологии, молекулярно-генетической диагностики вирусных болезней животных, научных исследований в ветеринарии, молекулярной биологии.
Лейкоз крупного рогатого скота - хроническое инфекционное заболевание, вызываемое вирусом лейкоза (ВЛКРС, bovine leukemia virus, BLV), который преимущественно поражает В лимфоциты. Лейкоз крупного рогатого скота наносит существенный экономический ущерб животноводческим хозяйствам РФ.
В комплексе мероприятий по оздоровлению стад от лейкоза ведущее место принадлежит диагностике. Проблема своевременной эффективной диагностики лейкоза КРС в связи с крайне неблагополучной эпизоотической ситуацией по данному заболеванию и отсутствием средств специфической профилактики стоит по-прежнему остро.
В настоящее время все более актуальным становится совершенствование методов прижизненной диагностики лейкоза КРС. Традиционные методы серологической диагностики ВЛКРС (РИД, ИФА) не всегда позволяют выявить инфицированных животных, что способствует использованию в комплексе с серологическими методами молекулярно-генетических, в частности ПЦР, с помощью которой возможно раннее выявление ВЛКРС в неблагополучных по лейкозу хозяйствах, а также повышение эффективности и сокращение сроков противолейкозных мероприятий.
Полимеразная цепная реакция (ПЦР), которая является прямым высокочувствительным и высокоспецифичным молекулярно-биологическим методом, способна идентифицировать фрагменты провирусной ДНК ВЛКРС в лимфоцитах периферической крови животного. Принцип метода заключается в многократном увеличении (копировании) определенного участка ДНК выявляемого микроорганизма с помощью фермента ДНК-полимеразы. Специфические праймеры комплементарны последовательностям ДНК провируса, ограничивающим нужный участок ДНК, и ориентированы таким образом - прямой и обратный, что элонгация новой цепи ДНК проходит только между ними. Основными параметрами эффективного прохождения реакции амплификации, обеспечивающими специфичность и чувствительность, являются правильный выбор области генома идентифицируемого агента, структура и температурный режим отжига олигонуклеотидных праймеров.
Известен способ дифференциации варианта tax гена вируса лейкоза крупного рогатого скота, заключающийся в проведении ПЦР с использованием праймеров, способных выявить полную последовательность tax гена ВЛКРС с целью дальнейшего выявления мутаций в кодируемых этим геном аминокислотных последовательностях и определения вариантов tax гена ВЛКРС. В частности, используются следующие праймеры:
Btax2:5′ AG TCT AGA GCT GAC GTC TCT GTC TG 3′
Btax3:5′ ACC TCG AGA TGG CAA GTG TTG TTG GTT GG 3′ [1].
Известен также способ выявления ДНК провируса лейкоза КРС методами ПЦР в режиме реального времени (RT-PCR) и «гнездовой» ПЦР (nested-PCR). Предлагаемые праймеры, комплементарные области гена роl имеют следующую структуру:
Pol (outer, sense) 5′-ATGTTATCAAGCCCTGGCTGC-3′
Pol (outer, antisense) 5′-CTTGGTTGTCAGTCAAGG-3′
Pol (nested, sense) 5′-CTACCTTGCAGATCTCATC-3′
Pol (nested, antisense) 5′-GCTTGTCGAAGCTCTGCAATGC-3′
Для использования метода ПЦР в режиме реального времени необходимо вместе с праймерами - Pol (nested, sense) 5′-CTACCTTGCAGATCTCATC-3′ и Pol (nested, antisense) 5′-GCTTGTCGAAGCTCTGCAATGC-3′ добавлять в реакционную смесь дополнительно синтезированный зонд - Pol (molecular beacon) 5′ (FAM)-CGAGCACACCCACTACCCGCCGGCCGCTCG-dabcyl-3′ с флюоресцентной меткой, благодаря чему и происходит детекция сигнала флюоресценции при применении данного метода. Объем реакционной смеси составляет 100 мкл.
Метод «гнездовой» ПЦР (nested-PCR) подразумевает использование двух пар праймеров (всего четыре праймера) - outer (I раунд) и nested (II раунд). Объем реакционной смеси составляет 50 мкл.
При постановке ПЦР обоими методами размер продукта на выходе составляет 202 п.н. [2]. Прототип.
Известные способы выявления ДНК провируса ВЛКРС: в аналоге не обеспечивали детекцию участка консервативного гена pol провируса ВЛКРС; в прототипе при использовании метода ПЦР в режиме реального времени дополнительно необходим зонд с флюоресцентной меткой, а при использовании метода «гнездовой» ПЦР необходима вторая пара праймеров для обнаружения искомого участка.
В задачу исследований входило разработать эффективный способ обнаружения ДНК провируса лейкоза крупного рогатого скота методом ПЦР путем конструирования двух специфических олигонуклеотидных праймеров.
Поставленную задачу достигают благодаря тому, что для постановки ПЦР в качестве праймеров используют два олигонуклеотида следующей структуры: РF2: 5′-TGA ACG GAC ААА TGG ACT GCT С-3′, РR2: 5′-CCG АСА GAG AGC GAG GAG AG-3′, имеющих следующие характеристики: комплементарность выбранной области гена pol ВЛКРС, отсутствие самокоплементарных участков внутри каждого праймера и между прямым и обратным, температура отжига составляет 66°С для обоих нуклеотидов, GC состав - 50% для РF2 и 65% для РR2, фланкирующих фрагмент консервативного гена pol ВЛКРС размером 438 пар нуклеотидов.
Предложенный способ заключается в следующем: с помощью компьютерной программы Vector NTI 11 (Invitrogen, США) на основании информации, представленной в базах данных Интернет ресурсов EMBL (Германия), GenBank (США), по генотипам ВЛКРС выбирают референс последовательность - К02120. Для оценки вариабельности и поиска консервативных участков нуклеотидные последовательности различных изолятов выравнивают друг относительно друга с помощью алгоритма ClastalW Multi Sequence Alignment. Поиск в данной последовательности наиболее консервативной области (участка гена pol) и подбор последовательностей, ограничивающих эту область, производят с использованием компьютерной программы BioEdit. Проверка качества, термодинамический анализ выбранных праймеров выполняют с помощью программы OLIGO DNA/RNA primer analysis software, v.4.0. Праймеры проверяют на отсутствие гомологии с последовательностями других вирусов и генома человека программой BLAST с помощью web-ресурса Национального центра биотехнологической информации (NCBI) (http://blast.ncbi.nlm.nih.gov/). Оценка специфичности сконструированных праймеров подтвердила гомологичность выбранных праймеров РF2 и PR2 с нуклеотидной последовательностью гена pol и отсутствие значимой гомологии с нуклеотидными последовательностями других видов вирусов. Расчетная длина специфического фрагмента составляла 438 пар нуклеотидов.
При проведении компьютерного анализа выбранных праймеров к участку консервативного провирусного гена pol провируса лейкоза КРС учитывают следующие критерии подбора:
- степень гомологии праймеров. Для специфической амплификации участка гена оба праймера (прямой и обратный) должны быть комплементарны выбранной области;
- отсутствие самокоплементарных участков внутри праймеров и комплементарности друг другу, чтобы не допускать возникновения очень устойчивых вторичных структур праймера и так называемых «димеров» праймеров, которые блокируют реакцию или приводят к появлению неспецифической амплификации;
- близость значений температуры плавления праймеров. Разница температур отжига прямого и обратного праймеров составляет 3-5°С. Выбор оптимальной температуры отжига праймеров является ключевым параметром среди прочих, влияющих на прохождение реакции амплификации. Завышение Тотж приводит к отсутствию синтеза ампликона и, как следствие - ложноотрицательному результату ПЦР. Занижение Тотж увеличивает вероятность появления неспецифических продуктов амплификации, усложнения анализа результатов ПЦР и интерпретации их как ложноположительных.
На основании проведенного компьютерного анализа была подобрана пара праймеров: РF2: 5′-TGA ACG GAC AAA TGG ACT GCT С-3′, РR2: 5′-CCG АСА GAG AGC GAG GAG AG-3′ для детекции фрагмента гена pol длиной 438 п.н.
Характеристика разработанных праймеров приведена в Таблице 1.
Синтез разработанных олигонуклеотидных праймеров заказывается в коммерческом сервисном центре.
Пример 1. Амплификация специфических фрагментов ДНК провируса лейкоза КРС с помощью разработанных праймеров для диагностики лейкоза КРС.
В процессе проведения практических экспериментов подбирают оптимальные условия прохождения полимеразной цепной реакции, с использованием разработанных праймеров. Полимеразную цепную реакции проводят в объеме реакционной смеси - 25 мкл на 1 пробу ДНК. Состав реакционной смеси представлен в Таблице 2. Температурно-временной режим проведения реакции для амплификатора «Терцик» («ДНК-технология», Россия) представлен в Таблице 3.
В качестве положительного контроля прохождения полимеразной цепной реакции с использованием разработанных праймеров используют лиофилизированный препарат положительного контрольного антигена (АГ) ВЛ КРС. Препарат получен из вируса, накопленного в вируспродуцирующей культуре клеток почки эмбриона овцы (FLK) (американский штамм вируса - FLK-BLV). Предварительно препарат АГ был испытан в ПЦР анализе с помощью коммерческих наборов для детекции ДНК провируса лейкоза КРС отечественных производителей.
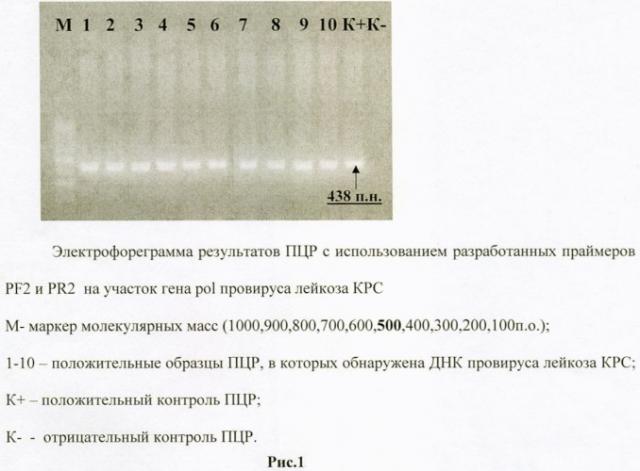
После проведения реакции амплификации продукты ПЦР анализируют методом электрофоретического разделения в 1,5% агарозном геле с добавлением бромистого этидия.
В процессе ПЦР получены продукты амплификации ДНК провируса лейкоза КРС длиной 438 п.н., что подтверждалось во всех экспериментах. Это свидетельствует о воспроизводимости результатов проведенных опытов. Электрофореграмма результатов полимеразной цепной реакции представлена на Рисунке 1. При учете результатов прохождения ПЦР в первую очередь оценивают контрольные образцы. В электрофоретической дорожке, соответствующей положительному контролю (К+), присутствовала светящаяся полоса. Ее электрофоретическая подвижность соответствовала длине ампликона 438 п.н. В электрофоретической дорожке, соответствующей отрицательному контролю (К-), такая полоса отсутствовала. Опытные пробы оценивают по наличию в соответствующей дорожке специфической полосы, которая располагалась на том же уровне, что и полоса в положительной контрольной пробе. В электрофоретических дорожках 1-9 присутствовала специфическая полоса на уровне полосы в дорожке К+, что свидетельствовало о наличии провирусной ДНК ВЛКРС.
Пример 2. Определение чувствительности реакции амплификации с использованием разработанных специфических олигонуклеотидных праймеров.
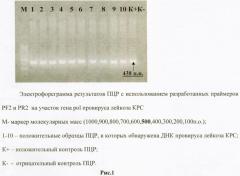
Анализировали пробы ДНК, выделенные из десятикратных разведений суспензии клеток FLK (вируспродуцирующая культура клеток почки эмбриона овцы (FLK), хронически инфицированная вирусом лейкоза КРС). Последним разведением, в котором обнаруживалась специфическая полоса на электрофореграмме, считается разведение 104, что составляет 1,8×104 коп/мл. Электрофореграмма результатов ПЦР представлена на Рисунке 2.
Пример 3. Определение специфичности реакции амплификации с использованием разработанных специфических олигонуклеотидных праймеров.
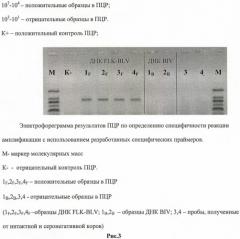
Специфичность проверяли на образцах провирусной ДНК FLK-BLV, выделенной из лиофилизированного препарата положительного контрольного АГ ВЛКРС, который получен из вируса, накопленного в вируспродуцирующей культуре клеток почки эмбриона овцы (FLK) (американский штамм ВЛКРС - FLK-BLV), положительных образцах, содержащих провирусную ДНК вируса иммунодефицита КРС (ВБИ, BIV), а также образцах от интактных и серонегативных коров. Положительный результат в ПЦР получали только с образцами ДНК, при отсутствии продукта амплификации с другими пробами. Электрофореграмма результатов ПЦР представлена на Рисунке 3.
Как видно из вышеописанных примеров, предложенный способ позволяет детектировать на ранних стадиях высококонсервативную область гена pol провируса лейкоза крупного рогатого скота. Выбор высококонсервативной области гена pol позволяет повысить чувствительность способа диагностики лейкоза КРС. Использование предлагаемых специфических праймеров дает возможность в дальнейшем определить первичную нуклеотидную последовательность полученных фрагментов ДНК методом автоматического секвенирования с применением этих же праймеров и для секвенирования.
Техническим результатом, на достижение которого направлено данное изобретение, является достоверный, высокочувствительный и высокоспецифичный способ выявления фрагмента провирусной ДНК ВЛКРС в биологическом материале в короткие сроки.
Предложенный способ апробирован с положительными результатами и регулярной воспроизводимостью этих результатов в 2010 году на 97 пробах ДНК, полученных из крови животных некоторых хозяйств Московской, Ростовской, Вологодской, Калужской, Тульской, Рязанской областей, республики Калмыкия, Алтайского края. Работу проводили на базе лаборатории лейкозологии ГНУ ВНИИЭВ им Я.Р.Коваленко совместно с ГНУ ВНИИВВиМ (г.Покров).
Предлагаемый способ может быть использован как в диагностике инфекционных заболеваний животных, так и в научных исследованиях для обнаружения генетического материала вируса лейкоза КРС методом полимеразной цепной реакции в пробах ДНК, выделенных из крови животных.
Источники информации
1. Патент - US 6646116 B1, 11.11.2003, C07/H 21/04.
2. Журнал - Journal of Veterinary Diagnostic Investigation (J Vet Diagn Invest). 2003, Vol.15, 72-76. USA.
Сущность изобретения поясняется таблицами и рисунками, в которых отображается следующая информация:
| Таблица 1 | ||||
| Характеристика разработанных праймеров для детекции ДНК провируса лейкоза КРС | ||||
| Название | 5′-3′ Последовательность | Тотж. °С /, GC состав, % / кол-во залипаний | Локализация в гене роl (К02120) | Длина продукта п.н. |
| РF2 | 5′-TGA ACG GAC AAA TGG ACT GCT С-3′ | 66/50/-- | 4470-4491 | 438 |
| PR2 | 5′-CCG АСА GAG AGC GAG GAG AG-3′ | 66/65/-- | 4888-4907 |
| Таблица 2 | |
| Состав реакционной смеси | |
| Компоненты | Объем на 1 реакцию (25 мкл), мкл |
| Буфер ПЦР (15 мМ MgCl) | 5 |
| дНТФ(10 мМ) | 1 |
| праймер РF2 (10 пмоль/мкл) | 1 |
| праймер РR2(10 пмоль/мкл) | 1 |
| Полимераза Taq (5 ед./мкл) | 0,2 |
| Вода (бидистиллированная) | 11,8 |
| Проба ДНК | 5 |
| Таблица 3 | |||
| Температурно-временной режим проведения ПЦР | |||
| Этапы | Температура, | Время | Кол-во |
| 1 | 95 | 3 минуты | 1 |
| 2 | 94 | 20 секунд | 35 |
| 62 | 30 секунд | ||
| 72 | 1 минута | ||
| 3 | 72 | 3 минуты | 1 |
| 4 | 10 | хранение |
Способ диагностики лейкоза крупного рогатого скота методом полимеразной цепной реакции, включающий прямой и обратный олигонуклеотидные праймеры для выявления фрагмента гена pol провируса лейкоза крупного рогатого скота с электрофоретическим определением размера амплифицируемого фрагмента нуклеотидной последовательности, отличающийся тем, что использует в качестве праймеров олигонуклеотиды следующей структуры - РF2: 5'-TGA ACG GAC ААА TGG ACT GCT С-3'; РR2: 5'-CCG АСА GAG AGC GAG GAG AG-3', которые имеют следующие характеристики: отсутствие самокоплементарных участков внутри каждого праймера и между прямым и обратным, температура отжига составляет 66°С для обоих олигонуклеотидов, GC состав - 50% для РF2 и 65% для РR2 и фланкируют область консервативного гена ро1 вируса лейкоза крупного рогатого скота размером 438 пар нуклеотидов высококонсервативного гена pol провируса лейкоза крупного рогатого скота.