Способ диагностики немелкоклеточного рака легких и набор для его осуществления
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована для диагностики немелкоклеточного рака легких. Для этого определяют уровень транскрипции гена RHOV в предположительно пораженной раком ткани человека и в прилегающей гистологически нормальной ткани. Повышенный уровень транскрипции гена RHOV в предположительно пораженной раком ткани человека по сравнению с ее уровнем в прилегающей гистологически нормальной ткани служит диагностическим признаком немелкоклеточного рака легких. Для осуществления полимеразной цепной реакции для определения уровня транскрипции гена RHOV может быть использован набор праймеров, имеющих последовательности SEQ ID NO:1 и 2. Изобретение позволяет с высокой достоверностью диагностировать немелкоклеточный рак легких, включая плоскоклеточный рак и аденокарциному, в том числе на самой ранней стадии прогрессии опухолевой трансформации. 2 н. и 10 з.п. ф-лы, 1 табл., 7 пр., 2 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности онкологии и молекулярной биологии, и может быть использовано для ранней диагностики немелкоклеточного рака легких, включая плоскоклеточный рак и аденокарциному.
Предшествующий уровень техники
Рак легких остается одной из основных причин смерти онкологических больных в мире. Смертность от рака легких превышает смертность от рака молочной железы, толстой кишки и простаты, вместе взятых [Jemal A., Siegel R., Ward E., Murray Т., Xu J., Smigal С., Thun M.J. 2006. Cancer statistics, 2006. CA Cancer J Clin. 56, 6-30]. В России показатели смертности от рака легких у мужчин составляют 68,2 случая на 100 тысяч населения, у женщин - 6,8 случая [Заридзе Д.Г. 2004. Эпидемиология и этиология злокачественных новообразований, стр.29-85 - в кн. Канцерогенез. / Под ред. Д.Г.Заридзе. - М.: Медицина]. Различают два основных вида рака легких (РЛ): мелкоклеточный (МРЛ) и немелкоклеточный (НМРЛ), составляющих соответственно 15-20 и 75-80%. К НМРЛ относят плоскоклеточный рак легких (ПРЛ), аденокарциному легких (АКЛ) и крупноклеточный рак. Среди разных форм рака легких по частоте встречаемости ПРЛ занимает первое место, АКЛ - второе.
Диагноз в половине случаев НМРЛ устанавливают на развернутой стадии опухолевого процесса, что делает малореальным радикальное излечение. Современные методы лечения повышают среднюю пятилетнюю продолжительность жизни больных НМРЛ не более чем на 15%. Этот показатель может быть существенно улучшен только с помощью разработки методов ранней диагностики.
Основными методами диагностики рака легких служат инструментальные - рентгеновские и эндоскопические. Используют также анализ мокроты на атипичные клетки, биопсию ткани легких, компьютерную томографию, флуоресцентную фиброскопию. Иммунологические методы диагностики находят пока ограниченное клиническое применение. Практическую значимость имеет определение опухолевых маркеров: СЕА (раковоэмбриональный антиген) - онкомаркер рака прямой кишки, но может использоваться в оценке рака легких; NSE (нейрон-специфическая энолаза) в ряде случаев используют в оценке состояния пациентов с раком легких; ТРА (тканевый полипептидный антиген) - фрагмент цитокератина, более специфичный маркер рака легких. Эти маркеры применяют для контроля лечения, выявления рецидивов, но не для диагностики РЛ на ранней стадии. Для диагностики НМРЛ широко используют маркеры SCC (антиген плоскоклеточной карциномы) и фрагмент цитокератина-19 (CYFRA 21.1) [Pastor A., Menendez R., Cremades M.J., Pastor V., Llopis R., Aznar J. 1997. Diagnostic value of SCC, СЕА and CYFRA 21.1 in lung cancer: a Bayesian analysis. Eur Respir J. 10, 603-609; Buccheri G., Torchio P., Ferrigno D. 2003. Clinical Equivalence of Two Cytokeratin Markers in Non-small Cell Lung Cancer. A Study of Tissue Polypeptide Antigen and Cytokeratin 19 Fragments. Chest. 124, 622-632], но они также малопригодны для ранней диагностики РЛ.
Диагностическими признаками злокачественной трансформации клеток могут служить также изменения генома в опухолевых клетках - точечные мутации в кодирующих и регуляторных участках генов, микросателлитная нестабильность, аллельные потери, изменение уровня транскрипции или трансляции генов, изменения характера метилирования промоторных участков генов и др. В отличие от белковых молекулярно-генетические маркеры обладают значительно большей чувствительностью. Рак легких сопровождается изменением функциональной активности многих генов. В числе перспективных потенциальных маркерных генов, вовлеченных в канцерогенез разных форм НМРЛ, можно рассматривать ген RHOV.
Ген RHOV [ras homolog gene family, member V]), кодирующий Rho ГТФазу Chp/Wrch2, содержит три экзона и у человека локализован на хромосоме 15q13.3 [Katoh, М., 2002. Molecular cloning and characterization of WRCH2 on human chromosome 15q15. Int J Oncol 20(5): 977-82]. ГТФаза Chp способна вызывать формирование ламеллиподий [Aronheim, A., Y.С.Broder, et al. 1998. Chp, a homologue of the GTPase Cdc42Hs, activates the JNK pathway and is implicated in reorganizing the actin cytoskeleton. Curr Biol 8(20): 1125-8; Aspenstrom, P., A. Fransson, et al. (2004). Rho GTPases have diverse effects on the organization of the actin filament system. Biochem J 377(Pt 2): 327-37], актин-богатых выпячиваний плазматической мембраны на лидирующем конце движущейся клетки, играющих важную роль в миграции и метастазировании опухолевых клеток. Одними из возможных эффекторов ГТФазы Chp являются серин-треониновые протеинкиназы Pak1 и Pak4. При этом было показано, что ГТФаза Chp способна активировать протеинкиназу Pak1 [Aspenstrom, P., A. Fransson, et al. (2004). Rho GTPases have diverse effects on the organization of the actin filament system. Biochem J 377(Pt 2): 327-37; Weisz Hubsman, M., N. Volinsky, et al. 2007. Autophosphorylation-dependent degradation of Paki, triggered by the Rho-family GTPase, Chp. Biochem J 404(3): 487-97]. Увеличение уровня экспрессии и/или уровня активности Pak киназ характерно для многих опухолей человека [Dummler, В., К. Ohshiro, et al. 2009. Pak protein kinases and their role in cancer. Cancer Metastasis Rev 28(1-2): 51-63]. При этом наиболее часто встречается увеличение экспрессии Pak1 и Pak4, в частности за счет амплификации соответствующих генов [Dummler, В., К. Ohshiro, et al. 2009. Pak protein kinases and their role in cancer. Cancer Metastasis Rev 28(1-2): 51-63]. Повышение уровня активности этих протеинкиназ приводит к увеличению подвижности клеток, резистентности к апоптозу и вызывает пролиферацию клеток вне зависимости от контакта с субстратом. Учитывая эти данные, можно предположить, что увеличение активности Chp в опухоли может сопровождаться увеличением активности Pak1.
Помимо опосредованного протеинкиназами Pak влияния на онкогенез, ген RHOV сам по себе обладает свойствами онкогена. Было показано, что экспрессия активной формы ГТФазы Chp в клетках линии фибробластов мыши NIH3T3 приводит к формированию вторичных очагов роста в конфлуэнтных культурах и вызывает формирование колоний клеток в мягком агаре [Chenette, E.J., A. Abo, et al. 2005. Critical and distinct roles of ammo- and carboxyl-terminal sequences in regulation of the biological activity of the Chp atypical Rho GTPase. J Biol Chem 280(14): 13784-92; Chenette, E.J., N.Y. Mitin, et al. (2006). Multiple sequence elements facilitate Chp Rho GTPase subcellular location, membrane association, and transforming activity. Mol Biol Cell 17(7): 3108-21], что отражает соответственно потерю контактного торможения роста и появление способности клеток к пролиферации независимо от контакта с субстратом. Эти процессы являются одними из характерных особенностей злокачественной трансформации клеток и позволяют рассматривать ген RHOV в качестве потенциального онкогена.
Механистически экспрессия RHOV может быть связана с активацией канонического Wnt-сигнального пути [Guemar, L., P. de Santa Barbara, et al. 2007. The small GTPase RhoV is an essential regulator of neural crest induction inXenopus. Dev Biol 310(1): 113-28]. В то же время аномальная активация Wnt-сигнального пути часто наблюдается в различных типах опухолей и вносит свой вклад в формирование и прогрессию опухолевого фенотипа, в частности, в случае опухолей легких [Mazieres J., Не В., You L., Xu Z., Jablons D.M. 2005. Wnt signaling in lung cancer. Cancer Lett. 222: 1-10; He В., You L., Uematsu K., Xu Z., Lee A.Y., Matsangou M., McCormick P., Jablons D.M. 2004. A monoclonal antibody against Wnt-1 induces apoptosis in human cancer cells. Neoplasia. 6: 7-14; You L., He В., Xu Z., Uematsu K., Mazieres J., Mikami I., Reguart N., Moody T.W., Kitajewski J., McCormick P., Jablons D.M. 2004. Inhibition of Wnt-2 -mediated signaling induces programmed cell death in non-small-cell lung cancer cells. Oncogene. 23: 6170-6174]. Вместе эти данные позволяют предположить, что аномальная активация Wnt-сигнального пути в опухолевых клетках может приводить к усиленной экспрессии RHOV в них.
Анализ экспрессии гена RHOV у человека не выявил транскрипта в легких [Katoh, M. 2002. Molecular cloning and characterization of WRCH2 on human chromosome 15q15. Int J Oncol 20(5): 977-82], однако у крысы экспрессия RhoV была отмечена в ткани легких [Aronheim, A., Y.С.Broder, et al. 1998. Chp, a homologue of the GTPase Cdc42Hs, activates the JNK pathway and is implicated in reorganizing the actin cytoskeleton. Curr Biol 8(20): 1125-8]. Усиленная экспресия гена RHOV обнаруживалась в ряде опухолевых клеточных линий, в том числе в клетках линии рака легких А549 [Katoh, M. 2002. Molecular cloning and characterization of WRCH2 on human chromosome 15q15. Int J Oncol 20(5): 977-82]. Анализ экспрессии гена RHOV в 66 образцах первичных опухолей человека различного происхождения по сравнению с прилежащей нормальной тканью выявил значительное усиление экспрессии гена RHOV лишь в 5 случаях [Katoh, M. 2002. Molecular cloning and characterization of WRCH2 on human chromosome 15q15. Int J Oncol 20(5): 977-82]. При этом выборка опухолей легкого в данном исследовании насчитывала лишь 3 образца, поэтому полученные данные не позволяют сделать какой-либо вывод об экспрессии гена RHOV в опухолях легких.
В качестве ближайшего аналога настоящего изобретения авторы предлагают рассмотреть патент РФ №2330285. Изобретение согласно патенту РФ №2330285 относится к способу диагностики немелкоклеточного рака легких на основании определения различия уровня транскрипции гена WIF1 в предположительно пораженной раком ткани человека и в прилегающей гистологически нормальной ткани.
В указанном патенте приведен обзор методов, позволяющих осуществить стадии способа согласно настоящему изобретению.
Так, в соответствии с указанным аналогом в качестве образцов для проведения анализа могут быть использованы биоптаты, пунктаты, в том числе материал, полученный при бронхоскопии с прямой биопсией (центральный рак легких) и трансторакальной (чрескожной) пункции опухоли (периферический рак).
Способы выделения тотальной РНК из образцов ткани млекопитающих хорошо известны специалистам и, как правило, включают следующие стадии: измельчение в жидком азоте образцов опухолевых и нормальных тканей, лизис клеток, выделение РНК и ее очистку, проверку качества РНК электрофорезом в 1%-ном агарозном геле в присутствии красителя бромида этидия или в денатурирующем полиакриламидном геле, а также спектрофотометрическое определение количества РНК. Гомогенизацию кусочков ткани можно проводить вручную, растирая пестиком в керамической ступке, или с помощью механических гомогенизаторов, например, Omni Mixer или Micro-Dismembrator U фирмы Sartorius (Германия). Для выделения РНК могут быть использованы различные протоколы, широко известные специалистам в данной области. В классических методах выделения РНК используют растворяющие белки сильные хаотропные агенты, такие как гуанидинхлорид и гуанидинизотиоцианат, и последовательные экстракции фенолом и хлороформом для денатурации и удаления белков [Sambrook J., Fritsch E.F., Maniatis Т., Molecular Cloning. A laboratory Manual. 2nd Edition ed. 1989, Cold Spring Harbour: CSHL Press]. Широко используют также метод с использованием реагента Trizol [GIBCO/Life Technologies]. Для предотвращения разрушения РНК РНКазами могут быть использованы ингибиторы, такие как игибитор RNAsin плацентарного или рекомбинантного происхождения или, например, ванадил-рибозидный комплекс - неспецифический ингибитор РНКаз широкого спектра действия.
Быстрое и качественное выделение РНК можно проводить с использованием ряда коммерчески доступных наборов ("Выделение тотальной РНК YellowSolve" (фирма Клоноген, Санкт-Петербург); RNeasy kits (Qiagen, Германия); SV Total RNA Isolation System (Promega, США) и т.д.).
Также в патенте РФ №2330285 описано проведение реакции обратной транскрипции: синтеза кДНК на матрице РНК, выделенной из образцов ткани легких, и ее перевод в двуцепочечную форму. Процесс обратной транскрипции, в результате которой на РНК-матрице синтезируют одноцепочечную цепь ДНК, при необходимости, с достройкой второй цепи, позволяет от нестабильных молекул РНК перейти к более стабильным молекулам ДНК и амплифицировать с помощью полимеразной цепной реакции до количеств, необходимых для детекции. ОТ-ПЦР-амплификация позволяет использовать очень малые количества исходной РНК (на уровне 1 нанограмма), а следовательно, и количество исследуемой легочной ткани, из которой выделяют РНК.
Реакцию обратной транскрипции можно проводить с использованием ряда коммерчески доступных препаратов обратных транскриптаз, таких как обратная транскриптаза вируса лейкоза мышей Молони (M-MLV), вируса миелобластоза птиц (AMV), PowerScript (точечная мутация M-MLV-RT), C.Therm Polymerase и др., с помощью которых можно получать продукты амплификации длиной до нескольких тысяч и даже несколько десятков тысяч пар нуклеотидов (т.п.н.). Может быть использована термостабильная ДНК-полимераза Thermus thermophilus (Tth), обладающая обратной транскриптазной активностью в присутствии ионов Mn2+.
Для обратной транскрипции могут быть использованы различные праймеры, например:
1. Олиго(dT)n-содержащие праймеры, которые связываются с эндогенным полиА-хвостом на 3'-конце мРНК (число n обычно равно 12-18, но может достигать и большей величины). Эти праймеры наиболее часто используют для получения полноразмерных кДНК. К олиго(dT)-последовательности часто добавляют на 3'-конце нуклеотиды А, С или G, чтобы «заякорить» праймер на границу транскрипта и поли-А тракта.
2. Случайные гексануклеотидные праймеры (статистические затравки), которые гибридизуются с РНК в многочисленных участках. При обратной транскрипции с этими праймерами получают короткие кДНК. Случайные гексамеры используют для преодоления трудностей, связанных с прочной вторичной структурой РНК, они более эффективны при обратной транскрипции 5'-областей мРНК.
3. Гексамеры или другие короткие олигонуклеотиды (10-12 нуклеотидов) случайного состава могут быть также использованы в комбинации с олиго(dT)-содержащими праймерами.
4. Специфические олигонуклеотидные праймеры используют для транскрипции участка мРНК, представляющего интерес для исследования. Эти праймеры успешно применяют для диагностических целей.
Анализ транскрипции генов можно проводить, используя одноцепочечную или двуцепочечную и амплифицированную кДНК. Для синтеза второй цепи и ее амплификации наиболее часто используют специфичные праймеры. Коммерчески доступны наборы для синтеза кДНК, основанные на применении различных обратных транскриптаз и различных праймеров для затравки. Для получения кДНК разработан также SMART-метод (switching mechanism at the 5' end of RNA templates of reverse transcriptase), в основе которого лежит свойство обратных транскриптаз добавлять на 3'-конец синтезированной первой цепи кДНК несколько нуклеотидных остатков, преимущественно dC. Эта олиго(dC)-последовательность служит местом отжига олигонуклеотидного адаптера, имеющего комплементарную олиго(dG)-последовательность на 3'-конце. Обратная транскриптаза воспринимает праймер как продолжение РНК-матрицы и продолжает синтез первой цепи [Schmidt W.M., Mueller M.W. 1999. CapSelect: a highly sensitive method for 5' CAP-dependent enrichment of full-length cDNA in PCR-mediated analysis of mRNAs. Nucleic Acids Res. 27, e31]. Таким образом, первая цепь кДНК оказывается фланкирована с одной стороны последовательностью 3'-праймера с олиго(dT) на 3'-конце, а с другой - последовательностью, комплементарной адаптеру. Эти праймеры имеют одинаковые внешние последовательности, отличаясь только на 3'-конце. Затем первую цепь амплифицируют в ПЦР с праймером, соответствующим внешней части 3'-праймера и адаптера. Нуклеотидную последовательность общей части этих праймеров подбирают в зависимости от дальнейших целей, например, получения клонотек, применения вычитающей гибридизации и т.д. В результате получают двухцепочечную ДНК, обогащенную полноразмерными последовательностями. За счет использования адаптера с заблокированным 3'-концом достигается существенное снижение фоновой амплификации. При использовании модифицированного SMART-метода за короткое время происходит амплификация исходного материала более чем в 105 раз, поэтому можно работать с очень небольшими количествами РНК (меньше 1 нанограмма), а следовательно, и с небольшим количеством исследуемой ткани [Zhu Y.Y., Machleder E.M., Chenchik A., Li R., Siebert P.D. 2001. Reverse transcriptase template switching: a SMART approach for full-length cDNA library construction. Biotechniques 30, 892-897]. Наборы для получения кДНК этим способом выпускают различные фирмы, например, Евроген, Россия (набор MINT), Clontech, США и т.п.
Раскрытие настоящего изобретения
Настоящее изобретение стало возможным в результате проведенного авторами сравнительного анализа уровня транскрипции гена RHOV в опухолевых тканях легких различного типа и на разных этапах их злокачественного перерождения и выявления того факта, что уже ранние стадии развития злокачественной трансформации сопровождаются значительным увеличением уровня транскрипции гена RHOV. Таким образом, настоящее изобретение обеспечивает новый генетический маркер для диагностики немелкоклеточного рака легких и основанный на определении уровня транскрипции этого маркера простой и надежный способ диагностики НМРЛ на разных стадиях развития злокачественной трансформации, включая начальные. Достоверное различие уровней транскрипции гена RHOV в нормальных и опухолевых тканях может быть использовано для обнаружения рака легких.
Настоящее изобретение в своем первом аспекте относится к новому маркеру для диагностики немелкоклеточного рака легких, который представляет собой уровень транскрипции гена RHOV. Повышенный уровень в предположительно пораженной раком ткани человека по сравнению с ее уровнем в здоровой ткани служит диагностическим признаком немелкоклеточного рака легких.
Конкретно настоящее изобретение относится к способу диагностики немелкоклеточного рака легких, предусматривающему следующие стадии:
а) получение исходной пары образцов ткани от пациента, где один из образцов получен из предположительно пораженной раком ткани, а второй получен из прилегающей гистологически нормальной (условно нормальной) ткани;
б) выделение и очистка препаратов РНК из исходной пары образцов;
в) синтез одноцепочечной или двуцепочечной кДНК на матрице РНК с использованием олигонуклеотидных праймеров;
г) нормирование концентрации кДНК гена-маркера по контрольному гену, уровень транскрипции которого постоянен в норме и при раке легких;
д) проведение количественной или полуколичественной реакции амплификации фрагмента кДНК гена-маркера с использованием кДНК, полученной на стадии в), в качестве матрицы и пары геноспецифичных олигонуклеотидных праймеров;
е) сравнение количества амплифицированного фрагмента кДНК гена-маркера для образца, полученного из предположительно пораженной раком ткани, с количеством амплифицированного фрагмента кДНК для образца, полученного из нормальной ткани. При этом указанные количества амплифицированного фрагмента кДНК отражают уровень транскрипции гена-маркера, причем изменение транскрипции гена-маркера служит диагностическим признаком немелкоклеточного рака легких;
отличающемуся тем, что ген-маркер представляет собой ген RHOV, а изменение транскрипции гена-маркера представляет собой усиление транскрипции гена RHOV.
Как следует из формулировки способа, в качестве материала для сравнительного анализа уровней транскрипции гена RHOV в нормальных и опухолевых тканях использовали кДНК, синтезированные на матрицах РНК, изолированных из сравниваемых образцов тканей и нормированных между собой по содержанию кДНК контрольного гена, как это описано в уровне техники (в частности, в патенте РФ №2330285). Осуществление (в существенной степени повторение) этих известных стадий описано в примерах 1-4 ниже. Отличие дальнейших стадий от стадий изобретения-аналога определяются тем, что в качестве гена-маркера немелкоклеточного рака легких в соответствии с настоящим изобретением впервые использован ген RHOV.
В соответствии с одним из вариантов осуществления настоящего изобретения рак легких, в отношении которого уровень транскрипции гена RHOV служит в качестве диагностического маркера, представляет собой плоскоклеточный рак легких.
В соответствии с другим вариантом осуществления настоящего изобретения рак легких, в отношении которого уровень транскрипции гена RHOV служит в качестве диагностического маркера, представляет собой аденокарциному легких.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии в) указанного способа олигонуклеотидные праймеры, используемые для синтеза одноцепочечной или двуцепочечной кДНК, выбирают из числа олиго(dT)-содержащих праймеров, случайных гексануклеотидных праймеров или их комбинации, а также геноспецифичных праймеров.
В соответствии с одним из вариантов осуществления настоящего изобретения последовательность праймеров на стадии д) указанного способа представлена SEQ ID NO:1 и 2.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии д) указанного способа количественная или полуколичественная реакция амплификации фрагмента гена RHOV представляет собой ПЦР в реальном времени или стандартную ОТ-ПЦР.
В соответствии с одним из вариантов осуществления настоящего изобретения на стадии г) указанного способа в качестве контрольного гена используют ген GAPDH, кодирующий белок глицеральдегид-3-фосфатдегидрогеназу.
Используя первую или вторую цепь кДНК как матрицу, коммерчески доступную от ряда производителей термостабильную ДНК-полимеразу (например, Taq, Pfu, Tfl, Tth, Tma и т.д.) и специфические праймеры, сайты отжига которых расположены в представляющем интерес транскрипте или комплементарны ему, проводят стандартную полуколичественную ПЦР, в ходе которой амплифицируемый фрагмент транскрипта детектируется простым гель-электорофорезом, или количественную ПЦР в реальном времени. Выбор специфических праймеров осуществляют способом, хорошо известным специалистам в данной области. Для подбора праймеров и температур отжига целесообразно использовать коммерчески доступные программы или программы, находящиеся в свободном доступе в сети Интернет. Среди таких программ можно упомянуть Oligo (версия 6.42), PrimerSelect из пакета Lasergene (www.dnastar.com), Primer Premier 5, primers3 (http://frodo.wi.mit.edu/cgi-bin/primer3/primer3_www.cgiC), EasyExonPrimer (Wu X., Munroe D.J. 2006. EasyExonPrimer: Automated Primer Design for Exon Sequences. Appl Bioinformatics. 5, 119-120), ExPrimer (Sandhu K.S., Acharya K.K. 2005. ExPrimer: to design primers from exon-exon junctions. Bioinformatics. 21, 2091-2092), PerlPrimer, FastPCR (http:/www.biocenter.helsinki.fi/bi/Programs/fastpcr.htm), PrimerQuest (http://scitools.idtdna.com/Primerquest/). С учетом сложности анализируемого генома длина праймеров может быть выбрана в диапазоне от 18 до 25 п.н.
С целью упростить процедуру осуществления способа для целей клинического анализа и обеспечить максимальную сохранность содержащейся в образце РНК необходимо свести к минимуму манипуляции с образцом ткани, которые потенциально могут приводить к разрушению РНК. В этой связи в одном из предпочтительных вариантов получения препарата РНК в данном изобретении не используют ДНКазу, свободную от РНКазы. При этом праймеры для ПНР подбирают таким образом, чтобы продукты амплификации на матрице кДНК даже в присутствии в препарате примеси геномной ДНК могли быть дифференцированы от продуктов амплификации на матрице примесной геномной ДНК. Этого можно достигнуть, например, путем подбора праймеров к разным экзонам гена RHOV. При использовании геноспецифичных праймеров, комплементарных участкам разных экзонов, длина продукта ПЦР, амплифицированного с примесной геномной ДНК, будет значительно больше длины ожидаемого продукта ПЦР, амплифицированного с кДНК.
В соответствии с одним из предпочтительных вариантов осуществления настоящего изобретения используют праймер RHOV_F, выбранный в экзоне 2 гена RHOV, и праймер RHOV_R, последовательность которого комплементарна фрагменту последовательности экзона 3 гена RHOV:
RHOV_F (SEQ ID NO:1) 5'-GCATTGAGCTCTGGGACACA-3' и
RHOV_R (SEQ ID NO:2) 5'-TGGTCCAGCTGAATTAGTACG-3'.
Специалисту в данной области будет понятно, что могут быть подобраны и другие пары праймеров, различающиеся, например, по своей длине, по своей локализации относительно последовательности транскрипта гена RHOV, которые будут обеспечивать специфическую и эффективную амплификацию фрагмента транскрипта гена RHOV лаже в присутствии примеси геномной ДНК.
Количественная оценка уровня транскрипции достигается с помощью параллельного проведения ПЦР на матрице тестируемого транскрипта и на матрице контрольного (стандартного) транскрипта или предварительного уравнивания количеств матриц в ПЦР по количеству контрольного (стандартного) транскрипта. В качестве эндогенного внутреннего контроля, относительно которого проводилось нормирование продуктов амплификации исследуемого гена RHOV, удобно выбрать ген «домашнего хозяйства», например, ген GAPDH, кодирующий глицеральдегид-3-фосфатдегидрогеназу. Экспрессия генов «домашнего хозяйства» во всех клетках одинакова. Для гена GAPDH в случае НМРЛ показан наименьший разброс уровней транскрипции в нормальных и опухолевых тканях (D.W.Liu, S.T.Chen, H.P.Liu. Choice of endogeneous control for gene expression in nonsmall lung cancer. 2005. Eur. Respir.J, 26, 1002-1008).
Для анализа уровня транскрипции генов может быть использована не только стандартная ПЦР, но и ПЦР в реальном времени (ПЦР-РВ). В отличие от стандартного метода, где фиксируются только конечные продукты реакции, для ПЦР в реальном времени используются флуоресцентно меченные олигонуклеотидные зонды для детекции ДНК в процессе ее амплификации, что позволяет наблюдать накопление амплифицированных фрагментов в экспоненциальной фазе реакции, что, в свою очередь, увеличивает чувствительность и точность метода. Зонд, комплементарный средней части амплифицируемого фрагмента, содержит на концах флуорофор и тушитель. Когда флуорофор и тушитель связаны с олигонуклеотидным зондом, наблюдается лишь незначительная флуоресцентная эмиссия. В ходе процесса амплификации за счет 5'-экзонуклеазной активности Taq-полимеразы флуоресцентная метка переходит в раствор, освобождаясь от соседства с тушителем, и генерирует флуоресцентный сигнал, усиливающийся в реальном времени пропорционально накоплению амплификата.
Подбор зондов для проведения ПЦР-РВ может осуществляться в соответствии со стандартными рекомендациями производителя приборов для ПЦР-РВ. Если отсутствует необходимость мультиплексного анализа нескольких генов одновременно, экономичной альтернативой может быть система, использующая специфический к двухспиральной ДНК краситель SYBR Green, интенсивность флуоресценции которого возрастает в реальном времени пропорционально увеличению количества ампликонов. В таком варианте можно использовать праймеры без зонда.
Для проведения ПНР в реальном времени различными фирмами разработаны амплификаторы, например: ABI Prism 7000 Sequence Detection System фирмы Applied Biosystems (США), Chromo4, MiniOpticon или iCycler iQ5 MJ Research (Bio-Rad), а также отечественные приборы ДТ-322 (ДНК-Технология), АНК-32 (Институт Аналитического Приборостоения РАН, http://www.syntol.ru/productank.htm) и т.д. Применение ПЦР-РВ позволяет также уменьшить риск контаминации и автоматизировать процесс диагностики. Процесс продолжается два-три часа (50 или 60 циклов ПЦР соответственно) и включает одновременное проведение ПЦР, детекцию флуоресцентного сигнала, обработку данных и их представление в графическом виде (полной кинетической кривой) с помощью специального программного обеспечения. Результаты анализа становятся доступными сразу после завершения процесса и не требуют дополнительно очистки и анализа продуктов ПЦР. В качестве основного метода измерения уровня транскрипции генов обычно выбирают сравнительный метод (метод относительных измерений, RQ-метод), основанный на относительном измерении количества исследуемых полинуклеотидных последовательностей, позволяющий проводить двойное сравнение результатов - для контрольных и целевых генов, а также для нормальных и опухолевых образцов кДНК.
Уровень транскрипции гена RHOV считался повышенным в опухоли в следующих случаях: а) если продукт не обнаруживался на любом из циклов амплификации в норме и обнаруживался в опухоли, начиная с любого из циклов амплификации, б) если продукт обнаруживался в норме, начиная с любого из циклов амплификации, и уровень траснкрипта RHOV в опухоли после 34 циклов амплифкации превышал таковой в норме. Достоверность различий в транскрипции RHOV в опухолях и условных нормах оценивали по точному критерию Фишера. Данные считали достоверными при Р<0,05, где Р - показатель статистической значимости (достоверности) данных.
Настоящим изобретением также предусмотрено, что, поскольку повышенный уровень транскрипта RHOV является характерной чертой опухолевых, но не нормальных, клеток в ткани легких, определение уровня транскрипции гена RHOV будет полезным при мониторинге эффективности проводимой противораковой терапии, причем анализ в соответствии со способом согласно настоящему изобретению следует проводить до начала и после окончания курса лечения, а также при необходимости по ходу курса лечения. Снижение уровня транскрипции гена RHOV по ходу или по завершении курса лечения может рассматриваться как индикатор элиминации опухолевых клеток и, возможно, принимая во внимания упомянутую выше возможную причинно-следственную связь транскрипции гена RHOV с прогрессией опухоли, позволит говорить о положительном эффекте лечения. Напротив, увеличение или неизменность уровня транскрипции гена RHOV может свидетельствовать о неэффективности лечения.
В соответствии с еще одним своим аспектом настоящее изобретение относится к набору праймеров для осуществления полимеразной цепной реакции для определения уровня транскрипции гена RHOV, имеющих последовательность SEQ ID NO:1 и 2.
Таким образом, настоящее изобретение позволяет расширить арсенал средств диагностики немелкоклеточного рака легких и, снабжая онколога дополнительным диагностическим инструментом, повысить точность такой диагностики.
Краткое описание фигур
Далее изобретение будет более подробно раскрыто со ссылкой на отдельные иллюстративные примеры и фигуры.
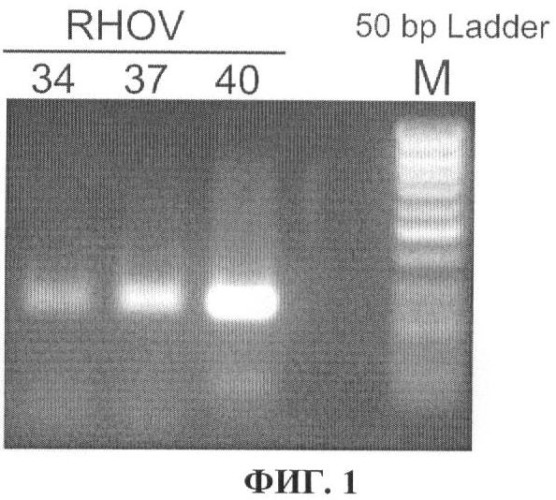
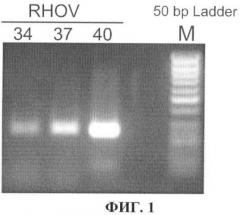
На фиг.1 показаны результаты подбора условий определения уровня транскрипции гена RHOV в образцах тканей легких. Электрофоретическое разделение в агарозном геле продуктов ПНР (размер 238 п.н.), полученных после 34, 37 и 40 циклов, проводили в 1,8%-ном агарозном геле при использовании в качестве матрицы кДНК одного из образцов опухоли легких. М - маркер молекулярных масс ДНК (50 bp Ladder, Fermentas, Литва).
На фиг.2 показаны результаты ОТ-ПЦР-анализа уровня транскрипции гена RHOV при ПРЛ с центральной локализацией опухоли и АКЛ (после 34-х, 37-ми и 40-ка циклов). Номера образцов и число циклов амплификации указаны над дорожками. Т - опухоль, N - условная норма (прилежащие к опухоли ткани). Образцы были предварительно выравнены по уровню транскрипции GAPDH. Электрофоретическое разделение продуктов ПЦР проводили в 1,8%-ном агарозном геле. Показаны репрезентативные результаты анализа.
Далее настоящее изобретение будет подробно проиллюстрировано конкретными примерами, представляющими собой одни из предпочтительных вариантов осуществления настоящего изобретения. При этом среднему специалисту в данной области техники будет очевидно, что изобретение не ограничивается этими конкретно описанными вариантами осуществления. Напротив, предполагается, что под его объем подпадают любые альтернативы, модификации или эквиваленты, допустимые с учетом сущности изобретения.
Описание конкретных примеров осуществления изобретения
Пример 1. Образцы тканей легких
Анализировали 29 пар образцов легочных тканей (опухоль/условная норма) пациентов с НМРЛ: 25 пар образцов ПРЛ (19 образцов с центральной локализацией опухоли и шесть - с периферической) и четыре пары образцов АКЛ. За условную норму принимали гистологически нормальные ткани легких, взятые из прилегающей к опухоли ткани ближе к краю резекции. Средний возраст пациентов, среди которых 28 мужчин и одна женщина, составляет 61 год (диапазон 34-76 лет). Диагноз в каждом случае устанавливали на основании результатов клинического, морфологического, эндоскопического и рентгенологического обследований. Все опухолевые образцы охарактеризованы согласно международной системе клинико-морфологической классификации опухолей TNM, где Т (tumor) - ТО-Т4 - категории, отражающие нарастание размера и/или местного распространения первичной опухоли, N (nodulus) - N0-N3 - категории, отражающие различную степень поражения региональных лимфатических узлов; М (metastasis) - М0-М1 - характеризует отдаленные метастазы. Все возможные комбинации TNM объединяют в более крупные группы - стадии, отражающие течение опухолевого процесса. I-я стадия заболевания установлена у шести больных, II-я - у 18-ти, III-я - у пяти. Признаков отдаленных метастазов не наблюдали ни у одного из пациентов. Никто из пациентов не подвергался до операции лучевой терапии и химиотерапии.
Пример 2. Выделение РНК из образцов тканей
Тотальную РНК выделяли из замороженных, измельченных в жидком азоте образцов опухолевых и нормальных тканей. Образцы тканей гомогенизировали на приборе Micro-Dismembrator U (Sartorius, Германия). Очистку РНК проводили стандартным методом с использованием гуанидинизотиоцианата и фенола с последующим осаждением этиловым спиртом [Sambrook et al., 1989, supra]. Для удаления примесей гликопротеидов, которыми богаты ткани легких, использовали дополнительное осаждение РНК солевым раствором [Chomczynski P., Mackey К. 1995. Modification of the TRI reagent procedure for isolation of RNA from polysaccharide- and proteoglycan-rich sources. Biotechniques 19, 942-945]. После солевого осаждения все препараты РНК очищали с помощью набора "RNeasy Mini kit" (Qiagen, США) согласно прилагаемому изготовителем протоколу. Такая трехэтапная процедура очистки РНК позволила эффективно избавиться не только от труднорастворимых осадков гликопротеидов, но и от низкомолекулярных РНК. Качество препарата РНК проверяли электрофорезом в 1%-ном агарозном геле в присутствии бромида этидия. Количество РНК определяли спектрофотометрически [Sambrook et al., 1989, supra].
Пример 3. Реакция обратной транскрипции
Синтез первой цепи кДНК
На матрице РНК, выделенной, как описано в примере 2, синтезировали одноцепочечную кДНК. Для получения кДНК использовали модифицированный SMART-метод [Zhu Y.Y., Machleder E.M., Chenchik A., Li R., Siebert P.D. 2001, Reverse transcriptase template switching: a SMART approach for full-length cDNA library construction. Biotechniques 30, 892-897], 2 нг - 1 мкг тотальной РНК, праймеры:
SMART (5'-AAGCAGTGGTATCAACGCAGAGTACGCrGrGrG-3') и
CDS(5'-AGCAGTGGTATCAACGCAGAGTAC(T)30N-1N-3'), и
обратную транскриптазу PowerScript (Clontech, США).
Условия реакции:
Состав реакционной смеси (10 мкл):
| РНК (1 мкг/мкл) | 1,0 мкл |
| праймер SMART (6 мкМ) | 2,0 мкл |
| праймер CDS (10 мкМ) | 1,0 мкл |
| стерильная деионизованная вода | 1,0 мкл. |
Смесь прогревали при 72°С в течение 3 мин и помещали в лед. Добавляли 5 мкл смеси:
| буфер (Clontech) для построения 1-й цепи (5×) | 2,0 мкл |
| dNTP (10 мМ) | 1,0 мкл |
| DТТ (20 мМ) | 1,0 мкл |
| обратная транскриптаза PowerScript (Clontech) | 1,0 мкл |
Смесь инкубировали при 42°С в течение 60 мин. Реакцию останавливали прогреванием при 65°С в течение 5 мин, добавляли 2 мкл 60 мМ ЭДТА и доводили объем смеси до 20 мкл.
Пример 4. Синтез второй цепи кДНК
Для синтеза второй цепи кДНК и амплификации брали 1/10 часть от объема реакционной смеси, полученной в примере 3. Синтез проводили с помощью Advantage2 DNA Polymerase с праймером 5'-AAGCAGTGGTATCAACGCAGAGT-3' согласно протоколу «Advantage 2 PCR kit» (Clontech, Heidelberg, Germany).
Условия проведения ПЦР:
Состав реакционной смеси (50 мкл):
| ПЦР-буфер Advantage 2 (Clontech) (10×) | 5,0 мкл |
| dNTP (2,5 мМ) | 5,0 мкл |
| праймер 10 мкМ | 1,0 мкл |
| кДНК (одноцепочечная) | 1,0 мкл |
| Advantage 2 ДНК-полимераза (Clontech) | 1,0 мкл |
| стерильная деионизованная вода | 37,0 мкл |
Условия амплификации:
95°С, 1,5 мин, 1 цикл;
95°С, 20 с; 65°С, 20 с; 72°С, 3 мин, 14-17-20-23 цикла.
Для каждого образца подбирали количество циклов, позволяющих получать одинаковое количество амплифицированного материала.
Пример 5. Подбор условий определения уровня транскрипции гена RHOV в образцах тканей опухолей легких
При подборе условий определения уровней транскрипции для амплификации двуцепочечной кДНК использовали геноспецифичные праймеры RHOV_F (SEQ ID NO: 1) и RHOV_R (SEQ ID NO: 2), которые были подобраны к разным экзонам гена RHOV. В этих условиях присутствие примесей геномной ДНК не влияет на результаты определения уровня транскрипта RHOV, поскольку возможные продукты амплификации на матрице геномной ДНК (гена RHOV) будут большего размера, чем продукты амплификации на матрице кДНК RHOV.
Амлификацию проводили с помощью набора реагентов для амплификации ДНК "GenePak PCR Core" производства Isogene Lab. Ltd. (Москва, Россия) согласно протоколу производителя. Размер продукта амплификации составляет 238 п.н. Подбор условий проведения ПЦР осуществляли на нескольких образцах кДНК тканей случайно выбранных опухолей легких. Амплификацию проводили в 20 мкл смеси. Реакционную смесь (60 мкл) разделяли на 3 части по 20 мкл для проведения 34, 37 и 40 циклов амплификации.
В состав реакционной смеси (60 мкл) входило:
| ПЦР-растворитель | 30,0 мкл |
| праймер RHOV_F, 45 мкМ | 0,6 мкл |
| праймер RHOV_R, 43 мкМ | 0,6 мкл |
| образец кДНК (0,1 мкг/мкл) | 3,0 мкл |
| стерильная деионизованная вода | 25,8 мкл. |
ПЦР проводилась в следующих условиях:
94°С, 2 мин 1 цикл;
94°С, 30 с; 60°С, 60 с; 72°С, 60 с; 34, 37 и 40 циклов;
72°С, 3 мин 1 цикл.
Образцы кДНК нормировали по контрольному гену GAPDH, кодирующему белок глицеральдегид-3-фосфатдегидрогеназу. Для этого подбирали количества матриц, обеспечивающих получени