Реактив для измерения тромбоцитов, набор реактивов для измерения тромбоцитов и способ измерения тромбоцитов
Иллюстрации
Показать всеНастоящее изобретение относится к диагностике, а именно к реактиву для измерения тромбоцитов. Реактив для измерения тромбоцитов, содержащий в качестве реактива для окрашивания тромбоцитов гидросульфат нильского голубого. Набор реактивов для измерения тромбоцитов, содержащий в качестве первого реактива гидросульфат нильского голубого и второго реактива - буферное вещество. Способ измерения тромбоцитов, где в качестве первого реактива используют гидросульфат нильского голубого и второго реактива - буферное вещество. Реактив для измерения тромбоцитов, содержащий в качестве красителя для окрашивания тромбоцитов нильский голубой и кислоту. Набор реактивов для измерения тромбоцитов, содержащий в качестве первого реактива нильский голубой, кислоту и второго реактива - буферное вещество. Способ измерения тромбоцитов, где в качестве первого реактива используют нильский голубой, кислоту и второго реактива - буферное вещество. Вышеописанные реактивы позволяют повысить точность определения количества тромбоцитов. 6 н. и 7 з.п. ф-лы, 21 ил., 10 табл., 48 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к реактиву для измерения тромбоцитов, набору реактивов для измерения тромбоцитов и способу измерения тромбоцитов с их использованием. Более конкретно, настоящее изобретение относится к реактиву для измерения тромбоцитов, содержащему нильский голубой, в частности гидросульфат нильского голубого.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Известны способы, основанные на принципе проточной цитометрии, которые позволяют быстро измерять клетки крови, т.е. лейкоциты, ретикулоциты, эритроциты и т.п.
В качестве одного из таких способов измерения, например, в патенте США №6114173 раскрыт способ подсчета и определения ретикулоцитов, эритроцитов и тромбоцитов в образцах цельной крови, а также композиция, содержащая реактивы, используемые в этом способе. В частности, ретикулоциты окрашивают смесью реактивов, содержащих катионный краситель, в частности Oxazine 750, и их сигнал светорассеяния и сигнал светопоглощения измеряют с помощью проточной цитометрии. Затем эритроциты и ретикулоциты в образцах крови дифференцируют по различиям в сигналах поглощения, а группу из эритроцитов и ретикулоцитов и тромбоцитов дифференцируют по различиям в сигналах светорассеяния с тем, чтобы определить общее количество клеток каждого вида.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая проблема
Известно, что фрагментированные эритроциты, липиды и прочее, встречающееся в крови, по размеру похожи на тромбоциты, так что они действуют на измерения как загрязнители. В особенности, образцы, содержащие небольшое количество тромбоцитов, при котором может потребоваться переливание крови, в большей степени подвержены действию этих загрязнителей на измерения. Такая проблема может возникать при осуществлении способа, раскрытого в патенте США №6114173. Однако в патенте США №6114173 не говорится о том, что при измерении тромбоцитов противодействуют какому-либо действию загрязнителей.
Кроме того, красители, которыми можно окрашивать тромбоциты, со временем могут разлагаться в растворе. Измерение тромбоцитов с помощью проточной цитометрии осуществляют посредством обнаружения рассеянного света и флуоресценции, которые возникают при попадании света на клетки, окрашенные красителем в образцах. Однако, когда используют раствор красителя, в котором снижено количество красителя, содержащегося для окрашивания тромбоцитов, нельзя добиться правильного рассеяния света или флуоресценции и нельзя получить точные результаты измерений.
Настоящее изобретение было осуществлено, принимая во внимание вышеупомянутые обстоятельства, и предназначено для того, чтобы предоставить реактив и набор реактивов для измерения тромбоцитов, которые делают возможным измерение тромбоцитов с более высокой точностью, предотвращая действие загрязнителей, которые могут содержаться в образцах, и предотвращают обнаружение тромбоцитов, и которые имеют высокую устойчивость при хранении. Настоящее изобретение также предназначено для того, чтобы предоставить способ измерения тромбоцитов, который делает возможным измерение тромбоцитов с более высокой точностью.
Средства решения проблем
Следовательно, настоящее изобретение относится к реактиву для измерения тромбоцитов, в котором в качестве красителя для окрашивания тромбоцитов содержится нильский голубой, содержащий гидросульфат-ион в качестве противоиона.
Настоящее изобретение также относится к набору реактивов для измерения тромбоцитов, содержащему:
первый реактив, в котором в качестве красителя для окрашивания тромбоцитов содержится нильский голубой, содержащий гидросульфат-ион в качестве противоиона, и
второй реактив, содержащий буферное вещество.
Кроме того, настоящее изобретение относится к способу измерения тромбоцитов, включающему стадии:
смешивание первого реактива, который в качестве красителя для окрашивания тромбоцитов содержит нильский голубой, содержащий гидросульфат-ион в качестве противоиона, и образца с добавлением второго реактива, содержащего буферное вещество, или без добавления второго реактива, чтобы получить образец для измерений;
освещение клеток в полученном образце для измерений, чтобы обнаружить рассеянный свет и флуоресценцию, излучаемую клетками; и
обнаружение тромбоцитов, содержащихся в образце для измерений на основании обнаруженного рассеянного света и флуоресценции.
В другом аспекте настоящее изобретение относится к реактиву для измерения тромбоцитов, который в качестве красителя для окрашивания тромбоцитов содержит нильский голубой, содержащий ион неорганической кислоты в качестве противоиона, и кислоту.
Кроме того, настоящее изобретение относится к набору реактивов для измерения тромбоцитов, содержащему:
первый реактив, который содержит, в качестве красителя для окрашивания тромбоцитов, нильский голубой, содержащий ион неорганической кислоты в качестве противоиона, и кислоту, и
второй реактив, содержащий буферное вещество.
Кроме того, настоящее изобретение относится к способу измерения тромбоцитов, включающему в себя стадии:
смешивание реактива для измерения тромбоцитов, содержащего нильский голубой и кислоту, и образца с добавлением или без добавления второго реактива, содержащего буферное вещество, чтобы получить образец для измерений;
освещение клеток в полученном образце для измерений, чтобы обнаружить рассеянный свет и флуоресценцию, излучаемую клетками; и
обнаружение тромбоцитов, содержащихся в образце для измерений, на основании обнаружения рассеянного света и флуоресценции.
Как применяют в настоящем документе, «нильский голубой» обозначает красители, состоящие из соединения, которое может быть представлено, например, с помощью следующей формулы (II):
где X- представляет собой анион;
и находится в форме соли, образованной с противоионом, обозначенным как X-. В настоящем описании красители, представленные формулой (II), в которой противоион, обозначенный как X-, конкретно не ограничен, называются просто «нильский голубой», а красители, представленные формулой (II), в которых противоион конкретно задан, называются «XXX нильского голубого» (XXX обозначает соль, образуемую конкретным ионом). Например, краситель, содержащий сульфат-ион (1/2 ) в качестве противоиона, называется «сульфат нильского голубого», а краситель, содержащий гидросульфат-ион в качестве противоиона, называется «гидросульфат нильского голубого».
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг.1 изображены контейнеры, в которых может содержаться набор реактивов для измерения тромбоцитов по настоящему изобретению.
На фиг.2 изображен вид спереди схематической конструкции анализатора образцов.
На фиг.3 изображена блочная диаграмма, на которой показана схематическая конструкция анализатора образцов.
На фиг.4 изображена схема расположения, на которой показано устройство блока обнаружения.
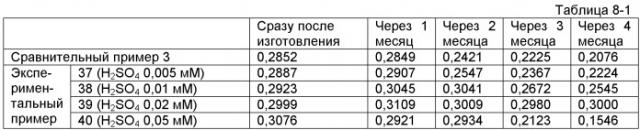
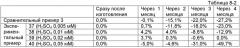
На фиг.5 показаны диаграммы рассеивания, полученные при измерении тромбоцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 9.
На фиг.6 показаны диаграммы рассеивания, полученные при измерении тромбоцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 10.
На фиг.7 показаны диаграммы рассеивания, полученные при измерении тромбоцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 11.
На фиг.8 показаны диаграммы рассеивания, полученные при измерении тромбоцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 12.
На фиг.9 показаны диаграммы рассеивания, полученные при измерении тромбоцитов с использованием красящего реактива в экспериментальном примере 13.
На фиг.10 показаны диаграммы рассеивании, полученные при измерении содержащихся в крови фрагментированных эритроцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 9.
На фиг.11 показаны диаграммы рассеивания, полученные при измерении содержащихся в крови липидных частиц с использованием реактива для измерения тромбоцитов в экспериментальном примере 9.
На фиг.12 показаны диаграммы рассеивании, полученные при измерении содержащихся в крови фрагментированных эритроцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 10.
На фиг.13 показаны диаграммы рассеивания, полученные при измерении содержащихся в крови липидных частиц с использованием реактива для измерения тромбоцитов в экспериментальном примере 10.
На фиг.14 показаны диаграммы рассеивания, полученные при измерении образцов с использованием реактивов для измерения тромбоцитов в экспериментальных примерах с 14 до 24.
На фиг.15 показаны диаграммы рассеивания, полученные при измерении образцов с использованием реактива для измерения тромбоцитов в экспериментальном примере 25.
На фиг.16 показаны диаграммы рассеивания, полученные при измерении тромбоцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 45.
На фиг.17 показаны диаграммы рассеивания, полученные при измерении тромбоцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 46.
На фиг.18 показаны диаграммы рассеивания, полученные при измерении тромбоцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 47.
На фиг.19 показаны диаграммы рассеивания, полученные при измерении тромбоцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 48.
На фиг.20 показаны диаграммы рассеивания, полученные при измерении содержащихся в крови фрагментированных эритроцитов с использованием реактива для измерения тромбоцитов в экспериментальном примере 45.
На фиг.21 показаны диаграммы рассеивания, полученные при измерении содержащихся в крови липидных частиц с использованием реактива для измерения тромбоцитов из экспериментального примера 45.
ОПИСАНИЕ ОБОЗНАЧЕНИЙ ПОЗИЦИЙ
A Первый контейнер
В Второй контейнер
1 Анализатор образцов
2 Измерительный блок
3 Блок обработки данных
4 Блок управления
5 Блок обнаружения
6 Блок подготовки образцов
7 Интерфейс
8 Блок управления
9 Блок анализа данных
10 Блок вывода
11 Блок ввода
12 Интерфейс
51 Проточная кювета
52 Источник лазерного излучения
53 Линзы для фокусировки луча
54 и 57 Фотодиоды
54a Шторка для луча
54b Усилитель
55 Боковая собирающая линза
56 Дихроическое зеркало
57 Фотодиод
57a и 58b Усилители
58 Фотоумножитель
58a Оптический фильтр
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Реактив для измерения тромбоцитов
Авторы настоящего изобретения обнаружили, что тромбоциты можно четко отличать от загрязнителей в крови, таких как компоненты клеток крови, отличные от тромбоцитов, или липидные частицы, используя нильский голубой в качестве красителя для окрашивания тромбоцитов в способах измерения тромбоцитов с помощью проточной цитометрии.
Кроме того, авторы настоящего изобретения проводили экстенсивные исследования условий для измерения тромбоцитов с использованием нильского голубого и обнаружили, что реактивы для измерения тромбоцитов обладают более высокой устойчивостью при хранении, когда (1) они содержат гидросульфат нильского голубого; или (2) они содержат нильский голубой и кислоту, с тем чтобы выполнить настоящее изобретение.
В приведенной выше формуле (II) анион (противоион) X- включает ион неорганической кислоты, такой как сульфат-ион (1/2 ), хлорид-ион (Cl-), гидросульфат-ион , перхлорат-ион .
Вышеупомянутые виды нильского голубого коммерчески доступны и были приобретены, например, в Sigma Aldrich, Tokyo Chemical Industry Co., Ltd., Nacalai Tesque, Inc., Wako Pure Chemical Industries, Ltd., Kishida Chemical Co., Ltd. и т.п.
В частности, гидросульфат нильского голубого приобретали в Wako Pure Chemical Industries, Ltd. и Kishida Chemical Co., Ltd.
Нильский голубой, содержащийся в реактиве для измерения тромбоцитов по настоящему изобретению (например, гидросульфат нильского голубого), предпочтительно содержится в красящем реактиве в некотором диапазоне концентраций, с тем чтобы получить концентрацию от 0,05 до 5,0 м.д., более предпочтительно от 0,1 до 0,6 м.д., более предпочтительно от 0,2 до 0,5 м.д., когда реактив для измерения тромбоцитов смешивают с образцом. Например, когда реактив для измерения тромбоцитов смешивают с образцом при степени разбавления 1/50, концентрация нильского голубого в реактиве для измерения тромбоцитов предпочтительно составляет от 2,5 до 250 м.д.
Тромбоциты можно более четко отличать от компонентов клеток крови, отличных от тромбоцитов, или загрязнителей, когда нильский голубой присутствует в вышеприведенном диапазоне концентраций.
В том аспекте, в котором реактив для измерения тромбоцитов по настоящему изобретению содержит нильский голубой и кислоту, кислота может представлять собой или органическую кислоту, или неорганическую кислоту, предпочтительно неорганическую кислоту. Неорганическая кислота включает оксокислоты, такие как серная кислота, фосфорная кислота, перхлорная кислота, и бескислородные кислоты, такие как соляная кислота, фтороводородная кислота, йодистоводородная кислота, бромистоводородная кислота, синильная кислота, гидроизоциановая кислота, сероводород, азотистоводородная кислота.
В вышеупомянутом аспекте реактива для измерения тромбоцитов по настоящему изобретению кислота содержится в реактиве для измерения тромбоцитов в концентрации, которая равна или ниже молярной концентрации нильского голубого в реактиве для измерения тромбоцитов. В частности, отношение молярных концентраций нильского голубого и кислоты в реактиве для измерения тромбоцитов предпочтительно составляет от 10:1 до 1:1. Когда кислота представляет собой соляную кислоту, отношение молярных концентраций нильского голубого и соляной кислоты предпочтительно составляет от 3:1 до 1:1. Когда кислота представляет собой серную кислоту, отношение молярных концентраций нильского голубого и серной кислоты предпочтительно составляет от 4:1 до 1:1. Используя кислоту в вышеупомянутых концентрациях, снижение концентрации эффективного красящего компонента нильского голубого в реактиве для измерения тромбоцитов со временем можно эффективно предотвратить с тем, чтобы можно было улучшить устойчивость при хранении реактива для измерения тромбоцитов.
В вышеупомянутом аспекте реактива для измерения тромбоцитов по настоящему изобретению можно использовать любое сочетание нильского голубого и кислоты. Более предпочтительные сочетания:
(A) сульфат нильского голубого и оксокислота или бескислородная кислота;
(B) хлорид нильского голубого и серная кислота; и
(C) гидросульфат нильского голубого и оксокислота или бескислородная кислота.
В другом аспекте реактива для измерения тромбоцитов по настоящему изобретению, когда нильский голубой представляет собой голубой гидросульфат нильского голубого, в реактиве для измерения тромбоцитов не обязательно должна содержаться кислота. Когда нильский голубой представляет собой гидросульфат нильского голубого, снижение концентрации эффективного красящего компонента нильского голубого в реактиве для измерения тромбоцитов со временем можно эффективно предотвратить без использования кислоты с тем, чтобы можно было улучшить устойчивость при хранении реактива для измерения тромбоцитов.
Следующие две гипотезы можно выдвинуть в отношении вопроса о том, почему реактивы для измерения тромбоцитов по настоящему изобретению в двух вышеупомянутых аспектах имеют улучшенную устойчивость при хранении.
(1) Предполагается, что нильский голубой обладает высокой стабильностью, когда он присутствует в форме соли гидросульфата.
Когда к сульфату нильского голубого добавляют кислоту, протон (H+), который образуется при диссоциации кислоты, связывается с сульфата нильского голубого с образованием , так что и нильский голубой находятся в равновесии 1:1 и стабилизированы.
Когда нильский голубой представляет собой соль, отличную от вышеупомянутых, можно добавлять серную кислоту, так что , образованный серной кислотой, может стабилизировать нильский голубой.
Таким образом, реактив для измерения тромбоцитов по настоящему изобретению может представлять собой реактив, содержащий нильский голубой и необязательно кислоту с тем, чтобы в реактиве существовал гидросульфат-ион.
(2) Нильский голубой содержит три атома азота в своей диэтиламиногруппе, аминогруппе и феноксазиновой структуре. Среди этих атомов азота атомы азота, отличные от тех, которые образуют соль с противоанионом, обозначенным X- в приведенной выше формуле, образуют кислотно-аддитивную соль, так что улучшается стабильность атомов азота и растворимость красителя, а также улучшается стабильность реактива для измерения тромбоцитов.
То есть, гидросульфат нильского голубого может образовывать протон (H+) и сульфат-ион в результате диссоциации гидросульфат-иона Этот протон может связываться с любым атомом азота в нильском голубом и образовывать протонированный атом азота. Предполагается, что этот протонированный атом азота образует межмолекулярную соль с помощью серной кислоты, и таким образом, могут быть улучшены растворимость и стабильность красителя.
Когда кислоту добавляют к нильскому голубому, отличному от соли гидросульфата, предполагается, что протон и анион, образующиеся при диссоциации кислоты, участвуют в образовании межмолекулярных солей нильского голубого, так что растворимость и стабильность красителя могут быть улучшены.
Таким образом, реактив для измерения тромбоцитов по настоящему изобретению может представлять собой реактив, содержащий нильский голубой и необязательно кислоту, с тем чтобы нильский голубой мог образовать межмолекулярную соль.
Реактив для измерения тромбоцитов по настоящему изобретению предпочтительно содержит водорастворимый органический растворитель. Водорастворимый органический растворитель конкретно не ограничен при условии, что он может растворять вышеупомянутый нильский голубой и включает протонные растворители, такие как этиленгликоль, диэтиленгликоль, поли(этиленгликоль).
Реактив для измерения тромбоцитов по настоящему изобретению можно получить растворением вышеупомянутого нильского голубого и, необязательно, кислоты в водорастворимом органическом растворителе при вышеупомянутой желаемой концентрации.
Набор реактивов для измерения тромбоцитов
Вышеупомянутый реактив для измерения тромбоцитов можно комбинировать с реактивом, содержащим буферное вещество для разведения реактива для измерения тромбоцитов, содержащего краситель, чтобы сформировать набор реактивов.
Таким образом, настоящее изобретение также относится к набору реактивов для измерения тромбоцитов, содержащему:
первый реактив, содержащий гидросульфат нильского голубого, или нильский голубой и кислоту (в дальнейшем в этом документе также обозначаемый как «красящий реактив»); и
второй реактив, содержащий буферное вещество (в дальнейшем в этом документе также обозначаемый как «реактив для разведения»).
Особенности первого реактива совпадают с особенностями, описанными выше для реактива для измерения тромбоцитов.
Буферное вещество, содержащееся во втором реактиве, может быть конкретно не ограничено при условии, что оно сможет удерживать pH второго реактива в желаемом диапазоне и может представлять собой карбоксилаты, фосфаты, Good Buffers, таурин, триэтаноламин, в зависимости от желаемого pH. Буферное вещество предпочтительно содержится в реактиве для разведения с тем, чтобы получить диапазон pH реактива для разведения от 6,0 до 11,0, более предпочтительно от 7,0 до 10,0 и более предпочтительно от 8,0 до 9,5. Когда pH реактива для разведения составляет 6,0 или выше, эритроциты становятся устойчивыми к лизису и можно снизить загрязнение фрагментированными эритроцитами при смешивании реактива для разведения и образца. Когда pH равен 11,0 или ниже, можно снизить неспецифическое окрашивание фрагментированных эритроцитов.
Таким образом, второй реактив предпочтительно представляет собой буфер с pH от 6,0 до 11,0.
В дополнение к буферному веществу, реактив для разведения может содержать другие компоненты, такие как регуляторы осмотического давления, средства для ускорения окрашивания для ускорения окрашивания тромбоцитов нильским голубым.
Регулятором осмотического давления может быть любое соединение при условии, что оно удерживает осмотическое давление реактива для разведения в соответствующем диапазоне и может включать соли щелочных металлов и органических кислот, таких как пропионовая кислота, сахариды, такие как глюкоза, манноза. Также можно использовать галиды щелочных металлов, такие как NaCl, и галиды щелочноземельных металлов. Можно использовать один или несколько регуляторов осмотического давления.
Регулятор осмотического давления предпочтительно содержится в реактиве для разведения для того, чтобы регулировать осмотическое давление реактива для разведения от 150 до 600 мосм/кг и более предпочтительно от 200 до 300 мосм/кг. Регулируя осмотическое давление в пределах вышеуказанного диапазона, осмотическое давление смеси реактивов в наборе реактивов и образце может быть ближе к физиологичесому осмотическому давлению, так что можно предотвратить гемолиз, вызванный гипотоничностью, сдерживать увеличение количества фрагментированных эритроцитов, а измерение тромбоцитов сделать более точным. Когда осмотическое давление реактива для разведения может удерживаться в вышеуказанном диапазоне посредством использования вышеупомянутого буферного вещества, регулятор осмотического давления может не потребоваться.
Средство для ускорения окрашивания может представлять собой любое соединение, которое может увеличивать проницаемость нильского голубого внутрь тромбоцитов, и включает поверхностно-активные вещества, особенно предпочтительны катионные поверхностно-активные вещества.
Предпочтительным катионным поверхностно-активным веществом является вещество, представленное следующей формулой (I):
где R11 представляет собой алкильную группу, содержащую от 8 до 12 углеродных атомов; R12, R13 и R14 являются одинаковыми или отличающимися друг от друга и представляют собой алкильную группу, содержащую от 1 до 6 углеродных атомов; и Y- представляет собой анион.
В приведенной выше формуле (I) алкильная группа из R11, содержащая от 8 до 12 углеродных атомов, может быть линейной или разветвленной и включает, например, октил, децил, лаурил, цетил, миристил и прочие подобные группы.
Алкильная группа из R12, R13 и R14, содержащая от 1 до 6 углеродных атомов, может быть линейной или разветвленной и включает, например, метил, этил, пропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и прочие подобные группы. Среди них предпочтительными являются метильная и этильная группы.
Анион Y- предпочтительно представляет собой ион хлора или брома.
Предпочтительные катионные поверхностно-активные вещества с формулой (I) включают децилтриметиламмоний бромид (DTAB), октилтриметиламмоний бромид (OTAB), лаурилтриметиламмоний хлорид (LTAC), цетилтриметиламмоний хлорид (CTAC), миристилтриметиламмоний бромид (MTAB) и т.п. Можно использовать одно или несколько катионных поверхностно-активных веществ.
Катионное поверхностно-активное вещество предпочтительно содержится в реактиве для разведения в концентрации от 50 до 20000 м.д. В частности, предпочтительная концентрация может зависеть от типа катионного поверхностно-активного вещества и предпочтительно составляет от 500 до 3000 м.д. при использовании DTAB и от 100 до 500 м.д. при использовании LTAC. Когда реактив для разведения содержит катионное поверхностно-активное вещество в такой концентрации, можно предотвратить гемолиз и ускорить окрашивание тромбоцитов при смешивании реактивов из набора реактивов для измерения тромбоцитов и образца.
Реактив для разведения может содержать, в дополнение к вышеупомянутым компонентам, консервант, такой как 2-пиридилтио-1-оксид натрия, β-фенеэтиловый спирт.
Буферное вещество, которое содержится в реактиве для разведения, и другие компоненты, которые необязательно могут содержаться в реактиве для разведения, можно заранее смешивать с красящим реактивом. Однако поскольку нильский голубой, содержащийся в красящем реактиве, может разлагаться под действием воды или щелочных компонентов, то набор реактивов, отдельно содержащий красящий реактив и реактив для разведения, предпочтителен с точки зрения устойчивости при хранении.
Набор реактивов для измерения тромбоцитов согласно настоящему варианту осуществления может содержаться в первом контейнере A для хранения красящего реактива и во втором контейнере В для хранения реактива для разведения, как показано на фиг.1. Когда красящий реактив и реактив для разведения содержатся в раздельных контейнерах, разложение нильского голубого, содержащегося в красящем реактиве, можно предотвратить за счет того, что вода или щелочные компоненты содержатся в реактиве для разведения, так что можно предоставить набор реактивов для измерения тромбоцитов, обладающий более высокой устойчивостью при хранении.
Способ измерения тромбоцитов
Реактив или набор реактивов для измерения тромбоцитов смешивают с образцом, который может содержать тромбоциты, и таким образом окрашивают тромбоциты.
Таким образом, настоящее изобретение дополнительно относится к способу измерения тромбоцитов посредством использования реактива или набора реактивов для измерения тромбоцитов.
Способ измерения по настоящему изобретению содержит стадии:
смешивание первого реактива, содержащего гидросульфат нильского голубого или нильский голубой и кислоту, с образцом, чтобы получить образец для измерений;
освещение клеток в полученном образце для измерений, чтобы обнаружить рассеянный свет и флуоресценцию, излучаемую клетками; и
обнаружение тромбоцитов, содержащихся в образце для измерений на основании обнаруженного рассеянного света и флуоресценции.
На стадии смешивания первого реактива и образца в вышеупомянутом способе дополнительно можно необязательно примешивать второй реактив, содержащий буферное вещество. Предпочтительно дополнительно примешивать второй реактив.
Особенности первого и второго реактивов совпадают с особенностями, описанными выше для набора реактивов для измерения тромбоцитов.
Образец включает кровь (цельную кровь, обогащенную тромбоцитами плазму (PRP) и т.д.) и жидкий костный мозг, полученные из организмов, в частности из млекопитающих, включая человека. Образец может представлять собой кровь или жидкий костный мозг, разбавленный подходящим раствором, таким как буфер.
Первый реактив и образец предпочтительно смешивают для того, чтобы добиться концентрации нильского голубого в образце для измерений от 0,05 до 5,0 м.д., предпочтительно от 0,1 до 0,6 м.д. и более предпочтительно от 0,2 до 0,5 м.д.
Первый реактив можно разводить вторым реактивом для того, чтобы достичь вышеуказанной концентрации нильского голубого в образце для измерений после смешивания с образцом.
Когда используют второй реактив, первый и второй реактивы и образец предпочтительно смешивают при соотношении объемов (первый реактив + второй реактив): образец = от 100:1 до 1000:1.
Когда используют второй реактив, соотношение объемов первого и второго реактивов предпочтительно составляет от 1:10 до 1:100 и более предпочтительно от 1:20 до 1:75.
Когда на стадии смешивания добавляют второй реактив, порядок смешивания первого реактива, второго реактива и образца конкретно не ограничен.
Стадию смешивания можно осуществлять при температуре приблизительно от 25 до 50°C, более предпочтительно приблизительно от 35 до 45°C.
Время перемешивания предпочтительно составляет от 10 секунд до 5 минут, более предпочтительно от 10 секунд до 2 минут и более предпочтительно от 10 секунд до 60 секунд.
В способе измерения по настоящему изобретению клетки в образце для измерений освещают таким образом, чтобы добиться обнаружения и рассеивания света и флуоресценции, излучаемой клетками.
Устройство для освещения предпочтительно представляет собой проточный цитометр. В проточном цитометре образец для измерений вводят в проточную кювету проточного цитометра и освещают клетки в образце для измерений, проходящем через проточную кювету.
Источник света проточного цитометра конкретно не ограничен и может представлять собой любой источник света, подходящий для возбуждения нильского голубого (например, приблизительно от 600 до 680 нм). Источник света включает, например, красный полупроводниковый лазер и He-Ne лазер. Полупроводниковый лазер можно использовать, поскольку он дешевле, чем газовый лазер.
Рассеянный свет, излучаемый клетками, освещенными в проточном цитометре, может представлять собой или прямой рассеянный свет (угол падения света составляет приблизительно от 0 до 20 градусов), или боковой рассеянный свет (угол падения света составляет приблизительно 90 градусов). Прямой рассеянный свет может представлять собой или прямой рассеянный свет с малым углом (угол падения света составляет приблизительно от 1 до 5 градусов), или прямой рассеянный свет с большим углом (угол падения света составляет приблизительно от 6 до 20 градусов).
Флуоресценцию, излучаемую клетками, освещенными в проточном цитометре, можно обнаружить, выбрав длину волны падающего света, подходящую для нильского голубого (приблизительно от 630 до 680 нм).
На основании рассеянного света и флуоресценции, полученных как описано выше, получают диаграмму рассеивания для того, чтобы обнаружить тромбоциты путем дифференцирования тромбоцитов от загрязнителей, таких как компоненты клеток крови, отличные от тромбоцитов, липидные частицы. Также можно посчитать обнаруженные таким образом тромбоциты. Обнаружение и/или подсчет тромбоцитов предпочтительно осуществляют при помощи подходящего аналитического программного обеспечения.
Далее будет описано измерение тромбоцитов, используя анализатор образцов, оснащенный проточным цитометром, со ссылками на приложенные фигуры.
На фиг.2 изображен вид спереди схематической конструкции анализатора образцов. Анализатор образцов 1 представляет собой устройство, используемое, например, для гематологических тестов, и в общих чертах оно состоит из измерительного блока 2 и блока обработки данных 3. В измерительном блоке 2 измеряют определенные компоненты, содержащиеся в образце крови, а блок обработки данных 3 принимает данные об измерении для того, чтобы осуществлять аналитическую обработку.
На фиг.3 изображена блочная диаграмма, на которой показана схематическая конструкция анализатора образцов 1. Как показано на фиг.3, измерительный блок 2 содержит блок управления 4 управления работой соответствующих блоков; блок обнаружения 5 оснащен проточным цитометром для обнаружения частиц, подлежащих анализу в образце; блок подготовки образцов 6 для получения образца для измерений и предоставления подготовленного образца для измерений в блок обнаружения 5; и интерфейс 7 для передачи данных из блока обработки данных 3. Блок обработки данных 3 содержит блок управления 8 для управления работой соответствующих блоков; блок анализа данных 9 для анализа обнаруженных данных, принятых от измерительного блока 2; блок вывода 10, который отображает результаты анализа из блока анализа данных 9 в виде диаграмм рассеивания; блок ввода 11, который воспринимает команды оператора; и интерфейс 12 для передачи данных из измерительного блока 2.
Далее будет описано устройство блока обнаружения 5, оснащенного проточным цитометром, со ссылками на фиг.4. На фиг.4 изображена схема расположения, на которой показано устройство блока обнаружения. В блоке обнаружения 5 предусмотрен полупроводниковый источник лазерного излучения 52 для того, чтобы испускать лазерный луч в направлении проточной кюветы 51. Между полупроводниковым источником лазерного излучения 52 и проточной кюветой 51 предусмотрены линзы для фокусировки луча 53, состоящие из нескольких линз. На световой оси, проходящей линейно от полупроводникового источника лазерного излучения 52, предусмотрена шторка для луча 54a так, чтобы располагаться за проточной кюветой 51 напротив линз для фокусировки луча 53, так что прямому свету от полупроводникового источника лазерного излучения 52 препятствует шторка для луча 54a. Далее по ходу световой оси за шторкой для луча 54a предусмотрен фотодиод 54.
Когда образец для измерений проходит через проточную кювету 51, сигналы рассеянного света и флуоресценции образуются благодаря лазерному лучу. Из этих сигналов прямой световой сигнал испускается в направлении фотодиода 54. Наряду с лучами света, которые идут вдоль световой оси, линейно распространяющимися от полупроводникового источника лазерного излучения 52, прямому свету от полупроводникового источника лазерного излучения 52 препятствует шторка для луча 54a, и на фотодиод 54 в основном падает рассеянный свет, который идет от источника света (в дальнейшем в этом документе обозначается как «прямой рассеянный свет»). Прямой рассеянный свет, испускаемый из проточной кюветы 51, подвергается фотоэлектрическому преобразованию в фотодиоде 54, и, таким образом, образовавшийся электрический сигнал (в дальнейшем в этом документе обозначается как «прямой сигнал светорассеяния») усиливается в усилителе 54b. Прямой сигнал светорассеяния передается в блок управления 4, а затем передается в блок обработки данных 3 через интерфейс 7 и обрабатывается в блоке анализа данных 9 блока обработки данных 3.
Такой прямой сигнал светорассеяния отражает размер обнаруживаемых частиц. При помощи обработки прямого сигнала светорассеяния в блоке анализа данных 9 получают размеры обнаруженных частиц.
В направлении, которое под прямым углом пересекается со световой осью, которая линейно идет от полупроводникового источника лазерного излучения 52 к фотодиоду 54, предусмотрена боковая собирающая линза 55 для того, чтобы с помощью боковой собирающей линзы 55 собирать боковой свет, который образуется, когда полупроводниковым лазером освещают подлежащие обнаружению частицы, проходящие через проточную кювету 51 (свет, который испускается в направлении под прямым углом к световой оси). Далее по ходу, за боковой собирающей линзой 55, в направлении бокового света, предусмотрено дихроическое зеркало 56 для того, чтобы делить световой сигнал, поступающий от боковой собирающей линзы 55, на компоненту рассеянного света и флуоресцентную компоненту. Сбоку от дихроического зеркала 56 (в направлении, которое пересекает световую ось, соединяющую боковую собирающую линзу 55 и дихроическое зеркало 56) предусмотрен фотодиод 57, на который падает боковой рассеянный свет, и далее по ходу световой оси, за дихроическим зеркалом 56, предусмотрен оптический фильтр 58a и фотоумножитель 58. Боковая компонента рассеянного света, отделенная дихроическим зеркалом 56, подвергается фотоэлектрическому преобразованию в фотодиоде 57, и, таким образом, образующийся электрический (в дальнейшем в этом документе обозначается как «боковой сигнал светорассеяния») усиливается в усилителе 57a. Боковой сигнал светорассеяния подается в блок управления 4, а затем подается в блок обработки да