Способ определения бактериальных липополисахаридных антигенов в почве
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается способа определения бактериальных липополисахаридных антигенов в почве. Сущность изобретения включает получение антител на липополисахариды, приготовление почвенной суспензии с последующей сорбцией бактериальных клеток и липополисахаридов в составе микроосадка из полученной суспензии, проведение иммунноферментного анализа сформированного микроосадка с антителами на липополисахариды, выделенными из сыворотки крови кроликов, иммунизированных целыми бактериальными клетками рода Azospirillum, обработанными 2%-ным раствором глутарового альдегида и представляющими собой иммуноглобулины класса G, с измерением оптической плотности продуктов иммуноферментной реакции, сравнение измеренных значений оптической плотности с контрольными значениями, при этом о наличии бактериальных липополисахаридных антигенов судят по величине отклонения измеренных значений от контрольных на величину не менее 10-15%. Преимущество изобретения заключается в выявлении антигена, специфичного для почвенных азотфиксирующих бактерий рода Azospirillum, непосредственно в почвенных суспензиях. 7 з.п. ф-лы, 1 пр., 3 ил.
Реферат
Изобретение относится к способам исследования материалов при помощи иммунологического анализа.
Известен способ твердофазного иммуноферментного анализа для специфической идентификации и подсчета Azospirillum brasilense Cd на корнях злаковых растений, который может быть использован и для определения бактериальных антигенов в почве. Способ заключается в выявлении бактерий с помощью кроличьих антител (Ат) на интактные клетки в бактериальных суспензиях или гомогенатах корней с применением анти-кроличьих Ат, коньюгированных со щелочной фосфатазой (Levanony H., Bashan Y., Kahana Z.E. Enzyme-linked immunosorbent assay for specific identification and enumeration of Azospirillum brasilense Cd in cereal roots // Appl. Environ. Microbiol. 1987. V.53. P.358-364).
Однако антитела, используемые для реализации известного метода, характеризуются весьма широкой специфичностью и ограниченно пригодны для выявления штаммов азоспирилл, относящихся к определенным серологическим группам. Кроме того, для получения регистрируемых результатов с помощью этого способа требуется долговременная инкубация реагентов с козьими анти-кроличьими антителами, конъюгированными со щелочной фосфатазой (в течение ночи), а время развития ферментативной реакции составляет от 2-х до 24-х часов. При этом используют не стандартные планшеты для иммуноферментного анализа (ИФА), а планшеты для культуры тканей, специально предназначенных для адсорбции клеток.
Известен способ иммуноферментного определения в почве фитопатогенного вируса, заключающийся в иммуноферментном исследовании (сэндвич-методом) вирусных частиц, извлеченных из почвенных образцов с помощью вымывающего буфера, отфильтрованных под вакуумом от частиц почвы через специальный фильтр и переведенных в осадок с помощью ультрацентрифугирования. Сэндвич-метод иммуноферментного определения при этом подразумевает использование специальных дополнительных антител для адсорбции определяемых частиц в лунках планшетов для ИФА (ToMV (Fillhart R.C., Bachand G.D., Castello J.D. Detection of infectious tobamoviruses in forest soils // Appl. Environ. Microbiol. 1998. V.64. P.1430-1435)).
Однако известный способ не позволяет выявлять вирусы непосредственно в почвенных образцах и требует выполнения дополнительных процедур (фильтрование, ультрацентрифугирование) для выделения и концентрирования вирусных частиц.
Задачей, на решение которой направлено заявляемое техническое решение, является оптимизация условий проведения твердофазного ИФА с использованием Ат на липополисахариды (ЛПС).
Технический результат, достигаемый при использовании заявляемого изобретения, заключается в выявлении антигена, специфичного для почвенных азотфиксирующих бактерий рода Azospirillum, непосредственно в почвенных суспензиях.
Почвенные азотфиксирующие бактерии рода Azospirillum представляют собой признанный модельный объект в исследовании феномена растительно-микробной ассоциативности. Прогресс в их исследовании в качестве потенциальных стимуляторов роста растений в значительной степени зависит от развития быстрых и надежных способов качественного и количественного определения данных микроорганизмов в почве. Выявляющие системы на основе антител являются весьма удобным средством мониторинга разнообразных микроорганизмов, и одним из наиболее эффективных серологических подходов является иммуноферментный анализ - метод выявления антигенов (или антител), основанный на определении комплекса антиген-антитело за счет введения в один из компонентов реакции ферментативной метки.
Поставленная задача решается тем, что способ определения бактериальных липополисахаридных антигенов в почве согласно техническому решению включает получение специфических антител на липополисахариды, приготовление почвенной суспензии с последующей сорбцией бактериальных клеток и липополисахаридов в составе микроосадка из полученной суспензии, проведение иммунноферментного анализа сформированного микроосадка с антителами на липополисахариды с измерением оптической плотности продуктов иммуноферментной реакции, сравнение измеренных значений оптической плотности с контрольными значениями, при этом о наличии бактериальных липополисахаридных антигенов судят по величине отклонения измеренных значений от контрольных на величину не менее 10-15%. Для получения специфических антител на липополисахариды приготавливают суспензию грамотрицательных бактерий в 2%-ном растворе глутарового альдегида, после чего проводят иммунизацию кроликов обработанной суспензией с последующим забором крови и выделением из нее антител в виде фракции иммуноглобулинов класса G. При приготовлении почвенной суспензии образцы почвы ресуспендируют в 0.05-молярном натрий-карбонатном буферном растворе из расчета на 1 часть почвы - 35-45 частей буферного раствора, после чего полученную суспензию титруют последовательными двойными разведениями с использованием вышеупомянутого буферного раствора в лунках планшета для проведения иммуноферментного анализа. При проведении иммуноферментного анализа в лунки с почвенной суспензией вносят по 100 мкл 0.05% раствора полиэтиленгликоля с молекулярной массой 15000-25000 в качестве балластного блокирующего соединения, затем удаляют блокирующий раствор, после чего вносят в лунки по 50 мкл специфических антител на липополисахариды, растворенных в забуференном фосфатами физиологическом растворе, содержащем 0.02% Твин-20 и 0.005% полиэтиленгликоля, после многократной промывки лунок, достаточной для избавления от неспецифически связанных антител, вносят по 50 мкл раствора, содержащего 0.02% Твин-20 и 0.005% полиэтиленгликоля, в который были добавлены меченые пероксидазой козьи анти-кроличьи антитела в количестве 1-5 мкг/мл, затем планшеты дважды промывают забуференным фосфатами физиологическим раствором, содержащим 0.02% Твин-20, и в лунки вносят по 50 мкл субстрата для оценки пероксидазной активности, представляющего собой 0.03% орто-фенилендиамина и 0.02% перекиси водорода в 0.1 М натрий-цитратном буфере (рН 4.5). Иммунизацию кроликов проводят внутривенно, при этом животным вводят 6 раз ежедневно суспензию клеток объемом от 0.4 до 1.6 мл, спустя неделю инъекции повторяют 4 раза (ежедневно), используя по 2 мл суспензии, или проводят внутрикожно или подкожно рассредоточенными подкожными инъекциями в область спины, при этом животным вводят 1 мл бактериальной суспензии, предварительно смешанной с адъювантом Фрейнда в соотношении 1:1, еженедельно в течение 4 недель или проводят 3 раза с интервалом 2 недели, вводя в подколенные лимфатические узлы, 0.5, 1 и 1.5 мл суспензии клеток, предварительно смешанной с адъювантом Фрейнда в соотношении 1:1; при этом отбор крови проводят через 6 суток после последней иммунизации, антитела получают фракционированием антисыворотки 40% сульфатом аммония с последующим диализом против забуференного фосфатами физиологического раствора. При ресуспендировании образцов почвы сначала проводят разведение образцов почвы из расчета на 1 г почвы - 10 мл 0.05-молярного натрий-карбонатного буфера (рН 9.6), после чего взвесь встряхивают в течение 25-35 сек, затем отбирают 250 мкл взвеси и разводят ее тем же буфером, доводя объем до 1 мл. Для проведения сорбции антигена из полученной почвенной суспензии планшеты с нанесенными образцами почвенной суспензии выдерживают в течение 30-60 мин на виброшейкере при температуре 18-22°, затем выдерживают в течение 18 часов при температуре 4°, после чего производят декантирование суспензии. Изобретение поясняется следующими изображениями.
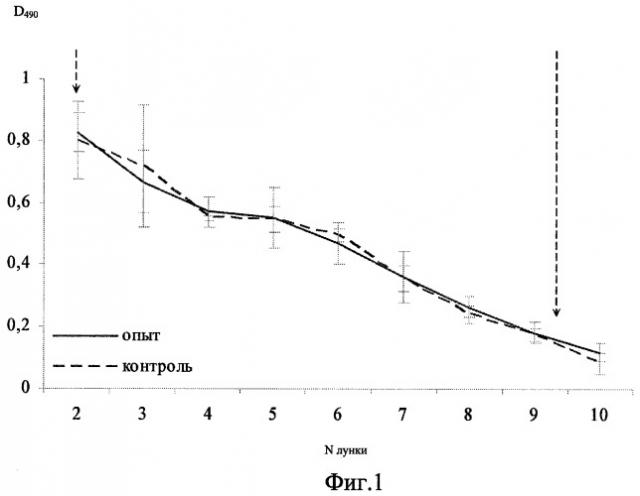
На фиг.1 представлен график значений D490 опытных и контрольных образцов почвы через 60 мин после внесения в почву бактерий A. brasilense Sp245 (вертикальными стрелками отмечены области значений, использованные при учете результатов).
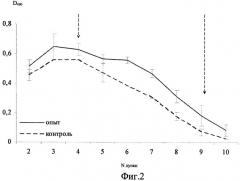
На фиг.2 представлен график значений D490 опытных и контрольных образцов почвы через 7 суток после внесения в почву бактерий A. brasilense Sp245 (вертикальными стрелками отмечены области значений, использованные при учете результатов).
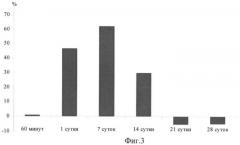
На фиг.3 представлены результаты ИФА образцов почвы (чернозем южный) с использованием Ат на ЛПСSp245 после внесения суспензии клеток A.brasilense Sp245.
Заявляемый способ осуществляют следующим образом.
В модельных почвенных экспериментах использовали образец почвы чернозема южного, отобранный в Саратовской области.
При осуществлении способа использованы антитела, полученные иммунизацией кроликов целыми клетками азоспирилл, поверхность которых предварительно обрабатывали глутаровым альдегидом. При таком способе иммунизации в крови подопытных животных синтезируются антитела, специфичные к O-антигенам бактерий. Культуры клеток выращивали в течение 18 часов на жидкой синтетической малатной среде, содержащей в 1 л: малат Na - 5 г, KH2PO4 - 0.4 г, K2HPO4 - 0.4 г, NaCl - 0.1 г, MgSO4 - 0.2 г, FeSO4·7H2O - 0.02 г, Na2MoO4·2H2O - 0.002 г, NH4Cl - 1 г (рН 6.8-7.0). По окончании культивирования клетки отделяли центрифугированием, отмывали дважды в забуференном фосфатами физиологическом растворе (ЗФР) и переносили в раствор, содержащий 2% глутарового альдегида. Полученную суспензию клеток хранили при температуре +4°С. Непосредственно перед иммунизацией клетки дважды отмывали в ЗФР. Использовали суспензию клеток с оптической плотностью D660=0.5 при длине волны света 660 нм в кювете толщиной 1=1 см, чему соответствует их концентрация примерно 109 кл/мл. Иммунизацию животных производят различными способами, например, внутривенным введением суспензии клеток объемом от 0.4 до 1.6 мл. При этом животных иммунизировали 6 раз ежедневно. Через неделю инъекции повторяли 4 раза (ежедневно), используя по 2 мл суспензии. Отбор крови проводили через 6 суток после последней иммунизации. Фракции иммуноглобулинов (IgG) получали из антисывороток осаждением сульфатом аммония. Иммунизация может быть произведена и внутрикожно/подкожно и внутрь лимфатических узлов, однако наиболее оптимальной с точки зрения эффективности дальнейшей реализации способа является иммунизация внутрь лимфатических узлов, заключающаяся в трехкратном введении кроликам с интервалом 2 недели в подколенные лимфатические узлы 0.5, 1 и 1.5 мл суспензии клеток, предварительно смешанной с адъювантом Фрейнда в соотношении 1:1. Преимущество этой методики определяется меньшими трудозатратами при неизменно высоком титре получаемых специфических антител.
Для дальнейшей реализации способа подготавливали почвенную суспензию. Образцы почвы в количестве 1 г тщательно ресуспендировали в 10 мл 0.05-молярного натрий-карбонатного буфера (рН 9.6), после чего полученную суспензию активно встряхивали вручную в течение 30 сек, отбирали 250 мкл взвеси и разводили ее тем же буфером, доводя объем до 1 мл. По 50 мкл последовательных двойных разведении образцов вносили в лунки планшета для иммуноферментного анализа. Анализ всех проб проводили в дупликатах. «Нулевым» контролем, определяющим значение оптической плотности, вычитаемое из всех значений, полученных для индивидуального образца, являлись лунки с натрий-карбонатным буфером, не содержащие антигена. Планшеты с нанесенными образцами выдерживали в течение 30 мин на виброшейкере при комнатной температуре для обеспечения равномерной сорбции антигена из раствора; в половине планшетов иммобилизацию антигена на этом завершали, удалив из них исследуемые суспензии декантированием, а в оставшихся планшетах иммобилизацию проводили в течение ночи (18 ч) при +4°С без перемешивания. На следующем этапе в лунки планшетов вносили по 100 мкл 0.05% раствора полиэтилегликоля-20000 (ПЭГ) в качестве балластного соединения для блокирования свободных связей на полистироле. После удаления блокирующего раствора в лунки вносили по 50 мкл кроличьих анти-ЛПС антител («первых» Ат), растворенных в ЗФР, содержащем 0.02% Твин-20 и 0.005% ПЭГ (для предотвращения неспецифической сорбции антител) (раствор 1). После трехкратной промывки лунок 100 мкл ЗФР, содержащим 0.02% Твин-20 (раствор 2), в них вносили по 50 мкл раствора 1, в который были добавлены меченые пероксидазой козьи анти-кроличьи антитела («Sigma», США) (2 мкг/мл). Планшеты дважды промывали раствором 2 и в лунки вносили по 50 мкл субстрата для оценки пероксидазной активности, представляющего собой 0.03% ОФДА и 0.02% перекиси водорода в 0.1 М натрий-цитратном буфере (рН 4.5). Реакцию останавливали внесением в лунки планшетов по 100 мкл 1-нормального раствора серной кислоты. Измерения оптической плотности исследуемых проб проводили при длине волны 490 нм (D490).
Для выявления специфического бактериального антигена использовали непрямой иммуноферментный анализ - при котором окрашенный продукт появляется в результате взаимодействия комплекса антиген-антитело с анти-иммуноглобулиновыми Ат, конъюгированными с ферментом.
Установлено, что даже кратковременная иммобилизация образцов на твердой фазе позволяет получать достоверный результат по выявлению бактерий. Тем не менее, время иммобилизации антигена сказывалось на результатах эксперимента, т.к. разница в итогах 30-минутной и 18-часовой адсорбции составляла примерно 10%. Зависимость величины регистрируемого сигнала от концентрации анализируемого соединения при проведении ИФА практически всегда имеет в той или иной степени нелинейный характер. При этом анализ такого сложного матрикса, как почва, осложняется наличием различных интерферирующих факторов, влияющих на протекание ферментной реакции в каждом конкретном случае. Поэтому отмечают не абсолютные значения D490, а разницу значений D490 опытных и контрольных образцов в областях примерной линейной зависимости значений оптической плотности от степени разведения проб. На фиг.1 и 2 приведены графики, отражающие различия значений D490 опытных и контрольных образцов почвы через 60 мин (а) и через 7 суток (б) после внесения бактерий A.brasilense Sp245. Математическая обработка результатов состоит в определении выраженной в процентах разницы значений D490 опытных и контрольных образцов. Разницу значений находят для каждого разведения, конечный результат (фиг.3) представляет собой среднюю величину (среднее арифметическое).
Результаты ИФА почвенных суспензий позволили оценить динамику численности азоспирилл в почве, инокулированной штаммом A. brasilense Sp245.
Пример конкретного выполнения.
Заявляемый способ реализован для образцов почвы чернозема южного, отобранного в Саратовской области. В экспериментах по интродукции бактерий в почву использовали штамм A.brasilense Sp245. Бактерии выращивали при 30°С до поздней логарифмической фазы роста в жидкой синтететической малатной среде и отмывали в ЗФР. Поликлональные Ат на ЛПС штамма A. brasilense Sp245 получали иммунизацией кроликов. Образцы почв отбирали в середине августа. Для внесения штамма A. brasilense Sp245 в почву 18-часовую бульонную культуру дважды отмывали в ЗФР и осаждали центрифугированием. Ресуспендированные в ЗФР клетки вносили в лабораторные пластиковые сосуды с почвой (1×109 кл/г почвы). Результаты ИФА почвенных суспензий получены при адсорбции образцов в лунках планшетов в течение ночи, концентрации выявляющих кроличьих антител 50 мкг/мл, концентрации конъюгированных с пероксидазой козьих анти-кроличьих антител 2 мкг/мл и развитии хромофорной реакции в течение 4 мин. Для проведения иммуноферментного анализа в качестве твердой фазы использовали полистироловые 96-луночные планшеты (ООО «Медполимер», г.Санкт-Петербург, Россия). Тестируемые образцы иммобилизовали за счет простой адсорбции. В качестве ферментной метки использовали пероксидазу хрена, конъюгированную с козьими анти-кроличьими антителами («Sigma», США). В качестве субстратного реагента использовали орто-фенилендиамин (ОФДА) с перекисью водорода. Интенсивность окрашивания раствора измеряли на иммуноферментном анализаторе АИФ-Ц-01С (ЗАО «ИЛИП», г.Санкт-Петербург, Россия). Изменение численности интродуцированных бактерий оценивали в сравнении с контрольной почвой. Отбор проб проводили через 60 мин, 24 часа (1 сутки), а также через 7, 14, 21 и 28 суток после внесения бактериальной суспензии в почву. Полученные результаты подвергали статистической обработке. Доверительные интервалы определяли для 95% уровня значимости.
Таким образом, заявляемый способ может быть использован как для контроля поведения интродуцированных в почву бактерий и оценки эффективности применения бактериальных удобрений и биокомплексов, так и для исследования воздействия различных факторов на почвенный микробиоценоз.
1. Способ определения бактериальных липополисахаридных антигенов в почве, включающий приготовление почвенной суспензии с последующей сорбцией бактериальных клеток и липополисахаридов в составе микроосадка из полученной суспензии, проведение иммуноферментного анализа сформированного микроосадка с антителами на липополисахариды, выделенными из сыворотки крови кроликов, иммунизированных целыми бактериальными клетками рода Azospirillum, обработанными 2%-ным раствором глутарового альдегида, и представляющими собой иммуноглобулины класса G, с последующим измерением оптической плотности продуктов ферментной реакции, сравнение измеренных значений оптической плотности с контрольными значениями, при этом о наличии бактериальных липополисахаридных антигенов судят по величине отклонения измеренных значений от контрольных на величину не менее 10-15%, при этом для приготовления почвенной суспензии образец почвы сначала суспендируют в натрий-карбонатном буфере, а затем отбирают взвесь и разводят ее тем же буфером для последующего иммуноферментного анализа, иммуноферментный анализ проводят с использованием меченных пероксидазой козьих анти-кроличьих антител.
2. Способ определения бактериальных липополисахаридных антигенов в почве по п.1, отличающийся тем, что при приготовлении почвенной суспензии образцы почвы ресуспендируют в 0,05-молярном натрий-карбонатном буферном растворе из расчета на 1 часть почвы - 35-45 частей буферного раствора, после чего полученную суспензию титруют последовательными двойными разведениями с использованием вышеупомянутого буферного раствора в лунках планшета для проведения иммуноферментного анализа.
3. Способ определения бактериальных липополисахаридных антигенов в почве по п.1, отличающийся тем, что при проведении иммуноферментного анализа в лунки с почвенной суспензией вносят по 100 мкл 0.05%-ного раствора полиэтиленгликоля с молекулярной массой 15000-25000 в качестве балластного блокирующего соединения, затем удаляют блокирующий раствор, после чего вносят в лунки по 50 мкл специфических антител на липополисахариды, растворенных в забуференном фосфатами физиологическом растворе, содержащем 0.02% Твин-20 и 0.005% полиэтиленгликоля, после многократной промывки лунок, достаточной для избавления от неспецифически связанных антител, вносят по 50 мкл раствора, содержащего 0.02% Твин-20 и 0.005% полиэтиленгликоля, в который были добавлены меченые пероксидазой козьи анти-кроличьи антитела в количестве 1-5 мкг/мл, затем планшеты дважды промывают забуференным фосфатами физиологическим раствором, содержащим 0.02% Твин-20, и в лунки вносят по 50 мкл субстрата для оценки пероксидазной активности, представляющего собой 0.03% орто-фенилендиамина и 0.02% перекиси водорода в 0.1 М натрий-цитратном буфере (рН 4.5).
4. Способ определения бактериальных липополисахаридных антигенов в почве по п.1, отличающийся тем, что иммунизацию кроликов проводят внутривенно, при этом животным вводят 6 раз ежедневно суспензию клеток объемом от 0.4 до 1.6 мл, спустя неделю инъекции повторяют 4 раза (ежедневно), используя по 2 мл суспензии.
5. Способ определения бактериальных липополисахаридных антигенов в почве по п.1, отличающийся тем, что иммунизацию кроликов проводят внутрикожно или подкожно рассредоточенными подкожными инъекциями в область спины, при этом животным вводят 1 мл бактериальной суспензии, предварительно смешанной с адъювантом Фрейнда в соотношении 1:1, еженедельно в течение 4 недель.
6. Способ определения бактериальных липополисахаридных антигенов в почве по п.1, отличающийся тем, что иммунизацию кроликов проводят 3 раза с интервалом 2 недели, вводя в подколенные лимфатические узлы, 0.5, 1 и 1.5 мл суспензии клеток, предварительно смешанной с адъювантом Фрейнда в соотношении 1:1; при этом отбор крови проводят через 6 суток после последней иммунизации, антитела получают фракционированием антисыворотки 40% сульфатом аммония с последующим диализом против забуференного фосфатами физиологического раствора.
7. Способ определения бактериальных липополисахаридных антигенов в почве по п.2, отличающийся тем, что при ресуспендировании образцов почвы сначала проводят разведение образцов почвы из расчета на 1 г почвы - 10 мл 0.05-молярного натрий-карбонатного буфера (рН 9.6), после чего взвесь встряхивают в течение 25-35 с, затем отбирают 250 мкл взвеси и разводят ее тем же буфером, доводя объем до 1 мл.
8. Способ определения бактериальных липополисахаридных антигенов в почве по п.1, отличающийся тем, что для проведения сорбции антигена из полученной почвенной суспензии планшеты с нанесенными образцами почвенной суспензии выдерживают в течение 30- 60 мин на виброшейкере при температуре 18-22°, затем выдерживают в течение 18 ч при температуре 4°, после чего производят декантирование суспензии.