Способ получения генетически модифицированных растений каланхоэ, экспрессирующих ген цекропина p1
Иллюстрации
Показать всеИзобретение относится к области биотехнологии растений. Предложен способ получения генетически модифицированных растений рода каланхоэ, экспрессирующих ген цекропина Р1 и обладающих антимикробной активностью. Использование изобретения обеспечивает повышение бактерицидных свойств растений рода каланхоэ, что может найти дальнейшее применение в фармакологии. 2 з.п. ф-лы, 1 табл., 15 пр., 5 ил.
Реферат
Изобретение относится к области селекции и биотехнологии растений, в частности к генной инженерии растений. Изобретение может быть использовано для получения генетически модифицированных растений каланхоэ, экспрессирующих ген антимикробного пептида - цекропина Р1.
Каланхоэ - лекарственное растение, сок которого используют для лечения ожогов, язв, кожных ран и в качестве биостимулятора при пересадке кожи. В соке этого многолетнего травянистого растения содержатся флавоноиды, дубильные вещества, витамин С, микро- и макроэлементы: алюминий, магний, железо, кальций, кремний, марганец, медь. В листьях каланхоэ обнаружены полисахариды, органические кислоты: яблочная, щавелевая, уксусная, а также ферменты, из которых получают биологически активные препараты. Каланхоэ оказывает общее благотворное влияние на иммунитет человека.
Повышение лечебных и бактерицидных свойств каланхоэ можно получить за счет экспрессии в растениях генов антибактериальных пептидов. В настоящее время антимикробные пептиды рассматривают как перспективную альтернативу классическим антибиотикам. Антимикробные пептиды различных классов найдены у всех эукариот, в том числе у растений и человека. Они являются интегрированной частью их иммунной системы, проявляют специфическую антибиотическую активность против различных патогенных бактерий и грибов и обладают апоптозной активностью [1].
Механизм действия антимикробных пептидов связан с нарушением целостности клеточной мембраны патогенов и последующей их гибелью. В отличие от разнообразной защиты против классических антибиотиков, микроорганизмы не обладают механизмами устойчивости против антимикробных пептидов. В настоящее время установлена структура более 700 таких соединений, характерные свойства которых - суммарный положительный заряд и амфифильность. Антимикробные пептиды вызывают лизис клеток бактерий и грибов, нарушая целостность мембран и повышая их проницаемость. В концентрации 0.1-5 мкМ они проявляют литическую активность против различных микроорганизмов, но не по отношению к клеткам животных и растений [2].
В настоящее время методы генетической инженерии позволяют синтезировать и производить в клетках различных органов гетерологичные белки с терапевтической целью. Трансгенные растения являются перспективными объектами для получения дешевых и безопасных рекомбинантных белков по сравнению с их традиционными продуцентами. В бактериальных системах экспрессии синтезируемые белки могут не приобретать нативной конформации и требуют сложной и дорогостоящей процедуры их очистки.
Трансгенные растения представляют собой экономически выгодную альтернативу другим системам экспрессии и могут быть использованы в качестве "биофабрик" по производству целевых белков для медицинских и фармацевтических целей.
Так, с помощью генно-инженерных методов получены растения, способные производить ряд биофармацевтических продуктов для лечения различных заболеваний человека, например, эритропоэтин для лечения анемии, инсулин для лечения диабета, также получены трансгенные растения, экспрессирующие энкефалины, α-интерферон, человеческий сывороточный альбумин [3, 4]. Что касается получения трансгенных растений каланхоэ, то имеются только единичные публикации по трансформации некоторых видов этих растений.
Известен способ агробактериальной трансформации вида каланхоэ Kalanchoe daigremontiana, когда исследовалось соединение фруктозо-2.6-бифосфат (Fru2,6-P2), играющее важную роль в регуляции углеродного обмена при САМ фотосинтезе (кислотный метаболизм толстянковых). Трансгенные растения каланхоэ содержали ген 6-фосфофрукто-2-киназу (35S/6-PF-2-K), клонированный в бинарный вектор pBin19 в штамме агробактерий Agrobacterium tumefaciens LBA4404 (pAL4404). Трансформация растений этим геном приводила к увеличению концентрации Fru2,6-P2 в листьях и, как следствие, к повышению устойчивости растений к стрессовым условиям.
В качестве эксплантов для трансформации использовали сегменты листьев. В процессе трансформации экспланты культивировали на селективной среде МС (Мурашиге-Скуга) [5], содержащей 3,0% сахарозы, 0.8% агара, 10 мкМ кинетина (КТ), 0.5 мкМ 2.4.дихлорфеноксиуксусной кислоты (2.4 Д), 100 мг/л карбенициллина (Кб) и 50 мг/л канамицина для индукции каллусогенеза. После образования каллусов через 3 недели, экспланты переносили на свежую среду МС, содержащую 3% сахарозы, 0.8% агара, 5 мкМ бензиладенина (БА), 100 мг/л Кб и 50 мг/л Км для побегообразования (6-8 недель). Образовавшиеся побеги для укоренения переносили в сосуды со средой МС, содержащей 2% сахарозы, 0.8% агара и 20 мг/л Км. Растения культивировали при 24°C, световой режим: 14 ч день и 10 ч ночь, 3 клк [6].
Этот способ трансформации имеет недостаток - в нем отсутствует органогенез и применена стадия каллусообразования, что повышает вероятность сомаклональной изменчивости.
Известен способ трансформации каланхоэ вида Ласиниата (Kalanchoe laciniata). Листовые экспланты каланхоэ кокультивировали с агробактериальными штаммами Agrobacterium tumefaciens A208SE, Agrobacterium tumefaciens GV3111SE, Agrobacterium tumefaciens EHA101, несущими бинарный вектор pRDA93. Вектор содержал гены nptII (неомицинфосфотрансферазы II) и gus (β-глюкуронидазы).
Для получения трансгенных побегов использовали 3 стадии культивирования: 1-я стадия включала индукцию побегов на среде МС, содержащей 1 мг/л БА и 0.2 мг/л ИУК (индолилуксусной кислоты); 2-я стадия - элонгацию побегов на среде МС, содержащей 0.5 мг/л КТ и 0.1 мг/л ИУК. 3-я стадия - укоренение побегов - включала культивирование растений на среде, содержащей 1/2 солей МС и 0.2 мг/л ИУК [7].
Известен способ получения трансгенных растений каланхоэ вида Блосфельдиана (Kalanchoe blossfeldiana) с уменьшенной чувствительностью к растительному гормону этилену, за счет экспрессии мутантного рецептора гена etr1-1 из арабидопсиса (Arabidopsis thaliana) под контролем цветоспецифичного промотора fbp1 из петунии (Petunia).
В этой работе генетическую трансформацию каланхоэ проводили с помощью агробактерий Agrobacterium tumefaciens AGL0 с бинарным вектором рВЕO210:: etr1-1. Для регенерации побегов использовали селективную среду, содержащую регуляторы роста: 0.45 мкМ тидиазурон (ТДЗ), 0.57 мМ ИУК и антибиотики: 100 мг/л канамицин (Км) и 300 мг/л цефотаксим. Субкультивацию проводили через каждые 3 недели. Через 4 месяца побеги пересаживали на среду, содержащую 0.57 мМ гибберелловой кислоты (ГА) и 0.57 мМ нафтилуксусной кислоты (НУК) для элонгации и укоренения побегов. Через 3 месяца отдельные укорененные растения высаживали в почву.
Трансгенные растения обладали замедленной скоростью старения. Увядание контрольных цветов начиналось на 2-й день при добавлении этилена 2 мкл/л, в то время как цветы трансгенных растений увядали на 10-й день [8].
Известен способ агробактериальной трансформации каланхоэ вида Дегремона (Kalanchoe daigremontiana). Используя механизмы процессов органогенеза и эмбриогенеза исследовали регуляцию вегетативного размножения в листьях каланхоэ. Супрессия мутантного гена stm (shoot meristemless) из арабидопсиса, перенесенного в растения каланхоэ, исключала возможность образования молодых побегов («деток») по краю листа каланхоэ [9, 10].
Однако эти способы имеют ряд недостатков - низкая эффективность трансформации - около 3%, использовалось большое количество регуляторов роста, из-за чего эксперимент по получению трансгенных растений занимает длительный период времени (больше года).
Рассмотренные примеры способов генетической трансформации различных видов каланхоэ указывают на их отличия как в использовании векторных систем, так и в методах селекции трансформированных клеток и их культивирования и регенерации до целых растений, что свидетельствует о необходимости разработки эффективных специфических способов трансформации каждого конкретного вида каланхоэ.
Что касается каланхоэ перистого (Kalanchoe pinnata), широко применяемого в фармакологии, то в литературе отсутствуют данные о получении трансформированных растений этого вида.
Цекропин Р1 нематод относится к группе линейных α-спиральных пептидов, не содержащих цистеина. Изучение его структуры показало, что в отличие от цекропинов насекомых он состоит из одной длинной положительно заряженной α-спирали, в образовании которой задействованы практически все аминокислотные остатки.
В связи с особенностями действия на мембраны цекропин Р1 обладает уникальными свойствами. Он высоко активен против грамотрицательных бактерий (Pseudomonas aeruginosa IFO3899, Salmonella typhimurium IFO 13245, Serratia marcescens IFO3736, Escherichia coli JM 109, Acinetobacter calcoaceticus Ac 11), против грамположительных бактерий (Staphylococcus aureus IFO12732, Bacillus subtillis IFO3134, Bacillus megaterium Bm 11, Micrococcus luteus IFO12708), а также против дрожжей (Sacharomyces cerevisiae MAFF113011, Candida albicans IFO1060), опухолевых клеток [12] и грибных фитопатогенов [13].
Таким образом, представляется актуальным биосинтез в трансгенных растениях, в частности в каланхоэ, цекропина Р1 для его фармацевтического и медицинского использования. Трансгенные растения свободны от вирусов патогенных для человека и, следовательно, не требуется очистка получаемого в них продукта от вирусов.
Наиболее близким к предлагаемому является способ, описанный в работе [14], он включает получение и анализ трансгенных растений каланхоэ перистое (Kalanchoe pinnata), экспрессирующее синтетический ген цекропина Р1. Для трансформации растений каланхоэ использовалась конструкция - вектор pGA482::cecP1. Полученную конструкцию переносили в клетки агробактерий GV310 (pMP90RK), которую использовали для трансформации растений.
Результаты биотестирования по устойчивости показали, что трансгенные растения каланхоэ проявляли антибактериальную и антифунгальную активность против Erwinia carotovora, Pseudomonas syringae, Sclerotinium sclerotiorum и Phytophthora infestans.
В данной работе описано получение трансгенного растения одного вида, проявляющее антибактериальную и антифунгальную активность против четырех видов фитопатогенов и не проявляющего активность против патогенов человека.
Задачей указанного изобретения является разработка эффективного способа получения генетически модифицированных растений рода Kalanchoe, экспрессирующих ген цекропина Р1.
Технический эффект, который может быть получен при использовании предлагаемого изобретения, заключается в том, что полученные трансгенные растения каланхоэ обладают ценными фармакологическими свойствами и повышенной устойчивостью к патогенам, кроме того, способ обеспечивает высокую эффективность трансформации и сокращение сроков получения генетически модифицированных растений. Сок полученных трансгенных растений каланхоэ обладает свойством сохранять антимикробную активность за счет экспрессии цекропина Р1 после кипячения, что может быть полезным для получения фармакологического препарата сока каланхоэ.
Поставленная задача решается тем, что проводят сокультивирование эксплантов растений, выбранных из ряда растений вида Kalanchoe daigremontiana, Kalanchoe laciniata, Kalanchoe blossfeldiana, Kalanchoe pinnata, со штаммом бактерий Agrobacterium tumefaciens GV3101(pMP90RK), содержащим плазмиду pGA482, несущую ген белка цекропина P1 cecP1. Помещают экспланты на питательную среду для прямой регенерации до фертильных трансгенных растений, имеющих внесенные гены и признаки исходного сорта. Для элиминации агробактерий используют антибиотик тикарциллин и стимулирующую морфогенез добавку - банановый порошок. Для регенерации растений используют питательную среду МС, содержащую 6-бензиламинопурин (БАП) в количестве 0.5-1.0 мг/л и нафтилуксусную кислоту (НУК) в количестве 0.07-0.1 мг/л.
В качестве целевого гена для трансформации используют синтетический ген антимикробного пептида цекропина Р1 (cecP1), кодирующий 31-членную аминокислотную последовательность: SWLSKTAKKLENSAKKRISEGIAIAIQGGPR [11].
Штамм бактерий Agrobacterium tumefaciens GV3101(pMP90RK) [15] содержит плазмиду pGA482 [16]. При этом в состав кассеты экспрессии плазмиды pGA482 входят генетические конструкции, выбранные из ряда: промотор CaMV 35S - ген cecP1 - терминатор pACaMV;
промотор pNOS - ген nptII- терминатор pAnos.
Сокультивацию эксплантов каланхоэ с агробактериями (процесс трансформации) предпочтительно осуществляют в течение 48±5 часов при 18 - 24±2°С. При этом для регенерации используют питательную среду МС, содержащую регуляторы роста 1 мг/л БАП, 0.1 мг/л НУК и 30 г/л бананового порошка (Banana powder, "Sigma") (БП).
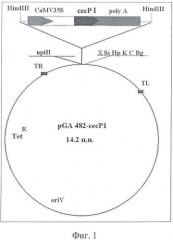
В качестве вектора для трансформации используют сконструированную при участии авторов предлагаемого изобретения плазмиду pGA482::сесР1 [17] (Фиг.1).
Ген цекропина P1 (cecP1) встречается в природе у нематод млекопитающих, из которых он был выделен и охарактеризован [18].
Векторная плазмида pGA482 с последовательностью cecP1, кодирующей пептид цекропин Р1, для переноса в растительные клетки конструировалась с использованием известных методов молекулярного клонирования [19] (Фиг.1).
Частота регенерации трансгенных побегов является важным показателем эффективности способа генетической трансформации. Она складывается из эффективностей отдельных этапов, начиная с подготовки эксплантов и заканчивая составом среды для селекции трансформантов. Частота регенерации отражает число отдельных трансформантов при пересчете на число исходных инокулированных эксплантов.
Полученные данные приводятся в таблице 1. Из таблицы видно, что усовершенствованный метод трансформации, который включает добавление в питательную среду для регенерации бананового порошка, стимулирующего морфогенез, и использование нового антибиотика тиракциллина повышает эффективность регенерации трансформированных побегов до 30%, по сравнению с методами трансформации, когда используется антибиотик цефатоксим и не добавляется банановый порошок.
Проводят анализ природы полученных растений. С целью изучения встраивания Т-ДНК в геном канамицин-резистентных линий, полученных генетической трансформации посредством бинарного вектора pGA482, проводят ПЦР анализ ДНК растений. Для выделения геномной ДНК и белковых экстрактов используют материал как in vitro, так и in vivo. Для анализа ДНК растений, выращенных in vitro, молодые побеги возраста 2-3 недели, растирают в жидком азоте [20]. Из тепличного материала ДНК выделяют с применением 2хCTAБ-бyфepa [6].
Присутствие гена cecP1 в трансгенных растениях каланхоэ подтверждают методом ПНР с праймерами, специфичными для кодирующей области трансгенной конструкции.
Прямой поиск трансгенных растений каланхоэ, синтезирующих антимикробный пептид цекропин Р1, проводят методом вестерн-блот анализа.
Анализ уровня экспрессии цекропина Р1 в трансгенных растениях осуществляют методом ингибирования роста бактериальной культуры экстрактами трансгенных растений.
На Фиг.1 представлена схема бинарного вектора pGA482::cecP1, где TL и TR - левый и правый краевые повторы Т-ДНК; CaMV35S - промотор 35S РНК вируса мозаики цветной капусты; polyA - сигнал полиаденилирования; nptII - ген растительного селективного маркера неомицинфосфотрансферазы II; cecP1 - последовательность cecropinP1, кодирующая ген антимикробного пептида цекропина P1; oriV - начало репликации; Тетr - ген устойчивости к антибиотику тетрациклину для селекции бактерий; HindIII, X, Ss, Hp, K, C, Bg - сайты рестрикции рестриктаз HindIII, XhoII, SspI, HpaI, KpnI, CfrI, BglII.
В таблице 1 показана эффективность регенерации и трансформации каланхоэ. Указаны средние значения по результатам 3 опытов.
На Фиг.2А представлены результаты ПЦР-анализа ДНК трансгенных растений каланхоэ, содержащих ген cecP1 под контролем промотора 35S РНК вируса мозаики цветной капусты: 1-4 - ДНК разных видов трансгенных растений; 5 - ДНК нетрансформированного растения; 6 - ДНК плазмиды, содержащей ген cecP1.
На Фиг.2Б показаны результаты вестерн-блот-анализа экстрактов листьев растений каланхоэ разных видов: 1-4 - растительные экстракты исследуемых растений (100 мкг общего белка); 5 - экстракт нетрансгенного растения; 6 - синтетический пептид цекропин Р1 (10 нг).
На Фиг.3 демонстируется ингибирующее действие растительных экстрактов из трансгенных (лунки 2-4) и контрольных (лунка 1) растений на рост штамма Staphylococeus aureus FDA 209-р, ИНА 00985, условно патогенного для человека.
На Фиг.4 показано ингибирующее действие растительными экстрактами трансгенных (А) и контрольных растений (Б) на рост фитопатогенных бактерий Erwinia carotovora В15.
На Фиг.5 - повышенная устойчивость трансгенных растений каланхоэ перистого к фитопатогенным бактериям Erwinia carotovora В15 (А) и фитопатогенным грибам Sclerotinia sclerotiorum (Б): 1 - лист нетрансформированного растения каланхоэ на 10-й день заражения - появление зон отмирания ткани; 2 - лист трансгенного растения с геном cecP1 - полное сохранение жизнеспособности.
Возможность осуществления предлагаемого способа подтверждается представленными примерами, но не ограничивается ими.
Пример 1. Микроклональное размножение и культивирование в гноотобиотических условиях растений каланхоэ.
Стерилизацию растительного материала проводят следующим образом: срезают молодые, полностью развернувшиеся листья каланхоэ, выращенные в теплице, дезинфицируют их, обработав 5% раствором гипохлорита натрия, содержащим 0,5% Твин 20 в течение 10 мин, затем ополаскивают трижды в стерильной дистиллированной воде. Разрезают листья на кусочки длиной 5-10 мм и помещают их на питательную среду МС, содержащую стандартный набор солей, 7 г/л агара, 30 г/л сахарозы (pH 5,8) и включающую в качестве регуляторов роста 6-бензиламинопурин 1 мг/л и нафтилуксусную кислоту 0.1 мг/л, а также добавку банановый порошок 30 г/л.
Экспланты инкубируют при 22-24°С, 16-часовом световом дне и освещенности 2000 лк. Придаточные побеги или регенеранты образуются из экспланта через 4 недели. Побеги отрезают и переносят в стеклянные пробирки со свежей средой МС. Черенкование растений проводят 1 раз в месяц. Для этого растение каланхоэ высотой 15-20 см делят на 4 части, оставляя на стебле 1-2 листа с междоузлиями, и рассаживают в пробирки.
Через 2 месяца проводят очередное черенкование и таким образом растения размножают до нужного количества. Затем микроразмноженный in vitro посадочный материал используют для трансформации. Трансформированные растения каланхоэ из пробирок высаживают в закрытый грунт в условия in vivo для адаптации. Через 2 недели, когда растения укоренятся, их пересаживают в почву для продолжения вегетации и получения семян.
Пример 2. Генные конструкции для трансформации каланхоэ.
Плазмиду pGA482, содержащую ген сесР1 и селективный ген устойчивости к канамицину nptII, переносят в штамм Agrobacterium tumefaciens GV3101(pMP90RK), который используют для трансформации растений каланхоэ.
Пример 3. Условия трансформации и селекции эксплантов Kalanchoe pinnata.
А. Подготовка бактериальной суспензии. Бактериальную суспензию штамма Agrobacterium tumefaciens GV3101(pMP90RK, pGA482::сесР1) для инокуляции наращивают в течение ночи в 50 мл среды LB [19] при 28°С. Перед инокуляцией суспензию клеток центрифугируют при 6 т. об/мин в течение 5 минут. Осадок промывают в 50 мл жидкой среды МС для удаления остатков LB. Промытый осадок клеток ресуспендируют в жидкой среде МС до О.П.600=0.5.
Б. Подготовка растительных эксплантов. Со стерильных растений, выращенных описанным выше способом, за два дня до трансформации срезают молодые листья, обрезают у них кромку и центральную жилку. Затем скальпелем на чашке Петри в присутствии небольшого количества жидкой среды МС листья нарезают на небольшие кусочки размером 0.5х05 см2, которые раскладывают на поверхности твердой среды МС, содержащей 1 мг/л БАП, 0.1 мг/л НУК и 30 г/л БП. Инкубацию проводят при температуре 22-24°C и 16-часовом световом дне в течение 2 суток.
Затем экспланты аккуратно пинцетом переносят в суспензию агробактерий Agrobacterium tumefaciens GV3101 (pMP90RK) на 20 минут. После этого экспланты переносят в стерильные чашки с бумажными фильтрами и подсушивают в течение 5 минут для удаления избытка агробактерий, после чего раскладывают на чашки со средой МС с 1 мг/л БАП, 0.1 мг/л НУК и 30 г/л БП на 2 суток. На следующем этапе трансформации экспланты переносят в чашку Петри с жидкой средой МС с добавлением 500 мг/л тикарциллина (Tr) и 5 минут перемешивают для удаления избытка агробактерий.
Отмытые экспланты переносят в чашки Петри с твердой средой МС, содержащей 1 мг/л БАП, 0.1 мг/л НУК, 30 г/л БП, 500 мг/л тикарциллина и 50 мг/л канамицина.
Тикарциллин используют для элиминации агробактерий на эксплантах, а канамицин является селективным агентом, поскольку в векторной конструкции в качестве селективного маркера используется ген неомицинфосфотрансферазы nptII.
Регенерация побегов начинается через 3 недели культивирования трансформированных эксплантов.
Образовавшиеся побеги отделяют от исходной ткани эксплантов и переносят для дальнейшего роста на среду с 1/2 солей МС и с уменьшенной концентрацией антибиотиков: 250 мг/л тиракциллина и 25 мг/л канамицина. Укоренение протекает в течение 2-3 недель. Полученные укорененные растения используют для дальнейшего молекулярно-генетического анализа и биологического тестирования.
Пример 4. Условия трансформации и селекции эксплантов Kalanchoe daigremontiana.
Трансформацию эксплантов Kalanchoe daigremontiana и селекцию проводят аналогично описанному в примере 3.
Пример 5. Условия трансформации и селекции эксплантов Kalanchoe laciniata.
Трансформацию эксплантов Kalanchoe laciniata и селекцию проводят аналогично описанному в примере 3.
Пример 6. Условия трансформации и селекции эксплантов Kalanchoe blossfeldiana.
Трансформацию эксплантов Kalanchoe blossfeldiana и селекцию проводят аналогично описанному в примере 3.
Пример 7. Анализ растений методом ПЦР.
Для ПЦР-анализа генома растений на наличие гена сесР1 используют праймеры, последовательность которых была сконструирована на основе данных о последовательности гена цекропина Р1:
1) 5'-CGGGATCCATGGGCTCTTG-3' и
2) 5'-CGAGATCTCTACTTAGCGCGGC-3'.
ДНК трансгенных растений выделяют из листьев 3-х недельных растений Kalanchoe [20]. Листья (около 100 мг) растирают в 2 мл пробирках, добавляют 0,4 мл буфера для экстракции (0.2 М трис-HCl, pH 7.5; 0.25 М NaCl; 25 мМ ЭДТА; 0.5% SDS), перемешивают и оставляют на 1 ч при комнатной температуре. Далее экстракты осветляют центрифугированием при 12000 об/мин. ДНК осаждают равным объемом изопропанола и осадок растворяют в 100 мкл буфера ТЕ (10 мМ трис-HCl, pH 8.0; 1 мМ ЭДТА).
Полученную растительную ДНК используют в качестве матрицы в ПЦР анализах. Реакционная смесь содержит 0,1 мкг плазмидной ДНК рВМ-сес в качестве матрицы, 10 мМ трис-HCl, pH 8.8 (при 25°C), 50 мМ KCl, 0.1% Тритон Х-100, 1.5 мМ MgCl2, 0.2 мМ смеси дНТФ (USB, США), по 50 пикомолей каждого праймера и 2.5 ед. ДНК полимеразы Taq ("Promega", США).
Реакцию проводят в объеме 25 мкл при следующих условиях: 94°C - 5 мин; 30 циклов: 94°C - 1 мин, 55°C - 30 с, 72°C - 30 с, затем 72°C - 7 мин на амплификаторе Gene Amp® PCR System 2400 (Perkin Elmer, США).
Продукты амплификации анализируют с помощью электрофореза в 6%-ном ПААГе в трис-боратном буфере при напряженности электрического поля 6 В/см с последующим окрашиванием геля бромистым этидием. При этом концентрация красящего раствора - 2 мкг/мл в воде, время окрашивания - 20 минут при комнатной температуре. Гель фотографируют в ультрафиолете при длине волны 260-280 нм.
На фиг.2А представлена электрофореграмма ПЦР-продуктов амплификации ДНК трансгенных растений каланхоэ, содержащих ген сесР1 под контролем промотора 35S РНК вируса мозаики цветной капусты: 1 - ДНК трансгенных растений Kalanchoe pinnata; 2 - ДНК трансгенных растений Kalanchoe daigremontiana; 3 - ДНК трансгенных растений Kalanchoe laciniata; 4 - ДНК трансгенных растений Kalanchoe blossfeldiana; 5 - ДНК нетрансформированного растения; 6 - ДНК плазмиды, содержащей ген cecP1.
Появление продукта ПНР с указанными праймерами и длиной 102 нуклеотида при условии отсутствия его в реакциях, поставленных на контрольной ДНК, свидетельствует о присутствии искомого гена в ДНК исследуемых растений.
Пример 5. Анализ растений методом вестерн-блот.
Проводят анализ экстрактов из листьев Kalanchoe, содержащих около 100 мкг общего белка. Концентрацию общего белка определяют по методу Бредфорд [21]. Ткани трансформированных и контрольных растений замораживают в жидком азоте и разрушают растиранием в ступке. К полученным лизатам добавляют буфер в соотношении 1:1. Экстрагирующий буфер имеет состав: 4% ДДС-Na и 20 мМ Трис-HCl, pH 6.8. Гомогенат выдерживают 10 мин при 95°C и центрифугируют 4 мин при 14000 g.
Для электрофоретического разделения белков трансгенных растений используют SDS-трициновую систему в 16%-ном ПААГе [22]. Для переноса белков используют PVDF-мембрану ("Porablot", Германия). Электроперенос проводят в течение 2 ч при 200 мА или ночь при 20 мА в буфере (25М Трис-HCl, 250 мМ глицина) с добавлением 20% метанола.
Мембрану сначала инкубируют с антителами к гену cecP1, затем с вторичными кроличьими поликлональными антителами, конъюгированными с пероксидазой хрена. Иммунодетекцию проводят с помощью набора реактивов хемилюминесцентной системы ECL ("Amersham", Великобритания). Синтетический цекропин Р1 получают методом твердофазного синтеза.
На фиг.2Б представлены результаты вестерн-блот-анализа экстрактов листьев отдельных растений каланхоэ. 1 - растительные экстракты (100 мкг общего белка) Kalanchoe pinnata; 2 - растительные экстракты Kalanchoe daigremontiana; 3 - растительные экстракты Kalanchoe laciniata; 4 - растительные экстракты Kalanchoe blossfeldiana; 5 - экстракт нетрансгенного растения; 6 - синтетический пептид цекропин Р1 (10 нг).
В результате анализа в экстрактах растений каланхоэ был обнаружен искомый пептид с молекулярной массой 3,4 кДа, соответствующий зрелой форме цекропина Р1.
Пример 6. Анализ антибиотической активности растительных экстрактов трансгенных растений каланхоэ по отношению к микроорганизмам, условно-патогенным для человека.
Листья анализируемых растений каланхоэ растирают в фарфоровой ступке с жидким азотом, затем добавляют экстракционный буфер (10% глицерина, 40 мМ ЭДТА, 150 мМ NaCl, 100 мМ NH4Cl, 10,0 мМ трис-HCl, pH 7,5; 3,0 мг/мл дитиотрейтола; 0,2 мг/мл лейпептина; 0,2 мг/мл ингибитора трипсина; 4 мМ фенилметилсульфонилфторида; 2 мг/мл БСА [6]) и продолжают растирать до гомогенной суспензии.
Полученный экстракт центрифугируют 20 мин при 10000 g и супернатант используют для определения в нем антибиотической активности методом радиальной диффузии [23]. Белок в растительных экстрактах определяют по методу [21].
Ингибирующее влияние экстрактов на рост клеток бактерий анализируют на чашках Петри, содержащих 30 мл 1.5% агара со штаммом бактерий Staphylococeus aureus FDA 209-р, ИНА 00985 (108 клеток/мл). Для этого в лунки (диаметр 5 мм) добавляют экстракты с одинаковым количеством белка (2 мг общего белка) из листьев трансгенных и контрольных (нормальных) растений.
Каждый опыт проводят с листом среднего яруса растения в трех биологических повторностях. Чашку Петри инкубируют 8 ч при 4°C для диффузии экстрактов в агар, а затем инкубируют при 25°C в течение двух дней. Радиус чистой зоны вокруг лунки служит показателем ингибирования роста бактерий. Количественную оценку содержания цекропина Р1 в экстрактах трансгенных растений проводят сравнением с контрольными экспериментами, где в качестве стандарта используют известные концентрации синтетического цекропина ("Sigma", США).
На фиг.3 видно, что экстракты трансгенных растений каланхоэ проявляют значительно большую антибактериальную активность по сравнению с экстрактами из нетрансгенных растений по отношению к бактериальному штамму Staphylococeus aureus FDA 209-р ИНА 00985, условно патогенному для человека: лунка 1 - контрольное (не трансформированное) растение; лунка 2 - экстракт растения Kalanchoe pinnata, лунка 3 - экстракт растения Kalanchoe daigremontiana, лунка 4 - экстракт растения Kalanchoe blossfeldiana.
Экстракт растения Kalanchoe laciniata проявлял аналогичную описанной ранее антимикробную активность по отношению к штамму Staphylococeus aureus. Проявление некоторой антибактериальной активности у экстрактов нетрансгенных растений (лунка 1) может быть связано с наличием у них собственных антибактериальных защитных соединений, в том числе и антибактериальных пептидов. Так, диаметр чистой зоны у экстрактов контрольных растений составляет 2 мм (лунка 1), тогда как у экстрактов трансгенных растений диаметр такой зоны составляет 6-8 мм (лунки 2-4), что говорит о повышенной антибактериальной активности в клетках растений, экспрессирующих ген цекропина P1.
Образование чистой зоны вокруг лунки является результатом совместного действия как собственных защитных пептидов, так и дополнительно синтезируемых.
Аналогичные результаты антибиотической активности получены для штаммов условно патогенных для человека: Pseudomonas aeruginosa IF03899, Bacillus subtillis ATEC 6633 ИНА 01041, бактериальных фитопатогенов: Erwinia carotovora В 15, Pseudomonas syringae В-1546 и Pseudomonas sp. marginata В-1298, грибных фитопатогенов: Sclerotinia sclerotiorum, Fusarium oxyspomm и Phomopsis helianthi.
Пример 7. Анализ уровня экспрессии цекропина Р1 в растениях каланхоэ методом ингибирования роста бактериальной культуры экстрактами трансгенных растений.
Для тестирования антимикробной активности экстрактов из трансгенных растений используют метод ингибирования роста, который проводят на газоне клеток бактерий [24]. Бактерии Erwinia carotovora В15 выращивают до О.П.600=0.2 для получения клеток, находящихся в среднелогарифмической фазе роста. Затем культуру бактерий разводят свежей средой LB в соотношении 1:1000, к которой добавляют экстракты из трансгенных и нетрансгенных растений до конечной концентрации белка 1 мг.
Культуру бактерий с экстрактами инкубируют 30 минут при 37°C, затем аликвоту 10 мкл высевают на чашки Петри и инкубируют в течение ночи в термостате при 37°C.
Для определения количественного содержания пептида в трансгенных растениях исследуют ингибирование роста бактерий с разным содержанием синтетического цекропина Р1 - от 1 - до 6 мкМ. Подсчитывают количество жизнеспособных клеток бактерий, выросших в чашках Петри на среде LB. Полное ингибирование роста бактерий цекропином Р1 происходит при добавлении пептида в растущую культуру бактерий в количестве 6 мкМ. Подсчет выросших колоний и сравнение данных по калибровочной кривой, построенной для разных разведений синтетического цекропина Р1, показывает, что экстракты трансформированных растений в количестве 1 мг общего белка ингибируют рост патогенных бактерий так же, как при добавлении раствора цекропина Р1 в количестве 5 мкМ. Это соответствует экспрессии цекропина Р1 в трансгенных растениях на уровне 0.002% от общего содержания белка листьев.
На фиг.4 показано ингибирующее действие растительных экстрактов из трансгенных (А) и контрольных растений Kalanchoe pinnata (Б) на рост фитопатогенных бактерий Erwinia carotovora В15. Экстракты растений Kalanchoe daigremontiana, Kalanchoe blossfeldiana и Kalanchoe laciniata проявляли ингибирующее действие на рост бактериальных клеток аналогично экстрактам Kalanchoe pinnata. Экстракты контрольных растений активностью, ингибирующей рост бактериальных клеток, не обладали.
Пример 8. Анализ устойчивости трансгенных растений Kalanchoe pinnata к бактериальным фитопатогенным микроорганизмам Erwinia carotovora В 15, Pseudomonas syringae В-1546 и Pseudomonas sp. marginata B-1298.
Штаммы бактерий выращивают в LB среде до плотности 106 кл/мл и используют для инфицирования отдельных листьев и целых растений. Заражение отдельных листьев растений проводят уколом иглой, смоченной в суспензии бактерий. Листья инкубируют в чашках Петри на влажной фильтровальной бумаге при температуре 22-24°C.
Степень повреждения оценивают спустя 7-21 суток после заражения. Через неделю на контрольных листьях отмечается разрушение ткани мезофилла. К концу третьей недели поражение контрольных листьев составляет 100% по площади. В то же время трансгенные листья остаются без признаков повреждения.
Аналогичные симптомы наблюдаются при заражении целых растений штаммами. Трансгенные растения остаются неповрежденными в течение всего времени эксперимента, в то время как контрольные полностью сгнивают. На фиг.5А показаны симптомы заражения листьев фитопатогенным штаммом Erwinia carotovora В 15.
Степень повреждения растений Kalanchoe pinnata бактериальными штаммами Pseudomonas syringae В-1546 и Pseudomonas sp. marginata В-1298 была аналогично описанному повреждению штаммом Erwinia carotovora В 15.
Пример 9. Анализ устойчивости трансгенных растений Kalanchoe daigremontiana к бактериальным фитопатогенным микроорганизмам Erwinia carotovora В 15, Pseudomonas syringae В-1546 и Pseudomonas sp. marginata B-1298.
Признаки повышения устойчивости Kalanchoe daigremontiana к фитопатогенным бактериальным штаммам были аналогичны описанному в примере 8.
Пример 10. Анализ устойчивости трансгенных растений Kalanchoe blossfeldiana к бактериальным фитопатогенным микроорганизмам Erwinia carotovora В 15, Pseudomonas syringae В-1546 и Pseudomonas sp. marginata B-1298.
Повышение устойчивости Kalanchoe blossfeldiana к фитопатогенным бактериальным штаммам было аналогично описанному в примере 8.
Пример 11. Анализ устойчивости трансгенных растений Kalanchoe laciniata к бактериальным фитопатогенным микроорганизмам Erwinia carotovora В 15, Pseudomonas syringae В-1546 и Pseudomonas sp. marginata B-1298.
Повышение устойчивости Kalanchoe laciniata к фитопатогенным бактериальным штаммам было аналогично описанному в примере 8.
Пример 12. Анализ устойчивости трансгенных растений Kalanchoe pinnata к грибным фитопатогенным микроорганизмам Sclerotinia sclerotiomm, Fusarium oxysporum и Phomopsis helianthi.
Фитопатогенные грибы для тестирования растений выращивают на глюкозо-картофельном агаре. Культуру грибов Sclerotinia sclerotiorum, Fusarium oxysporum и Phomopsis helianthi поддерживают при +4°C. Для определения устойчивости трансгенных растений к заражению грибным патогенам берут как целые растения, так и отдельные листья. Для отдельных листьев используют метод заражения в чашках Петри.
Заражение отдельных листьев растений Kalanchoe pinnata проводят, помещая кусочки агара с мицелием на срез черешка листа. Листья инкубируют в чашках Петри на влажной фильтровальной бумаге при температуре 22-24°C. Степень повреждения оценивают спустя месяц после заражения. Уже в первые дни эксперимента на контрольных листьях заметны признаки поражения - темные некротические пятна и в дальнейшем полная гибель. У трансгенных листьев таких признаков нет, они остаются полностью здоровыми и неповрежденными (фиг.5Б).
Целые растения заражают грибами, помещая кусочки мицелия гриба в междоузлия листьев. Растения выращивают при температуре 22-24°C. Уже через неделю на контрольных листьях заметен некроз ткани. К концу второй недели поражение контрольных растений составляет 50% по площади, в то время как трансгенные растения остаются без признаков повреждения.
В течение 15-20 суток контрольные растения погибают от воздействия патогена, а трансгенные проявляют устойчивость.
На фиг.5Б показаны симптомы заражения листьев Kalanchoe pinnata фитопатогенным штаммом Sclerotinia sclerotiorum.
Степень повреждения растений Kalanchoe pinnata грибными штаммами Fusarium oxysporum и Phomopsis helianthi была аналогична описанному повреждению штаммом Sclerotinia sclerotiorum.
Пример 13. Анализ устойчивости трансгенных растений Kalanchoe daigremontiana к грибным фитопатогенным микроорганизмам Sclerotinia sclerotiorum, Fusarium oxysporum и Phomopsis helianthi.
Повышение устойчивости Kalanchoe daigremontiana к грибным фитопатогенным штаммам было аналогично описанному в примере 12.
Пример 14. Анализ устойчивости трансгенных растений Kalanchoe blossfeldiana к грибным фитопатогенным микроорганизмам Sclerotinia sclerotiorum, Fusarium oxysporum и Phomopsis helianthi.
Повышение устойчивости Kalanchoe blossfeldiana к грибным фитопатогенным штаммам было аналогично описанному в примере 12.
Пример 15. Анализ устойчивости трансгенных растений Kalanchoe laciniata к грибным фитопатогенным микроорганизмам Sclerotinia sclerotiorum, Fusarium oxysporum и Phomopsis helianthi.
Повышение устойчивости Kalanchoe laciniata к грибным фитопатогенным штаммам было аналогично описанному в примере 12.
Тестирование проростков in vitro на устойчивость к исследуемым патогенам показало их значительную устойчивость в 3-5 раз по сравнению с контрольными проростками.
При пересадке трансгенных проростков из пробирок в грунт теплицы происходит их быстрая приживаемость, активное развитие растений и устойчивость их к почвенным фитопатогенам за счет экспрессии в тканях растения антимикробного пептида цекропина Р1. Растения выращивают до стадии цветения. Образовавшиеся семена обладают хорошей всхожестью.
Аналогичные симптомы наблюдали при заражении целых растений штаммами фитопатогенных микроорганизмов. Трансгенные растения остаются неповрежденными в течение всего времени эксперимента, в то время как контрольные полностью сгнивают.
Способы трансформации каланхоэ, применяемые ранее другими исследователями имеют ряд недостатков - низкая эффективность трансформации - около 3%, использование большего количества регуляторов роста, из-за чего эксперимент по получению трансгенных растений занимает длительный период времени (больше года). Наш метод позволяет ускорить процесс получения трансгенных побегов каланхоэ з