Способ получения концентратов нанодисперсий нульвалентных металлов с антисептическими свойствами
Иллюстрации
Показать всеИзобретение относится к способу получения концентратов нанодисперсий нульвалентных металлов, таких как серебро, золото, медь, палладий, платина и ртуть, которые обладают антисептическими свойствами. Указанный способ включает смешивание раствора растворимой соли металла в растворителе с аммиаком с получением комплексного соединения, которое затем смешивают с алканоламином до образования раствора. Полученный раствор смешивают с раствором полимерного стабилизатора с получением стабилизированного катиона металла и восстанавливают стабилизированный катион металла за счет добавления в раствор органического или неорганического восстановителя с последующим образованием устойчивой дисперсии наночастиц металла. Заявленный способ получения проводят при определенных соотношениях компонентов в течение 10-60 минут в атмосфере воздуха при температуре до 100°С. Изобретение направлено на получение дисперсий металлов с повышенной седиментационной и химической стойкостью и высокой антисептической способностью, которые совместимы с физиологическим раствором NaCl. Также способ обеспечивает снижение времени синтеза и значительное упрощение его процесса, увеличение производительности и полной конверсии катионного металла в нульвалентный. 10 з.п. ф-лы, 28 ил., 3 табл., 104 пр.
Реферат
Изобретение относится к способам получения концентратов нанодисперсий (коллоидных растворов наночастиц) нульвалентных металлов Ме0, в том числе обладающих антисептическими (в т.ч. биоцидными, антимикробными, вирулицидными и фунгицидными) свойствами, и которые могут быть использованы в различных областях техники, промышленности, косметики, бытовой химии, пищевой промышленности, водоподготовки в качестве консервантов, различных функциональных добавок, антисептических средств, а также в медицине, ветеринарии, в фармацевтической отрасли - для изготовления гелей, мазей, спреев, пропиток для салфеток и т.п., которые характеризуются высокой антисептической (бактериоцидной, вирулицидной и фунгицидной) эффективностью, нетоксичностью, седиментационной и химической стабильностью.
Известны средства, содержащие в своем составе коллоидные металлы - серебро, медь и золото, обладающие бактериоцидными свойствами, в том числе «Серебро, золото, медь - коллоидный комплекс / Colloidal Copper Gold & Silver Oligo» фирмы NSP, США [http://allfarm.ru/copper.html], позиционированное как противовоспалительное и бактерицидное средство для внутреннего и наружного применения, альтернативный заменитель антибиотиков. При этом серебро блокирует размножение вредных бактерий, вирусов и грибков. Золото и медь увеличивают спектр антибактериального действия. Ингредиентный состав: 1 мл ионизированного раствора содержит серебро (silver) 0,0107 мг, медь (copper) 0,0225 мг, золото (gold) 0,0007 мг.
Однако способ синтеза данного продукта фирмой не описан. К известным недостаткам относится высокая цена на данный продукт, а также наличие в дисперсии, в соответствии с описанием продукта, ионизированного (катионного) серебра.
В известных препаратах коллоидного серебра (колларгол и протаргол), обладающих антисептическими свойствами, стабилизатором высокодисперсных частиц серебра служат белковые полимеры казеин и желатин [М.Д.Машковский. Лекарственные средства. Т.2, Новая волна, М., 2000]. Эти препараты из-за наличия в их составе белков непостоянного состава обладают аллергическим действием и не поддаются строгой стандартизации. Наличие же в их составе значительных количеств катионного серебра придает им обжигающее действие и несовместимость с физиологическим раствором (хлористый натрий NaCl, 0,9 мас.%). Их единственная выпускная форма - только порошки, которые перед использованием необходимо растворять в асептической обессоленной воде.
Кроме этого, при добавлении к растворам этих препаратов в дистиллированной воде полосы поглощения в электронных спектрах, которые можно отнести к плазменному резонансу наночастиц металлического серебра в препаратах колларгол и протаргол (максимумы поглощения при 409 и 406 нм соответственно, фиг.1, 2, Таблица 2), исчезают (фиг.3, 4, Таблица 2), что свидетельствует об исчезновении частиц нульвалентного металла Ме0 и переходе нульвалентных атомов серебра Ag0 в катионную форму Ag+ (хлорид серебра AgCl и т.п.), с последующим переходом солей серебра в осадок и вывода его из объема препарата.
Известен препарат наноразмерных частиц серебра в водных растворах - Арговит (Витар) (ТУ 9310-13-00008064-00), который представляет собой комплекс серебра с медицинским поливинилпирролидоном («Применение препаратов серебра в медицине» - Сборник трудов по материалам научно-практической конференции «Новые химические системы и процессы в медицине», под. ред. Е.М.Благитко, Новосибирск, 2004, 115 с.). Препарат состоит из нанокластеров металлического серебра, стабилизированных поли-N-винил-пирролидоном-2, получаемых химическим восстановлением водорастворимой соли серебра с последующей сушкой до порошка.
Получаемые частицы серебра имеют по данным авторов размеры несколько нанометров и вследствие этого повышенную активность, чем повиаргол, и агрегативную устойчивость.
Арговит выпускается в виде стабилизированного концентрированного раствора, из которого путем разведения дистиллированной водой готовят разбавленные рабочие растворы для применения. По внешнему виду - концентрированный раствор темно-коричневого цвета, разбавленные растворы - от коричневого до желтого цвета различной интенсивности в зависимости от степени разбавления. По данным авторов, разбавленные растворы седиментационно устойчивы в течение не менее 2 недель.
Однако и сам препарат Арговит и его растворы в воде при добавлении физиологического раствора (хлористый натрий NaCl, 0,9 мас.%) через непродолжительное время обесцвечиваются, и на дне сосуда наблюдается образование легкого сероватого осадка. При этом полоса поглощения с максимумом при 407 нм, отнесенная к плазменному резонансу наночастиц металлического серебра (фиг.5, Таблица 2), исчезает (фиг.6, Таблица 2). Выявленное таким образом в составе Арговита наличие катионного серебра свидетельствует о несовместимости препарата с физиологическим раствором (хлористый натрий, 0,9 мас.%) и о его повышенной химической активности. Также при этом содержание в объеме дисперсии наночастиц металла существенно уменьшается, что проявляется как уменьшение интенсивности рассеяния проходящего через раствор луча лазера (Эффект Тиндаля) - луч утоньшается, и его интенсивность (видимость) заметно падает. Кроме того, конкретные составы композиции и условия ее приготовления неизвестны.
Известен способ получения наноструктурных металлических частиц путем восстановления ионов металла в двухфазной системе обратных мицелл, включающий приготовление обратномицеллярной дисперсии восстановителя на основе раствора поверхностно-активного вещества в неполярном растворителе [RU 2147487, 20.04.2000].
Недостатками таких дисперсий и способа их получения является то, что:
- размерность частиц в патенте не определена ни прямо, ни косвенно (в т.ч. по максимумам полос поглощения в электронных спектрах, отнесенным к плазменному резонансу наночастиц металла),
- способ получения является достаточно сложным, многостадийным и дорогостоящим, особенно в случае водных дисперсий, так как для получения водной дисперсии металлических наночастиц необходима дополнительная операция их перевода в водную фазу (удаления органической фазы), что осложняет и удорожает получение устойчивых концентрированных водных дисперсий наночастиц,
- процесс получения требует применения большого набора реагентов и органических растворителей, требуется значительный расход дорогого восстановителя (что повышает затраты на изготовление металлических наночастиц),
- сравнительно низкая концентрация по металлическому серебру получаемых водных дисперсий (0,00324-0,0324 мас.%),
- скорость формирования наночастиц в двухфазной системе относительно невелика (вследстви необходимости диффузии компонентов через границы раздела фаз),
- в реакционной системе присутствуют избыток восстановителя и токсичные компоненты (в т.ч. поверхностно-активное вещество АОТ),
- наличие в дисперсии в качестве стабилизатора дисперсии сравнительно большого количества ПАВ - в данном случае анионного соединения АОТ (ограниченно смешивающегося с водой и образующего с ней микроэмульсию) - приводит к оптической неоднородности водных растворов, а также к ограниченному смешению их с различными, особенно неводными, системами,
- кроме этого, совместимость дисперсий с различными системами, препаратами может в значительной степени ограничиваться также и анионной природой используемого ПАВ (АОТ), который может образовывать, например, с катионными соединениями, в т.ч. катионными ПАВ, нерастворимые соединения. К тому же многие ПАВ, включая АОТ, не имеют разрешения для их использования в пищевых и медицинских продуктах, что ограничивает возможности их использования в этих направлениях.
Для получения наночастиц серебра с улучшенными характеристиками известен способ, основанный на переводе растворимой соли серебра в комплекс с аммиаком [RU 2322327, 27.07.2007]. Способ получения препарата наноструктурных частиц металла, необязательно имеющего в составе дополнительные восстановители: гидразин, водород, борогидрид натрия, кверцетин - или стабилизаторы, например полимеры, путем восстановления ионов металлов при использовании в качестве микрореактора обратных мицелл, включающий приготовление обратномицеллярных растворов поверхностно-активного вещества в неполярном растворителе, введение раствора ионов соли металла, перемешивание или солюбилизацию ультразвуковой обработкой, деаэрирование, восстановление ионов металла сольватированными электронами или восстановительными радикалами, генерированными при воздействии ионизирующего излучения на приготовленную водно-органическую дисперсию. Синтез наночастиц при этом проводится в обратно-мицеллярной системе, недостатки которого описаны выше.
Известно использование в качестве метода получения сферических частиц серебра предварительно образованного комплекса серебра с алканоламинами с последующей обработкой раствора восстановителя [US 5389122, 14.02.1995].
Метод состоит из следующих стадий:
1. Взаимодействие водного раствора соли серебра с алканоламином (моноэтаноламином, диэтаноламином, триэтаноламином, диизопропаноламином) с образованием гомогенного раствора комплекса серебра с алканоламином.
2. Приготовление водного раствора восстановителя - аскорбиновой кислоты.
3. Быстрое смешение обоих растворов при температуре от 10°С до 100°С, приводящее к образованию частиц металлического серебра с размером от 0,77 мкм до 20 мкм.
4. Отделение частиц серебра от раствора.
5. Промывка частиц серебра.
6. Сушка частиц серебра.
К недостаткам способа относится возможность получения частиц металла только крупных (микронных) размеров, не обладающих седиментационной устойчивостью в состоянии дисперсии в растворителях.
Известен способ изготовления препарата наноструктурных частиц металла путем восстановления ионов металла в комплексе с гетероциклическим соединением с хелатирующими свойствами, что позволяет химическим методом промышленно получить наноразмерные частицы металлов с использованием широкого выбора соединений в качестве исходных реактивов, позволяет сократить количество операций и ускорить процесс подготовки реакционных смесей, позволяет регулировать режим и условия синтеза [RU 2312741, 20.12.2007].
Этому способу синтеза наночастиц также присущи все недостатки, характерные для способов синтеза наночастиц металлов в обратно-мицеллярных растворах поверхностно-активного вещества в неполярном растворителе. Концентрация соли при синтезе находится при этом в диапазоне 0,1×10-3-10×10-3 М (при молекулярной массе нитрата серебра 169,8 это соответствует концентрациям 0,0017-0,17 мас.%), что существенно ниже возможного в однофазной системе. Указывается, что при превышении концентрации соли 0,17 мас.% выход наночастиц металла существенно не изменяется и растет непроизводительный расход металла.
В качестве гетероциклического соединения с хелатирующими свойствами использованы природные пигменты или синтетические красители - арилбензопираны, кумарины, каратиноиды, цианиновые красители, введение которых, согласно описанию способа, способствует увеличению выхода наночастиц. Последнее, однако, ясно указывает, что при данном способе синтеза наночастиц конверсия катионного металла заведома неполна и в итоговой реакционной массе присутствуют металлы в катионной форме. Действительно, указанные гетероциклические соединения являются по своей сути органическими восстановителями средней силы. Кроме этого, как следует из описания изобретения, в результате реакции образуются частицы серебра с максимумом полосы поглощения плазменного резонанса в электронных спектрах при 426 нм и более, т.е. достаточно крупные.
Известен бактерицидный раствор и способ его получения, в котором водный раствор соли серебра предварительно обрабатывают раствором аммиака, что обеспечивает создание высокоэффективного бактерицидного средства с высокой биологической активностью по отношению к микроорганизмам, которую сохраняет в течение длительного времени [RU 2341291, 20.12.2008].
Описание продукта дано на сайте http://www.nanotech.ru/pages/about/ag_part.htm].
По данным сайта, препараты "AgБион" производятся по вышеприведенному патенту методом биохимического синтеза в виде коллоидных растворов наночастиц серебра, стабильных в водной фазе, в различных органических растворителях (додекан, октан), а также в растворах смешанного типа, например спирт-вода. Внешне концентраты представляют собой прозрачную жидкость бурого цвета, активнодействующий компонент которой - наночастицы серебра размером от 3 до 16 нм, стабилизированные молекулами поверхностно-активного вещества.
Наночастицы серебра (НЧС) поставляются (ЗАО Концерн «НАНОИНДУСТРИЯ») в двух видах:
- Концентрат коллоидного раствора в органическом растворителе - "AgБион-1" (ТУ 2499-002-44471019-2006);
- Концентрат коллоидного раствора в воде - "AgБион-2" (ТУ 2499-003-44471019-2006).
Срок годности средства-2 года, рабочих растворов 14 суток.
При разбавлении гексаном продукт AgБион-1 (ТУ 2499-002-44471019-2006) обнаруживает в электронном спектре полосу с максимумом поглощения при 430 нм, которую можно отнести к плазменному резонансу частиц серебра (фиг.7, Таблица 2). Величина длины волны 430 нм ясно указывает на относительно большие размеры наночастиц серебра.
При разбавлении водой продукт AgБион-2 (ТУ 2499-003-44471019-2006) обнаруживает в электронном спектре полосу с максимумом поглощения при 410 нм, которую можно отнести к плазменному резонансу частиц серебра (фиг.8, Таблица 2). При добавлении к водному раствору продукта AgБион-2 физиологического раствора (хлористый натрий NaCl, 0,9 мас.%) дисперсия через непродолжительное время обесцвечивается и на дне сосуда наблюдается образование легкого сероватого осадка. При этом полоса поглощения с максимумом при 410 нм, отнесенная к плазменному резонансу наночастиц металлического серебра (фиг.8, Таблица 2), исчезает (фиг.9, Таблица 2). Выявленная таким образом несовместимость препарата, синтезированного по обратно-мицеллярной технологии, с физиологическим раствором (хлористый натрий, 0,9 мас.%), свидетельствует о наличии в составе продукта AgБион-2 катионного серебра, следовательно, и о его повышенной химической активности. Об этом также свидетельствует и срок годности рабочих растворов, указанный производителем, всего 14 суток.
Таким образом, и этому способу синтеза наночастиц также присущи все недостатки, характерные для способов синтеза наночастиц металлов в обратно-мицеллярных растворах поверхностно-активного вещества в неполярном растворителе.
Наиболее близким аналогом заявленного изобретения является способ получения водорастворимой бактерицидной композиции, содержащей высокодисперсное металлическое серебро, стабилизированное защитным полимером, путем восстановления ионного серебра в водных растворах при нагревании с последующей сушкой. Восстановление ионного серебра ведут в атмосфере инертного газа при взаимодействии 0,025-29,73 мас.% раствора нитрата серебра с 5,0-38,6 мас.% водным раствором этилового спирта, содержащим 0,065-11,0 мас.% поли-N-винилпирролидона-2, при этом реакцию проводят в темноте с нагреванием до 65-75°С (RU 2088234, 27.08.1997).
К недостаткам способа получения препарата относится то, что взаимодействие ведут в темноте и в атмосфере инертного газа, что существенно осложняет ведение процесса. При этом изменение условий проведения реакции - изменение концентрации восстановителя (этилового спирта) и температуры реакции - может сопровождаться увеличенными потерями серебра за счет реакции «серебряного зеркала».
Способ получения этого средства трудоемок и требует больших энергозатрат, поскольку технология производства предусматривает распылительную сушку полученной дисперсии и хранение ее уже в виде водорастворимого порошка.
Предлагаемое изобретение позволяет использовать достоинства обоих методов получения нанодисперсий металлов (однофазный - в растворах, и двухфазный - в обратно-мицеллярных системах), исключив их основные недостатки.
Процесс синтеза наночастиц металла проводится в растворителе с использованием покрывающих катионы металла молекул, удерживающих атомы металла в процессе синтеза и в получаемой дисперсии от агрегации и окисления, за счет этого происходит снижение времени синтеза и значительное упрощение его процесса.
Способ получения концентрата нанодисперсий металла (коллоидного раствора наночастиц металла) при этом заключается в смешении раствора растворимой соли металла в растворителе с аммиаком с получением комплексного соединения, затем смешении полученного комплексного соединения с алканоламином, далее смешении образовавшегося раствора с раствором полимерного стабилизатора с получением стабилизированного катиона металла, восстановлении стабилизированного катиона металла добавляемым в раствор органическим или неорганическим восстановителем с последующим образованием устойчивой дисперсии наночастиц металла. При необходимости выделяют стабилизированные наночастицы металла из раствора в сухом виде (известным способом, в том числе высаждением в нерастворитель, распылительной или иной сушкой и т.п.).
При этом неожиданно обнаружилось, что введение в состав раствора соли металла сначала аммиака, а затем алканоламина в указанных количествах перед введением полимерного стабилизатора и последующего проведения реакции восстановления приводит к образованию частиц восстановленного (нульвалентного М0) металла с повышенной седиментационной и химической стойкостью и высокой антисептической способностью.
Процесс химического восстановления катионов металла проводится таким образом в гомогенной однофазной системе - в растворе, в присутствии полимерного стабилизатора дисперсий, в частности известного нетоксичного и биосовместимого полимера, например медицинского низко- и среднемолекулярного ПВП (или другого синтетического или биополимера, допущенного для использования в медицинских, фармацевтических или пищевых целях), используемого в качестве внешнего стабилизатора.
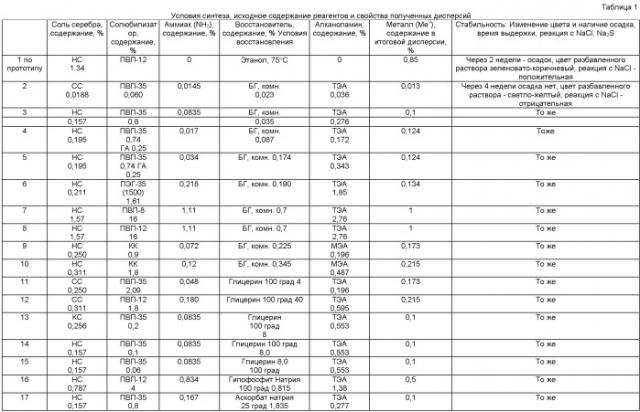
Содержание компонентов в реакционной смеси согласно изобретению находится в следующих интервалах (мас.%):
- Растворимая соль металла (по металлу) 0,013-2,5,
- Аммиак 0,028-1,67,
- Алканоламин 0,196-5,54,
- Полимерный стабилизатор 0,4-20,0,
- Восстановитель 0,07-60,
- Растворитель до 100 мас.%.
В качестве растворителя используется любой подходящий растворитель, растворяющий все компоненты реакционной смеси, в том числе вода, этиловый и изопропиловый спирт, глицерин, ацетон, диметилсульфоксид, этиленгликоль, формамид, хлороформ, водные растворы органических растворителей т.п.
В качестве металлов могут быть использованы различные металлы, образующие устойчивые комплексы с аммиаком и алканоламинами, в том числе драгоценные металлы (серебро, золото, палладий, платина), а также медь, ртуть, цинк и т.п.
В качестве источника катионов металла используется любая растворимая в выбранном для синтеза растворителе соль металла, в т.ч. нитрат, ацетат, сульфат, хлорид металла, или его хлористоводородная кислота.
В качестве алканоламина используется соединение, содержащее в своем составе как минимум одну гидроксильную и одну аминогруппу, разделенные в пространстве,
например, метиленовыми группами (не менее 2), в частности, общей формулы (1):
где R=-СН2-, или -СН2СН2-, или -СН2-СН-СН3;
У=1-3;
х=3-у;
z=0,1,
в том числе изобретение иллюстрируется частными примерами таких алканоламинов:
- соединение общей формулы (1):
| где R=-СН2СН2-; | у=1; | х=2; z=0; | Этаноламин, ЭА |
| R=-CH2CH2-; | y=2; | x=1; z=0; | Диэтаноламин, ДЭА |
| R=-СН2СН2-; | у=3; | х=0; z=0; | Триэтаноламин, ТЭА |
| R=-СН2-СН-СН3, | у=2; | х=1, z=0, | Диизопропаноламин, ДИПА |
| R=-CH2-; | y=3; | х=2; z=1; | Трис-(оксиметил)-аминометан, ТРИС |
В качестве внешнего полимерного стабилизатора, кроме ПВП, могут быть также использованы и другие подходящие известные в качестве стабилизаторов дисперсий (солюбилизаторов, защитных коллоидов) синтетические или природные полимеры, например различные поливиниловые спирты (ПВС) и их производные (в т.ч. поливинилбутирали ПВБ, поливинилэтилали ПВЭ), желатины ЖЕЛ, производные целлюлозы (метилцеллюлоза МЦ, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза КМЦ и ее натриевая соль Na-КМЦ и т.п.), полиэтиленгликоли или полиэтиленоксиды (ПЭГ или ПЭО), полиакриламиды ПАА, полимеры и сополимеры акриловой кислоты и их соли (ПАК, карбомеры), альбумин, декстран, растительные полисахариды (в т.ч. камеди), хитозаны ХТЗ, и другие полимеры, в основном имеющие разрешение на их использование для производства пищевых, медицинских, фармацевтических или косметических продуктов.
В качестве химического восстановителя могут использоваться любые подходящие известные неорганические или органические восстановители, в частности глицерин, аскорбиновая кислота или аскорбат натрия, цитрат натрия, боргидрид натрия, гипофосфит натрия, соли двухвалентного цинка и т.п., в том числе недорогие и нетоксичные соединения. Например, гидразин и его соли из-за их высокой токсичности для получения дисперсий медицинского или пищевого назначения применять в качестве восстановителя не рекомендуется, несмотря на их высокую эффективность.
Процесс при этом проводится в течение короткого времени (от 10 до 60 минут), при дневном свете, в атмосфере воздуха, при температурах от комнатной до 100 градусов Цельсия.
Таким образом, полученные по данному способу монофазные дисперсии не содержат ПАВ, других токсичных или аллергенных компонентов.
Реакция металлического зеркала при проведении процесса во всем температурном диапазоне отсутствует. В процессе синтеза концентрата нанодисперсий и при их последующем хранении также не происходит и образование осадков, т.е. потери металла при проведении процесса практически отсутствуют.
Заявленное изобретение поясняется чертежами, где на фиг.1 изображен электронный спектр поглощения раствора колларгола; на фиг.2 - электронный спектр поглощения раствора протаргола; на фиг.3 - электронный спектр поглощения раствора колларгола + физиологический раствор NaCl 0,9%; на фиг.4 - электронный спектр поглощения раствора протаргола + физиологический раствор NaCl 0,9%; на фиг.5 - электронный спектр поглощения раствора Арговита в воде (1:4); на фиг.6 - электронный спектр поглощения раствора Арговита (1:4) + физиологический раствор NaCl 0,9% (раствор бесцветный мутный); на фиг.7 - электронный спектр поглощения раствора дисперсии AgBion-1; на фиг.8 - электронный спектр поглощения раствора дисперсии AgBion-2; на фиг.9 - электронный спектр поглощения раствора AgBion-2 (1:20)+физиологический раствор NaCl 0,9%; на фиг.10 - электронный спектр поглощения раствора дисперсии нульвалентного серебра по изобретению (по примеру 2); на фиг.11 - электронный спектр поглощения раствора дисперсии наносеребра по изобретению (по примеру 2, через месяц хранения дисперсии на свету); на фиг.12 - электронный спектр поглощения раствора дисперсии по примеру 2 + физиологический раствор NaCl 0,9%; на фиг.13 - электронный спектр поглощения раствора дисперсии по примеру 2, приготовленного из исходной дисперсии, хранившейся в течение месяца на свету; на фиг.14, 15 - наночастицы серебра по примеру 2, AFM(Multi Mode SPM, Digital Inst, Inc., в режиме тэппинг-моды с использованием кремниевого зонда NCH-50, Nanoworld, с силовой константой 42 Н/м, резонансной частотой 320 кГц. Слева - фотография наночастиц, справа - сечение(профиль) наночастиц; на фиг.16 - электронный спектр поглощения раствора дисперсии наносеребра по изобретению (по примеру 2, редиспергированный из порошка в воде); на фиг.17 - электронный спектр поглощения раствора дисперсии наночастиц золота; на фиг.18 - электронный спектр поглощения раствора наночастиц меди; на фиг.19 - электронный спектр поглощения раствора наночастиц палладия; на фиг.20 - электронный спектр поглощения раствора наночастиц платины; на фиг.21 - электронный спектр поглощения раствора наночастиц ртути; на фиг.22 - спектр пропускания дисперсии наночастиц Ag0; на фиг.23 - спектр пропускания дисперсии наночастиц Аu0; на фиг.24 - спектр пропускания дисперсии наночастиц Сu0; на фиг.25 -электронный спектр поглощения раствора Аргоника; на фиг.26 - электронный спектр поглощения дисперсии наносеребра (по примеру 51), разбавленный раствор; на фиг.27 - электронный спектр поглощения дисперсии наносеребра (по примеру 42), разбавленный раствор; на фиг.28 - электронный спектр поглощения дисперсии наносеребра (по примеру 53), разбавленный раствор.
Контроль за исчерпанием ионного металла в ходе взаимодействия проводили методом отбора проб реакционной смеси с использованием взаимодействия с 1%-ным раствором хлорида натрия NaCl или сульфида натрия Na2S.
Размеры частиц металла, получаемых в соответствии с изобретением, оценивали по данным электронной спектроскопии (длине волны максимума плазменного резонанса), а также по данным атомно-силового микроскопа (туннельного микроскопа).
В соответствии с данными электронной спектроскопии полоса поглощения, отнесенная к плазменному резонансу наночастиц металлического серебра, имеет максимум при 386-403 нм (например, фиг.13), что значимо меньше, чем у прототипа и аналогов, измеренных при тех же самых условиях (см. Таблицу 2).
Седиментационную и химическую устойчивость полученных дисперсий и их растворов определяли по образованию осадков или изменению цвета и прозрачности дисперсий или растворов при их выдержке в плотно закрытой стеклянной посуде в течение заданного времени при дневном освещении (исключая прямые солнечные лучи). Времена выдержки были выбраны 1 сутки, 3 суток, 7 суток, 14 суток, 20 суток, 30 суток. Отсутствие изменений, в т.ч. спектральных характеристик приготовленных из них растворов стандартной концентрации (10 мг/кг раствора по металлу), свидетельствует о стабильности дисперсии или раствора.
Контроль за наличием (появлением) ионного металла в ходе хранения растворов проводили методом взаимодействия с 0,9%-ным раствором хлорида натрия NaCl (физиологический раствор) или 0,1% раствора сульфида натрия Na2S - по отсутствию помутнений раствора и образованию осадка.
Полученные данным способом концентраты нанодисперсий можно для большинства применений использовать в виде жидкого раствора, что обеспечивается их высокой седиментационной стабильностью (в том числе при комнатных температурах и на свету) и высокой концентрацией по нульвалентному металлу. Последнее является существенным преимуществом данного изобретения, так как позволяет снизить издержки пользователя за счет исключения процедуры растворения в асептической обессоленной воде препаратов медицинского назначения, что возможно только в условиях сертифицированных аптечных производств. В связи с высокой стойкостью к ионам, присутствующим обычно в питьевой воде, такие препараты можно разбавлять до рабочей концентрации, при необходимости, даже обычной питьевой водой.
Далее жидкие растворы могут быть переведены при необходимости в порошковую форму известными способами, например методом сушки (в т.ч. распылительной сушки) или методом высаждения дисперсии (смешением раствора с жидким нерастворителем полимерного стабилизатора) с последующей досушкой на воздухе и/или в вакууме при комнатной или повышенной температуре. Например, в случае полимерного стабилизатора - ПВП, таким нерастворителем может быть диэтиловый эфир. В этом случае ряд компонентов итогового раствора из получаемых порошковых форм могут быть частично или полностью удалены (а именно компонентов, растворимых в диэтиловом эфире и его смесях с водой и/или летучих), в частности излишки или весь аммиак, алканоламин, продукты реакции окисления восстановителей, связанные в растворимые соли анионные составляющие соли металла (например, анионы NO3 -, СО3 2-, НСО3 -, SO4 2-, СН3СОО-, Cl) и т.п., и в итоге можно получить практически чистую двухкомпонентную систему «наночастицы металла - полимерный стабилизатор», что может быть важно для некоторых (пищевых, медицинских) областей применения.
Заявленные интервальные параметры имеют следующие обоснования:
- Снижение концентрации полимерных стабилизаторов (ПВП и других) менее 0,4% сопровождается формированием крупных частиц металла, быстрым образованием осадка.
- Увеличение концентрации полимерных стабилизаторов свыше 20% значительно увеличивает вязкость раствора, что снижает скорость процесса и затрудняет проведение реакции.
- Снижение концентрации металла ниже 0,013% приводит к неоправданному экономически разбавлению концентрата нанодисперсии.
- Увеличение концентрации металла свыше 2,5% приводит к ускоренному росту зародышей нульвалентного металла образованию крупных частиц металла, выпадению осадка.
- Снижение концентрации восстановителя ниже заявленных пределов приводит к существенному замедлению реакции восстановления и к наличию в конечном продукте следов ионного металла.
- Увеличение концентрации восстановителя выше заявленных пределов ухудшает санитарно-гигиенические условия производства и сопровождается повышенными потерями восстановителя.
- Снижение концентрации алканоламина ниже заявленных пределов сопровождается формированием крупных частиц металла, снижением седиментационной устойчивости дисперсии, быстрым образованием осадка.
- Увеличение концентрации алканоламина свыше заявленных пределов снижает скорость процесса, затрудняет проведение реакции и вызывает образование металлического зеркала.
- Снижение концентрации аммиака ниже заявленных пределов сопровождается формированием крупных частиц металла, снижением агрегативной устойчивости дисперсии, быстрым образованием осадка.
- Увеличение концентрации аммиака свыше заявленных пределов снижает скорость процесса, затрудняет проведение реакции и вызывает образование металлического зеркала. Получаемые концентраты дисперсии наночастиц металла при этом имеют высокую концентрацию по металлу - до 2,5 вес.%, стабильны на свету и на воздухе в течение длительного времени (не менее 3 лет), представляют из себя гомогенные прозрачные окрашенные в специфический для каждого металла цвет нанодисперсии (от светло-желтого до красно-коричневого для серебра, от сиреневого до темно-вишневого для золота, красно-коричневого для меди, от темно-коричневого до черного для палладия, платины и ртути и т.п.).
Так как потери металла при проведении процесса практически отсутствуют, то содержание наночастиц нульвалентного металла (в мас.%) в полученных концентратах нанодисперсии практически равно содержанию металла в реакционной смеси.
При разбавлении концентратов нанодисперсии растворителем образуются стабильные прозрачные растворы:
- для серебра - от светло-желтого до светло-красно-коричневого цвета (длина волны плазмонного резонанса при максимуме поглощения равна 386-403 нм),
- для золота - розового или сиреневого цвета (длина волны плазменного резонанса при максимуме поглощения равна 521-528 нм),
- для палладия, платины, ртути, цинка - светло-коричневого цвета (поглощение за счет плазменного резонанса в ближней ультрафиолетовой и видимой зоне спектра, равномерно спадающее с ростом длины волны, без явно выраженного максимума),
что свидетельствует о размерах наночастиц в диапазоне от 2 до 20 нм.
Растворы нанодисперсий, в том числе разбавленные, могут храниться на свету в течение длительного времени (не менее 1 года), не изменяя своего цвета, и без образования осадков.
Отсутствие же в их составе катионного металла во время всего периода хранения обеспечивает растворам препарата совместимость, в случае серебра, с физиологическим раствором (хлористый натрий, 0,9 мас.%) в течении как минимум месяца (отсутствие помутнения растворов, отсутствие осадков, в т.ч. и при хранении на свету).
Полученные дисперсии наночастиц серебра, а также наночастиц серебра с добавками меди, золота обладают более высокой антимикробной активностью, чем препараты по прототипу и аналоги, при этом проявляют антимикробное действие в отношении патогенных микробов Escherichia coli. Salmonella typhimurium, Staphyllococcus aureus. Bacillus subtilis, Candida albigans., стерилизуя водные растворы (по e.coli) при концентрациях от 0,1 ррм и выше, а также обладают вирулицидной и фунгицидной активностью, существенно превосходящей известные аналоги и прототип.
Подтверждением этому могут служить данные сравнительных испытаний антимикробной активности серебросодержащих препаратов на разных тест-штаммах (колларгол, протаргол, повиаргол, арговит), выполненных предприятием ГНЦ ВБ «Вектор» [http://vector-vita.narod.ru/Documents/papers/Ag_presentation_2007.pdf]. Наиболее высокой бактерицидной активностью против staphylococcus aureus обладали арговит - 0,5 мкг/мл (0,5 ррм) и повиаргол - 1 мкг/мл (1 ррм), а против e.coli - арговит - 5 мкг/мл (5 ррм) и повиаргол - 5 мкг/мл (5 ррм).
Таким образом, бактерицидная активность полученного продукта в 5-10 и более раз выше, чем у известных продуктов - аналогов и прототипа.
Действительно, в инструкции к препарату Повиаргол [http://medical-instructions.ru/preparat?id=10209] указывается, что повиаргол подавляет рост большинства бактерий (Staphylococcus spp.. Streptococcus spp., Pseudomonas aeruginosa и Escherichia coli, Proteus spp., Shigella spp., Salmonella spp. и др.) при концентрациях до 100 мкг/мл, что при содержании в составе препарата серебра 7,5-8 мас.%, соответствует 7,5-8 ррм.
По сравнению с аналогами и прототипом полученные концентраты дисперсии наночастиц металла обладают высокой концентрацией по металлу, высокой дисперсностью и повышенной агрегатной устойчивости частиц металла в водных и неводных растворах, пониженной токсичностью и аллергенностью, а также воспроизводимостью физико-химических характеристик. Используемые компоненты дисперсии нетоксичны и имеют разрешение на применение в составе медицинских, фармацевтических, косметических и пищевых продуктов, не загрязняют окружающую среду.
Дисперсии - в качестве добавок, хорошо совместимы с различными системами, в т.ч. на водной и на спиртовой основе, с димексидом, глицерином и т.п. В составе дисперсий практически отсутствуют катионы металла (что доказывается отсутствием осадков (и помутнения растворов) при введении в дисперсии растворов хлористого натрия или сульфида натрия), а также ионогенные ПАВ и ионогенные полимеры, что обуславливает повышенную совместимость дисперсий, в т.ч. с системами и препаратами, содержащими ионогенные компоненты, а также имеющими повышенные или пониженные значения рН. Кроме этого, это обеспечивает совместимость дисперсий с большинством известных антибиотиков, что дает возможность сочетанного применения дисперсий наночастиц металла, особенно серебра, с антибиотиками.
Способ получения концентратов дисперсий наночастиц металла по сравнению с аналогами и прототипом отличается простотой, быстротой, хорошей воспроизводимостью, полной конверсией катионов металла в наночастицы металлического серебра, отсутствием потерь металла, дешевизной и нетоксичностью используемых компонентов. Полученные дисперсии могут быть использованы в различных областях промышленности, техники, косметики, быта и медицины, ветеринарии, пищевой промышленности, водоподготовки, а также в качестве действующего начала (субстанции) высокоэффективных антисептических средств, консервантов и других функциональных добавок.
Ниже приведены примеры реализации изобретения.
Пример 1 (по прототипу - RU 2088234).
В защищенный от света стеклянный реакционный аппарат, снабженный мешалкой, капельной воронкой и барботером для продувки инертным газом, загружают 200 г поли-N-винилпирролидона-2 (ПВП) с М 12600, добавляют при перемешивании смесь 1000 мл воды и 300 мл этанола (19%-ный раствор этанола). Полученный 14% раствор ПВП нагревают в течение 10 мин при 75°С и при этой температуре добавляют при перемешивании раствор 27,39 г нитрата серебра (х.ч.) в 500 мл воды (5,2 мас.%). Реакционную смесь, содержащую 12% этанола, 10% ПВП и 1,4% нитрата серебра, перемешивают при той же температуре в течение 60 мин. Водно-спиртовый раствор сушат на распылительной сушилке.