Комплекс для лечения отравлений, содержащий фенотиазиновое соединение, и способы лечения отравлений
Иллюстрации
Показать всеИзобретение относится к медицине и описывает фармацевтический комплекс для коррекции метаболических нарушений пациентов, пострадавших от отравлений токсическими соединениями, содержащий фенотиазиновое соединение, являющееся метиленовой синью, нитроэфирное соединение, являющееся нитроглицерином, этанол и фармацевтически приемлемый носитель. Также описаны способы лечения отравлений, вызванных фторацетатом, этиленгликолем и цианидом, включающие введение нуждающемуся в этом пациенту эффективного количества заявленного комплекса. Данное изобретение обеспечивает лечение отравлений, вызванных фторацетатом, этиленгликолем и цианидом. 4 н. и 19 з.п. ф-лы, 6 табл., 1 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к комплексу и способам лечения отравлений, вызванных токсическими агентами.
УРОВЕНЬ ТЕХНИКИ
Патогенное воздействие при отравлении, вызванном фторацетатами, этиленгликолем, цианидом и другими токсическими агентами, часто выражается в развитии у человека или животного гипоксических или ишемических состояний.
Фторацетаты и другие монофтористые соединения крайне токсичны. Их действие обычно включает в себя латентную стадию, которая у человека продолжается от 30 минут до нескольких часов даже при летальных дозах (Goncharov et al., J Appl. Toxicol. 26:148-161 (2006), включена в настоящую заявку в полном объеме путем ссылки). Натриевая соль фторацетата в некоторых странах используется при борьбе с вредителями. Случайное или намеренное острое отравление может произойти в случае контакта с исходным раствором при приготовлении приманки и в случае попадания на кожу или при вдыхании при использовании приманки. Кроме того, некоторые фтор-содержащие соединения, такие как противораковые агенты, наркотические анальгетики, пестициды или промышленные химикаты, метаболизируются во фторацетат как в промежуточный продукт. Фторацетат проходит ряд метаболических превращений, в результате которых происходит синтез фторцитрата, который блокирует производство энергии, ингибируя цикл Кребса. Антидотная терапия при отравлении фторацетатом до сих пор была направлена на предотвращение синтеза фторцитрата и блокады аконитазы в митохондриях, а также на обеспечение выхода цитрата из этой органеллы. Наиболее приемлемым антидотом в течение последних 60 лет был этиловый спирт,
Цианид (CN-), быстродействующее соединение, часто применяется при суицидах, убийствах и как химическое оружие (см., например, Salkowski et al., Vet. Hum. Toxicol. 36:455-466 (1994) and Borowitz et al., B. Somani (Ed.), Chemical Warfare Agents, Academic Press, New York, p.209-236 (1992), включена в настоящую заявку в полном объеме путем ссылки),
Токсическое воздействие цианида может иметь место в ряде различных ситуаций, например при вдыхании дыма при пиролизе пластика или полимерных волокон на основе нитрила, материалов, которые обычно используются при строительстве или изготовлении мебели. Токсическое воздействие цианида может иметь место при употреблении растительных экстрактов, содержащих цианид-продуцирующие гликозиды, или при вдыхании атмосферных выбросов около промышленных или производственных предприятий. Системное токсическое воздействие цианида объясняется главным образом его связыванием с трехвалентным железом цитохромоксидазы. В ходе реакции образуется стабильный, но обратимый комплекс, что приводит к нарушению производства энергии в клетке. Снижение потребления клеточного кислорода приводит к росту парциального давления кислорода в венозной крови. Классический набор противоядных мер при отравлении цианидом включает в себя вдыхание амилнитрита с последующей внутривенной инъекцией нитрита натрия и тиосульфата натрия (Chen et al., Proc. Soc. Exp. Biol. Med. 31:250-252 (1933), публикация включена в настоящую заявку в полном объеме путем ссылки). Эта процедура все еще используется в клинической практике во всем мире, включая Соединенные Штаты Америки (см., например, Dreisbach, в Handbook of poisoning: Diagnosis and treatment, 12 th edition, 10 Lange Med. Publications., Los Altos, Calif., p.251 (1987), данная публикация включена в настоящую заявку в полном объеме путем ссылки).
Отравление гликолями, особенно этиленгликолем (ЭГ), - это тяжелое состояние, часто приводящее к летальному исходу. Отравление этиленгликолем распространено среди детей и животных, особенно из-за его наличия в больших концентрациях в автомобильном антифризе и других широко используемых бытовых продуктах. Несведущий ребенок или животное могут случайно выпить жидкость, содержащую этиленгликоль, обычно это происходит из-за сладкого аромата или вкуса таких жидкостей, и если лечение не начинают немедленно после употребления, в зависимости от количества употребленного вещества наступает необратимое поражение внутренних органов или смерть. После того как этиленгликоль попадает в организм, он сначала метаболизируется алкогольдегидрогеназой в печени до гликоальдегида. Гликоальдегид затем окисляется до гликолевой кислоты, глиоксиловой кислоты и, в конце концов, до щавелевой кислоты. Таким образом, острое токсическое воздействие этиленгликоля может проходить в три этапа, на каждом из которых задействован различный метаболит: подавление центральной нервной системы (этиленгликоль), воздействие на сердечную и дыхательную системы, связанное с метаболическим ацидозом (гликолевая кислота) и, в конце концов, токсическое воздействие на почки (щавелевая кислота). Токсическое воздействие этиленгликоля может зависеть от общего количества попавшего в организм вещества и эффективности терапевтического вмешательства. Существующие антидоты/способы лечения отравления гликолем немногочисленны. Метаболизм этиленгликоля может быть ингибирован путем применения антидотов, которые ингибируют алкогольдегидрогеназу. Обычно это делали путем использования высоких доз этанола. При достаточно больших концентрациях этанол насыщает алкогольдегидрогеназу, предотвращая ее действие на этиленгликоль, таким образом, он делает возможным выведение этиленгликоля почками в неизмененном состоянии. Однако терапия с применением этанола осложнена тем, что сам этанол неизменно оказывает токсическое воздействие, и необходимо тщательно отслеживать уровень его содержания в сыворотке крови и регулировать количество вводимого этанола. Современной альтернативой терапии с применением этанола является применение фомепизола, или 4-метилпиразола. Как и этанол, фомепизол ингибирует алкогольдегидрогеназу; однако он не обладает серьезным побочным действием (Brent J. Drugs. 2001, 61(7):979-88; Corley RA, McMartin KE. Toxicol Sci. 2005; 85(1):491-501, данная публикация включена в настоящую заявку в полном объеме путем ссылки).
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении описаны в общем фармацевтический комплекс и способы лечения пациентов, пострадавших от отравления токсическими соединениями, такими как фторацетат, цианид и этиленгликоль.
Согласно одному аспекту настоящего изобретения фармацевтический комплекс может включать в себя фенотиазиновое соединение, нитроэфирное соединение, этанол и фармацевтически приемлемый носитель.
В качестве фенотиазинового соединения может выступать метиленовая синь. В качестве соединения нитроэфира может выступать нитроглицерин. Фармацевтический комплекс может дополнительно включать в себя пиразол. Пиразол может быть 4-метилпиразолом. Фармацевтический комплекс может дополнительно включать в себя соединение дикарбоновой кислоты. В качестве соединения дикарбоновой кислоты может выступать соль глутаминовой кислоты. В качестве соли глутаминовой кислоты может выступать глутамат натрия. В качестве соединения дикарбоновой кислоты может выступать 2-оксоглутаратная соль. В качестве 2-оксоглутаратной соли может выступать 2-оксоглутарат. В качестве соединения дикарбоновой кислоты может выступать соль аспарагиновой кислоты. В качестве соединения дикарбоновой кислоты может выступать соль янтарной кислоты. Фармацевтический комплекс может дополнительно включать в себя соединение монокарбоновой кислоты. В качестве соединения монокарбоновой кислоты может выступать соль пировиноградной кислоты. В качестве соли пировиноградной кислоты может выступать пируват натрия.
Согласно другому аспекту настоящего изобретения способ лечения отравления, вызванного фторацетатом, может включать в себя введение нуждающемуся в этом пациенту эффективного количества комплекса, включающего в себя фенотиазиновое соединение, нитроэфирное соединение и этанол. В качестве фенотиазинового соединения может выступать метиленовая синь. В качестве соединения нитроэфира может выступать нитроглицерин. Фармацевтический комплекс может дополнительно включать в себя соединение дикарбоновой кислоты. В качестве соединения дикарбоновой кислоты может выступать соль глутаминовой кислоты. В качестве соли глутаминовой кислоты может выступать глутамат натрия. В качестве соединения дикарбоновой кислоты может выступать 2-оксоглутаратная соль. В качестве 2-оксоглутаратной соли может выступать 2-оксоглутарат натрия. В качестве соединения дикарбоновой кислоты может выступать соль аспарагиновой кислоты. В качестве соединения дикарбоновой кислоты может выступать соль янтарной кислоты. Фармацевтический комплекс может дополнительно включать в себя монокарбоксилатную кислоту. В качестве монокарбоксилатной кислоты может выступать соль пировиноградной кислоты. В качестве соли пировиноградной кислоты может выступать пируват натрия. Фенотиазиновое соединение может вводиться подкожно. Фенотиазиновое соединение может вводиться через 45-75 и 100-140 минут после отравления. Фенотиазиновое соединение может вводиться через 5-15 и 100-140 минут после отравления. Нитроэфирное соединение и этанол могут вводиться внутрибрюшинно. Нитроэфирное соединение и этанол могут вводиться через 5-15, 50-70 и 100-140 минут после отравления. Фенотиазиновое соединение, нитроэфирное соединение и этанол могут дополнительно вводиться через 20-28 и 40-56 часов после отравления,
Согласно следующему аспекту настоящего изобретения способ лечения отравления этиленгликолем может включать в себя введение нуждающемуся в этом пациенту эффективного количества комплекса, включающего в себя фенотиазиновое соединение, нитроэфирное соединение и этанол. В качестве фенотиазинового соединения может выступать метиленовая синь. В качестве соединения нитроэфира может выступать нитроглицерин. Фенотиазиновое соединение может вводиться подкожно. Фенотиазиновое соединение может вводиться через 45-75 и 100-140 минут после отравления. Фенотиазиновое соединение может вводиться через 5-15 и 100-140 минут после отравления. Нитроэфирное соединение и этанол могут вводиться внутрибрюшинно. Нитроэфирное соединение и этанол могут вводиться через 5-15, 50-70 и 100-140 минут после отравления. Фенотиазиновое соединение, нитроэфирное соединение и этанол могут дополнительно вводиться через 20-28 и 40-56 часов после отравления. Фармацевтический комплекс может дополнительно включать в себя пиразол. Пиразол может быть 4-метилпиразолом. Пиразол может вводиться подкожно. Пиразол может вводиться через 5-15 и 100-140 минут после отравления. Фенотиазиновое соединение, нитроэфирное соединение и этанол могут дополнительно вводиться через 45-75 минут и 20-28 часов после отравления.
Согласно другому аспекту настоящего изобретения способ лечения отравления цианидом может включать в себя введение нуждающемуся в этом пациенту эффективного количества комплекса, включающего в себя фенотиазиновое соединение, нитроэфирное соединение и этанол. В качестве фенотиазинового соединения может выступать метиленовая синь. В качестве соединения нитроэфира может выступать нитроглицерин. Фенотиазиновое соединение, нитроэфирное соединение и этанол могут вводиться внутрибрюшинно. Фенотиазиновое соединение, нитроэфирное соединение и этанол могут вводиться через 0.5-2 и 25-45 минут после отравления.
Другие аспекты, свойства и задачи настоящего изобретения будут понятны из описания и формулы изобретения.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Повторяющееся введение особой комбинации соединений может с достижением преимущества оказывать терапевтический эффект на пациентов, пострадавших от отравления фторацетатами, этиленгликолем, цианидом или другими токсическими соединениями, которое приводит к гипоксическим или ишемическим состояниям
Комплекс может включать в себя особые комбинации соединений, таких как фенотиазиновое соединение, соединение дикарбоновой кислоты и/или соединение монокарбоновой (или монокарбоксилированной) кислоты, нитроэфирное соединение и/или алкилэтанол.
Фенотиазиновое соединение может быть замещенным или незамещенным фенотиазиновым соединением или их солью. Фенотиазин может быть замещен одной или более замещающей группой, независимо выбранной из галогеновой, гидроксильной, алкокси, амино, алкиламино, диалкиламино или алкильной. Примеры фенотиазиновых соединений включают в себя, не ограничиваясь: хлорпромазин, флуфеназин, мезоридазин, перфеназин, прохлорперазин, промазин, тиоридазин, трифлуоперазин, трифлуопромазин или метиленовую синь. Метиленовая синь может быть собственно метиленовой синью или ее производной, такой как азур А, В, С и тионин.
Соединение дикарбоновой (или двухосновной карбоновой) кислоты может быть С2-С6 дикарбоновой кислотой или ее солью. Например, соединение дикарбоновой кислоты может иметь формулу HOOC-(CR1\R2)n-COOH, в которой n является 0, 1, 2, 3, 4, 5 или 6 и в которой каждая из R1 и R2 является, независимо, Н, галогеном, C1-C4 алкилом, амино, замещенной амино, тио, или гидроксильной, или звеном (с примыкающей R1 или R2 для формирования двойной или тройной связи); или R1 и R2 вместе являются оксо, С1-С4 алкидиденовыми или иминовыми. Примеры соединений дикарбоновой кислоты включают в себя: глутаминовую кислоту, аспарагиновую кислоту, 2-оксиглутаровую кислоту, малоновую кислоту, янтарную кислоту, адипиновую кислоту, пимелиновую кислоту, субериновую кислоту. Соль может быть мононатриевой солью, монолитиевой солью, монокалиевой солью, двунатриевой солью, двулитиевой солью, двукалиевой солью, солью кальция, магния или другой фармацевтически приемлемой солью. В качестве соединения дикарбоновой кислоты может выступать глутамат натрия, 2-оксоглутарат натрия или аспартат натрия.
Соединение монокарбоновой (или монокарбоксилированной) кислоты может быть С2-С6 монокарбоновой кислотой или ее солью. Например, соединение дикарбоновой кислоты может иметь формулу C(R3)3-(CR1R2)n-COOH, в которой n является 0, 1, 2, 3, 4, 5 или 6 и в которой каждая из R1, R2 и R3 является, независимо, Н, галогеновой, C1-C4 алкильной, амино-, замещенной амино-, тио, или гидроксильной, или звеном (с примыкающей R1 или R2 для формирования двойной или тройной связи); или R1 и R2 вместе являются оксо-, C1-C4 алкидиденовыми или иминовыми. Примеры соединений монокарбоновой кислоты включают в себя пировиноградную кислоту, уксусную кислоту, молочную кислоту. Соль может быть мононатриевой солью, монолитиевой солью, монокалиевой солью, двунатриевой солью, двулитиевой солью, двукалиевой солью, солью кальция, магния или другой фармацевтически приемлемой солью. Например, в качестве соединения монокарбоновой кислоты может выступать пируват натрия, ацетат натрия или лактат натрия.
Нитроэфирное соединение может быть моноспиртом или полиолом, например диспирт, триспирт, тетраспирт, пентаспирт или гексаспирт, имеющие одну или более нитроэфирную группу. Например, в качестве соединения нитроэфира может выступать тетранитрат пентаэритрита, тринитрат глицерина или динитрат изосорбита.
В качестве алкилового спирта может выступать этанол.
В одном варианте выполнения настоящего изобретения комплекс может включать в себя фенотиазиновое соединение, этиленовый спирт и нитроэфирное соединение. Например, комплекс включает в себя метиленовую синь, этанол или нитроглицерин.
В дополнительном варианте выполнения комплекс может включать фенотиазиновое соединение, этиловый спирт, нитроэфирное соединение и соединение дикарбоновой кислоты или соединение монокарбоновой кислоты, или их комбинации. Например, комплекс включает метиленовую синь, этанол, нитроглицерин и глутамат натрия или 2-оксиглутарат натрия, пируват натрия, сукцинат натрия, аспартат натрия.
Соединения в каждом уникальном комплексе могут использоваться в форме фармацевтически приемлемых солей, полученных из неорганических или органических кислот и оснований.
Такие кислые соли включают в себя: ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, пальмоат, памоат, пектинат, персульфат, 3-фенил-пропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат или ундеканоат. Основные соли включают в себя соли аммиака, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли органических оснований, такие как дициклогексиламиновые соли, N-метил-D-глюкамин, и соли с аминокислотами, такими как аргинин, лизин и так далее. Также основные группы, содержащие азот, могут быть кватернизированы такими соединениями, как низшие алкильные галоиды, такие как метил, этил, пропил и бутил хлорид, бромиды и йодиды; диалкильные сульфаты, такие как диметил, диэтил, дибутил и диамил сульфаты, галоиды с длинной цепью, такие как децил, лаурил, миристил и стеарил хлориды, бромиды и йодиды, аралкил галоиды, такие как бензил и фенилэтил бромиды или другие. Таким образом, получаются водорастворимые и маслорастворимые продукты.
Фармацевтический комплекс может включать в себя эффективное количество комбинации соединений, описанных в рамках настоящей заявки.
Эффективное количество определяется как количество, которое необходимо для получения терапевтического эффекта у пациента, подвергающегося лечению. Оно будет зависеть от различных факторов, таких как природа отравляющего соединения, размеры пациента, цель лечения, природа патологии, против которой направлено лечение, конкретный применяемый фармацевтический комплекс и решение лечащего врача. В качестве источника (см. Freireich et al., Cancer Chemother. Rep. 1966, 50, 219 and Scientific Tables, Geigy Pharmaceuticals, Ardsley, NY, 1970, 537). Эффективными являются дозировки активного ингредиента соединения от 0.001 до 100 г на килограмм массы тела в день, предпочтительно от 0.01 до 10 г на килограмм массы в день. Эффективное количество может также варьироваться, что определяется профессионалами в данной области, в зависимости от формы введения, используемого формообразующего средства и возможности параллельного использования с другими терапевтическими средствами, включая другие антидоты, или до или после лечения этими средствами. Эффективное количество активного ингредиента может также зависеть от терапевтического или профилактического агента, если таковой существует, с которым данный ингредиент вводится параллельно. Пациентом может быть человек или животное, такое как шимпанзе и другие виды обезьян; сельскохозяйственные животные, такие как крупный рогатый скот, лошади, овцы, козы и свиньи; домашние животные, такие как кролики, собаки и кошки; лабораторные животные, включая грызунов, таких как крысы, мыши и морские свинки; и т.п. Пациентами могут также быть немлекопитающие, такие как птицы и т.п.
Согласно одному варианту выполнения настоящего изобретения способ лечения отравления фторацетатом натрия может включать в себя введение нуждающемуся в этом пациенту эффективного количества комплекса, включающего фенотиазиновое соединение и соединение дикарбоновой кислоты. В качестве фенотиазинового соединения может выступать метиленовая синь, а в качестве соединения дикарбоновой кислоты может выступать глутамат натрия.
Согласно другому варианту выполнения настоящего изобретения способ лечения отравления фторацетатом натрия может включать в себя введение нуждающемуся в этом пациенту эффективного количества комплекса, включающего в себя фенотиазиновое соединение, нитроэфирное соединение и алкилэтанол. В качестве фенотиазинового соединения может выступать метиленовая синь. В качестве соединения нитроэфира может выступать нитроглицерин. В качестве алкилэтанола может выступать этанол. Согласно дополнительному варианту выполнения настоящего изобретения способ лечения отравления фторацетатом может включать в себя введение нуждающемуся в этом пациенту эффективного количества комплекса, включающего в себя фенотиазиновое соединение, нитроэфирное соединение, алкилэтанол и соединение дикарбоновой кислоты. В качестве фенотиазинового соединения может выступать метиленовая синь. В качестве соединения нитроэфира может выступать нитроглицерин. В качестве алкилэтанола может выступать этанол. В качестве соединения дикарбоновой кислоты может выступать глутамат натирия, или 2-оксоглутарат натрия, или аспартат натрия, или сукцинат натрия. Согласно другому варианту выполнения настоящего изобретения способ лечения отравления фторацетатом натрия может включать в себя введение нуждающемуся в этом пациенту эффективного количества комплекса, включающего в себя фенотиазиновое соединение, нитроэфирное соединение, алкилэтанол и монокарбоксилированное соединение. В качестве фенотиазинового соединения может выступать метиленовая синь. В качестве соединения нитроэфира может выступать нитроглицерин. В качестве алкилэтанола может выступать этанол. В качестве монокарбоксилированного соединения может выступать пируват, или ацетат, или лактат.
Согласно другому варианту выполнения настоящего изобретения способ лечения отравления этиленгликолем может включать в себя введение нуждающемуся в этом пациенту эффективного количества комплекса, включающего в себя фенотиазиновое соединение, нитроэфирное соединение и алкилэтанол. В качестве фенотиазинового соединения может выступать метиленовая синь. В качестве соединения нитроэфира может выступать нитроглицерин. В качестве алкилэтанола может выступать этанол.
Согласно другому варианту выполнения настоящего изобретения способ лечения отравления цианистым калием может включать в себя введение нуждающемуся в этом пациенту эффективного количества комплекса, включающего в себя фенотиазиновое соединение, нитроэфирное соединение и алкилэтанол. В качестве фенотиазинового соединения может выступать метиленовая синь. В качестве соединения нитроэфира может выступать нитроглицерин. В качестве алкилэтанола может выступать этанол.
В ходе лечения соединения, входящие в состав каждого конкретного комплекса, могут вводиться вместе или последовательно. Каждый комплекс может вводиться нуждающемуся в этом пациенту на начальном этапе, периодично или повторно, до или сразу после острого отравления или в течение 0, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 минут, 1 часа, 90 минут, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 часов после отравления
Соединение в каждом конкретном комплексе может вводиться через 0-0.5, 0.5-2, 2-5, 5-10, 5-15, 15-25, 25-45, 45-75, 75-100, 100-140 минут, 20-28 или 40-56 часов после отравления. Например, фенотиазиновое соединение может вводиться через 60 и 120 минут после отравления. Фенотиазиновое соединение может вводиться через 10 и 120 минут после отравления. Нитроэфирное соединение и этанол могут вводиться через 10, 60 и 120 минут после отравления. Фенотиазиновое соединение, нитроэфирное соединение и этанол могут вводиться через 1 и 30 минут после отравления. Фенотиазиновое соединение, нитроэфирное соединение и этанол могут вводиться через 1 и 24 часа после отравления. Фенотиазиновое соединение, нитроэфирное соединение и этанол могут вводиться через 24 и 48 часов после отравления.
Комплекс может вводиться нуждающемуся в нем пациенту через менее чем 96 часов, менее чем 72 часа, менее чем 48 часов, менее чем 36 часов, менее чем 30 часов, менее чем 24 часа, менее чем 18 часов, менее чем 12 часов, менее чем 6 часов, менее чем 3 часа или менее чем 1 час после отравления. Комплекс может вводиться нуждающемуся в нем пациенту с хроническим отравлением 10 раз в день, 9 раз в день, 8 раз в день, 7 раз в день, 6 раз в день, 5 раз в день, 4 раза в день, 3 раза в день, два раза в день, каждый день, каждые два дня, каждые 3 дня, каждые 4 дня, каждые 5 дней, каждые 6 дней, каждую неделю, каждые две недели, каждый месяц или так часто, как требуется.
Антидоты, действие которых направлено на конкретные виды отравлений, могут вводиться вместе с комплексом либо одновременно, либо последовательно. Антидоты могут вводиться нуждающемуся пациенту до или после введения комплекса. Примеры антидотов включают в себя, не ограничиваясь, амилнитрит, нитрит натрия, тиосульфат натрия или витамин В12 в случае отравления цианидом; пиразол, такой как 4-метилпиразол, для отравления этиленгликолем.
Комбинации соединений могут быть оформлены в фармацевтические комплексы, которые могут применяться энтерально, парэнтерально, в виде спрея для ингаляций, местно, ректально, назально, буккально, вагинально или через имплантированный резервуар. Термин «парентерально» в рамках настоящего изобретения означает подкожные, внутривенные, внутримышечные, внутрисуставные, внутрисиновиальные, интрастемальные, интратекальные, внутрипеченочные, интралезиональные, интракраниальные инъекции или инфузионные техники.
Фармацевтический комплекс может включать в себя различные комбинации соединений или их фармацевтически приемлемых производных вместе с фармацевтически приемлемым носителем. Термин «носитель» в рамках настоящего изобретения включает в себя приемлемые вспомогательные вещества и наполнители.
Фармацевтически приемлемые носители включают в себя, не ограничиваясь: ионообменное вещество, оксид алюминия, стеарат алюминия, лецитин, сывороточный протеин, такой как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси насыщенных растительных жирных кислот с неполным глицеридом, вода, соли или электролиты, такие как протаминсульфат, двузамещенный фосфорнокислый натрий, вторичный кислый фосфат калия, хлористый натрий, соли цинка, коллоидная окись кремния, трисиликат магния, поливинилпирролидон, целлюлозные вещества, полиоксиэтиленгликоль, натриевая карбоксиметилцеллюлоза, полиакрилат, воски, полиэтиленполиоксипропиленовые полимеры, полиэтиленгликоль или ланолин.
Фармацевтический комплекс может иметь форму стерильного препарата для инъекций, например стерильной водной или масличной эмульсии. Эта эмульсия может быть получена с использованием техник, известных из уровня техники, с использованием диспергирующих или увлажняющих суспендирующих агентов. Стерильный препарат для инъекций также может быть выполнен в форме суспензии для инъекций или раствора в нетоксичном растворителе или разбавителе, приемлемом для парентерального введения, например, в форме раствора в 1.3-бутандиоле. В качестве приемлемых вспомогательных веществ и растворителей могут применяться вода, раствор Рингера и изотонический раствор хлористого натрия. Дополнительно, традиционно в качестве растворителя или суспендирующей среды используются стерильные нелетучие масла. С этой целью могут использоваться слабо нелетучие масла, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, могут использоваться при приготовлении инъекционных препаратов, так же как и натуральные фармацевтически приемлемые масла, такие как оливковое или касторовое масла, особенно их полиоксиэтилированные варианты. Эти масляные растворы или суспензии могут также содержать S-длинноцепные спиртовые разбавители или дисперсанты.
Фармацевтические комплексы могут вводиться перорально в любой приемлемой для этого дозе, включая, не ограничиваясь, капсулы, таблетки, водные суспензии или растворы.
В случае если используется таблетированная форма для перорального введения, традиционно применяемые носители включают в себя лактозу и кукурузный крахмал. Традиционно также добавляются лубриканты, такие как стеарат магния. В случае если для перорального введения используется капсульная форма, применяемые разбавители включают в себя лактозу и кукурузный крахмал. Если для перорального введения необходимы водные суспензии, активный ингредиент смешивается с эмульгирующим и суспендирующим агентами. При желании могут быть добавлены определенные конкретные подсластители, ароматизаторы или красители.
Фармацевтический комплекс может вводиться в форме ректальных суппозиториев. Они могут быть приготовлены путем смешивания агента с подходящим, не вызывающим раздражение формообразующим средством, которое сохраняет твердую форму при комнатной температуре и становится жидким при ректальной температуре и таким образом тает в прямой кишке для выделения лекарственного вещества. Такими веществами являются масло какао, пчелиный воск или полиэтиленгликоли.
Фармацевтический комплекс может вводиться местно, особенно если цель лечения включает в себя зоны или органы, которые легкодоступны для местного введения комплекса, включая случаи поражения глаз, кожи или нижнего отдела желудочно-кишечного тракта. Подходящие формы для местного применения легко готовятся для каждой из этих зон или органов.
Местное применение в нижнем отделе желудочно-кишечного тракта может осуществляться путем применения комплекса в форме ректальных суппозиториев (см. выше) или в форме, приемлемой для введения через клизму. Для местного применения могут быть использованы трансдермальные пластыри.
Для местного применения фармацевтический комплекс может быть оформлен в виде мази, содержащей активный агент, суспендированный или растворенный в одном или более носителях. Носители, используемые при местном применении соединений согласно настоящему изобретению, включают в себя, не ограничиваясь, минеральное масло, жидкий вазелин, медицинский вазелин, пропиленгликоль, полиоксиэтилен, соединение полиоксипропилена, эмульгирующий воск или воду. В качестве альтернативы фармацевтический комплекс может быть оформлен в виде соответствующего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителях.
Приемлемые носители включают в себя, не ограничиваясь, минеральное масло, сорбитмоностеарат, полисорбат 60, воск цетиловых эфиров, цетиариловый спирт, 2-октилдодеканол, бензиловый спирт или воду.
Для офтальмологического использования фармацевтический комплекс может быть выполнен в форме тонкодисперсных суспензий в изотоническом, pH доведенном стерильном физиологическом растворе или, предпочтительно, в форме растворов в изотоническом, pH доведенном стерильном физиологическом растворе, с или без консерванта, такого как бензилалкониум хлорид. В качестве альтернативы для офтальмологического применения фармацевтические комплексы могут быть выполнены в форме мази, такой как вазелин.
Фармацевтический комплекс может также вводиться в виде назального аэрозоля или ингаляционно с использованием небулайзера, ингалятора для сухих ингаляций или дозирующего ингалятора Такие комплексы производятся в соответствии с технологиями, хорошо известными из уровня техники в области фармацевтических технологий приготовления лекарственных средств, и могут быть выполнены в виде растворов в физиологическом растворе, с использованием бензилового спирта или других приемлемых консервантов, промоутеров абсорбции для повышения биологического усваивания, фторуглеродов и/или других общепринятых растворяющих или диспергирующих агентов.
Нижеследующие примеры приведены лишь с целью иллюстрации изобретения, а не с целью ограничения вариантов выполнения.
ПРИМЕРЫ
Материалы и методы.
Соединения и условия их введения были протестированы на экспериментальных крысах и мышах. Соединения использовали свежеприготовленными (не позднее чем за 1 день до введения) в виде водных растворов. Фторацетат натрия (SFA) синтезировали согласно Berhmann et al., J Chern. Soc (London), стр.3786-3788 (1953) в Научно-исследовательском институте гигиены, профпатологии и экологии человека (Санкт-Петербург, Россия). Согласно результатам хромато-масс-спектрометрии (GC-MS) и элементного анализа беспримесность синтезированного образца составила не менее 98%.
Использовали метиленовую синь (MB), соль глутаминовой кислоты (SG) и 4-метилпиразол (4МР) фирмы Sigma, 1% раствор нитроглицерина (GT) в этаноле (ET) фирмы Merck, пируват натрия фирмы Serva. Этиленгликоль (EG), 2-оксоглутарат, хлористый аммоний (АС) и химически чистый цианистый калий (KCN) закупались в компании Экрос, Россия.
Беспородные крысы и крысы линии Wistar, самки и самцы, и беспородные мыши закупались в питомнике лабораторных животных «Рапполово» (Ленинградская область) и содержались в институтском вивариуме. В каждой клетке размещали 5-6 животных (при температуре 21°С±2°С, относительная влажность составляла не менее 30%). У животных был свободный доступ к кормушкам со стандартным лабораторным гранулированным питанием для грызунов (компании «Лабораторснаб», Московская область) и водопроводной воде. До начала экспериментов животные проходили, по крайней мере, 2-недельный карантин и период ассимиляции. В ходе эксперимента использовали 2-6-месячных крыс весом 200-400 г. Для минимизации сезонных или возрастных колебаний, ключевые эксперименты проводили с крысами одного пола, купленными у одной и той же компании, и приблизительно одного возраста. Эти эксперименты проводились в короткие сроки (3-4 недели). Обычно в каждой группе было 3-4 крысы, и в каждом эксперименте участвовало 3-4 группы. Эксперименты могли при необходимости повторяться для получения статистически значимых данных. Контрольные животные и животные, получавшие лечение, находились под наблюдением в течение 2 недель, и в каждой группе регистрировали совокупную смертность. Параметры токсического воздействия рассчитывали в ходе пробит-анализа по методу Литчфилда-Вилкоксона с использованием специального программного обеспечения.
Растворенный в дистиллированной воде SFA вводили орально (в виде внутрижелудочной инъекции с использованием специального зонда из нержавеющей стали, подсоединенного к стеклянному шприцу объемом 1 мл) по 0.2 мл на 100 г веса крысы, через 7-9 часов после прекращения кормления.
Комбинация из двух соединений: 1) водного раствора (5 мг/мл) метиленовой сини (MB), вводимого подкожно в дозе 5 мг/кг; 2) водного раствора (130 мг/мл) глутамата натрия (SG), вводимого внутрибрюшинно в дозе 250 мг/кг; вводилась через 10 и 120 минут после острого отравления фторацетатом натрия (SFA).
Комбинация из трех соединений: водного раствора MB (в дозе 5 мг/кг, вводимого подкожно), водного раствора 25-50% этанола (ЕТ) и 0.25-0.5% нитроглицерина (GT) (соответствующие дозы чистого этанола (ЕТ) и нитроглицерина (GT) составляли 1 г/кг и 10 мг/кг, вводились внутрибрюшинно); вводилась через 10, 60 и 120 минут (ЕТ и GT) или 60 и 120 минут (MB) после отравления SFA.
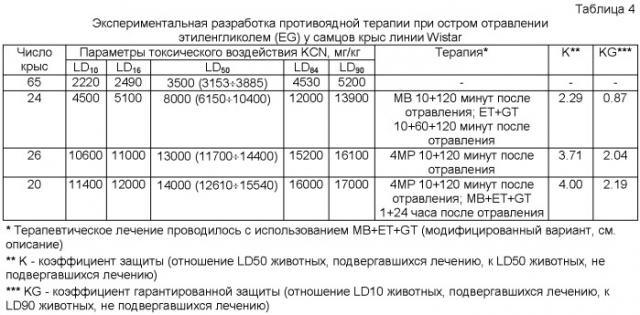
Комбинацию, созданную для лечения отравления цианистым калием (KCN): метиленовая синь (MB), этанол (ЕТ) и нитроглицерин (GT) смешивали вместе и вводили внутрибрюшинно через 1 и 30 минут после отравления. Дозу MB повышали до 10 мг/кг.
Комбинация из четырех соединений: водного раствора MB (в дозе 5 мг/кг, вводимого подкожно) и водного раствора 25% этанола (ЕТ), 025% GT и 12.5-25 мг/мл соли глутаминовой кислоты (SG), так что доза для чистого этанола составляла 1 г/кг, для нитроглицерина (GT) - 10 мг/кг и для соли глутаминовой кислоты (SG) - 50-100 мг/кг, вводимых внутрибрюшинно; вводилась через 10, 60 и 120 минут, 24 и 48 часов (для ЕТ, GT и SG) и 10 и 120 минут, 24 и 48 часов (для MB) после отравления SFA.
Для проверки эффективности препаратов при остром отравлении фторацетатом натрия (SFA) комбинация метиленовой сини и глутамата натрия вводилась через 10 и 120 минут после острого отравления SFA. Было выявлено, что комбинация имела коэффициент эффективности для LD50 (KLD50) на уровне 2.5 (Таблица 1).
| Таблица 1 | ||||
| Определение эффективности комбинации метиленовой сини (MB) и глутамата натрия (SG) при остром отравлении SFA у самок крыс | ||||
| Доза Мг/кг | Терапия | Число крыс | Смертность | Пробит-анализ по методу Литчфилда-Вилкоксона |
| 1.17 | Нет | 6 | 1 | LD16=1.179 |
| 1.4 | Нет | 6 | 3 | LD50=1.368 (1.215÷1.540) |
| 1.75 | Нет | 6 | 6 | LD84=1.586 |
| 3.0 | Комбинация (MB+SG) 1 час + 2 часа после отравления | 6 | 0 | |
| 3.5 | Комбинация (MB+SG) 1 час + 2 часа после отравления | 18 | 9 | LD1 |