Реакции озонолиза в жидком co2 и растворителях, расширенных co2
Иллюстрации
Показать всеСпособ повышения концентрации озона в жидкости может включать обеспечение наличия газа, включающего озон; введение озонсодержащего газа в жидкость, причем комбинация жидкости и озона имеет температуру приблизительно от 0,8 до 1,5 критического значения температуры озона; изотермическое повышение давления озонсодержащего газа над жидкостью приблизительно до 0,3-5 критических значений давления озона, чтобы повысить концентрацию озона в жидкости. Температура выражена в абсолютных единицах (по шкале Кельвина или шкале Ренкина). Способ может быть использован для удаления озона из газа или для очистки озона. Жидкость, имеющая высокую концентрацию озона, может быть использована для озонолиза субстрата. 6 н. и 31 з.п. ф-лы, 27 ил., 2 табл.
Реферат
Предпосылки создания изобретения
Реакции озонолиза традиционно осуществляются барботированием О3 либо через водную фазу, либо через органическую жидкую фазу, содержащую субстрат, подлежащий химическому модифицированию, такой как молекулы, содержащие двойные связи углерод-углерод (т.е. C=C). Известные способы, однако, имеют ряд недостатков. Во-первых, поскольку O3 обладает высокой реакционной способностью, применяемые температуры реакции обычно ниже температуры окружающей среды (часто приблизительно 0°C), при этом растворимость O3 в жидкой фазе низкая, хотя и обычно выше растворимости молекулярного кислорода. Например, растворимость O3 в воде составляет 0,105×10-2 г/мл при 0°C и давлении 1,013 бар. Во-вторых, O3 вступает в реакцию со многими традиционными органическими растворителями, что не только снижает доступность O3 для окисления субстрата, но также приводит к образованию нежелательных продуктов (например, отходов), возникающих из-за окисления растворителя и увеличенного потребления растворителя. В-третьих, растворимость O3 в жидкой фазе не чувствительна к изменению давления, что часто ограничивает возможность управления скоростью реакции и селективностью продукта.
Таким образом, было бы полезно иметь процесс и условия реакции для осуществления озонолиза с повышенной растворимостью O3 в растворителе. Также было бы полезно иметь процесс и условия реакции для осуществления озонолиза в растворителе, который, по существу, инертен к O3, чтобы ограничить количество и объем нежелательных побочных продуктов. Далее, было бы выгодно иметь процесс и условия реакции для осуществления озонолиза, когда растворимость O3 в жидкой фазе регулируется давлением, чтобы обеспечить возможность управления скоростью реакции и селективностью продукта.
Сущность изобретения
В одном примере осуществления настоящее изобретение включает способ увеличения концентрации озона в жидкости. Такой способ может включать обеспечение озонсодержащего газа; введение озонсодержащего газа в жидкость, причем комбинация жидкости и озона имеет температуру приблизительно 0,8-1,5 критического значения температуры озона; изотермическое повышение давления комбинации озонсодержащего газа над жидкостью до приблизительно 0,3-5 критических значений давления озона, чтобы повысить концентрацию озона в жидкости. Также температура может быть приблизительно 1-1,2 критического значения температуры озона, причем температура указывается по Кельвину. Кроме того, давление может быть повышено приблизительно до 0,5-2 критических значений давления озона, причем давление указано в барах. Концентрация озона в жидкости увеличивается по меньшей мере приблизительно в 5 раз, выше половины порядка величины или выше приблизительно на порядок величины. Конечно, диапазоны температуры и давления могут преобразовываться и выражаться в других единицах.
В одном примере осуществления жидкость может включать любое из следующего: жидкий диоксид углерода, жидкие легкие углеводороды (например, C4 или менее), метанол, этанол, спирты, гексан, жидкий SF6, жидкий ксенон, вода, фторуглеродные растворители, высоконакислороженные молекулы, высокофторированные молекулы, СF3СО2Н, ионные жидкости, сильные жидкие кислоты, Н2SO4, НSO3F, НSO3СF3, органические кислоты, насыщенные углеводороды или их комбинации. Также жидкость может быть одной из вышеназванных жидкостей, расширенной диоксидом углерода.
В одном примере осуществления настоящее изобретение может включать способ извлечения озона из газа. Такой способ может включать обеспечение озонсодержащего газа при температуре приблизительно 0,8-1,5 критического значения температуры озона; изотермическое повышение давления озона приблизительно до 0,3-5 критических значений давления озона; введение сжатого озона в жидкость, причем комбинация жидкости и озона имеет температуру приблизительно 0,8-1,5 критического значения температуры озона, а давление в комбинации жидкости и озона составляет приблизительно 0,3-5 критических значений давления озона. Температура и давление могут быть такими, как здесь описано. Также жидкости и жидкости, расширенные диоксидом углерода, могут быть такими, как здесь описано.
В одном примере осуществления настоящее изобретение может включать способ осуществления озонолиза на молекуле в жидкости. Такой способ может включать обеспечение композиции с жидкостью и озоном, причем композиция жидкости и озона имеет температуру приблизительно 1-1,2 критического значения температуры озона и давление приблизительно 0,5-2 критического значения давления озона, причем молекула растворена или диспергирована в жидкости; и осуществление реакции молекулы с озоном. Способ дополнительно может включать введение молекулы в одно из следующего: в жидкость до озона, в озон до жидкости или в комбинацию жидкости и озона. Температура и давление могут быть такими, как здесь описано. Также жидкости и расширенные диоксидом углерода жидкости могут быть такими, как здесь описано.
В одном примере осуществления озонолиз дополнительно может включать введение озона в жидкость, причем комбинация жидкости и озона имеет температуру приблизительно 0,8-1,5 критического значения температуры озона; изотермическое повышение давления озона в жидкости до приблизительно 0,3-5 критического значения давления озона, чтобы увеличить концентрацию озона в жидкости.
В одном примере осуществления молекула, подвергаемая озонолизу, может быть выбрана из группы, состоящей из молекулы, имеющей ненасыщенный углеводород, молекулы, имеющей двойную связь углерод-углерод, ненасыщенных углеводородных кислот, метилолеата, масел, жиров, соевого масла, ненасыщенных жирных кислот, растительных жирных кислот, сложных эфиров жирных кислот, амидов жирных кислот, алкенов, стероидов, бензильных соединений, молекулы, имеющей аллильную группу, терпенов, цефалоспорина, производных цефалоспорина, третичного аллильного спирта и т.п.
В одном примере осуществления настоящее изобретение может включать текучую композицию для осуществления озонолиза на молекуле, имеющую комбинацию жидкости, например жидкого диоксида углерода или жидкости, расширенной диоксидом углерода, и озона, имеющего температуру приблизительно 1-1,2 критического значения температуры озона и давление приблизительно 0,5-2 критического значения давления озона. Композиция может также включать молекулу, подвергаемую озонолизу. Температура и давление могут быть такими, как здесь описано. Также жидкости и расширенные диоксидом углерода жидкости могут быть такими, как здесь описано.
В одном примере осуществления текучая композиция может быть охарактеризована как имеющая полосу поглощения с λmax приблизительно при 253,7 нм, приблизительно при 577 нм и приблизительно при 603 нм, причем по меньшей мере при λmах оптическая плотность равна приблизительно 0,005, когда давление равно приблизительно 0,5 критического значения давления озона, или при λmах оптическая плотность равна приблизительно 0,01-0,1, когда давление равно приблизительно 0,5-2 критическим значениям давления озона.
В одном примере осуществления настоящее изобретение может включать способ выделения озона из воздуха или газа кислорода, имеющего озон. Такой способ может включать обеспечение газа, содержащего озон, с температурой выше критического значения температуры озона и давлением ниже критического значения давления озона; изменение температуры газа до температуры, близкой или ниже критического значения температуры озона; увеличение давления газа приблизительно до критического значения давления озона, чтобы выделить озон из газа. Температура и давление могут быть такими, как здесь описано. Также жидкости и расширенные диоксидом углерода жидкости могут быть такими, как здесь описано. Дополнительно газ может находиться в присутствии жидкости, и озон выделяется из газа в жидкость.
Эти и другие примеры осуществления и признаки сенсорного устройства станут более наглядными из последующего описания и приложенной формулы изобретения, а также о них можно узнать из приведенной ниже практики использования сенсорного устройства.
Данное краткое описание является только наглядным и не предназначено быть ограничительным ни в коей мере. Вдобавок к наглядным аспектам, примерам осуществления и признакам, описанным выше, дальнейшие аспекты, примеры осуществления и признаки станут более явными при ссылках на чертежи и последующее подробное описание.
Чертежи
Чтобы далее разъяснить вышеприведенные и другие преимущества и признаки устройства реактора озонолиза и подаваемых и реакционных смесей, будет представлено наглядное описание устройства реактора озонолиза со ссылкой на приложенные чертежи. Подразумевается, что эти чертежи показывают только наглядные примеры осуществления устройства реактора озонолиза, и поэтому они не считаются ограничивающими его объем. Таким образом, чертежи не следует считать ограничивающими любой объект по форме или размерам, а признаки настоящего изобретения, такие, как устройство реактора озонолиза, могут иметь различные требуемые или задаваемые формы и размеры.
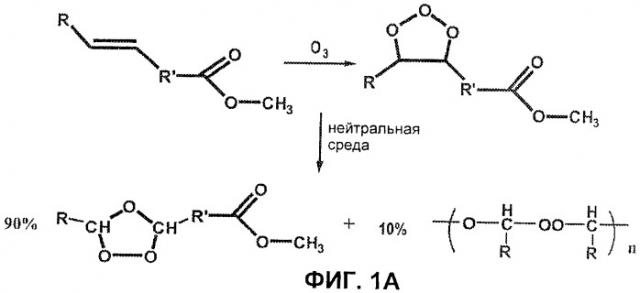
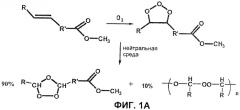
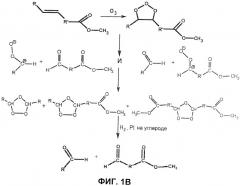
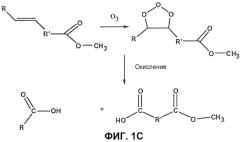
Фиг.1А-1C являются схематическими изображениями реакций озонолиза (Kirk-Othmer Encyclopedia of Chemical Technology 4th Edition, John Wiley and Sons, New York 8 124-125 (1996)).
Фиг.2А-2Е являются схематическими изображениями реакции озонолиза.
Фиг.3 представляет собой принципиальную схему системы для осуществления озонолиза или очищения озона от газа.
Фиг.4А-4В представляют собой графики, показывающие УФ/видимый спектры озона, имеющего высокую полосу поглощения Хартли и низкую полосу поглощения Чаппуиса.
Фиг.5 представляет собой график, показывающий увеличение поглощения в полосе Чаппуиса при добавлении озона (путем повышения давления) до фиксированного объема жидкого CO2.
Фиг.6 представляет собой график, показывающий концентрацию озона в зависимости от Ptotai при добавлении озоновоздушной или озонокислородной смесей (путем повышения давления) в фиксированный объем жидкого CO2.
Фиг.7 представляет собой график, показывающий увеличение поглощения в полосе Чаппуиса при добавлении озона в жидкий диоксид углерода.
Фиг.8 представляет собой график, показывающий концентрацию озона в зависимости от Ptotai при добавлении озона в жидкий CO2.
Фиг.9 представляет собой график, показывающий влияние температуры на увеличение в объеме бинарной смеси метанол/соевое масло (молярное соотношение 6:1) посредством CO2.
Фиг.10 представляет собой график, показывающий УФ/видимый спектры расширенного диоксидом углерода метанола при добавлении озона.
Фиг.11 представляет собой график, показывающий УФ/видимые спектры расширенного диоксидом углерода гексана при добавлении озона.
Фиг.12 представляет собой график, показывающий УФ/видимый спектры жидкого метанола под давлением 1,013 бар при добавлении озона.
Фиг.13 представляет собой график, показывающий УФ/видимые спектры озонированного метанола при добавлении метилолеата.
Фиг.14 представляет собой график, показывающий УФ/видимый спектры метилолеата в метаноле при добавлении озона.
Фиг.15 представляет собой график, показывающий меру растворимости озона в воде как функцию давления при изотермических условиях, когда температура равна 2°C.
Фиг.16 представляет собой график, показывающий меру растворимости озона в воде как функцию давления при изотермических условиях, когда температура равна 6°C.
Фиг.17 представляет собой график, показывающий меру растворимости озона в воде как функцию давления при изотермических условиях, когда температура равна 20°C.
Фиг.18 представляет собой принципиальную схему системы, имеющей ультразвуковой зонд для обеспечения ультразвукового перемешивания в процессе озонолиза или при очистке озона от газа.
Фиг.19 представляет собой график, показывающий скорость разложения в воде при ультразвуковом перемешивании и без него (Kang, J-W., Lee, K-H., Koh, C-I., Nam, S-N., Korean Journal of Chemical Engineering 18 336 (2001)).
Фиг.20 представляет собой таблицу, показывающую влияние ультразвукового перемешивания на константы скорости разложения озона в воде и жидком диоксиде углерода.
ПОДРОБНОЕ ОПИСАНИЕ
В нижеизложенном подробном описании делается ссылка на приложенные чертежи, являющиеся частью данного документа. На чертежах одинаковые символы обычно обозначают одинаковые компоненты, если иное не обусловлено контекстом. Наглядные примеры осуществления, описанные в подробном описании, чертежи и формула изобретения не подразумеваются как ограничивающие. Могут также использоваться другие примеры, могут вноситься другие изменения, без отступления от сущности и объема предмета изобретения, представленного здесь.
I. Введение
В целом настоящее изобретение включает новые процессы для увеличения концентрации озона в жидкостях и для осуществления реакций озонолиза. Озон имеет критическую температуру (Тc), равную - 12,15°С (261 К), критическое давление (Рс), равное 55,73 бар, и критическую плотность, равную (ρc) 540 кг/м3. В процессе озонолиза субстрат (например, молекулу, содержащую C=C) либо растворяют, либо эмульгируют в жидком диоксиде углерода или растворителях, расширенных диоксидом углерода. Чтобы увеличить концентрацию озона в жидкостях, поток газа, содержащего озон (O3), полученный с использованием воздуха или кислорода в озоногенераторе, добавляют в жидкую фазу (например, жидкий углерод или растворители, расширенные диоксидом углерода) при температурах предпочтительно приблизительно 1-1,2 критического значения температуры O3 (выраженной в К). Озон сжимают до давления предпочтительно приблизительно 0,5-2 критического значения давления O3. Определено, что растворимость O3 в жидком СО2 возрастает почти на порядок величины при увеличении давления приблизительно от 51-65 бар. При этих условиях было показано, что О3 стабилен при смешивании с жидким СО2, и О3 способен разрывать двойные связи углерод-углерод в субстратах, особенно в контексте процесса получения химикатов из биомассы, дающего строительные блоки для синтеза множества промышленных химических продуктов. Реакция протекает через промежуточные соединения, являющиеся метастабильными, но дальнейшее окисление или снижение, последующее за основным окислением озоном, дает молекулы меньшей массы, обычно пригодные в качестве строительных блоков для химического синтеза. В качестве примера было показано, что озонолиз метилолеата, СН3(СН2)7СН=СН(СН2)7С(=O)ОСН3, в жидком СО2 и жидкостях, расширенных СО2, дает карбоксильные кислоты, дикарбоксильные кислоты и альдегиды.
Процесс озонолиза по настоящему изобретению может применяться для разрыва двойных связей углерод-углерод в субстратах, особенно в субстратах, относящихся к процессу получения химикатов из биомассы, дающему строительные блоки для синтеза множества промышленных химикатов. Реакция протекает через промежуточные соединения, являющиеся метастабильными, но дальнейшее окисление или восстановление, последующее за основным окислением озоном, дает молекулы меньшей массы, пригодные в качестве строительных блоков для химического синтеза. В жидком СО2 плотность озона приближается существенно близко к критической точке, что позволяет увеличить растворимость озона и возможность регулирования концентрации озона в жидкой фазе для особой цели. Также озон предпочтительно окисляет многие олефиновые субстраты в СО2 и расширенной диоксидом углерода жидкости. Для озонирования метилолеата система растворителей дает следующее: в CO2 получают нонаналь, пеларгоновую кислоту и азелаиновую кислоту; в гексане, расширенном CO2, получают нонанол, пеларгоновую кислоту и азелаиновую кислоту; а в метаноле, расширенном CO2, получают азелаиновую кислоту и пеларгоновую кислоту.
Значимые характеристики нового процесса являются следующими: (i) О3 стабилен в предпочтительном растворителе в силу отсутствия химической активности при предпочтительных условиях реакции; (ii) при предпочтительных температурах реакции растворимость О3 в растворителе может быть повышена приблизительно на порядок величины при сравнительно малых изменениях давления. Такая регулируемость обеспечивает возможность управления скоростью реакции и селективностью продукта; (iii) пониженная опасность воспламенения; (iv) низкая токсичность растворителя; (v) легкое отделение продукта.
Из-за своего высокого окислительного потенциала (Е°=2,075 В в кислоте и 1,246 В в основании) озон был исследован в качестве мощного и безопасного для окружающей среды окислителя, поскольку он в конечном итоге разлагается до атмосферного кислорода. Например, озонолиз метилолеата, СН3(СН2)7СН=СН(СН2)7С(=O)ОСН3, с последующим каталитическим восстановлением в воде дает выход альдегидов, приближающийся к 90%. Подробное изучение метастабильных исходных продуктов окисления показало, что 90% метилолеата преобразуется в 1,2,4-триоксолан, а 10% дают олигомеры пероксидов (фиг.1А). Последние должны сопровождаться эквивалентным молярным количеством альдегида. 1,2,4-Триоксолан образуется путем перегруппировки исходного продукта из 1,3 присоединения озона в двойную связь, 1,2,3-триоксолан. Эту перегруппировку понимают как происходящую посредством обратимого диссоциативного процесса в альдегид и цвиттер-ионный пероксид. Фиг.1В показывает схему реакции, расширенную для отображения сложности промежуточных продуктов, получаемых этим диссоциативным процессом.
Вопреки вероятности образования семи или приблизительно того промежуточных продуктов (не считая геометрических изомеров) образуется только пара продуктов, альдегид и сложного карбоксиэфира альдегид. Важно, что если за реакцией озонолиза следует завершение процесса окисления, продуктами являются карбоновая кислота и дикарбоновая кислота (фиг.1C).
II. Озонолиз
В одном примере осуществления настоящее изобретение обеспечивает улучшенные процессы и условия реакции для осуществления озонолиза с повышенной растворимостью O3 в жидком растворителе (т.е. жидкой среде). Процессы и условия реакции для осуществления озонолиза могут включать использование жидкого растворителя, который, по существу, инертен по отношению к O3, чтобы ограничить количество и объем нежелательных побочных продуктов. Процесс озонолиза может осуществляться, когда растворимость O3 в жидкой фазе может регулироваться давлением, чтобы обеспечить возможность управления скоростью реакции и селективностью продуктов. Такие процессы и реакции могут быть достигнуты при использовании жидкого СO2 (Рс, СO2=73,76 бар; Тс, СО2=31,1°С или 304,25 К) или расширенных СО2 жидкостей в качестве растворяющей среды.
В одном примере осуществления озонолиз может осуществляться с жидким СO2 и различными жидкими растворителями, расширенными CO2, такими, как натуральные ненасыщенные кислоты (например, олеиновая кислота) или их метилэфиры. Скорость реакции для озонолиза вероятнее всего ограничивается низкой растворимостью озона в жидкой фазе. Использование СО2 и расширенных СО2 жидкостей (CXL) в качестве сред реакции может улучшить растворимость О3 и обеспечить инертное окружение для озонолиза. К тому же невоспламеняемый СО2 также является смешиваемым с растворителями с низкой полярностью, такими как н-гексан. Озонолиз с последующим надлежащим гидролитическим, восстановительным или окислительным этапом может давать карбоновые кислоты, дикарбоновые кислоты, спирты с карбоксильными концевыми группами или карбоксиальдегиды. Что значимо, те же результаты можно ожидать и с другими жирными кислотами, имеющими две или три двойные связи углерод-углерод.
В одном примере осуществления озонолиз может осуществляться в жидком СО2. Здесь показано, что О3 стабилен в жидком СО2 и по существу не вступает в реакцию с СО2. Растворимость О3 в жидком СО2 может постоянно регулироваться (например, повышение растворимости приблизительно на порядок величины) при сравнительно малых изменениях давления около критического давления озона. Например, растворимость О3 в жидком CO2 при минус 0,7°С (272,45 К) (например, 1,044 Тс, O3) была экспериментально определена как равная приблизительно 0,006 единицы оптической плотности при 52,4 бар (0,94 Pc, О3) и 0,06 единицы оптической плотности при 65,5 бар (1,18 Tc, О3). Таким образом, высокоточная регулировка растворимости О3 в жидком СО2 связана с чрезмерной сжимаемостью О3 в окрестности его критической точки.
О3 находится в окрестности своей критической температуры (т.е. между 1 и 1,25 Тc, О3) при -0,7°С (272,45 К). Следовательно, сжимаемость озона (а значит, и его плотность) будет резко увеличиваться при изотермическом повышении давления выше критического (например, выше приблизительно 55,6 бар). С другой стороны, воздух и О2, являющиеся фоновыми газами в потоке О3 при минус 0,7°С (272,45 К), смещены достаточно далеко от их соответствующих критических температур и, следовательно, ведут себя как идеальные газы в диапазоне давления 50,6-66,9 бар, при этом не наблюдается какое-либо резкое увеличение сжимаемости. По существу, даже если О3 присутствует в разбавленной концентрации, такой как порядка нескольких мольных процентов либо в потоке воздуха, или либо в потоке О3, его сжимаемость, а следовательно, и плотность, резко увеличивается в окрестности критического давления, приводя к его селективному растворению в жидком СО2. Этот феномен похож на повышенное растворение околокритического СО2 в органических растворителях при увеличении давления выше его критического давления. Другие преимущества повышения концентрации озона в СО2 или расширенных СО2 жидкостях в качестве растворяющих сред являются следующими: (i) пониженная воспламеняемость из-за присутствия плотного СО2, который в газообразной фазе представляет собой огнезащитный состав; (ii) СО2 менее токсичен, чем большинство органических растворителей; (iii) применение СO2 считается безопасным для окружающей среды, если его получают из существующих неизолированных источников, и (iv) продукты могут быть легко отделены от растворителя СО2 путем снижения давления.
Средой озонолиза на первом этапе может быть любой жидкий СО2 при различных температурах, близких к критической температуре озона. Температура озона в жидком СО2 может быть от 0,75 до 1, 5 Тc озона, более предпочтительно приблизительно 0,9-1,35 Тc озона и наиболее предпочтительно приблизительно от 0,95 до 1,25 Тc озона. Предпочтительные температуры озона в жидком СО2 могут быть приблизительно 1 Тc озона, приблизительно 1,1 Тc озона и приблизительно 1,15 Тс озона. Температура как функция Тc выражается в абсолютных единицах (по шкале Кельвина или шкале Ренкина); однако температура и температурные диапазоны могут быть преобразованы в другие единицы.
Средой озонолиза на первом э тапе может быть любой жидкий СО2 при температуре, близкой к критической температуре озона и подходящем давлении, близком к критическому. Давление озона в жидком СО2 может составлять 0,75-1,5 Pc озона, более предпочтительно приблизительно от 0,9 до 1,35 Pc озона и наиболее предпочтительно приблизительно от 0,95 до 1,25 Рс озона. Предпочтительное давление озона в жидком СО2 может быть приблизительно 1, приблизительно 1,1 и приблизительно 1,15 Pc для озона. Другими словами, давление озона в жидком СО2 может быть выше приблизительно 40,5 бар, между приблизительно 45,6 бар и 76 бар, более предпочтительно приблизительно от 50,7 бар до приблизительно 65,9 бар и наиболее предпочтительно приблизительно от 54,7 бар до приблизительно 60,8 бар. Предпочтительное давление озона в жидком СО2 может быть приблизительно 52,7 бар, приблизительно 55,7 бар и приблизительно 59,8 бар. Давление как функция Pc может выражаться в атмосферах (атм) или барах, и могут быть сделаны соответствующие изменения на другие единицы давления.
Средой озонолиза для первого этапа может быть любой жидкий СО2, имеющий различные плотности озона, близкие, а предпочтительно, превышающие критическую плотность озона. Плотность озона может быть от 0,75 до 1000 ρс, более предпочтительно приблизительно от 0,9 до 100 ρс и более предпочтительно от 0,95 до 10 ρс озона.
Реакция озонолиза является экзотермической, а растворитель может замедлять скорость реакции и, следовательно, скорость тепловыделения. Растворители, инертные или более инертные по сравнению с субстратом, действуют как теплоотвод, чтобы поглотить тепло реакции. Однако есть примеры, в которых субстрат также может быть растворителем, когда обеспечен в количестве, достаточном, чтобы действовать в качестве растворителя и обеспечивать достаточно субстрата для реакции озонолиза.
Озонолиз может проводиться в жидких растворителях, таких как органические кислоты, спирты, метиленхлорид, этилацетат, ТГФ и даже вода; однако они могут давать множество промежуточных пероксидов. Вода желательна, но такие реакции для кислот с более высокой молекулярной массой и сложных эфиров могут потребовать применения двухфазных жидкостных систем. Спирты привлекательны из-за хорошей взаимосвязи с растворимостью и частично потому, что растворитель может отразить алкильную группу сложного эфира. Недостаток спиртов в качестве растворителей для озонолиза - их восприимчивость к окислению, фактор, который может представлять опасность. В настоящем изобретении может применяться система растворителей, такая как расширенная диоксидом углерода жидкость (CXL), образованная спиртами малой молекулярной массы, метанолом и этанолом.
Эффективность жидких растворителей, являющихся расширенными диоксидом углерода жидкостями (CXL), и другими расширенными диоксидом углерода жидкостями в каталитических окислениях может быть повышена путем использования чистого молекулярного кислорода. Их преимущества включают высокую растворимость О2 (например, в сто раз больше в присутствии органического растворителя) и эффект безопасности среды, которая является негорючей и будет доминировать над паровой фазой в равновесии со средой реакции. В дополнение к интенсификации процесса, основанной на повышенной растворимости окислителя, молекулярный перенос в расширенных диоксидом углерода жидкостях во многом сопоставим с большинством сред. Далее, расширенные диоксидом углерода жидкости, основанные на полярных спиртах, демонстрируют эту полярность в увеличенных скоростях реакции, сравнимых с неполярными средами, например сверхкритическим СО2 или углеводородами.
Расширенные диоксидом углерода жидкости на основе метанола могут применяться в качестве жидкой среды для окислительного расщепления метилового эфира олеиновой кислоты и высших ненасыщенных кислот. Жирные кислоты, такие как пальмитиновая кислота, проявляют ограниченную растворимость или в метаноле, или в сверхкритическом СО2. Растворимость пальмитиновой кислоты в сверхкритическом СО2 составляет порядка 10-4 мольной доли даже при давлении до 150 бар. Например, соевое масло также может использоваться в качестве жидкой среды для озонолиза. Эмульсия исчезает и поверхность раздела метанол/соевое масло появляется вновь при выделении СО2. Это наблюдение указывает на возможность осуществления озонолиза субстратов из жирных кислот, диспергированных в виде эмульсии в метаноле, расширенном СО2. Таким образом, метанол, расширенный диоксидом углерода, представляется как прекрасно подходящий для окисления озоном сложных метиловых эфиров ненасыщенных кислот для производства двухфункциональных молекул с меньшей молекулярной массой и имеющих значение в качестве продуктов процесса получения химикатов из биомассы. Однако наши результаты показывают, что О3 может разрушать метанол, в особенности если концентрация метанола существенно выше, чем субстрата.
Некоторые примеры растворителей для расширенной диоксидом углерода жидкости, которые могут применяться для озонолиза, включают легкие углеводородные жидкости (С4 или менее), метанол, этанол, низшие спирты (например, С4-С10), высшие спирты (например, С10-С20), гексан, SF6, ксенон, вода, водные растворы, фторуглеродные растворители, высоконакислороженные молекулы, высокофторированные молекулы, СF3СO2Н, ионные жидкости, сильные жидкие кислоты, H2SO4, HSO3F, НSО3СF3, органические кислоты, насыщенные углеводороды, жидкие субстраты для озонолиза, их комбинации и т.п. Растворимость озона в любом из вышеназванных растворителей может быть повышена путем приготовления расширенной диоксидом углерода жидкости, как описывается здесь.
В некоторых случаях может быть предпочтительно, чтобы растворитель в расширенной диоксидом углерода жидкости был инертен. Некоторые примеры возможных инертных растворителей для расширенной диоксидом углерода жидкости, которые могут применяться для озонолиза, могут включать SF6, ксенон, воду, водные растворы, фторуглеродные растворители, высоконакислороженные молекулы, высокофторированные молекулы, СF3СО2Н, H2SO4, HSO3F, HSO3CF3.
Эксперименты показали, что некоторые неинертные растворители могут применяться, если О3 выборочно разрушает субстрат в присутствии растворителя (таков случай использования метанола как растворяющей добавки). То есть жидкий субстрат может использоваться в качестве растворителя в случаях, когда субстрат, с которым желательна реакция, более реакционноспособен по отношению к озонолизу. Это позволяет озону в большей степени реагировать с желаемым субстратом, нежели с растворителем (например, возможный субстрат при использовании в инертных или более инертных растворителях). Например, некоторые кандидаты в субстраты, такие как растительные масла, включающие соевое масло, которые, как известно, реагируют с озоном, могут быть использованы в качестве растворителей, когда желаемый субстрат сравнительно более реакционноспособен. В этом контексте растворитель является более инертным компонентом системы растворитель-субстрат. Таким образом, растворитель представляет собой жидкость, которая или полностью, или в значительной степени является инертной по отношению к разрушению озоном, или же в меньшей степени разрушается озоном в присутствии более реакционноспособного субстрата.
Некоторые примеры возможных неинертных растворителей для расширенной диоксидом углерода жидкости, которые могут применяться для озонолиза, могут включать метанол, этанол, низшие спирты (например, С4-С10), высшие спирты (например, С10-С20), гексан, ионные жидкости, жидкие кислоты, органические кислоты и насыщенные углеводороды.
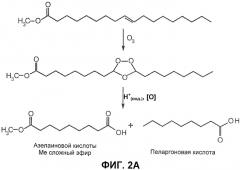
В одном примере осуществления процесс озонолиза по настоящему изобретению может использоваться для окислительного расщепления масел и жиров, таких как ненасыщенные жирные кислоты. Двойные связи в ненасыщенных жирных кислотах обеспечивают реакционноспособные участки для осуществления множества превращений. Соответственно, окислительное расщепление олефинов может быть получено с помощью озонолиза. Как показано на фиг.2А, это высокоселективная реакция изначально образует озонид, который может обеспечить выход альдегидов или карбоновых кислот, с восстанавливающей или окисляющей активностью, соответственно. Этот способ особенно привлекателен для производства карбоновых кислот, содержащих нечетное число атомов углерода в скелете полиметиленов. Например, в промышленности азелаиновую кислоту получают из олеиновой кислоты с помощью озонолиза и используют в производстве пластификаторов, смазок, гидравлических масел и косметики. Она также используется в качестве антибактериального средства при лечении угрей. Количество потенциальных субстратов для этой реакции озонолиза обширно и включает жирные кислоты, их сложные эфиры и другие источники масла и жиров.
В одном примере осуществления процесс озонолиза может использоваться для приготовления ингредиентов и реагентов для парфюмерных и душистых химических составов. Например, для приготовления ингредиентов и реагентов может использоваться озонирование терпенов. Накислороженные соединения образуют большую часть наиболее благовонных химических составов, так что неудивительно, что озонолитическое расщепление алкенов широко используется в парфюмерной промышленности и промышленности душистых веществ. Существует обширная область химии, связанная с производством множества душистых молекул из терпенов, а большая часть технологических процессов синтеза начинается с озонолитического расщепления аллильной группы в молекуле терпена. Например, озонолиз терпена, (+)-n-мент-1-ена, может образовывать, посредством восстанавливающей рабочей группы, (-)-3-изопропил-6-оксогептанал. Эта молекула затем может подвергаться множеству реакций для образования нескольких душистых молекул (например, свежескошенное сено, мятная нота, ландыш, типа бергамота, цветок розы/апельсина и т.п.), как показано на фиг.2В.
В одном примере осуществления процесс озонолиза может использоваться для подготовки активных агентов для фармацевтических продуктов или реагентов для получения фармацевтических продуктов. Озонолиз подходящих субстратов, таких как натуральные продукты или биологически активные агенты, может быть использован для приготовления новых биологически активных агентов или производных множества биологически активных молекул. Например, оксандролон является анаболическим стероидом, используемым для ускорения набора веса пациентами, перенесшими хирургическое вмешательство, хроническую инфекцию или тяжелые травмы. Также он облегчает боль в костях, связанную с остеопорозом. Впервые он был разработан фирмой G.D.Searle Company и был синтезирован из метиландростанолона по многоступенчатой технологии, включающей применение высокотоксичных OsO4 и Рb(ОАс)4. Альтернативный технологический процесс для получения многокилограммовых количеств оксандролона фармацевтической чистоты согласно Фармакопеи США разработан фирмой Cedarburg Pharmaceuticals, Inc., и в нем используется реакция озонолиза для производства ключевой промежуточной кислоты с хорошим выходом без применения высокотоксичных устойчивых реагентов и связанных с ними проблем по накоплению опасных отходов. Как показано на фиг.2С, процесс озонолиза по настоящему изобретению может использоваться для получения оксандролона с помощью безопасного и более экономичного процесса.
В другом примере процесс озонолиза по настоящему изобретению может использоваться для получения антибиотиков, таких как цефаклор и цефтибутен, из подходящих субстратов. Цефаклор и цефтибутен представляют собой соединения, относящиеся к классу лекарственных средств, называемых цефалоспориновые антибиотики. Они эффективны против обширного ряда инфекций и открыты фирмой Shionogi and Co. Ltd., Осака, Япония. Изначально они производились синтетическим путем из сульфоксидов пенициллина, но попытки снизить стоимость производства, осуществленные учеными в Schering Plough Research Institute привели к технологическим процессам синтеза из бульонов цефалоспорина С. Ключевая операция в этом технологичнском процессе - это операция озонолиза, на которой 3-экзометиленцефалоспорин (1) преобразуется в 3-гидроксицефем (2). Как показано на фиг.2D, процесс озонолиза по настоящему изобретению может использоваться для приготовления 3-гидроксицефема (2) посредством более безопасного и более экономичного процесса.
В другом примере процесс озонолиза по настоящему изобретению может использоваться для приготовления 2-гидроксииндан-2-карбоксальдегида. Ранее фирма Pfizer разработала синтез многокилограммового масштаба для альдегида,