Обнаружение целевых молекул в образце
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно способам детектирования мишени в пробе. Способ обнаружения присутствия люминесцентно меченной целевой молекулы в образце включает приведение образца в контакт с субстратом, имеющим иммобилизованные на нем зондовые молекулы, которые специфически связываются с целевой молекулой. Промывание субстрата на стадии промывания промывной жидкостью для удаления или разбавления несвязанных целевых молекул. Обнаружение присутствия полученных связанных комплексов на субстрате для определения, присутствует ли люминесцентно меченная целевая молекула в образце, в котором субстрат облучают пучком излучения. Регистрируют полученный пучок люминесценции от субстрата, а присутствие люминесцентно меченных целевых молекул обнаруживают путем регистрации люминесценции люминесцентно меченных целевых молекул. При этом регистрация полученного пучка люминесценции от субстрата происходит в присутствии промывной жидкости, где показатель преломления промывной жидкости находится в диапазоне от показателя преломления субстрата плюс 10% до показателя преломления субстрата минус 10%. Использование заявленного способа позволяет повысить надежность детектирования люминесценции за счет отделения люминесцентного свечения с низкой интенсивностью. 7 з.п.ф-лы, 1 пр., 1 табл., 4 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к способу обнаружения присутствия целевой молекулы в образце и, в частности, к способу, включающему контактирование образца с субстратом, с последующим промыванием субстрата на стадии промывания. Более того, изобретение относится к устройству для получения анализируемого образца, к системе оптического детектирования целевой молекулы в анализируемом образце, к субстрату, получаемому согласно способу, и к набору для выполнения анализа.
Уровень техники
Способы обнаружения конкретных биологических молекул (биомолекул) многообразны, и в настоящее время квалифицированный специалист имеет в распоряжении многочисленные разнообразные подходы. Обнаружение конкретных биологических молекул имеет ряд важных в практическом отношении вариантов применения, в том числе идентификацию генов для диагностических целей.
В общем детектирование биологического образца («цели»), такого как полинуклеотиды, ДНК, РНК, клетки и антитела, может быть главным образом выполнено на чипе, например, так называемом биочипе (или микрочипе), на котором в разнообразных местах чипа располагаются соответствующие зондовые молекулы. Примеры пар «цель-зонд» включают: ДНК/РНК-олигонуклеотид, антитело-антиген, клетка-антитело/белок, рецептор гормона-гормон и т.д. Когда цель связана или гибридизована с соответствующей зондовой молекулой, детектирование целевой биомолекулы может быть выполнено разнообразными оптическими, электронными и даже микромеханическими методами.
Общепринятой техникой, используемой для обнаружения молекулярного связывания на биочипах, является оптическое детектирование мишеней с флуоресцентными метками, также известных как «метка» или «маркер». В общем метка может представлять собой любое вещество, регистрируемое в отношении его физического распределения и/или интенсивности посылаемого им сигнала. Флуоресцентные вещества находят широкое применение, но альтернативу таковым составляют фосфоресцентные вещества, электролюминесцентные вещества, хемилюминесцентные вещества, биолюминесцентные вещества и т.д.
В общем проблема детектирования люминесценции связана с отделением люминесцентного свечения с низкой интенсивностью от облучающего нелюминесцентного света, в общем имеющего высокую интенсивность. Поэтому надежность детектирования люминесценции весьма зависит от оптических характеристик спектральных фильтров, которые используют в процессе отделения. Действие спектрального фильтра может включать две стадии: первый фильтр (называемый «фильтром возбуждающего излучения») предпочтительно пропускает лучи с длиной волны, перекрывающейся со спектром возбуждения метки, и блокирует все лучи с длиной волны, которая находится в пределах спектра интервала детектирования. Второй фильтр (называемый «фильтром испускания» или «фильтром детектирования») предпочтительно блокирует весь облучающий свет и пропускает только излучение люминесценции. Коэффициент ослабления (эффективность блокирования) типичного набора фильтров составляет лучше чем 10-6. Для этой цели также могут иметь существенное значение оптические свойства субстрата.
В патенте US 2005/0048571 описан субстрат для снижения аутофлуоресценции в сочетании с оптическим детектированием из биочипов. В описании пористый слой субстрата окрашен красящим веществом. Однако окрашивание субстрата имеет тот недостаток, что делает субстрат более дорогостоящим, и оно может ограничивать число различных типов субстратов, которые могут быть использованы.
Авторы настоящего изобретения принимали во внимание, что были бы весьма полезными усовершенствованные средства детектирования люминесценции, и в результате этого разработали настоящее изобретение.
Сущность изобретения
В настоящем изобретении предпринята попытка создать усовершенствованный подход к проведению детектирования люминесценции, такого какое выполняется в связи с биотестированием, и, предпочтительно, изобретение смягчает, ослабляет или устраняет один или более из вышеназванных или прочих недостатков, по отдельности или в любом сочетании.
Изобретение определяется независимыми пунктами формулы изобретения. Зависимые пункты формулы изобретения определяют преимущественные варианты осуществления.
Согласно первому аспекту настоящего изобретения представлен способ обнаружения присутствия целевой молекулы в образце.
Целевые молекулы могут представлять собой биомолекулы, конъюгированные с флуорофорами.
Излучение типично представляет собой электромагнитное излучение в видимом или близком к видимому диапазоне, в инфракрасном (IR, ИК) или в ультрафиолетовом (UV, УФ) диапазоне.
В контексте настоящего изобретения термины «флуоресценция» и «фосфоресценция» следует понимать в широком смысле как испускаемый свет, полученный из процесса, где свет был поглощен молекулой или атомом при определенной длине волны и затем излучен при той же или другой длине волны после истечения времени жизни возбужденного состояния данной молекулы/атома. Испускаемый свет часто, но не обязательно ограничиваясь таковым, излучается в видимой области спектра (VIS), ультрафиолетовой (UV) области спектра и инфракрасной (IR) области спектра.
В варианте осуществления целевые молекулы обнаруживаются при облучении субстрата пучком излучения и последующей регистрации полученного пучка люминесценции от субстрата, то есть люминесценции целевых молекул. Люминесцентная часть регистрируемого излучения может представлять собой фотолюминесценцию, в частности флуоресценцию или фосфоресценцию.
Субстрат для иммобилизации зондовых молекул может представлять собой биочип, приспособленный для анализа биологических целей. Обычно биочип может включать множество пятен, в которых могут быть иммобилизованы целевые молекулы. В этом контексте пятно следует понимать как зону, имеющую определенную протяженность. Пятно может иметь двумерную (2D) или трехмерную (3D) конфигурацию. Биочип может включать кремниевую пластину, стеклянную пластинку, пористую мембрану, такую как найлон, нитроцеллюлоза и т.д.
Оптические свойства субстратов, используемых для иммобилизации зондовых молекул, могут быть такими, что субстраты имеют очень высокий коэффициент отражения. Степень рассеяния, среди прочего, зависит от разности между коэффициентами преломления воздуха и субстрата. Вследствие своей высокой отражательной способности субстрат может затруднять проникновение в него падающего излучения, чем сокращается количество падающего излучения, которое способно возбуждать флуорофоры, связанные с субстратом, в особенности внутри субстрата. Более того, вследствие высокой отражательной способности большая часть отраженного света в некоторых конфигурациях может быть отражена в сторону детектора.
Изобретение в особенности, но не исключительно, полезно для сокращения отражательной способности субстрата. Путем применения жидкости по существу с подобранным показателем во время стадии промывания отражательная способность субстрата может быть в значительной степени понижена. Более того, количество света, проникающего в субстрат, будет увеличиваться, обеспечивая улучшение отношение падающего излучения к люминесцентному излучению.
В преимущественном варианте осуществления показатель преломления промывной жидкости находится в диапазоне показателя преломления субстрата плюс/минус 10%. В принципе предпочтительным является достижение настолько хорошего согласования показателей преломления, насколько возможно, однако может быть преимущественным компромисс по меньшей мере в ситуациях, где конкретный тип промывной жидкости требуется для данного зонда, и/или целевых молекул, и/или субстрата. Согласование показателя преломления промывной жидкости с показателем преломления субстрата может быть лучше чем плюс/минус 8%, плюс/минус 6%, плюс/минус 4%, плюс/минус 2%.
В преимущественном варианте осуществления промывная жидкость представляет собой водный раствор сахара (сахарозы) в воде, где весовое процентное содержание сахара составляет между 50% до 80%. Водные растворы сахарозы могут быть преимущественными, поскольку многие флуорофорные конъюгаты легко растворяются в такой жидкости.
Варианты осуществления изобретения преимущественно могут быть применены для пористого субстрата, поскольку сильное отражение от субстрата может быть даже более проблематичным для пористых субстратов вследствие рассеяния в порах.
В варианте осуществления способа согласно изобретению целевые молекулы представляют собой биомолекулы, конъюгированные с флуорофорами.
В варианте осуществления способа согласно изобретению субстрат представляет собой биотест, приготовленный с зондовыми молекулами, и целевые молекулы химически связываются с зондовыми молекулами, присутствующими в субстрате. В разнообразных преимущественных вариантах осуществления в маршрут светового пучка от источника излучения до детектора могут быть введены фильтры с определенной полосой пропускания излучения, зеркала и, возможно, прочие оптические компоненты.
Например, целевые молекулы обнаруживаются при облучении субстрата пучком излучения и последующем детектировании пучка, полученного от субстрата.
Полученный пучок может быть пропущен через субстрат или отражен от субстрата.
В варианте осуществления первый фильтр (2) с определенной полосой пропускания излучения введен в маршрут пучка между источником (36) излучения и субстратом (3, 30-32).
В варианте осуществления второй фильтр (4) с определенной полосой пропускания излучения введен в маршрут пучка между субстратом (3, 30-32) и детектором (35).
В варианте осуществления маршрут пучка далее включает дихроичное зеркало (5).
Способ согласно настоящему изобретению преимущественно может быть по меньшей мере частично автоматизирован, например, при реализации способа в устройстве или системе детектирования в соответствии с другими аспектами изобретения.
Во втором аспекте изобретение относится к устройству для получения анализируемого образца.
В третьем аспекте изобретение относится к системе оптического детектирования для регистрации целевой молекулы в анализируемом образце.
Второй и третий аспекты настоящего изобретения могут представлять устройство и систему детектирования для регистрации присутствия и, необязательно, количества одной или более биологических целей, то есть целевых молекул в образце. Система может обнаруживать цели, которые включают, но не ограничиваются таковыми, полинуклеотиды, ДНК, РНК, клетки и антитела. Системы биологического детектирования часто весьма усложнены, и преимущество настоящего изобретения состоит в представлении систем с высокой надежностью собранных данных.
В четвертом аспекте изобретение относится к субстрату, полученному в соответствии со способом первого аспекта.
В пятом аспекте изобретение относится к набору для выполнения анализа.
В общем разнообразные аспекты изобретения могут быть скомбинированы и сочетаются любым путем, возможным в пределах рамок изобретения. Эти и другие аспекты, признаки и/или преимущества изобретения будут очевидными из нижеописанных вариантов осуществления и разъяснены с привлечением таковых.
Краткое описание чертежей
Варианты осуществления изобретения будут описаны, только в качестве примера, с привлечением чертежей,
на которых
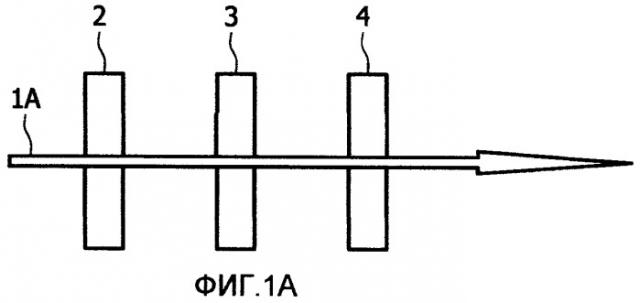
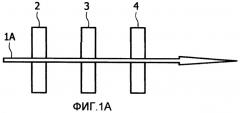
Фиг.1 схематически иллюстрирует два общих варианта осуществления оптической компоновки;
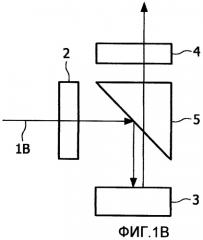
Фиг.2 иллюстрирует спектральные характеристики для компоновки на Фиг.1В вместе со спектром красителя Су5;
Фиг.3 иллюстрирует вариант осуществления способа обнаружения присутствия целевой молекулы в образце;
Фиг.4 показывает график зависимости показателя преломления, n, водных растворов сахарозы от весового процентного содержания, р.
Описание вариантов осуществления
В биологическом исследовании и медицинской диагностике многие биомаркеры детектируют с помощью присоединенной флуоресцентной метки. Обычно используемое устройство представляет собой флуоресцентный сканер или микроскоп, но для особенных вариантов применения делают специализированное оборудование на основе тех же принципов детектирования.
В общем варианте осуществления настоящего изобретения применяют оптическую компоновку, где использованы по меньшей мере два спектральных фильтра. Фиг.1 схематически иллюстрирует два общих варианта осуществления. Фиг.1А показывает схематическую иллюстрацию устройства регистрации флуоресценции в режиме пропускания, где полученный пучок пропускается через субстрат, тогда как Фиг.1В показывает схематическую иллюстрацию устройства регистрации флуоресценции в режиме отражения, где полученный пучок отражается от субстрата. На Фиг. 1А и 1В световой пучок 1А, 1В испускается в сторону субстрата 3. Чтобы отделить полученный флуоресцентный световой пучок от облучающего нефлуоресцентного света, используют спектральные фильтры.
Действие спектрального фильтра состоит из двух стадий: первый фильтр 2 излучения (называемый «фильтром возбуждающего излучения») устанавливают на маршруте пучка между источником излучения (света) и субстратом. Фильтр возбуждающего излучения предпочтительно пропускает лучи с длиной волны, перекрывающейся со спектром возбуждения метки, и блокирует все лучи с длиной волны, которая находится в пределах спектра интервала детектирования. Второй фильтр 4 излучения (называемый «фильтром испускания» или, альтернативно, «фильтром детектирования») вводят в маршрут пучка, фильтр испускания предпочтительно блокирует или по меньшей мере значительно подавляет облучающее излучение и пропускает только излучение флуоресценции. Коэффициент ослабления (эффективность блокирования) типичного набора фильтров составляет лучше чем 10-6.
Кроме того, на Фиг.1В применяется светоделитель 5, светоделитель может быть использован, например, в ситуации, где субстрат является непрозрачным. В альтернативном варианте осуществления вместо светоделителя может быть применено дихроичное зеркало, дихроичное зеркало отражает возбуждающий свет с длиной волны ниже определенного значения и пропускает свет с длиной волны выше этого значения. Дихроичное зеркало поэтому может также действовать как фильтр 4 испускания, но все же отдельный фильтр испускания может быть применен для повышения эффективности, но это может не понадобиться.
В варианте осуществления субстрат может быть облучен несколькими мощными светодиодами (LED), такими как от 2 до 10 красных светодиодов (LED), может быть использована компоновка затемненного поля. Полученный свет регистрируют цифровой CCD-камерой (не показана) с фильтром испускания, размещенным перед камерой. В качестве примера флуорофора может быть использован флуоресцентный цианиновый краситель Су5.
Субстрат 3 может быть приготовлен любым подходящим способом приготовления субстрата, такого как субстрат биочипа для применения в биотестировании. Один типичный способ тестирования на чипе включает иммобилизацию зондовых молекул в отдельных местах на субстрате. Раствор, содержащий целевые молекулы, которые связываются с присоединенными зондами, приводят в контакт со связанными зондами в условиях, достаточных для стимулирования связывания целей в растворе с комплементарными зондами на субстрате, с образованием фиксированного комплекса, который связан с поверхностью субстрата. Биочип может иметь размеры в микрометровом диапазоне или даже в миллиметровом диапазоне. Число различных пятен с различающимися характеристиками гибридизации на биочипе может варьировать от около 1 до 1000 на мм2 на данном чипе, и даже больше, например, вплоть до 106 пятен на мм2. Как правило, внутри пятна на чипе иммобилизованы идентичные зондовые молекулы.
Фиг.2 иллюстрирует вариант осуществления возможных спектральных характеристик, задействованных в компоновке на Фиг.1В, вместе со спектром красителя Су5. Фиг.2 скомпонована с использованием онлайн-приложения Curv-o-matic, доступного из веб-сайта Omega Optical (www.omegafilters.com). Фиг.2 показывает пропускание, Т, в процентах, как функцию длины волны, λ, в нанометрах, включенных спектров, для набора фильтров Omega XF110-2.
Фиг.2 показывает спектр 20 возбуждения красителя Су5, имеющий пиковую длину волны возбуждения при 649 нм, вместе с соответствующим спектром 21 испускания, имеющим пиковую длину волны испускания при 670 нм. Разность между длиной волны облучающего излучения и длиной волны флуоресценции, на фотон, называется «стоксовским сдвигом». Стоксовский сдвиг для красителя Су5 составляет 21 нм.
Фильтр возбуждения представляет собой фильтр возбуждения Omega 630AF50, характеризующийся спектром, обозначенным номером 22 (ширина полосы 50 нм с центром при 630 нм). Фильтр испускания представляет собой фильтр испускания Omega 695AF55, характеризующийся спектром, обозначенным номером 23 (ширина полосы 55 нм с центром при 695 нм). Дихроичное зеркало выбрано так, что спектр зеркала, обозначенный как 24, таковой, что оно отражает падающий свет при длине волны возбуждающего излучения, в то же время пропуская полученный свет со стоксовским сдвигом. Конкретный набор фильтров и дихроичное зеркало приведены в качестве примера и могут быть необязательно использованы во всех вариантах осуществления. Например, как упомянуто в связи с Фиг.1В, можно обойтись без фильтра испускания, когда применяется дихроичное зеркало.
Таблица показывает результаты эксперимента, в котором оптические характеристики были измерены на пористых найлоновых субстратах 3 (Nytran N и Nytran SPC). Эксперимент проводили путем облучения субстрата с длиной волны падающего света 650 нм и последующего детектирования пучка, полученного от субстрата. Были проведены два типа экспериментов, один с сухим субстратом, и один, в котором субстрат был подвергнут воздействию воды на стадии промывания.
| Nytran N | Влажный | Сухой |
| Пропускание | 31,1% | 4,2% |
| Отражение | 68,7% | 95,3% |
| Поглощение | 0,1% | 0,5% |
| Nytran SPC | ||
| Пропускание | 33,8% | 5,3% |
| Отражение | 65,4% | 94,4% |
| Поглощение | 0,8% | 0,4% |
Как можно видеть в таблице, субстрат имеет очень высокую отражательную способность, в особенности, будучи в сухом состоянии. Причина этой высокой отражательной способности состоит в рассеянии вследствие высокой пористости субстрата. Степень рассеяния зависит от разности между показателями преломления воздуха и субстрата. По сравнению с воздухом показатель воды является гораздо более близким к показателю субстрата. Это является причиной того, почему влажный субстрат проявляет более низкое отражение, чем сухой субстрат.
В соответствии с настоящим изобретением во время стадии промывания в ходе анализа употребляется жидкость с по существу согласованным показателем, и тем самым отражательная способность субстрата может быть значительно снижена, с сокращением до типичного значения 5% коэффициента отражения.
Интенсивность возбуждения может быть увеличена по меньшей мере в 3 раза по сравнению с водой в качестве промывной жидкости, но может быть повышена в 20 раз по сравнению с сухим субстратом.
Соотношение между возбуждающим излучением и флуоресцентным излучением может быть улучшено по меньшей мере в 14 раз, если сравнивать с водой, и может быть повышено в 19 раз по сравнению с сухим субстратом.
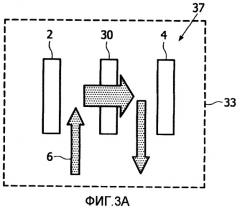
Фиг.3 иллюстрирует вариант осуществления способа обнаружения присутствия целевой молекулы в образце в соответствии с настоящим изобретением, где биочип приготовлен с использованием стадии промывания. Фиг. 3А-3С иллюстрируют по меньшей мере некоторые из примененных стадий.
В стадиях, предшествующих стадии из Фиг.3А, приготовили образец жидкости с целевыми биомолекулами, конъюгированными с флуорофорами. На стадии 37 на Фиг.3А образец 6 контактирует с субстратом 30 путем протекания образца жидкости через субстрат, обеспечивая присоединение целевых биомолекул, имеющих флуорофоры, к специфическим местам связывания на субстрате. Должно быть понятно, что целевые молекулы могут контактировать с субстратом альтернативными путями, например, путем нанесения капель из импульсного распылителя или другим пригодным способом.
Можно предполагать, что во время стадий приготовления не все флуорофоры будут связываться с зондовой молекулой. Это значит, что в дополнение к флуорофорам, которые связались с субстратом 30, есть также несвязанные флуорофоры, которые не присоединены к субстрату, но все еще присутствуют. Стадия 38 промывания применяется для удаления или по меньшей мере разбавления любых несвязанных флуорофорных конъюгатов, с оставлением в результате только связанных на субстрате флуорофорных конъюгатов, как иллюстрировано на Фиг.3В. Во время этой стадии промывную жидкость 7 продавливают через субстрат 31. В настоящем изобретении промывную жидкость 7 выбирают так, что она имеет показатель преломления промывной жидкости, по существу согласованный с показателем преломления субстрата 31.
Фиг.3 иллюстрирует стадию 39 детектирования, чтобы зарегистрировать присутствие полученных присоединенных комплексов на субстрате, стадия детектирования была описана в связи с Фиг.1. Поскольку во время стадии промывания (Фиг.3В) употребляли жидкость с по существу согласованным показателем, отражательная способность субстрата 32 была существенно снижена, увеличивая чувствительность стадии детектирования. Детектирование типично проводят непосредственно после стадии промывания так, что субстрат все еще является влажным.
В различных вариантах осуществления настоящего изобретения могут быть использованы различные жидкости с согласованным показателем. В одном варианте осуществления может быть применено масло, в качестве примера пригодного масла может быть использовано масло Zeiss Immersol 518F, с n=1,518 при температуре 23ºС. В других вариантах осуществления могут быть употреблены водные растворы плотных материалов. В конкретном варианте осуществления употребляется водный раствор сахара. Может быть предпочтительным применение 60%-70%-го раствора сахара (сахарозы и т.д.), тем самым достигая показателя преломления 1,45 (см. Фиг.4, иллюстрирующую показатель преломления, n, водных растворов сахарозы как функцию весового процентного содержания, р). Водные растворы сахарозы могут представлять собой предпочтительную жидкость для согласования показателя, поскольку флуорофорные конъюгаты легко растворяются в такой жидкости, делая жидкость пригодной как для стадии промывания, так и для стадии детектирования.
Должно быть понятно, что в альтернативном варианте осуществления могут быть применены дополнительные стадии промывания. Такие дополнительные стадии промывания могут быть использованы с отличающимися от таковой промывными жидкостями, в ситуации, где для различных стадий промывания употребляются различные промывные жидкости, по меньшей мере последнюю стадию промывания проводят с использованием промывной жидкости с показателем преломления, по существу согласованным с таковым для субстрата.
Стадии на Фиг. 3 и возможные дополнительные стадии могут быть выполнены, возможно, в автоматическом или полуавтоматическом режиме, в устройстве для получения анализируемого образца и/или системе оптического детектирования. Такие устройства и системы могут включать блок 33 обработки для принятия субстрата, и блок 34 промывания для выполнения стадии промывания на субстрате. Блок обработки и блок промывания могут быть исполнены в одном и том же агрегате, или образец может перемещаться между блоками. Варианты осуществления систем оптического детектирования также включают источник 36 излучения, такой как один или более лазерных диодов, и детектор 35 излучения, такой как CCD-камера.
Представлены также наборы для применения в тестах с детектированием целей. Наборы по меньшей мере включают промывную жидкость, причем промывную жидкость с показателем, по существу согласованным с субстратом, и инструкции по применению промывной жидкости. Наборы могут далее включать один или более дополнительных компонентов, употребляемых когда проводится тест с детектированием целей, таких как один или более субстратов, реагенты для приготовления образца, буферы, метки и т.д. Инструкции по применению могут быть выполнены в бумажном формате, записаны на подходящем носителе информации, приведены в форме указаний, как найти инструкции в удаленном источнике, например в интернете, и т.д.
Хотя настоящее изобретение было описано в связи с конкретными вариантами осуществления, оно не предполагается быть ограниченным изложенной здесь конкретной формой. Скорее рамки настоящего изобретения ограничиваются только прилагаемыми пунктами формулы изобретения. В пунктах формулы изобретения термин «включающий» не исключает присутствия других элементов или стадий. Дополнительно, хотя отдельные признаки могут быть включены в различные пункты формулы изобретения, таковые преимущественно могут быть по возможности скомбинированы, и включение в различные пункты формулы изобретения не подразумевает, что комбинация признаков ненадежна и/или неблагоприятна. В дополнение, упоминания в единственном числе не исключают множественного числа. Так, упоминания единственного числа, «первый», «второй» и т.д. не исключают множества. Далее, кодовые обозначения в пунктах формулы изобретения не должны толковаться как ограничения рамок изобретения.
1. Способ обнаружения присутствия люминесцентно меченной целевой молекулы в образце, включающий:(a) приведение образца (37) в контакт с субстратом, имеющим иммобилизованные на нем зондовые молекулы, которые специфически связываются с целевой молекулой;(b) промывание субстрата (38) на стадии промывания промывной жидкостью для удаления или разбавления несвязанных целевых молекул;(c) обнаружение присутствия полученных связанных комплексов (39) на субстрате для определения, присутствует ли люминесцентно меченная целевая молекула в образце;в котором субстрат облучают пучком излучения и далее регистрируют полученный пучок люминесценции от субстрата, и присутствие люминесцентно меченных целевых молекул обнаруживают путем регистрации люминесценции люминесцентно меченных целевых молекул, отличающийся тем, что регистрация полученного пучка люминесценции от субстрата происходит в присутствии промывной жидкости, где показатель преломления промывной жидкости находится в диапазоне от показателя преломления субстрата плюс 10% до показателя преломления субстрата минус 10%.
2. Способ по п.1, в котором показатель преломления промывной жидкости находится в диапазоне от показателя преломления субстрата плюс 4% до показателя преломления субстрата минус 4%.
3. Способ по п.1, в котором показатель преломления промывной жидкости находится в диапазоне от показателя преломления субстрата плюс 2% до показателя преломления субстрата минус 2%.
4. Способ по пп.1, 2 или 3, в котором промывная жидкость представляет собой водный раствор сахара в воде, где весовое процентное содержание сахара составляет между 50% до 80%.
5. Способ по п.1, далее включающий по меньшей мере одну дополнительную стадию промывания перед стадией промывания (b).
6. Способ по п.1, в котором субстрат представляет собой пористый субстрат.
7. Способ по п.1, в котором люминесцентно меченные целевые молекулы химически связываются с зондовыми молекулами, присутствующими в субстрате.
8. Способ по п.1, в котором люминесцентно меченная целевая молекула представляет собой флуоресцентно меченную целевую молекулу.