Способ моделирования экспериментального амилоидоза у животных
Иллюстрации
Показать всеИзобретение относится к медицине, экспериментальной биологии и может быть использовано для моделирования экспериментального амилоидоза у животных с целью получения возможности изучения патогенеза, профилактики и лечения амилоидоза внутренних органов, в частности при исследовании функционального состояния почек. Для этого сирийским хомякам однократно вводят нативную человеческую плазму, смешанную с адъювантом Фрейнда в равных пропорциях. Инъекции осуществляют в симметричные подмышечные и паховые области, и внутрибрюшинно из расчета 0,1 мл в каждую точку. Способ обеспечивает создание модели амилоидоза внутренних органов животных в короткие сроки эксперимента. 1 пр., 4 ил., 2 табл.
Реферат
Настоящее изобретение относится к медицине, экспериментальной биологии и может быть использовано для моделирования экспериментального амилоидоза у животных с целью получения возможности изучения патогенеза, профилактики и лечения амилоидоза, особенно при исследовании функционального состояния почек, системы кровообращения, минерального обмена и других показателей.
Амилоидоз (амилоидная дистрофия) - глубокое, необратимое нарушение белкового обмена, сопровождающееся образованием и отложением в тканях специфического белково-полисахаридного комплекса - амилоида.
Одно из ключевых звеньев развития амилоидоза связано с извращением белково-синтетической функции ретикуло-эндотелиальной системы, накоплением в плазме крови аномальных белков, служащих аутоантигенами. В результате взаимодействия антигена с антителом происходит осаждение грубодисперсных белков, участвующих в образовании амилоида. Откладываясь в тканях (например, в стенках сосудов, железистых и т.п.), амилоид вытесняет функционально специализированные элементы органа.
В свете современных представлений амилоид является сложным гликопротеидом, в котором фибриллярные и глобулярные белки тесно связаны с полисахаридами. Амилоид состоит из полипептидных цепей, что определяет двойное лучепреломление при окраске Конго красным, свойственное амилоиду. Кроме фибриллярного белка в состав амилоида входит другой белок - так называемый Р-компонент, который одинаков при всех формах амилоидоза.
Выявлено, что амилоид содержит альбумины, глобулины, фибриноген, фибрин; среди плазменных белков преобладает γ-глобулин (Dammacco F. Amyloidosis: clinical picture, immunological and biomolecular features, treatment prospects. // Ann. Ital. Med. Int. - 1991. - Jan-Mar - 6 (1 Pt 2). p.-107-116). В связи с этим возникла необходимость разработки и создания способов моделирования амилоидоза для получения возможности изучения патогенеза, профилактики и лечения амилоидоза.
Известен классический способ моделирования экспериментального амилоидоза (Грицман А.Ю. Некоторые вопросы экспериментальной терапии амилоидоза и резорбции амилоида. // Автореф. дисс. на соиск. уч. ст. канд. мед. наук, М., 1974), заключающийся в введении белым мышам через день по 0,5 мл 5% казеината натрия подкожно в течение 60 дней. Недостатком его является то, что приготовление раствора казеината связано с определенными сложностями, такими как поиск чистого казеина, необходимость растворения его точной навески в кипящем 0,25% растворе гидроокиси натрия, фильтрование, стерилизация, хранение. Готовый раствор казеината натрия имеет щелочную реакцию, высокое содержание натрия, что резко ограничивает применение данной модели при исследовании функционального состояния почек, системы кровообращения, минерального обмена и других показателей, связанных с влиянием натрия и его определением.
За прототип нами взят способ моделирования экспериментального амилоидоза у животных (патент РФ на изобретение №2347279, Пухова И.У., Козырев К.М., Брин В.Б., зарегистрированный 20.09.2007, заявка 2007135901/14 от 27.09.07 г., МПК G09B 23/28), заключающийся во введении сирийским хомякам нативной свиной плазмы через день из расчета 0,025 мл/г массы тела животного в течение 60 дней эксперимента.
Недостатком указанного прототипа является то, что для получения экспериментального амилоидоза требуется многократное введение нативной свиной плазмы, а с адъювантом Фрейнда достаточно однократного введения в пять точек биообъекта. Антигенная стимуляция, приводящая к амилоидозу, нативной человеческой плазмой у сирийских хомяков дает возможность изучения механизмов развития данного процесса у человека.
Заявляемое изобретение направлено на решение задачи, заключающейся в разработке способа моделирования экспериментального амилоидоза у животных, включающего введение белкового препарата подкожно.
Решение этой задачи обеспечивает расширение возможностей моделирования экспериментального амилоидоза у животных, особенно при исследовании функционального состояния системы почек, минерального обмена и других показателей экспериментальных животных.
Предлагаемый способ отличается от прототипа тем, что в качестве белкового препарата вводят нативную человеческую плазму, смешанную с адъювантом Фрейнда в равных пропорциях, инъекции осуществляют в симметричные подмышечные и паховые области, и внутрибрюшинно из расчета 0,1 мл в каждую точку, однократно с целью получения возможности изучения патогенеза, профилактики и лечения амилоидоза, особенно при исследовании функционального состояния почек, минерального обмена и других показателей экспериментальных животных. Однократное введение вышеописанной смеси приводит к развитию системного вторичного амилоидоза с преимущественным поражением почек, селезенки, печени.
Для получения экспериментального системного амилоидоза проводятся подкожные инъекции нативной человеческой плазмы, смешанной в одном шприце с адъювантом Фрейнда в равных пропорциях в симметричные подмышечные и паховые области и внутрибрюшинно из расчета 0,1 мл в каждую точку, однократно.
Заявленный способ является эффективным, экономически выгодным и легко воспроизводимым.
По имеющимся у автора сведениям совокупность существенных признаков, характеризующих сущность заявляемого изобретения, не известна, что позволяет сделать вывод о соответствии изобретения критерию «новизна».
Экспериментальным животным в качестве белкового препарата однократно вводят нативную человеческую плазму, смешанную в одном шприце с адъювантом Фрейнда в равных пропорциях в симметричные подмышечные и паховые области, и внутрибрюшинно из расчета 0,1 мл в каждую точку, однократно, что обеспечивает расширение возможностей моделирования экспериментального амилоидоза у животных, особенно при исследовании функционального состояния почек, системы кровообращения, минерального обмена и других показателей экспериментальных животных, что позволяет сделать вывод о соответствии критерию «изобретательский уровень».
Совокупность существенных признаков, характеризующих сущность изобретения, в принципе может быть многократно использована в медицине с получением результата, заключающегося в эффективном и легко воспроизводимом способе моделирования экспериментального амилоидоза у животных, что позволяет сделать вывод о соответствии изобретения критерию «промышленная применимость».
Данный способ осуществляется следующим образом.
Для получения экспериментального системного амилоидоза в качестве экспериментальных животных выбраны сирийские хомяки-самцы массой 100-150 г в возрасте 5-6 мес. Для моделирования системного амилоидоза экспериментальным животным проводились подкожные инъекции нативной человеческой плазмы, смешанной в одном шприце с адъювантом Фрейнда в равных пропорциях в симметричные подмышечные и паховые области и внутрибрюшинно из расчета 0,1 мл в каждую точку, однократно.
На станции переливания крови г.Владикавказа в научных целях с письменным разрешением проректора по НИР ГОУ ВПО СОГМА Росздрава нам было выделено около 10 литров замороженной, утилизированной, неинфицированной человеческой плазмы в контейнерах, объемом 200 мл.
Адъювант Фрейнда (Freund adjuvant) - один из наиболее распространенных неспецифических стимуляторов иммуногенеза, содержит убитые туберкулиновые микобактерии, супензированные в масляной фазе водяной эмульсии. Выпускается в ампулах по 10 мл.
У контрольных и опытных животных исследуется 6-часовой спонтанный диурез. Клубочковая фильтрация определяется по клиренсу эндогенного креатинина, рассчитывается канальцевая рабсорбция воды. Содержание натрия и калия в моче определяется методом пламенной фотометрии, содержание кальция - спектрофотометрически. Основные процессы мочеобразования и экскреция электролитов определяются по истечении 1 и 2 месяцев.
По истечении времени эксперимента (2 мес) животные забиваются под наркозом. Морфологическому исследованию на предмет выявления амилоидоза (окраска гематоксилином и эозином, Конго красным) подвергаются внутренние органы. Образцы тканей фиксируются в 10% нейтральном формалине, с последующим приготовлением парафиновых срезов толщиной 5-6 микрон. Срезы окрашиваются гематоксилином и эозином, Конго красным. Изучение срезов проводится в проходящем свете при помощи микроскопа Микмед-1 под увеличением × 80, × 200, × 400.
Сущность заявляемого способа подтверждается функционально и морфологически.
Исследования показали, что в условиях спонтанного диуреза на фоне подкожного введения вышеописанной смеси отмечается увеличение диуреза к концу первого месяца, а в конце второго месяца, наоборот, диурез идет на снижение. Увеличение диуреза обусловлено повышением скорости клубочковой фильтрации (СКФ). В течение второго месяца эксперимента спонтанный диурез резко снижается, наряду со значительным снижением канальцевой реабсорбции воды.
Экскреция натрия под влиянием амилоидогена в условиях спонтанного 6-часового диуреза постепенно снижается на протяжении обоих месяцев.
Экскреция калия и кальция под влиянием нативной челоческой плазмы в условиях спонтанного диуреза снижается, особенно по истечении двух месяцев (см. табл.2).
Под влиянием введения нативной человеческой плазмы с адъювантом Фрейнда отмечалось прогрессивное увеличение протеинурии более чем в 2 раза на протяжении двух месяцев эксперимента (см. табл.1).
| Таблица 1 | |||||
| Изменения объема спонтанного диуреза и основных процессов мочеобразования при формировании амилоидной нефропатии | |||||
| Условия опыта | Статистич. показатель | Процессы мочеобразования | Содержание белка, мг/мл | ||
| Диурез, мл/час/100 | СКФ, м/час/100 | Реабсорбция, % | |||
| Фон | М±m | 0,13±0,004 | 21,00±0,220 | 99,39±0,016 | 0,98±0,030 |
| 1 мес эксперимента | М±m | 0,16±0,004 | 22,06±0,304 | 99,28±0,013 | 1,71±0,079 |
| 2 мес эксперимента | М±m | 0,12±0,003 | 12,48±0,389 | 99,07±0,013 | 2,62±0,043 |
| Таблица 2 | ||||
| Изменения экскреции электролитов с мочой при формировании амилоидной нефропатии | ||||
| Условия опыта | Статистич. показатель | Электролитовыделительная функция | ||
| Экскреция Na | Экскреция К | Экскреция Са | ||
| Фон | М±m | 10,68±0,367 | 7,54±0,381 | 0,26±0,014 |
| 1 мес эксперимента | M±m | 8,61±0,186 | 8,59±0,279 | 0,32±0,012 |
| 2 мес эксперимента | M±m | 6,54±0,268 | 5,21±0,226 | 0,20±0,010 |
Морфологически отмечалось:
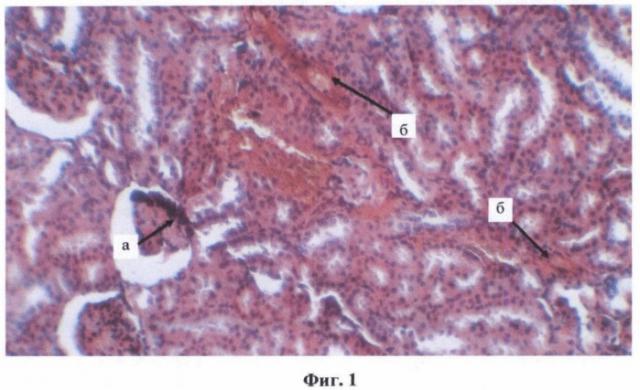
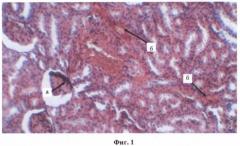
Фиг.1. Отложение конгофильных структур в клубочковых капиллярах, капсуле Боумена-Шумлянского, стенках сосудов почечного интерстиция и в базальных мембранах канальцев (а), гиперемия медуллы, плазматическое пропитывание и отек интерстиция обоих слоев почки. Выраженная паренхиматозная дистрофия нефротелия (б).
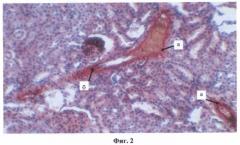
Фиг.2. Преимущественное отложения амилоида в стенках сосудов почек (а) с их утолщением и разрыхлением (б).
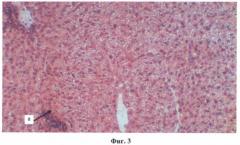
Фиг.3. Очаговая конгофилия мембранных структур гепатоцитов. Гиперемия, плазматическое пропитывание стенок сосудов всех калибров, отек ткани печени с резко выраженным расширением пространств Диссе. Отложение амилоида в печени преимущественно в стенках сосудов системы микроциркуляции (а) и базальных мембран портальных триад (артерия, вена, желчный проток), центральных сегментах печеночных долек и портальном интерстиции.
Фиг.4. Отложение амилоида в лимфоидных фолликулах селезенки (а), преимущественно в стенке их центральной артерии, а также в строме и сосудах системы гемомикроциркуляции (б) органа.
Пример №1.
Проведены серии опытов из 2 групп:
1-я группа - (10 сирийских хомяков) - контрольная;
2-я группа (10 сирийских хомяков) - амилоидная - животным проводились подкожные инъекции нативной человеческой плазмы, смешанной в одном шприце с адъювантом Фрейнда в равных пропорциях, в симметричные подмышечные, паховые области и внутрибрюшинно из расчета 0,1 мл в каждую точку, однократно.
Морфологическому исследованию на предмет выявления амилоидоза (окраска Конго красным) подвергнуты внутренние органы, кровеносные сосуды.
В результате проведенных исследований получены морфологические доказательства эффективности применения смеси нативной человеческой плазмы с адъювантом Фрейда для моделирования экспериментального амилоидоза у сирийских хомяков.
Гистологически у 2-й группы животных в почках (фиг.1) при окраске срезов красным Конго отмечалась выраженная конгофилия медуллярных и кортикальных стромально-сосудистых структур (артериол и капилляров) почки, в большей степени проявлявшаяся в мальпигиевых клубочках, капсуле Шумлянского-Боумена, базальных мембранах канальцев, гистоструктурах почечной лоханки и чашечек. Выявлялась слабая эндотелиальная реакция капилляров клубочков и сосудов микроциркуляторного русла стромы почки, особенно коркового слоя.
Исходя из полученных результатов исследования обосновывается использование данного амлоидогена для моделирования амилоидоза у сирийских хомяков.
Для наглядности изменений в органах микрофотографии повторяются в цветном виде в приложении.
Подводя итог, следует отметить, что подкожное введение нативной человеческой плазмы с адъвантом Фрейнда сирийским хомякам является эффективным способом моделирования экспериментального амилоидоза.
Способ моделирования экспериментального амилоидоза у животных, включающий введение сирийским хомякам белкового препарата подкожно, отличающийся тем, что в качестве белкового препарата вводят нативную человеческую плазму, смешанную с адъювантом Фрейнда в равных пропорциях, инъекции осуществляют в симметричные подмышечные и паховые области и внутрибрюшинно из расчета 0,1 мл в каждую точку, однократно.