Модуляция шаперонином 10 секреции цитокинов и хемокинов, индуцируемой toll-подобным рецептором
Иллюстрации
Показать всеИзобретение относится к области медицины. Предложены способ регуляции передачи сигнала Toll-подобным рецептором (TLR), способ регуляции индуцируемой агонистом TLR2 или TLR4 продукции и/или секреции иммуномодулятора, а также способ лечения заболеваний, чувствительных к регуляции передачи сигнала TLR2 или TLR4 у животного, включающие стадию введения животному, в клетки, ткани или органы шаперонина 10 (Cpn10). Также предложен молекулярный комплекс для обнаружения агониста или антагониста Cpn10, содержащий TLR, агонист TLR и Cpn10, и способ скрининга антагониста Cpn10 с использованием указанного комплекса. Изобретение обеспечивает возможность профилактического или терапевтического лечения заболеваний, нарушений или состояний, связанных с сердцем, чувствительных к регуляции передачи сигнала TLR2 или TLR4. 5 н. и 22 з.п. ф-лы, 10 ил., 2 табл., 8 пр.
Реферат
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к применению Шаперонина 10 для модуляции передачи сигнала Toll-подобным рецептором, и/или продукции, и/или секреции иммуномодулятора, индуцируемой Toll-подобным рецептором. Более конкретно, данное изобретение относится к модуляции секреции цитокинов и хемокинов, индуцируемой Toll-подобным рецептором, для лечения заболеваний, нарушений и состояний, возникающих вследствие избыточной секреции иммуномодуляторов. Данное изобретение также относится к получению, созданию и/или скринингу агонистов и антагонистов Шаперонина 10.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Семейство Toll-подобных рецепторов играет важную роль в воспалении и иммунной защите у насекомых, животных и у растений. Toll-подобные рецепторы (TLR) экспрессируются клетками мононуклеарной клеточной линии, в том числе лимфоцитами, макрофагами и дендритными клетками.
TLR2 активируется агонистами TLR2, такими как липотейхоевая кислота и липопептиды, которые могут быть компонентами наружной стенки некоторых бактерий. TLR3 активируется такими агонистами, как двухспиральная РНК вирусного происхождения.
TLR4 активируется липопротеинами, или липополисахаридами (LPS), или эндотоксином, которые являются компонентами наружной стенки грамотрицательных бактерий.
Активация TLR под действием патогенов или полученных из них молекул индуцирует внутриклеточную передачу сигнала, которая сначала приводит к активации фактора транскрипции NF-κΒ (Beg, 2002, Trends Immunol. 2002 23 509-12) и модуляции продукции цитокинов. Однако может быть запущен также и ряд других путей передачи сигнала, включая p38 митоген-активируемую киназу, c-Jun-N-концевую киназу и киназные пути, связанные с внеклеточной передачей сигнала (Flohe, et al., 2003, J Immunol, 170 2340-2348; Triantafilou & Triantafilou, 2002, Trends Immunol, 23 301-304). Профили генной экспрессии, индуцируемые лигированием разных TLR, различаются, но зачастую перекрываются. Например, большая часть генов, активируемых агонистами TLR3 и двухспиральной РНК, также активируются агонистами TLR4 и LPS (Doyle et al., 2002, Immunity, 17 251-263). В результате активации TLR4 под действием LPS в макрофагах происходит секреция TNF-α, IL-12 IL-1β, RANTES и MIP1β (Flohe et al., выше; Jones et al., 2002, J Leukoc Biol, 69 1036-1044).
Шаперонин 10 млекопитающих (также известный как белок теплового шока 10) впервые был описан как митохондриальный белок, участвующий в процессе пространственной упаковки белка, и является гомологом бактериального белка GroES. GroES и шаперонин 10 (Cpn10) олигомеризуется в семичленные кольца, которые связываются в виде крышечки на структуре, подобной чашке, которая включает в себя семь молекул GroEL или Hsp60, которые связывают денатурированные белки в комплекс (Bukau & Horwich, 1998, Cell, 92 351-366; Hartl & Hayer-Hartl, 2002, Science, 295 1852-1858). Cpn10 также часто обнаруживают на поверхности клетки (Belles et al., 1999, Infect Immun, 67 4191-4200; Feng et al., 2001, Blood, 97 3505-3512) и во внеклеточной жидкости (Michael et al., 2003, J Biol Chem, 278 7607-7616; Johnson et al., 2003, Cir Rev Immunol, 23 15-44).
Также было показано, что Cpn10 является фактором супрессии, присутствующим на ранней стадии беременности, и была показана иммуносупрессорная активность при экспериментальном аутоиммунном энцефаломиелите, гиперчувствительности замедленного типа и на моделях отторжения аллотрансплантата (Zhang et al., 2003, J Neurol Sci, 212 37-46; Morton et al., 2000, Immunol Cell Biol, 78 603-607).
Недавнее исследование с использованием Cpn10 Mycobacterium tuberculosis, описанное в публикации международной заявки WO 02/40038, дает возможность предположить, что эта молекула может обладать эффективностью при лечении таких заболеваний, как рак, аллергические реакции и/или состояния, опосредованные Th2-типом иммунных реакций. Предполагается, что этого можно достичь через индукцию цитокинов, таких как TNF-α и IL-6.
Однако механизм действия, которым Cpn10 и, в частности, Cpn10 млекопитающих осуществляет свои иммунорегуляторные функции, остается неясным.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Неожиданно авторы данного изобретения показали, что Cpn10 регулирует стимуляцию секреции иммуномодуляторов, опосредованную агонистом Toll-подобного рецептора.
Более конкретно, Cpn10 отрицательно регулирует индукцию провоспалительных иммуномодуляторов, опосредованную Toll-подобными рецепторами, и положительно регулирует индукцию секреции противовоспалительных иммуномодуляторов, опосредованную Toll-подобными рецепторами.
Таким образом, данное изобретение в широком смысле направлено на модуляцию передачи сигнала Toll-подобным рецептором под действием шаперонина 10 (Cpn10).
В первом аспекте данное изобретение относится к способу регуляции передачи сигнала Toll-подобным рецептором у животного или в полученных от него одной или нескольких клетках, или тканях, или органах, включающему в себя стадию введения Cpn10 или производного Cpn10 животному, в клетки, ткани или органы, тем самым регулируя передачу сигнала Toll-подобном рецептором.
Во втором аспекте, данное изобретение относится к способу регуляции секреции иммуномодулятора у животного или в полученных от него одной или нескольких клетках, или тканях, или органах, включающему в себя стадию введения Cpn10 или производного Cpn10, животному, в клетки, ткани или органы, тем самым регулируя продукцию и/или секрецию иммуномодулятора, индуцируемую Toll-подобным рецептором.
В соответствии с этими аспектами данное изобретение относится к способу регуляции передачи сигнала Toll-подобными рецепторами, и/или продукции, и/или секреции иммуномодуляторов, для модуляции, таким образом, иммунного ответа животного для профилактики или лечения заболевания, нарушения или состояния.
Предпочтительно данное заболевание, нарушение или состояние выбрано из острых или хронических воспалительных заболеваний, таких как септический шок, воспалительное заболевание кишечника, артрит, псориаз, заболевание сердца, атеросклероз, хроническое заболевание легких, кахексия, рассеянный склероз, болезнь «трансплантат против хозяина» (GVHD), трансплантация или рак.
В соответствии с данным изобретением Cpn10 предпочтительно регулирует Toll-подобный рецептор, выбранный из группы, состоящей из TLR2, TLR3 и TLR4.
Более предпочтительно Toll-рецептор выбран из группы, состоящей из TLR2 и TLR4.
Еще более предпочтительно Toll-рецептор представляет собой TLR4.
Соответственно, Cpn10 регулирует передачу сигнала Toll-подобным рецептором и продукцию и/или секрецию иммуномодуляторов, которая стимулируется, активируется или индуцируется под действием агониста Toll-подобного рецептора.
Агонистом Toll-подобного рецептора может быть патоген, полученная из него или продуцируемая им молекула или синтетический агонист Toll-подобного рецептора.
Предпочтительно агонист Toll-подобного рецептора выбран из группы, состоящей из LPS, липопептида и двухспиральной РНК.
В одном варианте осуществления, в котором Toll-подобный рецептор представляет собой TLR4, агонистом предпочтительно является LPS.
В другом варианте осуществления, в котором Toll-подобный рецептор представляет собой TLR3, агонистом предпочтительно является двухспиральная РНК.
Еще в одном варианте осуществления, в котором Toll-подобный рецептор представляет собой TLR2, агонистом предпочтительно является липопептид.
В конкретных вариантах осуществления липопептид может представлять собой PAM3CysSК4.
Соответственно, животное или полученные от него клетки, ткани или органы содержат клетки, экспрессирующие один или несколько Toll-подобных рецепторов.
Предпочтительно клетка представляет собой иммунокомпетентную клетку.
Более предпочтительно, когда иммунокомпетентная клетка представляет собой моноцит, макрофаг, дендритную клетку или лимфоцит.
Предпочтительно, если животное является млекопитающим.
Более предпочтительно животное представляет собой человека.
В соответствии с вышеуказанными аспектами в одном варианте осуществления иммуномодулятор представляет собой провоспалительный цитокин, такой как TNF-α или интерлейкин 6 (IL-6), или провоспалительный хемокин, такой как RANTES, но не ограничивается ими.
В другом варианте осуществления иммуномодулятор представляет собой противовоспалительный цитокин, такой как интерлейкин-10 (IL-10), или противовоспалительный хемокин, такой как TGF-β, но не ограничивается ими.
В тех вариантах осуществления, в которых иммуномодулятор представляет собой провоспалительный цитокин или хемокин, введение Cpn10 предпочтительно вызывает ингибирование, супрессию или иным образом снижает продукцию и/или секрецию указанного иммуномодулятора.
В тех вариантах осуществления, в которых иммуномодулятор представляет собой противовоспалительный цитокин или хемокин, введение Cpn10 предпочтительно повышает, облегчает, способствует или иным образом увеличивает продукцию и/или секрецию указанного иммуномодулятора.
В третьем аспекте данное изобретение относится к выделенному молекулярному комплексу, содержащему Toll-подобный рецептор, агонист Toll-подобного рецептора и Cpn10.
Предпочтительно Toll-подобный рецептор выбран из группы, состоящей из TLR2, TLR3 и TLR4.
Более предпочтительно Toll-рецептор выбран из группы, состоящей из TLR2 и TLR4.
Еще более предпочтительно Toll-подобный рецептор представляет собой TLR4.
В одном варианте осуществления, в котором Toll-подобный рецептор представляет собой TLR4, агонистом является LPS.
В другом варианте осуществления, в котором Toll-подобный рецептор представляет собой TLR3, агонистом является двухспиральная РНК.
Еще в одном варианте осуществления, в котором Toll-подобный рецептор представляет собой TLR2, агонист представляет собой PAM3CysSK4.
В одном конкретном варианте осуществления данное изобретение относится к выделенному молекулярному комплексу, содержащему TLR4, LPS и Cpn10.
В четвертом аспекте данное изобретение относится к способу получения, создания или скрининга агониста Cpn10, включающему в себя стадию определения имитирующего или усиливающего действия предполагаемого агониста на Cpn10 регуляцию передачи сигнала Toll-подобным рецептором, и/или продукцию, и/или секрецию иммуномодулятора, индуцируемого Toll-подобным рецептором.
В пятом аспекте данное изобретение относится к способу получения, создания или скрининга антагониста Cpn10, включающему в себя стадию определения ингибирования, снижения, супрессии или иного понижения под действием Cpn10 регуляции передачи сигнала Toll-подобным рецептором, и/или продукции, и/или секреции иммуномодулятора, индуцируемого Toll-подобным рецептором.
Предпочтительно Toll-подобный рецептор выбран из группы, состоящей из TLR2, TLR3 и TLR4.
Более предпочтительно Toll-рецептор выбран из группы, состоящей из TLR2 и TLR4.
Еще более предпочтительно Toll-подобный рецептор представляет собой TLR4.
В шестом аспекте данное изобретение относится к агонисту Cpn10 или агонисту, полученному, созданному или отобранному при скрининге в соответствии с аспектами, упомянутыми выше.
Будет понятно, что по тексту данного описания «включают в себя», «включает в себя» и «включающий в себя» использованы включительно, а не исключительно, будет понятно, что подразумевается включение установленного целого или группы целого, а не исключение любого другого целого или группы целого.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
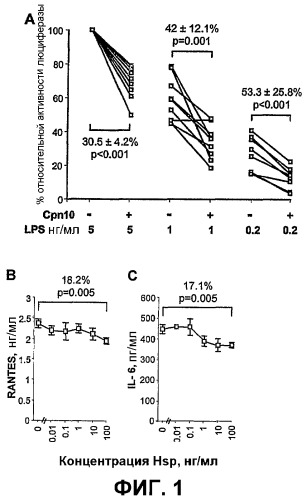
Фиг.1 Cpn10 ингибирует LPS-индуцированную активацию клеток RAW264.7 и продукцию провоспалительного медиатора.
(A) Cpn10-опосредованное ингибирование LPS-индуцированной активности NF-κΒ. В 9 отдельных экспериментах 100 мкг/мл Cpn10 (Hsp10 +) или буфера (Hsp10 -) предварительно инкубировали с клетками RAW264-HIV-LTR-LUC в течение 2 ч. Затем добавляли LPS в концентрации 5, 1 и 0,2 нг/мл и через 2 часа измеряли активность люциферазы. Условные единицы свечения (RLU) люциферазы, полученные для 5 нг/мл LPS, принимали за 100% относительной активности люциферазы, а 0% соответствует RLU, полученным в отсутствие LPS. Сам по себе Cpn10 не увеличивал в значительной степени RLU (данные не показаны). Среднее значение процента снижения (± SD) RLU, опосредованного Cpn10, показано для каждой концентрации LPS, и достоверность подсчитывали с использованием парного t-критерия Стьюдента.
(B, C) Cpn10-опосредованное ингибирование LPS-индуцированной секреции RANTES и IL-6. Клетки RAW264.7 инкубировали с указанной концентрацией Cpn10 (Hsp10) в течение 2 ч, с последующим добавлением 1 нг/мл LPS. Через 6 ч трехкратные супернатанты анализировали на наличие RANTES и IL-6 твердофазным иммуноферментным анализом (ELISA). Показано среднее значение процента снижения секреции RANTES и IL-6, опосредованное 100 мкг/мл Cpn10. Достоверность рассчитывали с использованием парного t-критерия Стьюдента.
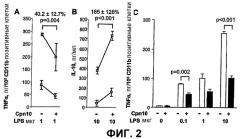
Фиг.2 Действие Cpn10 на секрецию цитокина в мышиных системах.
(A) Обработка Cpn10 снижала способность перитонеальных макрофагов, стимулированных LPS, продуцировать TNF-α. Мышам C57BL/6 (n=3) вводили Cpn10 (Cpn10 +) или контрольный разбавитель (Cpn10 -). Перитонеальные макрофаги в испытуемой группе от индивидуальных животных собирали путем перитонеального лаважа на 6 день и объединяли. Клетки помещали 2×105/лунку в присутствии LPS (1 мкг/мл). Культуральные супернатанты собирали через 5 часов и уровни TNF-α определяли с помощью ELISA. (Лунки без LPS продуцировали неопределяемое количество TNF-α - данные не показаны). Показаны средние значения ± SE по трем лункам и приведены к уровню продукции на 105 макрофагов на основании CD1 1b-окрашивания. Показаны данные двух идентичных экспериментов, и указан средний процент снижения, с достоверностью, рассчитанной методом ANOVA.
(В) Обработка Cpn10 увеличивала продукцию IL-10 клетками селезенки. Мышам C57BL/6 вводили либо Cpn10, либо контрольный разбавитель, как показано выше. Клетки селезенки собирали на 6 день и объединяли от индивидуальных животных в пределах испытуемой группы и культивировали при 5×105/лунку в присутствии LPS (10 мкг/мл). Культуральные супернатанты собирали через 48 часов и определяли уровни IL-10 с помощью ELISA. Показаны средние значения ± SE по трем лункам. Показан средний процент увеличения со статистическими данными, рассчитанными как для A. (С) Обработка Cpn10 снижала продукцию TNF-α IL-10-/- перитонеальными макрофагами. Мышам IL-10-/- C57BL/6 вводили Cpn10 или контрольный разбавитель, как показано выше, и перитонеальные макрофаги собирали, как показано для A. Через 5 часов культивирования в присутствии LPS (0,1, 1 или 10 мкг/мл) TNF-α определяли в культуральных супернатантах методом ELISA. Показано среднее значение ± SE по трем лункам для одного репрезентативного эксперимента. Уровни TNF-α сравнивали у животных, получавших Cpn10, и контрольных животных, используя непараметрический t-тест.
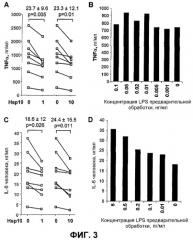
Фиг.3 Обработка Cpn10 мононуклеарных клеток периферической крови (PBMC) человека снижает секрецию TNF-α и IL-6, индуцированную LPS, и не индуцирует толерантность. (A) Cpn10 снижал секрецию TNF-α, индуцированную LPS. К PBMC от восьми различных доноров добавляли Cpn10 (1 и 10 мкг/мл) или буфер (0) за 1 час до добавления 0,04 нг/мл LPS. Супернатаны удаляли через 20 ч и анализировали на наличие TNF-α. Указаны проценты снижения и достоверность, рассчитанная с использованием парного t-критерия Стьюдента. Для всех доноров 10 мкг/мл Cpn10, в отсутствие LPS, не индуцировал уровни TNF-α выше определяемого уровня (31 пг/мл) (данные не показаны). (B) Предварительная обработка с использованием LPS в течение 1 ч не могла индуцировать толерантность к последующей секреции TNF-α, индуцированной LPS. PBMC подвергали воздействию указанных концентраций LPS предварительной обработки. Через 1 ч PBMC стимулировали действием 0,04 нг/мл LPS, и супернатанты анализировали на наличие цитокинов спустя 20 ч. (C) Cpn10 снижал секрецию IL-6, индуцированную LPS. Cpn10 (1 и 10 мкг/мл) или буфер (0) добавляли к PBMC от восьми различных доноров за 1 ч до добавления 0,04 нг/мл LPS. Через 20 ч супернатанты удаляли и анализировали на наличие IL-6. Указаны проценты снижения и достоверность (рассчитанные как для A). Для всех доноров 10 мкг/мл Cpn10, в отсутствие LPS, не индуцировал уровни IL-6 выше определяемого уровня (9 пг/мл) (данные не показаны). (D) Предварительная обработка с использованием LPS в течение 1 ч не могла индуцировать толерантность к последующей секреции IL-6, индуцированной LPS. PBMC подвергали воздействию указанных концентраций LPS предварительной обработки. Через 1 ч PBMC стимулировали 0,04 нг/мл LPS и супернатанты анализировали на наличие цитокина спустя 20 ч.
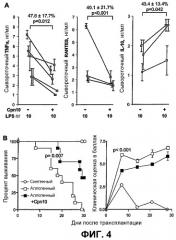
Фиг.4 Активность Cpn10 в моделях воспаления на мышах.
Cpn10 снижает уровни LPS-индуцированного сывороточного TNF-α и RANTES и повышает уровни IL-10. В 5 различных экспериментах мышам C57BL/6 (n=3 или 4 на группу) вводили буфер (Cpn10 -) или 100 мкг Cpn10 (Cpn10 +) внутривенно за 30 мин до внутривенного введения 10 мкг LPS. Через 1,5 часа животных скарифицировали и определяли сывороточные уровни TNF-α, RANTES и IL-10; (два последних определяли в 3/5 экспериментов). Планки погрешностей представляют стандартные ошибки в каждом эксперименте. Указаны сокращения в процентном выражении TNF-α и RANTES и увеличение IL-10 (± SD), и достоверность рассчитана с использованием ANOVA тестов.
Обработка Cpn10 перед трансплантацией задерживает смертность при GVHD и снижает клиническую тяжесть острого заболевания. Сингенные отрицательные контроли (n=8) (белые кружочки) представляют мышей B6D2F1, которым трансплантировали сингенный костным мозгом B6D2F1 и T-клетки. Аллогенные положительные контроли (n=10) (белые квадратики) представляют мышей реципиентов B6D2F1, которым предварительно вводили разбавитель, трансплантированных клетками мышей доноров B6, которым предварительно вводили разбавитель. Аллогенные + Cpn10 (n=10) (черные квадратики) представляют B6D2F1 реципиентов, получающих трансплантаты костного мозга и Т-клетки от мышей-доноров B6, где и реципиентов, и доноров предварительно перед трансплантацией обрабатывали Cpn10.
Кривые выживания Каплан-Мейера и клинические баллы показаны для трех групп, и аллогенные группы, получавшие Cpn10 и не получавшие Cpn10, сравнивали с помощью логарифмической ранговой статистики и непараметрического t-теста соответственно. Клинические баллы существенно отличались только на 7 день.
Фиг.5 (A) Область подкожной гранулемы у мышей BALB/c, которым вводили полный адъювант Фрейнда (CFA) с Cpn10 и без него. Cpn10 результаты показаны заштрихованными светлым колонками слева от каждой пары колонок по сравнению с буферным контролем (заштрихованы темным, правые колонки). (B-E) PAM3CysSK4-индуцированную активацию макрофагов ингибируют действием Cpn10 в клетках RAW264-HIV-LTR-LUC. (B) Cpn10 или разбавитель добавляли в течение 2 часов, с последующим добавлением PAM3CysSK4 в течение 2 ч, после чего проводят люциферазный анализ. (С) Cpn10 или разбавитель добавляли в течение 2 часов, после чего промывали для удаления Cpn10 или разбавителя, с последующим добавлением PAM3CysSK4 в течение 2 ч, а затем проводили люциферазный анализ. (D) Cpn10 или разбавитель добавляли в течение 2 часов с последующим добавлением PAM3CysSK4 в течение 2 ч, а затем проводили люциферазный анализ. (E) Использовали тот же протокол, что и в (В), за исключением того, что клетки активировали LPS вместо PAM3CysSK4. Верхняя панель показывает данные в условных единицах свечения, а нижняя - процент ингибирования, опосредованного действием Cpn10.
Фиг.6 Cpn10 не связывает TLR4 или TLR2 в отсутствие лиганда. Верхняя панель: TLR4 положительный контроль. MD-2 совместно иммунопреципитирует с TLR4 (но не с TLR2). Нижняя панель: Cpn10 физически не взаимодействует с TLR4 или TLR2 в этих условиях и в отсутствие лиганда.
Фиг.7 Ежедневное подкожное введение Cpn10 уменьшает потерю массы тела при адъювантном артрите у крыс. Среднее значение (± SEM) потери массы тела при адъювантном артрите (n=10 на группу).
Фиг.8 Cpn10-опосредованное воздействие на клетки RAW264.7, стимулированные LPS, не является следствием контаминации LPS (A) в качестве теста на толерантность вследствие LPS контаминации Cpn10, было показано, что предварительная обработка за 2 ч до стимуляции LPS не ингибировала LUC активность. Клетки RAW264-HIV-LTR-LUC предварительно обрабатывали указанными концентрациями LPS в двух параллельных экспериментах; через 2 ч клетки стимулировали действием 5, 1, 0,2 и 0 нг/мл LPS и 2 ч спустя измеряли активность LUC. (B) Обработанный трипсином Cpn10 не ингибировал LPS-индуцированную активность NF-κΒ. Обработка клеток RAW264-HIV-LTR-LUC в двух параллельных экспериментах в течение 2 ч 100 нг/мл Cpn10 (Hsp10) значительно снижала RLU при индукции действием 5, 1 и 0,2 нг/мл LPS по сравнению с клетками, обработанными буфером (Контроль); проценты снижения в RLU после вычитания фонового значения составили 29,7±0,8 (SD), 50±4,6 и 71±7,7 соответственно (p<0,001 с помощью двухфакторного дисперсионного анализа ANOVA, который включал в себя термин для обозначения концентрации LPS). По сравнению с контролем применение Cpn10, обработанного трипсином (Трипсин Hsp10), дало 0,1±8,8, 11,6±4,2 и 21±7,4 а буфера, обработанного трипсином (Трипсиновый буфер) 1,4±2,1, 5,8±1,1 и 14,9±2,4 процент снижения для 5, 1 и 0,2 нг/мл LPS соответственно; (не отличались в значительной степени ни от Контроля, ни друг от друга). Как ожидалось, обработка трипсином стимулирующего LPS не влияла на активность LPS (Трипсин LPS, p>0,05). (С) Cpn10-опосредованное снижение активности LUC, индуцированной LPS, является чувствительным к дозе. Данный эксперимент проводили, как на фиг.1 A, за исключением того, что концентрацию Cpn10 (Hsp10) изменяли, как указано. Для каждой концентрации LPS показан процент ингибирования активности LUC по сравнению с контрольными клетками, предварительно необработанными Cpn10.
Фиг.9 Внутривенная инфузия, а не подкожная инъекция Cpn10 индуцирует изменения величины стимулированного LPS TNF-α ответа клетками PBMC in vitro. A. Стимулированная LPS продукция TNF-α в 0 день (~12 часов перед инфузией) и в 1 день (8 часов после инфузии). B. Данные фиг.9A, графически показанные как изменение стимулированной LPS продукции TNF-α от пре- до пост-инфузии. С. LPS-стимулированная продукция TNF-α в 0 день (~12 часов перед инъекцией) по сравнению с 1 днем (8 часов после подкожной инъекции Cpn10/плацебо).
Фиг.10 Внутривенная инфузия Cpn10 ежедневно в течение 5 дней индуцирует изменения величины LPS-стимулированного TNF-α ответа клетками PBMC in vitro. LPS-стимулированная продукция TNF-α из PBMC, выделенных в 0 день 0 (~12 часов перед инфузией) по сравнению с клетками, выделенными в 1, 4 и 5 день (приблизительно 8 часов после инфузии). Кроме того, PBMC, выделенные на 8 и 12 дни (т.е. 3 дня и 7 дней после конечной инфузии Cpn10 на 5 день соответственно), сравнивали с реакцией, стимулированной LPS, в 0 день. Супернатанты клеточных культур также тестировали на продукцию IL-6 и демонстрировали такую же общую тенденцию, как указано здесь для TNF-α.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение явилось результатом, по меньшей мере, в части, открытия того, что в ряде различных in vitro и in vivo систем человека и мыши Cpn10 ингибируют LPS-опосредованную секрецию провоспалительных цитокинов TNF-α и IL-6 и противовоспалительного цитокина RANTES и увеличивает LPS-индуцированную секрецию противовоспалительного цитокина IL-10 в клетках, в том числе моноцитах, макрофагах и мононуклеарных клетках.
Это противоречит международной публикации WO 02/40038, в которой сделано предположение, что микобактериальный Cpn10 действует для подавления иммунных реакций, опосредованных Th2, путем повышения экспрессии цитокинов, таких как TNF-α и IL-6.
Не привязываясь к какой-либо конкретной теории, в соответствии с настоящим изобретением Cpn10 действует ни через Th1-, ни через Th2-зависимый механизм.
Авторы настоящего изобретения неожиданно продемонстрировали, что Cpn10 влияет на передачу сигнала Toll-подобным рецептором и результирующую секрецию иммуномодулятора в ответ на агонист Toll-подобного рецептора.
Более конкретно, Cpn10 снижает активацию NF-κΒ, стимулированную агонистом Toll-подобного рецептора, и секрецию TNF-α и RANTES и повышает секрецию IL-10 дозозависимым образом.
Кроме того, авторы данного изобретения также продемонстрировали, что Cpn10, Toll-подобные рецепторы и агонисты Toll-подобных рецепторов образуют молекулярный комплекс. Анализ с использованием флуоресцентного резонансного переноса энергии (FRET-анализ) дает возможность предположить, что возможно прямое взаимодействие между Cpn10 и Toll-подобным рецептором или что они находятся, по меньшей мере, в очень тесной пространственной близости (в пределах 1-10 нм друг от друга), в присутствии лиганда TLR (например, LPS).
Будет понятно, что агонист Toll-подобного рецептора может представлять собой патоген (такой как бактерия или вирус), полученную из него молекулу, или продуцируемую патогеном (такую как бактериальный LPS, бактериальный эндотоксин, микобактериальный липоарабиноманнан, липотейхоевая кислота, липопептид или двухспиральная РНК), или может представлять собой синтетический липопептидный агонист Toll-подобного рецептора, такой как пептид/аминокислота, связанная с длинноцепочечными ацилированными насыщенными жирными кислотами, такими как лауриновая и пальмитиновая кислота, например агонист TLR2 PAM3CysSK4.
В данном изобретении под «иммуномодулятором» подразумевается молекулярный медиатор, секретируемый клетками иммунной системы или молекулярный медиатор, который взаимодействует с клетками иммунной системы, который играет роль в активации, поддержании, созревании, ингибировании, супрессии или повышении иммунного ответа.
Под «цитокином» подразумевается молекулярный медиатор, секретируемый клетками иммунной системы, который играет роль в активации, поддержании, созревании, ингибировании, супрессии или повышении иммунного ответа. Неограничивающими примерами цитокинов являются TNF-α, интерлейкин-6 (IL-6), интерлейкин-12 (IL-12), интерлейкин-1β (IL-1β) и интерлейкин-10 (IL-10).
Под «хемокином» подразумевается молекулярный медиатор, который способствует и/или регулирует клеточную миграцию и активацию. Неограничивающими примерами хемокинов являются MIP1α, MIP1β, RANTES и TGF-β.
Под «провоспалительным иммуномодулятором» подразумевается цитокин или хемокин, который играет роль или вовлечен в процесс воспаления или воспалительную реакцию.
Неограничивающими примерами провоспалительных иммуномодуляторов являются IL-6, TNF-α, IL-12 и IL-1β, RANTES и MIP1β.
Под «противовоспалительным иммуномодулятором» подразумевается цитокин или хемокин, который играет роль в ингибировании, супрессии или ином уменьшении воспалительной реакции.
Неограничивающими примерами противовоспалительных иммуномодуляторв являются IL-10 и TGF-β.
Под «выделенным» подразумевается вещество, которое удалили из его природного состояния или иным образом подвергли проводимым людьми манипуляциям. Выделенное вещество может быть по существу или в значительной степени свободно от компонентов, которые обычно сопутствуют ему в природном состоянии, или может быть подвергнуто обработке таким образом, чтобы оно находилось в искусственно созданном состоянии вместе с компонентами, которые обычно сопровождают его в его природном состоянии. Выделенное вещество может быть в природной, химически синтезированной или рекомбинантной форме.
Под «белком» подразумевается аминокислотный полимер. Аминокислоты могут быть природными или неприродными аминокислотами D- или L- аминокислотами, хорошо изученными в данной области.
«Пептид» представляет собой белок, имеющий менее пятидесяти (50) аминокислот.
«Полипептид» представляет собой белок, имеющий более пятидесяти (50) аминокислот.
Используемый здесь термин «нуклеиновая кислота» означает одно- или двухспиральную мРНК, РНК, РНКi и ДНК, в том числе кДНК и геномную ДНК.
Cpn10 и фрагменты, варианты и производные Cpn10
В соответствии с настоящим изобретением «Cpn10» или «шаперонин 10» относится к любому эукариотическому Cpn10, в том числе Cpn10 млекопитающих, например человека, мыши, крысы или другим формам Cpn10.
Предпочтительно Cpn10 представляет собой Cpn10 млекопитающих.
Более предпочтительно Cpn10 представляет собой Cpn10 человека.
Cpn10 белок может содержать приpодную модификацию, такую как гликозилирование или ацетилирование, и/или быть в нативной, химически синтезированной или рекомбинантной форме. Также будет понятно, что Cpn10 также может называться «Hsp10». Они могут рассматриваться как относящиеся к одному и тому же белку.
В соответствии с данным изобретением также могут быть использованы фрагменты Cpn10.
В одном варианте осуществления «фрагмент» включает в себя аминокислотную последовательность, которая составляет менее 100%, но по меньшей мере 30%, предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 80% или еще более предпочтительно по меньшей мере 90%, 95% или 98% белка Cpn10.
Термин «фрагмент» включает в себя и охватывает «биологически активный фрагмент», который сохраняет биологическую активность белка Cpn10. Например, биологически активный фрагмент Cpn10, способный регулировать передачу сигнала Toll-подобным рецептором и/или секрецию иммуномодулятора, может быть использован в соответствии с данным изобретением. Биологически активный фрагмент составляет по меньшей мере более 50% биологической активности целого белка Cpn10, предпочтительно по меньшей мере более 60% биологической активности, более предпочтительно по меньшей мере более 75% биологической активности, еще более предпочтительно по меньшей мере более 80% биологической активности и преимущественно по меньшей мере 90% или 95% биологической активности Cpn10.
Используемый здесь термин «вариантные» белки представляют собой белки, в которых одна или несколько аминокислот заменены другими аминокислотами. Варианты белков Cpn10, которые сохраняют биологическую активность нативного Cpn10 или Cpn10 дикого типа, могут быть использованы в соответствии с данным изобретением. В данной области хорошо известно, что некоторые аминокислоты могут быть изменены на другие с приблизительно сходными свойствами без изменения характера активности белка (консервативные замены). В основном замены, которые вероятно вызывают наибольшие изменения свойств полипептидов, представляют собой замены, в которых (a) гидрофильный остаток (например, Ser или Thr) замещен гидрофобным остатком или на гидрофобный остаток (например, Leu, Ile, Phe или Val); (b) цистеин или пролин замещен любым другим остатком или на любой другой остаток; (c) остаток, имеющий электроположительную боковую цепь (например, Arg, His или Lys), замещен электроотрицательным остатком, или на электроотрицательный остаток (например, Glu или Asp), или (d) остаток, имеющий объемную боковую цепь (например, Phe или Trp) замещен остатком или на остаток, имеющий меньшую боковую цепь, (например, Ala, Ser) или без боковой цепи (например, Gly).
В отношении вариантов Cpn10, их можно получить с помощью мутагенеза белка Cpn10 или мутагенезом кодирующей нуклеиновой кислоты, как, например, случайным мутагенезом или сайт-направленным мутагенезом. Примеры методов мутагенеза нуклеиновой кислоты приведены в Главе 9 публикации CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, Ausubel et al., supra, которая включена здесь в качестве ссылки.
Используемые здесь «производные» белки Cpn 10 данного изобретения включают в себя белки, которые были изменены, например, конъюгацией или образованием комплекса с другими химическими частями молекулы или с использованием методик пост-трансляционной модификации, хорошо известных в данной области, в том числе слитые клеточные белки.
Другие производные, рассматриваемые данным изобретением, включают в себя, но не только, пегилирование, модификацию по боковым цепям, включение неприродных аминокислот и/или их производных во время синтеза белка и применение кросс-линкеров и другие способы, которые накладывают конформационные ограничения на белок Cpn10. Примеры модификаций боковых цепей, рассматриваемых настоящим изобретением, включают в себя модификации аминогрупп, например, ацилированием с использованием уксусного ангидрида; ацилирование аминогрупп янтарным ангидридом и тетрагидрофталевым ангидридом; амидирование метилацетимидатом; карбамоилирование аминогрупп цианатом; пиридоксилирование лизина пиридоксаль-5-фосфатом с последующим восстановлением с использованием NaBН4; восстановительное алкилирование взаимодействием с альдегидом с последующим восстановлением с использованием NaBН4; и тринитробензилирование аминогрупп 2,4,6-тринитробензолсульфоновой кислотой (TNBS).
Карбоксильная группа может быть модифицирована активацией карбодиимидом через образование O-ацилизомочевины, за которым следует последовательное получение производных, например, до соответствующего амида.
Гуанидиновая группа остатков аргинина может быть модифицирована образованием гетероциклических конденсированных продуктов с такими реактивами, как 2,3-бутандион, фенилглиоксаль и глиоксаль.
Сульфгидрильные группы могут быть модифицированы такими способами, как окисление надмуравьиной кислотой до цистеиновой кислоты; образование производных ртути с использованием 4-хлормеркурифенилсульфоновой кислоты, 4-хлормеркурибензоата; 2-хлормеркури-4-нитрофенола, хлорида фенилртути и других соединений ртути; образование смешанных дисульфидов с другими тиольными соединениями; реакция с имидом малеиновой кислоты, малеиновым ангидридом или другим замещенным имидом малеиновой кислоты; карбоксиметилирование иодуксусной кислотой или иодацетамидом; и карбамоилирование цианатом при щелочном pH.
Остатки триптофана могут быть модифицированы, например, алкилированием индольного кольца 2-гидрокси-5-нитробензилбромидом или сульфонилгалидами или окислением N-бромсукцинимидом.
Остатки тирозина могут быть модифицированы нитрованием тетранитрометаном до образования 3-нитро производного тирозина.
Имидазольное кольцо остатка гистидина может быть модифицировано N-карбэтоксилированием диэтилпирокарбонатом или алкилированием производными иодуксусной кислоты.
Примеры включения неприродных аминокислот и производных во время синтеза белка включают в себя, но не только, применение 4-аминомасляной кислоты, 6-аминокапроновой кислоты, 4-амино-3-гидрокси-5-фенилпентановой кислоты, 4-амино-3-гидрокси-6-метилгептановой кислоты, т-бутилглицина, норлейцина, норвалина, фенилглицина, орнитина, саркозина, 2-тиенилаланина и/или D-изомеров аминокислот.
Производные также могут включать в себя слитые клетки и короткие пептидные последовательности эпитопа (эпитоп-тэги). Хорошо известные примеры слитых клеток включают в себя, но не только, глутатион-S-трансферазу (GST), Fc часть IgG человека, белок, связывающий мальтозу (MBP) и гексагистидин (HIS6), которые особенно применимы для выделения слитого белка методом аффинной хроматографии. Для очистки слитого полипептида методом аффинной хроматографии подходящими матрицами для аффинной хроматографии являются глутатион-, амилоза- и никель- или кобаль-конъюгированные смолы соответственно. Многие из этих матриц доступны в виде «набора», такого как QIAexpress™ system (Qiagen), используемые с (HIS6) слитыми клетками, и система очистки Pharmacia GST.
Один конкретный пример слитой клетки представляет собой GST, описанный у Morton el al., 2000, Immunol Cell Biol 78 603-607. В некоторых случаях слитые клетки имеют сайты расщепления протеазой, например, для Фактора Xa или тромбина, которые дают возможность соответствующей протеазе частично переваривать слитый полипептид по данному изобретению и тем самым высвобождать из него рекомбинантный белок Cpn10. Высвобожденный белок Cpn10 затем может быть выделен из слитой клетки последовательным хроматографическим разделением. При расщеплении GST-Cpn10 тромбином, например, образуется производный белок GSM-Cpn10.
Слитые клетки в соответствии с данным изобретением также включают в своем объеме «эпитоп-тэги», которые обычно представляют собой короткие пептидные последовательности для каждого доступного специфичного антитела. Хорошо известными примерами «эпитоп-тэгов», для которых специфические моноклональные антитела легкодоступны, включают в себя c-myc, гемагглютинин и FLAG-тэги.
Белки Cpn10 в соответствии с данным изобретением (в том числе фрагменты, варианты, производные и гомологи) могут быть получены с помощью любого подходящего способа, известного специалистам в данной области, в том числе химическим синтезом и рекомбинантной экспрессией.
Предпочтительно Cpn10 представляет собой Cpn10.
Например, рекомбинантный белок Cpn10 может быть получен способом, включающим стадии:
(i) получения экспрессионной конструкции, которая включает в себя выделенную нуклеиновую кислоту, кодирующую Cpn10, функционально связанную с одной или несколькими регуляторными нуклеотидными последовательностями в экспрессионном векторе;
(ii) трансфектирования или трансформирования подходящей клетки-хозяина данной экспрессионной конструкцией; и
(iii) экспрессии рекомбинантног