Анальгетическое средство
Иллюстрации
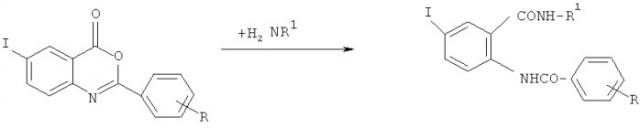
Показать всеИзобретение относится к области органической химии, а именно к новым соединениям класса амидов NH-ацил-5-йодантраниловой кислоты общей формулы (I), где: R1=CH2C6H5, R=4-NO2 (I); R1=CH2CH=CH2, R=3-NO2 (II); R1=CH2CH=CH2, R=4-CH3 (III). Полученные соединения обладают высокой анальгетической активностью, при этом они практически нетоксичны. 6 пр., 1 табл.
Реферат
Изобретение относится к области органической химии, классу амидов NН-ацил-5-йодантраниловой кислоты, а именно новым биологически активным веществам: бензиламид NН-(4-нитробензоил)-5-йодантраниловой кислоты (I), аллиламид NН-(3-нитробензоил)-5-йодантраниловой кислоты (II) и аллиламид NH-(4-метилбензоил)-5-йодантраниловой кислоты (III) формулы:
где: R1=CH2C6H5, R=4-NO2 (I); R1=CH2CH=CH2, R=3-NO2 (II);
R1=CH2CH=CH2, R=4-CH3 (III),
которые после углубленного изучения могут найти применение в качестве анальгетического лекарственного препарата в медицинской практике.
В качестве эталона сравнения по действию взяты ортофен и мефенамовая кислота [Машковский М.Д. Лекарственные средства. - 15-е изд., перераб., испр. и доп. - М.: ООО "Издательство Новая Волна", 2005. - С.170-171, 174-175]. Ближайшим структурным аналогом является аллиламид N-(фуроил-2)антраниловой кислоты [АС №1282498. Аллиламид N-(фуроил-2)антраниловой кислоты, проявляющий противовоспалительную и анальгетическую активность / Л.М.Коркодинова, Ю.В.Кожевников, Е.Л.Пидемский [и др.]; Перм. гос. фармац. ин-т. - №3917578; приор. 12.05.85 (СССР). - 3 с. - В сведениях перед текстом также: Л.Г.Марданова, М.И.Вахрин]. Недостатки аналога - недостаточно высокая анальгетическая активность.
Задачей предлагаемого изобретения является получение бензиламида NН-(4-нитробензоил)-5-йодантраниловой кислоты (I), аллиламида NН-(3-нитробензоил)-5-йодантраниловой кислоты (II) и аллиламида NH-(4-метилбензоил)-5-йодантраниловой кислоты (III), обладающих более высоким анальгетическим действием, а также расширение арсенала средств взаимодействия на живой организм, поставленная задача достигается получением амидов NН-ацил-5-йодантраниловой кислоты (I-III) взаимодействием 2-R-6-йод-3,1-бензоксазин-4-она с бензиламином или аллиламидом:
R1=CH2C6H5, R=4-NO2 (I); R1=CH2CH=CH2, R=3-NO2 (II);
R1=CH2CH=CH2, R=4-CH3 (III)
Схема получения амидов NН-ацил-5-йодантраниловой кислоты (I-III) описана в литературе [Власова Н.А. Синтез и свойства амидов N-ацил-5-йодантраниловой кислоты / Н.А.Власова, Е.Р.Курбатов, Л.М.Коркодинова // Научно-практический журнал «Вестник Пермской Государственной Фармацевтической Академии». Пермь. - 2008. - №4. - С.122-125. Власова Н.А. Синтез и свойства амидов NH-ацил-5-бром(йод)антраниловых кислот / Н.А.Власова, Е.Р.Курбатов, Л.М.Коркодинова // Научно-практический журнал «Вестник Пермской Государственной Фармацевтической Академии». Пермь. - 2009. - №5. - С.81-84].
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение бензиламида NН-(4-нитробензоил)-5-йодантраниловой кислоты (I). К раствору 0,30 г (0,00076 моль) 2-(4-нитрофенил)-6-йод-3,1-бензоксазин-4-она в 10 мл этанола приливают 0,096 г (0,00091 моль) бензиламина в 5 мл этанола. Оставляют на 60 мин при постоянном перемешивании при температуре 18-20°С. Осадок отфильтровывают, сушат и кристаллизуют из этанола. Т. пл. 235-237°С. Выход: 46% (0,17 г).
Пример 2. Получение аллиламида NH-(3-нитробензоил)-5-йодантраниловой кислоты (II). К раствору 0,30 г (0,00076 моль) 2-(3-нитрофенил)-6-йод-3,1-бензоксазин-4-она в 5 мл этанола приливают 0,07 г (0,00114 моль) аллиламина в 2 мл этанола. Оставляют на 60 мин при постоянном перемешивании при температуре 18-20°С. Осадок отфильтровывают, сушат и кристаллизуют из ацетонитрила. Т. пл. 203-204°С. Выход: 65% (0,22 г).
Пример 3. Получение аллиламида NН-(4-метилбензоил)-5-йодантраниловой кислоты (III). К 0,30 г (0,00083 моль) 2-(4-метилфенил)-6-йод-3,1-бензоксазин-4-она в 5 мл этанола приливают 0,07 г (0,0012 моль) аллиламина в 2 мл этанола. Оставляют на 60 мин при постоянном перемешивании при температуре 18-20°С. Осадок отфильтровывают, сушат и кристаллизуют из 2-бутанола. Т. пл. 198-200°С. Выход: 63% (0,22 г).
Предлагаемые соединения представляют собой желтого (I и II) или белого (III) цвета кристаллические вещества, не растворимые в воде, растворимые в этаноле, ДМСО, ДМФА. В спектре ЯМР 1Н (BS-567A (100 МГц) в ДМСО-d6, внутренний стандарт - ГМДС) соединения I имеются: дуплет двух протонов метиленовой группы при 4,45 м.д., мультиплет двенадцати протонов ароматических колец в области 7,24-8,35 м.д., триплет протона амидной группы при 9,43 м.д., синглет протона вторичной аминогруппы NH-ацильного фрагмента в области 12,49 м.д.
В спектре ЯМР 1Н (BS-567A (100 МГц) в ДМСО-d6, внутренний стандарт - ГМДС) соединения II имеются: триплет двух протонов метиленовой группы (=СН2) при 3,83-3,93 м.д., дуплет двух протонов метиленовой группы (-СН2) в интервале 5,01-5,22 м.д., мультиплет протона метановой группы при 5,67-5,98 м.д., мультиплет семи протонов ароматических колец в области 7,72-9,01 м.д., синглет протона амидной группы при 9,05 м.д., синглет протона вторичной аминогруппы NH-ацильного фрагмента при 12,48 м.д.
В спектре ЯМР 1Н (BS-567A (100 МГц) в ДМСО-d6, внутренний стандарт - ГМДС) соединения (III) имеются: синглет трех протонов метальной группы при 2,37 м.д., триплет двух протонов метиленовой группы (=СН2) при 3,89-4,01 м.д., дуплет двух протонов метиленовой группы (-СН2) в области 5,02-5,23 м.д., мультиплет протона метановой группы при 5,68-5,99 м.д., мультиплет семи протонов ароматических колец в области 7,25-9,02 м.д., синглет протона амидной группы при 9,06 м.д., синглет протона вторичной аминогруппы NH-ацильного фрагмента при 12,28 м.д.
Пример 4. Токсичность соединений, полученных по примерам 1-3. Острую токсичность определяли на белых нелинейных мышах массой 20-25 г. Исследуемые вещества и препараты сравнения вводили внутрибрюшинно в виде водного раствора из расчета 0,1 мл на 10 г массы животного в возрастающих дозах. Результаты обрабатывали по Прозоровскому с вычислением средней смертельной дозы (ЛД50) при Р≤0,05 [Прозоровский В.В., Прозоровская М.П., Демченко В.М. // Фармакология и токсикология. - 1978. - Т.41. - №4. - С.497-502].
Соединения I, II и III исследовали на наличие анальгетической активности двумя методами.
Пример 5. Методом «горячей пластинки» анальгетическую активность определяли на беспородных белых мышах массой 18-23 г. Исследуемые соединения вводили в дозе 50 мг/кг за 30 мин до помещения животных на нагретую до 53,5°C металлическую пластинку. Показателем изменения болевой чувствительности служила длительность пребывания животных на горячей пластинке до момента облизывания ими задних лапок. Каждое соединение испытывали на 5 животных [N.B.Eddy and D.J.Leimbach // J. Pharmacol. Exp. Ther. - 1953. - Soc.107. - P.385-393].
Пример 6. По методике «уксусных корчей» анальгетическая активность соединений исследована на беспородных белых мышах массой 18-23 г [S.Winstein, N.L.Jakobs, E.F.Levi [et al.] // J. Am. Chem. - 1946. - Soc. 68. - P.2714-2718]. В качестве альгогена использовали уксусную кислоту, которую вводили в виде 0,75% водного раствора внутрибрюшинно в объеме 0,25 мл. Подсчет числа «корчей» начинали сразу после введения и продолжали в течение 10 мин. Исследуемые соединения, аналог по структуре и мефенамовую кислоту вводили за 1 час до альгогена внутрибрюшинно в дозе 50 мг/кг, ортофен вводили в дозе 10 мг/кг. Эффект оценивали по уменьшению в процентах числа «корчей» по сравнению с контрольными животными.
Результаты испытаний представлены в таблице.
Из таблицы 1 видно, что исследованные соединения менее токсичны при внутрибрюшинном введении, чем аналог по структуре (в 1,2-1,4 раз), ортофен (в 29-37 раз) и мефенамовая кислота (в 14-18 раз). По классификации Сидорова Н.К. (1973) [Сидоров Н.К. О классификации токсичности ядов при парентеральных способах введения / Н.К.Сидоров // Токсикология новых промышленных веществ. - М., 1973. - С.47-51] они относятся к практически нетоксичным. Исследуемые соединения показали высокую анальгетическую активность по методике «горячей пластинки» (23,2-29,6 сек) и по методике «уксусных корчей» (58,5-72,9%). Соединение I превосходит по анальгетической активности эталонные препараты, а соединения II и III - на уровне аналога по структуре, но выше, чем у ортофена и мефенамовой кислоты. УШФД (условная широта фармакологического действия) исследуемых соединений в 1,2-1,6 раз превышает УШФД аналога по структуре, в 5,7-7,4 раз УШФД ортофена и в 14,2-18,3 раз УШФД мефенамовой кислоты.
| Таблица | |||||
| Острая токсичность и анальгетическое действие соединений (I, II, III) | |||||
| Соединение | Время оборонительного рефлекса, на пике действия, с | Число «уксусных корчей» | Торможение «уксусных корчей» к контролю, % | Острая токсичность, ЛД50, мг/кг | УШФД |
| I | 29,6±2,87 | 6,0±1,8 | 72,9 | 2125,0 (1770,8÷2520,0) | 42,5 |
| II | 25,8±1,02 | 7,1±2,9 | 68,0 | 2500,0 (2212,4÷2825,0) | 50,0 |
| III | 23,2±0,73 | 9,2±4,6 | 58,5 | 2750,0 (2083,3÷3630,0) | 55,0 |
| (аналог по структуре) | 23,4 | 10,4 | 65,8 | 1720 (1563÷1892) | 34,4 |
| Ортофен | 17,4 | 23,6 | 20,8 | 74,0 (48,8÷112,2) | 7,4 |
| Мефенамовая кислота | 23,8 | 21,4 | 28,1 | 150 (113,0÷198,0) | 3,0 |
Таким образом, бензиламид NН-(4-нитробензоил)-5-йодантраниловой кислоты (I), аллиламид NН-(3-нитробензоил)-5-йодантраниловой кислоты (II) и аллиламид NН-(4-метилбензоил)-5-йодантраниловой кислоты (III) практически нетоксичны и проявляют анальгетическое действие. Следовательно, заявляемые соединения (I, II и III) могут найти применение в медицине в качестве анальгетических лекарственных средств.
Анальгетическое средство, представляющее собой амиды NH-ацил-5-йодантраниловой кислоты общей формулы где: R1=CH2C6H5, R=4-NO2 (I);R1=CH2CH=CH2, R=3-NO2 (II);R1=CH2CH=CH2, R=4-СН3 (III).