Способ стимуляции регенерации дефектов кожи и слизистых оболочек и лекарственное средство для его реализации
Иллюстрации
Показать всеИзобретение относится микробиологии. Описан способ стимуляции регенерации раневых дефектов кожи и слизистых оболочек, заключающийся в местном применении лекарственной формы, содержащей эффективное количество бактериальных липополисахаридов. Представлена лекарственная форма для стимуляции регенерации раневых дефектов кожи и слизистых оболочек, отличающаяся тем, что она выполнена в виде геля и содержит бактериальные липополисахариды, водорастворимое производное целлюлозы, многоатомный спирт, консерванты и воду очищенную при следующем соотношении компонентов в г на 100 г геля: бактериальные липополисахариды 0,002-5,00, водорастворимое производное целлюлозы 1,00-10,00, многоатомный спирт 2,00-15,00, консерванты 0,0001-1,00, вода очищенная до 100,00. Изобретение расширяет арсенал средств и методов, позволяющих регенерировать раневые дефекты. 2 н. и 8 з.п. ф-лы, 7 ил., 7 пр.
Реферат
Способ стимуляции регенерации раневых дефектов кожи и слизистых оболочек и лекарственное средство для его реализации.
Изобретение относится к медицине и фармакологии, а именно к способам стимуляции регенерации (способности индуцировать и/или ускорять процессы регенерации) кожи и слизистых оболочек, а также к лекарственным средствам, обладающим многофакторным воздействием на процессы регенерации и воспаления, и может быть использован в хирургии, в том числе в косметической хирургии, дерматологии, косметологии, гинекологии, проктологии, урологии, стоматологии, оториноларингологии.
Известен способ профилактики и лечения инфекций роговицы глаз с использованием липополисахаридов Pseudomonas aeruginosa (Патент США №6984622). Недостатком указанного способа является ограниченная область применения (офтальмология). Кроме того, к недостаткам данного способа можно отнести недостаточную эффективность, связанную с особенностями химической структуры липополисахаридов Pseudomonas aeruginosa.
Известно лекарственное средство «Пирогенал», содержащее бактериальный липополисахариды Salmonella typhi, предназначенное для системного введения и выпускаемое в виде растворов для инъекций, а также в виде ректальных свечей, применяемое для терапии хронических заболеваний печени, хронических простатитов и уретритов, воспалительных процессов придатков матки, бесплодия, спаечной болезни брюшной полости, псориаза и других заболеваний (патент РФ 2139043). Механизм действия препарата связан с активацией врожденного иммунного ответа, что сопровождается пирогенным эффектом (гипертермией, повышением температуры тела). При терапии раневых дефектов кожи и/или слизистых оболочек системный способ введения не является целесообразным, т.к. невозможно при системном введении, учитывая высокую скорость метаболизма данного соединения, обеспечить достижение терапевтических концентраций липополисахаридов в области раневого дефекта. К недостаткам также относится наличие пирогенного эффекта.
Известен способ лечения ран, состоящий в использовании свободного от альбумина экстракта крови телят (Патент США №4177261). Известен гель «Солкосерил», в котором в качестве активного компонента используется депротеинизированный гемодиализат, содержащий низкомолекулярные компоненты клеточной массы и сыворотки крови молочных телят (Справочник VIDAL. Лекарственные препараты в России: Справочник. М.: АстраФармСервис, 2010. 1728 с. - с.Б-1173). Применяется как стимулятор процессов регенерации. К недостаткам данного способа можно отнести трудность стандартизации препарата ввиду сложности состава действующих веществ, представленных широким спектром разнообразных химических соединений, а также недостаточную эффективность. Недостатком данного способа также является потенциальная небезопасность препарата для пациентов, заключающаяся в возможной контаминации препарата возбудителями заболеваний, которые могут присутствовать в крови крупного рогатого скота (например, вирусы губчатой энцефалопатии).
Задачей изобретения является повышение эффективности терапии раневых дефектов кожи и слизистых оболочек различной этиологии и локализации, увеличение безопасности терапии, обеспечение возможности стандартизации содержания действующего вещества в препарате, а также создание высокоэффективного с точки зрения биологической доступности лекарственного средства, обладающего многофакторным терапевтическим действием на воспалительные и регенерационные процессы раневых дефектов.
Поставленная задача достигается за счет того, что способ стимуляции регенерации раневых дефектов кожи и слизистых оболочек, осуществляется путем местного применения лекарственной формы, содержащей эффективное количество бактериальных липополисахаридов. Продуцентом указанных бактериальных липополисахаридов является Salmonella typhi, либо Escherichia coli. При этом заявляемый способ используют для стимуляции регенерации раневых дефектов кожи и слизистых оболочек различной этиологии и локализации. Концентрация бактериальных липополисахаридов находится в диапазоне 0,002-5,0 г на 100 г лекарственной формы. Бактериальные липополисахариды и вспомогательные вещества содержатся в фармацевтически приемлемом носителе, адаптированном для местного применения. Лекарственная форма, содержащая эффективное количество бактериальных липополисахаридов, выполнена в виде геля и содержит бактериальные липополисахариды, водорастворимое производное целлюлозы, многоатомный спирт, консерванты и воду очищенную при следующем соотношении компонентов в г на 100 г геля:
| Бактериальные липополисахариды | 0,002-5,00 |
| Водорастворимое производное целлюлозы | 1,00-10,00 |
| Многоатомный спирт | 2,00-15,00 |
| Консерванты | 0,0001-1,00 |
| Вода очищенная | До 100,00 |
в качестве водорастворимого производного целлюлозы используют натриевую соль карбоксиметилцеллюлозы, в качестве многоатомного спирта используют глицерин, либо пропиленгликоль, а в качестве консерванта используют нипагин, либо нипазол, либо нипагин и нипазол.
Бактериальные липополисахариды и вспомогательные вещества, содержащиеся в фармацевтическом носителе, могут быть использованы в виде раствора для местного применения, раствора для полоскания, геля, крема, пасты, мази, линимента, трансдермальной терапевтической системы, пластыря, пудры, присыпки, клея, порошка, примочек, суспензии, лосьона, бальзама, шампуня, аэрозоля, спрея, таблеток для рассасывания в полости рта, пастилок для рассасывания в полости рта, вагинальных таблеток, вагинальных суппозиториев, интраназальных, глазных и ушных капель, глазных пленок, ушных свечей, перевязочных средств.
Сущность изобретения заключается следующем.
Предлагаемый способ лечения состоит в местном применении на область раневого дефекта кожи или слизистой оболочки с использованием терапевтически обоснованной схемы лекарственной формы, которая в качестве действующего активного компонента содержит бактериальные липополисахариды. Продуцентом указанных бактериальных липополисахаридов является Salmonella typhi, либо Escherichia coli. При этом заявляемый способ используют для стимуляции регенерации раневых дефектов кожи и слизистых оболочек различной этиологии и локализации. Повышение эффективности лечения раневых дефектов кожи и слизистых оболочек достигается многофакторным влиянием бактериальных липополисахаридов при местном применении на процессы воспаления, санации и регенерации. Эффекты местного применения бактериальных липополисахаридов заключаются в активации системы врожденного иммунного ответа, что обусловливает его местное антибактериальное и противовирусное действие, в санации раны от некротизированных тканей вследствие стимуляции секреции ряда ферментов и усиления процесса фагоцитоза, а также в стимуляции процессов регенерации путем усиления секреции биологически активных веществ, что обусловливает его регенерационный эффект. Увеличение безопасности терапии достигается отсутствием в препарате компонентов животного происхождения. Расширение области применения достигается путем использования лекарственных форм для терапии раневых дефектов кожи и слизистых оболочек различной этиологии и локализации, адаптированных для местного применения. Возможность стандартизации препарата достигается использованием в качестве действующего компонента схожих по химической структуре и биологическим свойствам веществ - бактериальных липополисахаридов.
Средство выполнено в виде геля и содержит бактериальные липополисахариды, водорастворимое производное целлюлозы, многоатомный спирт (глицерин или пропиленгликоль), консерванты и воду очищенную при следующем соотношении компонентов в г на 100 г геля:
| Бактериальные липополисахариды | 0,002-5,00 |
| Водорастворимое производное целлюлозы | 1,00-10,00 |
| Многоатомный спирт | 2,00-15,00 |
| Консерванты | 0,0001-1,00 |
| Вода очищенная | До 100,00 |
Бактериальные липополисахариды (ЛПС) представляют собой биомолекулы, состоящие из ковалентно соединенных липидной и полисахаридной частей. ЛПС являются основным компонентом наружной мембраны клеточной стенки грамотрицательных бактерий, обеспечивающих структурную целостность микроорганизмов.
ЛПС вызывают сложный гуморальный и клеточный ответ иммунной системы макроорганизма, опосредованный толл-подобным рецептором 4 (TLR-4). Согласно современным представлениям, механизм действия ЛПС заключается в следующем. После связывания молекул ЛПС с внеклеточными доменами TLR-4 происходит димеризация соседних рецепторов, что приводит к изменению конформации внутриклеточных доменов. Изменение конформации последних приводит к появлению сайтов связывания для адапторных молекул, рекрутирование и активация которых запускает каскад реакций, приводящих в конечном итоге к активации ряда транскрипционных факторов. Транскрипционные факторы изменяют экспрессию множества генов, продукты которых участвуют в ответе макроорганизма на присутствие микроорганизма или его структурных молекул. Известно также, что TLR-4 участвует в процессах активации и дифференцировки дендритных клеток, а также В- и Т-лимфоцитов.
Местное применение ЛПС способствует уменьшению микробной контаминации раневых дефектов, а также стимулирует процесс заживления. Этот эффект основан на способности ЛПС изменять (повышать) реактивность иммунной системы и неспецифических факторов защиты макроорганизма.
Антибактериальный эффект ЛПС обусловлен секрецией клетками макроорганизма в ответ на применение ЛПС эндогенных антимикробных факторов, таких как дефензины (присоединяются к клеточной мембране патогена и углубляются в нее, формируя поры), лизоцим (разрушает клеточные оболочки бактерий путем гидролиза мурамилглюкозамина клеточной стенки), перфорины (вызывают образование пор в цитоплазматической мембране бактерий), лактоферрин (связывает железо и лишает бактериальную микрофлору необходимого для ее роста и жизнедеятельности микроэлемента), а также активные формы кислорода и оксид азота, проявляющие антимикробную активность и стимулирующие процессы фагоцитоза. ЛПС активируют систему комплемента, что приводит к стимуляции фагоцитоза за счет опсонизации бактерий, а также к усилению цитотоксической функции.
Противовирусный эффект ЛПС связан с индукцией секреции эндогенных интерферонов β и γ, подавляющих синтез вирусных белков и препятствующих репликации вируса. Кроме того, интерферон γ стимулирует клеточный иммунный ответ.
Эффект санации раны от некротизированных тканей при применении ЛПС связан с секрецией ряда ферментов, таких как коллагеназа и эластаза, обеспечивающих ферментативную деструкцию некротизированных тканей, а также со стимуляцией процесса фагоцитоза, связанного с поглощением и элиминацией клеточного детрита.
Регенерационный эффект ЛПС опосредован стимуляцией секреции ряда факторов, регулирующих процессы регенерации и развития соединительной ткани:
основной фактор роста фибробластов (basic fibroblast growth factor, bFGF) стимулирует процессы ангиогенеза в раневом дефекте, пролиферацию и дифференцировку различных типов клеток в ране, осуществляет хемотаксис фибробластов и кератиноцитов, а также стимулирует продукцию фибробластами компонентов внеклеточного матрикса (фибронектина и коллагена);
васкулярный эндотелиальный фактор роста (vascular endothelial growth factor, VEGF) стимулирует процесс ангиогенеза в раневом дефекте (пролиферации, миграции эндотелиальных клеток и образовании новых кровеносных сосудов);
трансформирующий фактор роста β (transforming growth factor beta, TGF-β) стимулирует процессы пролиферации, дифференцировки и апопотоза различных типов клеток соединительной ткани, стимулирует хемотаксис фибробластов и продукцию ими коллагена и фибронектина;
эпидермальный фактор роста (epidermal growth factor, EGF) стимулирует процессы пролиферации и дифференцировки различных эпидермальных и эпителиальных клеток, в том числе фибробластов и кератиноцитов, является хемоаттрактантом для указанных типов клеток, стимулирует процесс ангиогенеза;
а также ряд других факторов, участвующих в процессах пролиферации, дифференцировки, миграции и апоптоза различных клеток при регенерации поврежденных тканей.
Таким образом, местное применение ЛПС оказывает комплексное терапевтическое воздействие на раневый процесс, состоящее в снижении микробной контаминации; стимуляции процесса очистки раны от некротизированных тканей; стимуляции регенерации.
В качестве терапевтических концентраций бактериальных липополисахаридов в лекарственной форме выбран диапазон 0,002-5,00 г в 100 г формы. Диапазон определен на основании экспериментальных данных и литературных сведений (Крайцеров Б.В. Концептуальный подход к пиротерапии с позиции теории стресса. М.: Лабиринт, 2001. - 560 с.).
Для терапии раневых дефектов, преимущественно ран в течение второй фазы раневого процесса предлагается использовать гель на гидрофильной основе, содержащий в качестве активного компонента ЛПС. В качестве гидрофильной основы предлагается использование водорастворимых производных целлюлозы, например натриевая соль карбоксиметилцеллюлозы (натрия кармеллоза) (Монография 01/2008:0472 Европейской Фармакопеи European Pharmacopoeia 6.0, Strasbourg, 2008. Том 2. Стр.1423-1424).
Преимущества данных основ:
- обладают ранозаживляющим действием;
- создают на поверхности раны пленку, защищающую рану от воздействия факторов окружающей среды, в том числе от микробной контаминации;
- обладают слабым осмотическим действием;
- не препятствуют газообмену;
- гипоаллергенны.
Для предлагаемого состава лекарственной формы с учетом природы и свойств входящих в нее ингредиентов разработана технология приготовления, состоящая из следующих последовательных этапов: растворение ЛПС в воде очищенной; введение в полученный раствор консервантов, например нипагина-метилпарагидроксибензоат, нипагин (Монография 01/2008:0409 Европейской Фармакопеи European Pharmacopoeia 6.0, Strasbourg, 2008. Том 2. Стр.2391-2392) и нипазола-пропилпарагидроксибензоат, нипазол (Монография 01/2008:0431 Европейской Фармакопеи European Pharmacopoeia 6.0, Strasbourg, 2008. Том 2. Стр.2772-2773). Нипагин и нипазол являются известными консервантами, разрешенными для использования в фармацевтическорй промышленности при изготовлении лекарственных форм (Государственная Фармакопея СССР. 11 издание. М.: Медицина, 1990. Вып.2, стр.162) - (раствор А); приготовление геля водорастворимого производного целлюлозы; смешивание и гомогенизация раствора А, геля и многоатомного спирта, в качестве которого использован, например, глицерин (Монография 01/2008:0496 Европейской Фармакопеи European Pharmacopoeia 6.0, Strasbourg, 2008. Том 2. Стр.1987-1988), либо пропиленгликоль (Монография 01/2008:0430 Европейской Фармакопеи European Pharmacopoeia 6.0, Strasbourg, 2008. Том 2. Стр.2773-2774).
1-й этап. В воде очищенной растворяют ЛПС при перемешивании. В полученный раствор при перемешивании вводят консерванты, перемешивание продолжают до полного растворения консервантов (раствор А).
2-й этап. Готовят гель водорастворимого производного целлюлозы. Для этого к воде очищенной, нагретой до 50-70°С, добавляют навеску водорастворимого производного целлюлозы, оставляют до набухания (1,5-2 часа), а затем тщательно перемешивают.
3-й этап. Гель водорастворимого производного целлюлозы соединяют с раствором А, добавляют многоатомный спирт и гомогенизируют до получения однородного геля.
Пример 1. Получение геля.
В 50 г воды очищенной при перемешивании растворяют 0,20 г ЛПС. В полученный раствор вводят при перемешивании 0,08 г нипагина и 0,02 г нипазола, перемешивание продолжают до полного растворения консервантов (раствор А). К 30 г воды очищенной, нагретой до 50-70°С, добавляют 5,00 г натриевой соли карбоксиметилцеллюлозы и оставляют на 1,5-2 часа до набухания, затем тщательно перемешивают. Гель натриевой соли карбоксиметилцеллюлозы соединяют с раствором А, добавляют 10,00 г глицерина и 4,70 г воды очищенной и гомогенизируют до получения однородного геля.
Полученный гель сохраняет стабильность в течение трех лет по ряду показателей: реологическая и микробиологическая стабильность, специфическая активность и т.д.
Рядом исследований установлено, что липополисахариды бактерий рода Salmonella обладают биологической активностью, практически эквивалентной биологической активности липополисахаридов Е. coli (Структура и функция липополисахаридов, обзорная статья, с.846, «Structure and function of lipopolysaccharides» Erridge C., Bennett-Guerrero Е., Poxton I.R. // Microbes and Infection. 2002 Jul; 4(8):837-851.)
Дальнейшие исследования проведены при использовании липополисахаридов бактерий рода Salmonella.
Пример 2. Оценка эффективности предлагаемого способа. Биомеханические испытания.
Прочность раневого дефекта является показателем, характеризующим общую степень заживления раны, косвенно характеризующим процессы пролиферации фибробластов и коллагенообразования.
В эксперименте использованы мыши-аутбреды линии ICR, самцы весом 26-30 г, в количестве 95 особей. Животные прошли акклиматизацию в течение 10 дней. Механическая депиляция была проведена триммером для животных Oster Mark II (США). Животные были анестезированы с помощью золетило-ксилазинового наркоза (45 мг/кг золетила и 7,5 мг/кг ксилазина внутримышечно). Операционное поле было обработано 70% этанолом. На спине животных вдоль линии хребта при помощи скальпеля были иссечены эпидермис, дермис и подкожная клетчатка до фасции так, чтобы создать разрез длиной 4 см. Раневый дефект был зашит двумя швами при помощи полиамидного шовного материала «Поликон». После операции животные были распределены по группам в случайном порядке и размещены в клетках индивидуально. Животным был предоставлен свободный доступ к корму и воде. Терапия начата в первый постоперационный день и заключалась в ежедневном местном нанесении на область раны по 150 мкл соответствующего препарата.
Группы животных, участвующие в эксперименте:
контрольные группы, в том числе: С1 - условно интактные животные (с животными проведены все указанные манипуляции, за исключением хирургических операций и терапии), количество животных - 5; группа С2 - с животными проведены все указанные выше манипуляции, за исключением терапии, количество животных - 15; группа С3 - с животными проведены все указанные выше манипуляции, терапия плацебо (гелем указанного выше состава и способа изготовления, но без содержания ЛПС), количество животных - 15; группа С4 - с животными проведены все указанные выше манипуляции, терапия препаратом сравнения - лекарственной формой «Солксосерил гель» производства Валеант Фармасьютикалс Швейцария ГмбХ, Швейцария;
тест-группы, в том числе: Т1 - с животными проведены все указанные выше манипуляции, терапия гелем, содержащим ЛПС Salmonella typhi в концентрации 0,2 мг/г лекарственной формы; Т2 - с животными проведены все указанные выше манипуляции, терапия гелем, содержащим ЛПС Salmonella typhi в концентрации 2 мг/г лекарственной формы; Т3 - с животными проведены все указанные выше манипуляции, терапия гелем, содержащим ЛПС Salmonella typhi в концентрации 10 мг/г лекарственной формы.
По пять животных из каждой группы (за исключением группы С4) были выведены из эксперимента в 7-й, 14-й и 21-й дни эксперимента. Животные группы С4 были выведены из эксперимента в 7-й день.
Биомеханические испытания были проведены по методике, представленной в публикации The effect of topical tretinoin on tissue strength and skin components in a murine incisional wound model. Muehlberger Т., Moresi J.M., Schwarze H., Hristopoulos G., Laenger F., Wong L. // Journal of the American Academy of Dermatology, 2005 Apr 52(4):583-588.
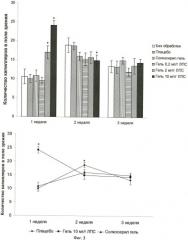
Для сравнительных испытаний были использованы: плацебо, заявляемый гель, содержащий бактериальные липополисахариды, лекарственная форма «Солкосерил гель». Полученные данные биомеханических испытаний представлены на фиг.1, где Н - сила, необходимая для разрыва раневого дефекта. Данные представлены для всех групп в виде гистограммы, а для групп С3, С4 и Т3 - также в виде графика. На фигуре представлены значения в формате: «среднее значение ± стандартное отклонение». *р<0.05 по сравнению с группой плацебо, вычислено с использованием критерия Стьюдента.
Кожа животных, содержащая раневый дефект, была разрезана на полоски длиной 3 см и шириной 0,5 см, при этом раневый дефект был расположен в центре полоски перпендикулярно наибольшему размеру. Полоски кожи были помещены в фосфатно-буферный изотонический раствор, содержащий антибиотики на 12 часов до проведения испытаний. Испытания были проведены на установке Instron 5848 Microtester (Англия) с использованием датчика на 50 Н. Расстояние между зажимами составляла 20 мм, скорость движения нижнего зажима 1 см/мин, при этом верхний зажим оставался неподвижным. Фиксировалось сила, необходимая для разрыва полоски кожи по раневому дефекту.
Представленные данные свидетельствуют об увеличении силы, необходимой для разрыва раневого дефекта при терапии согласно предлагаемому способу (гель в дозировке 2 мг/г и 10 мг/г) на всех сроках эксперимента по сравнению с терапией плацебо и терапией лекарственной формой «Солкосерил гель».
Пример 3. Оценка эффективности предлагаемого способа. Оценка процесса воспаления в раневом дефекте.
Воспаление - необходимый этап процесса заживления, однако продолжительное воспаление может приводить к задержке регенерации раневых дефектов.
Условия эксперимента указаны в примере 2.
Оценка процесса воспаления была проведена по методике, представленной в публикации "Влияние местного применения третиноина на прочность тканей и компоненты кожи на мышиной модели резаных ран». The effect of topical tretinoin on tissue strength and skin components in a murine incisional wound model. Muehlberger Т., Moresi J.M., Schwarze H., Hristopoulos G., Laenger F., Wong L. // Journal of the American Academy of Dermatology, 2005, 52(4):583-588.
Кожа животных средней части раны была разрезана на полоски длиной 3 см и шириной 1 см, при этом раневый дефект был расположен в центре полоски перпендикулярно наибольшему размеру. Материал был подвергнут гистологическому исследованию. Полоски кожи были фиксированы в 10% формалине. Проводка образцов осуществлялась по стандартной методике. При изготовлении парафиновых блоков материал был ориентирован так, чтобы поверхность среза была перпендикулярна длиннику раневого дефекта. Гистологическое исследование образцов осуществлялось на парафиновых срезах толщиной 4 мкм, окрашенных гематоксилином и эозином по стандартной методике. При гистологическом исследовании оценивался процесс воспаления в раневом дефекте.
Через неделю после нанесения ран в группах С2 и С3 наблюдались ярко выраженные воспалительные явления. Отмечалось наличие язвенных дефектов эпидермиса с дном, образованным некротическим детритом, отграниченных от окружающей ткани лейкоцитарным валом. В формирующейся рубцовой ткани отмечалось значительное количество гистиоцитов и нейтрофильных лейкоцитов. В группах С4, Т1, Т2, Т3 наблюдалось меньшее количество гистиоцитов и отсутствие нейтрофильных лейкоцитов в рубцовой ткани. Через две недели воспалительные изменения присутствовали только у отдельных животных групп С2 и С3, в группах С4, Т1, Т2, Т3 воспалительные явления отсутствовали. К третьей неделе отмечалось отсутствие воспалительных явлений во всех группах.
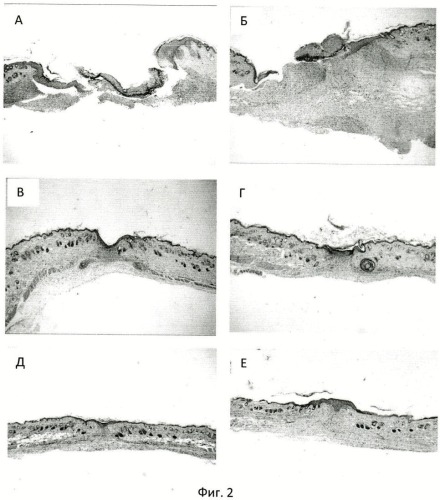
Репрезентативные фотографии гистологических срезов представлены на фиг.2 - оценка процесса воспаления в раневом дефекте. Временная точка - первая неделя эксперимента. Окраска по гематоксилин-эозином. Увеличение в 40 раз. Где А - без терапии, Б - терапия плацебо, В - терапия гелем «Солкосерил», Г - терапия заявленным гелем 0,2 мг/г ЛПС, Д - терапия заявленным гелем 2 мг/г ЛПС, Е - терапия заявленным гелем 10 мг/г ЛПС
Представленные данные свидетельствуют, что использование терапии по предлагаемому способу (гель в дозировке 0,2 мг/г, 2 мг/г и 10 мг/г) способствует быстрому завершению процесса воспаления.
Пример 4. Оценка эффективности предлагаемого способа. Оценка процесса ангиогенеза в раневом дефекте.
Условия эксперимента указаны в примере 2.
Ангиогенез необходим для заживления ран на ранних этапах раневого процесса. Образующиеся капилляры обеспечивают снабжение области раны кровью, кислородом и питательными веществами.
Оценка процесса ангиогенеза была проведена по методике, представленной в публикации «Синтетический аналог мочевой кислоты ускоряет заживление ран кожи у мышей». А synthetic uric acid analog accelerates cutaneous wound healing in mice. Chigurupati S., Mughal M.R., Chan S.L, Arumugam T.V., Baharani A., Tang S.C., Yu Q.S., Holloway H.W., Wheeler R., Poosala S., Greig N.H., Mattson M.P. // PLoS One. 2010 6; 5(4):e10044.
Кожа животных средней части раны была разрезана на полоски длиной 3 см и шириной 1 см, при этом раневый дефект был расположен в центре полоски перпендикулярно наибольшему размеру. Полоски кожи были фиксированы в 10% формалине. Материал был подвергнут гистологическому исследованию. Проводка образцов осуществлялась по стандартной методике. При изготовлении парафиновых блоков материал был ориентирован так, чтобы поверхность среза была перпендикулярна длиннику раневого дефекта. Гистологическое исследование образцов осуществлялось на парафиновых срезах толщиной 4 мкм, окрашенных гематоксилином и эозином по стандартной методике. При гистологическом исследовании оценивались следующий критерий: количество капилляров в одном поле зрения при увеличении ×400. Кровеносный сосуд не учитывался в качестве капилляра, если имел эластиновую мембрану, клетки гладкой мускулатуры или более трех эритроцитов в просвете.
Полученные данные представлены на фиг.3 - оценка процесса ангиогенеза в раневом дефекте. Данные представлены для всех групп в виде гистограммы, а для групп С3, С4 и Т3 - также в виде графика. На фигуре представлены значения в формате: «среднее значение ± стандартное отклонение». *р<0.05 по сравнению с группой плацебо, вычислено с использованием критерия Стьюдента.
Согласно полученным данным, использование терапии (гель в дозировке 2 мг/г и 10 мг/г) по предлагаемому способу способствует процессу ангиогенеза на ранних сроках заживления ран, в то время как с использованием препарата сравнения и при терапии плацебо максимальное количество капилляров в раневом дефекте наблюдалось только через две недели после нанесения раны.
Пример 5. Оценка эффективности предлагаемого способа. Оценка процесса фиброплазии в раневом дефекте.
Фиброплазия необходима на ранних этапах раневого процесса. Активированные фибробласты участвуют в процессе коллагенообразования, а также секретируют ряд регуляторных молекул. В то же время присутствие фибробластов на поздних сроках нежелательно, так как это свидетельствует о задержке регенерации и связано с образованием грубого рубца.
Условия эксперимента указаны в примере 2.
Оценка процесса фиброплазии проведена по методике, представленной в публикации «Терапевтические эффекты местного применения озона на заживление ран кожи». Therapeutic effects of topical application of ozone on acute cutaneous wound healing. Kim M.S., Noh S.U., Han Y.W., Kim K.M., Kang H, Kim H.O., Park Y.M. Journal of Korean medical science. 2009, 24(3):368-374.
Кожа животных средней части раны была разрезана на полоски длиной 3 см и шириной 1 см, при этом раневый дефект был расположен в центре полоски перпендикулярно наибольшему размеру. Полоски кожи были фиксированы в 10% формалине. Материал был подвергнут гистологическому исследованию. Проводка образцов осуществлялась по стандартной методике. При изготовлении парафиновых блоков материал был ориентирован так, чтобы поверхность среза была перпендикулярна длиннику раневого дефекта. Гистологическое исследование образцов осуществлялось на парафиновых срезах толщиной 4 мкм, окрашенных гематоксилином и эозином по стандартной методике. При гистологическом исследовании оценивались следующий критерий: суммарное количество фибробластов и фиброцитов в одном поле зрения при увеличении ×400.
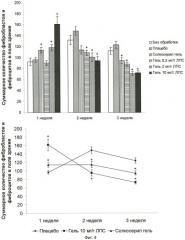
Полученные данные представлены на фиг.4 - оценка процесса фиброплазии в раневом дефекте. Данные представлены для всех групп в виде гистограммы, а для групп С3, С4 и Т3 - также в виде графика. На фигуре представлены значения в формате: «среднее значение ± стандартное отклонение». *р<0.05 по сравнению с группой плацебо, вычислено с использованием критерия Стьюдента.
Согласно полученным данным, использование терапии по предлагаемому способу (гель в дозировке 2 мг/г и 10 мг/г) способствует процессу фиброплазии на ранних сроках заживления ран (первая неделя), при этом на второй и третьей неделе количество фибробластов и фиброцитов резко снижается. При терапии препаратом сравнения данный эффект выражен слабее. При использовании плацебо максимум фиброплазии приходится на вторую неделю, при этом количество фибробластов и фиброцитов к концу третьей неделе остается высоким, что может свидетельствовать о задержке процесса регенерации.
Пример 6. Оценка эффективности предлагаемого способа. Оценка процесса образования коллагена в раневом дефекте.
Процесс коллагенообразования является ключевым процессом заживления ран.
Условия эксперимента указаны в примере 2.
Оценка процесса образования коллагена проведена по методике, представленной в публикации «Терапевтические эффекты местного применения озона на заживление ран кожи». Therapeutic effects of topical application of ozone on acute cutaneous wound healing. Kim H.S., Noh S.U., Han Y.W., Kim K.M., Kang H., Kim H.O., Park Y.M. Journal of Korean medical science. 2009, 24(3):368-374.
Кожа животных средней части раны была разрезана на полоски длиной 3 см и шириной 1 см, при этом раневый дефект был расположен в центре полоски перпендикулярно наибольшему размеру. Полоски кожи были фиксированы в 10% формалине. Материал был подвергнут гистологическому исследованию. Проводка образцов осуществлялась по стандартной методике. При изготовлении парафиновых блоков материал был ориентирован так, чтобы поверхность среза была перпендикулярна длиннику раневого дефекта. Гистологическое исследование образцов осуществлялось на парафиновых срезах толщиной 4 мкм, окрашенных по Массону по стандартной методике. При гистологическом исследовании оценивались следующие критерии: морфология и интенсивность окраски коллагеновых волокон.
На образцах первой недели интенсивность окраски коллагеновых волокон снижена для всех оперированных групп. На образцах второй недели для групп Т2 и Т3 отмечается появление больших по диаметру, расположенных параллельно поверхности эпидермиса коллагеновых волокон, имеющих более интенсивную окраску по Массону, по сравнению с остальными оперированными группами. На образцах третьей недели при окраске по Массону отмечается наличие коллагеновых волокон, имеющих одинаковую с волокнами дермы вне раневого дефекта интенсивность окраски и толщину. Данные изменения наиболее выражены в группах Т2 и ТЗ.
Репрезентативные фотографии гистологических срезов представлены на фиг.5. и фиг.6.
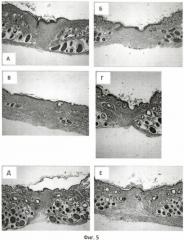
Фиг.5 - оценка процесса образования коллагена в раневом дефекте. Окраска по Массону. Увеличение ×100, временная точка - вторая неделя эксперимента. Где А - без терапии, Б - терапия плацебо, В - терапия гелем «Солкосерил», Г - терапия заявленным гелем 0,2 мг/г ЛПС, Д - терапия заявленным гелем 2 мг/г ЛПС, Е - терапия заявленным гелем 10 мг/г ЛПС
Фиг.6. Оценка процесса образования коллагена в раневом дефекте.
Временная точка - третья неделя эксперимента. Окраска по Массону. Увеличение ×100. Где А - без терапии, Б - терапия плацебо, В - терапия гелем «Солкосерил», Г - терапия заявленным гелем 0,2 мг/г ЛПС, Д - терапия заявленным гелем 2 мг/г ЛПС, Е - терапия заявленным гелем 10 мг/г ЛПС
Представленные данные свидетельствуют, что использование терапии (гель в дозировке 2 мг/г и 10 мг/г) по предлагаемому способу стимулирует процессы коллагенообразования в раневом дефекте.
Пример 7. Оценка эффективности предлагаемого способа. Оценка процесса эпителизации раневого дефекта.
Динамика процесса эпителизации, состоящего в образовании эпителия в месте повреждения кожи или слизистой оболочки, является важной характеристикой скорости регенерации.
Условия эксперимента указаны в примере 2.
Оценка процесса эпителизации проведена по методике, представленной в публикации "Влияние местного применения третиноина на прочность тканей и компоненты кожи на мышиной модели резаных ран». The effect of topical tretinoin on tissue strength and skin components in a murine incisional wound model. Muehlberger Т., Moresi J.M., Schwarze H., Hristopoulos G., Laenger F., Wong L. // Journal of the American Academy of Dermatology, 2005, 52(4):583-588.
Кожа животных средней части раны была разрезана на полоски длиной 3 см и шириной 1 см, при этом раневый дефект был расположен в центре полоски перпендикулярно наибольшему размеру. Материал был подвергнут гистологическому исследованию. Полоски кожи были фиксированы в 10% формалине. Проводка образцов осуществлялась по стандартной методике. При изготовлении парафиновых блоков материал был ориентирован так, чтобы поверхность среза была перпендикулярна длиннику раневого дефекта. Гистологическое исследование образцов осуществлялось на парафиновых срезах толщиной 4 мкм, окрашенных гематоксилином и эозином по стандартной методике. При гистологическом исследовании оценивался следующий критерий: толщина эпидермиса в зоне раневого дефекта.
Через неделю после нанесения ран в группах С4, Т1, Т2, Т3 отмечалась полная эпителизация раневого дефекта акантотически утолщенным эпидермисом, в то время как в группах С2 и С3 наблюдались язвенные дефекты эпидермиса. Через две недели в группах С2, С3 и С4 отмечалось наличие акантотически утолщенного эпидермиса, в то время как в группах Т1, Т2, Т3 количество слоев эпидермиса составляло 2-3 слоя, что соответствует толщине эпидермиса интактных животных (группа С1). К третьей неделе количество слоев эпидермиса во всех группах составляло 2-3 слоя, что соответствует толщине эпидермиса интактных животных (группа С1).
Представленные данные свидетельствуют, что использование терапии по предлагаемому способу (гель в дозировке 0,2 мг/г, 2 мг/г и 10 мг/г) стимулирует процессы эпителизации раневого дефекта.
Пример 8. Оценка безопасности предлагаемого способа.
Оценка безопасности предлагаемого способа была проведена с использованием общепринятых методов (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ» М.: ОАО «Издательство «Медицина», 2005. 832 с.). Для данного исследования были выбраны мыши как вид, общепринятый для исследований безопасности. Использовались мыши-аутбреды CD1. Количество животных в каждой группе составляло 10 особей, с тем, чтобы оценить характер и частоту проявления токсических эффектов и подвергнуть результаты экспериментов статистической обработке. Группы животных, участвовавших в эксперименте: А - нанесение геля, содержащего ЛПС Salmonella typhi в концентрации 10 мг/г лекарственной формы; Б - нанесение геля, содержащего ЛПС Salmonella typhi в концентрации 50 мг/г лекарственной формы; В - нанесение плацебо (геля указанного выше состава и способа изготовления, но без содержания ЛПС). Нанесение препаратов осуществлялось на предварительно выбритую кожу мышей один раз в сутки в течение 14 дней. Ежедневно фиксировалась масса тела животных, а также потребление корма и воды. Клинический осмотр каждого животного проводился в течение первого часа после первого нанесения препарата и далее ежедневно для регистрации признаков интоксикации, оценки поведения и общего состояния животных. При некропсии было проведено макроскопическое и гравиметрическое (взвешивание) изучение следующих органов: надпочечники, головной мозг, придатки семенников, сердце, почки, печень, легкие, селезенка, семенники/яичники, тимус. У каждого вскрытого животного были отобраны органы и ткани (печень, почки, сердце, тимус, селезенка, лимфатические узлы, место нанесения препарата (кожа)), и зафиксированы в 10% формалине. В дальнейшем гистологические срезы указанных органов и тканей были окрашены гематоксилином и эозином. Материал был подвергнут гистологическому исследованию.
Согласно полученным результатам, не были обнаружены значимые отклонения показателей экспериментальных и контрольной групп по исследуемым параметрам. В соответствии с данными гистологических исследований, патологических изменений исследованных органов/тканей животных, получавших гель ЛПС в концентрации 10 мг/г и 50 мг/г, не было обнаружено.
Фиг.7. Оценка безопасности накожного нанесения геля ЛПС с концентрацией 50 мг/г. Фотографии репрезентативных гистологических с