Способы получения симвастатина
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описаны способы получения симвастатина. В одном варианте способ осуществляют путем взаимодействия монаколина J и ацилтиоэфира, который отдает ацильную группу С8-гидроксильной группе монаколина J в присутствии ацилтрансферазы LovD; и ацилтрансферазы LovD и региоселективного ацилирования С8-гидроксильной группы монаколина J ацилтрансферазой LovD, использующей ацильную группу ацилтиоэфира. Во втором варианте - путем взаимодействия ловастатина и ацилтиоэфира, который отдает ацильную группу С8-гидроксильной группе монаколина J в присутствии ацилтрансферазы LovD и ацилтрансферазы LovD и воздействия ацилтрансферазы LovD, приводящего к гидролизу ловастатина до монаколина J и использованию ацильной группы ацилтиоэфира для региоселективного ацилирования С8-гидроксильной группе монаколина J. Изобретение расширяет арсенал средств получения симвастатина. 2 н. и 10 з.п. ф-лы, 24 ил., 5 табл., 4 пр.
Реферат
Перекрестная ссылка на связанные заявки
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 60/808088, поданной 24 мая 2006 г., все содержание которой включено в настоящее описание посредством ссылки.
Область техники, к которой относится изобретение
Изобретение относится к способам и материалам для биосинтеза таких соединений, как симвастатин, включая методики с использованием микроорганизмов-хозяев.
УРОВЕНЬ ТЕХНИКИ
Симвастатин является полусинтетическим производным природного соединения ловастатина, которое может быть выделено из среды культивирования Aspergillus terreus. Ловастатин и симвастатин представляют собой лекарственные средства, понижающие уровень холестерина, которые существенно понижают риск возникновения сердечных заболеваний у взрослых. Ловастатин и симвастатин поставляются фирмой Merck Со. под марками Mevacor и Зокор, соответственно. Симвастатин является более активным производным ловастатина и вторым, наиболее продаваемым препаратом в Соединенных Штатах в 2005 с ожидаемым уровнем продаж в $4,5 миллиардов только в США.
Кластер генов, регулирующих биосинтез ловастатина в А. terreus (см., например, J.Kennedy, К. et. al., Science, 1999, 284, 1368-1372; и C.R.Hutchinson, J. et. al., Antonie Van Leeuwenhoek, 2000, 78, 287-295), был описан ранее (см., например, патент США 6391583, содержание которого включено в настоящее описание посредством ссылки). Кластером генов кодируется белок LovD (46 кДа), который ранее был идентифицирован как гомолог эстеразы. Монаколин J, непосредственный предшественник в биосинтезе ловастатина, собирается расположенной против хода транскрипции мегасинтазой LovB (см., например, L. Hendrickson, C.R. et. al., Chem. Biol. 1999, 6, 429-439), (также известной, как ловастатин нонакетидсинтаза, LNKS), еноилредуктазой LovC и оксигеназами CYP450. Боковая цепь из пяти атомов углерода синтезируется LovF (ловастатин дикетидсинтазой, LDKS) посредством конденсации между ацетил-CoA и малонил-CoA. Конденсированный дикетид подвергается метилированию и восстановительному сшиванию отдельными доменами LovF с получением α-S-метилбутирилтиоэфира, ковалентно связанного с фосфопантетеиновой субъединицей ацилпереносящего белкового домена (ACP) LovF (см., например, J. Kennedy, K. et. al., Science, 1999, 284, 1368-1372 и C. R. Hutchinson, J. et. al., Antonie Van Leeuwenboek 2000, 78, 287-295), в результате из монаколина J образуется Ловастатин. Инактивация либо LovD, либо LovF у A. terreus приводит к накоплению предшественника монаколина J (см., например, J. Kennedy, K. et. al., Science, 1999, 284, 1368-1372 and C. R. Hutchinson, J. et. al., Antonie Van Leeuwenboek 2000, 78, 287-295).
После образования ловастатина, например, посредством ферментации реципиента A. terreus, из ловастатина может быть получен симвастатин. В настоящее время симвастатин является полусинтетическим производным ловастатина. Ловастатин получают в результате ферментации реципиента A. terreus. После очистки соединения полусинтез может быть проведен следующим образом: 1) 2-метилбутиратная боковая цепь может быть гидролизована в присутствии основания с получением в качестве промежуточного соединения монаколина J; 2) лактонизируют свободную кислоту; 3) спиртовую функциональную группу на C13 блокируют защитной группой (такой как трет-бутилдиметилсилильная); 4) этерифицируют доступный спирт C8 ацильным соединением, таким как 2-диметилбутирилхлорид, с получением C13-защищенного варианта симвастатина, и 5) снимают защиты с OH-группы на С13 с получением симвастатина (Фигура 3).
Различные способы многостадийного синтеза симвастатина были описаны ранее (см., например, РСТ WO 2005/066150 и заявки на патент США №№ 20050080275 и 20040068123, содержание которых включено в настоящее описание посредством ссылки). Например, широко используемый способ начинается с гидролиза C8 сложноэфирной группы ловастатина с образованием триола монаколина J с последующим селективным силилированием С13 спирта, этерификацией C8 спирта диметилбутирилхлоридом и снятием защиты с C13 спирта с получением симвастатина (см., например, W. F. Hoffman, et. al., J. Med. Chem. 1986, 29, 849-852). Ферментативные преобразования, применение липаз и эстераз были исследованы как альтернативы химическому синтезу симвастатина (см., например, РСТ WO 2005/040107, РСТ WO 94/26920 и T. G. Schimmel, et. al., Appl. Environ. Microbiol 1997, 63, 1307-1311, содержание которых включено в настоящее описание посредством ссылки). Однако необходимость региоселективной этерификации неизменно требует защиты других гидроксильных групп и часто приводит к снижению общего выхода. Таким образом, специфичный реагент, способный выборочно ацилировать C8-позицию монаколина J, важен для эффективного синтеза симвастатина и дополнительных аналогов статина.
Изменения вышеописанных схем являются обычными, однако большинство методик сначала неизменно требует выделения ловастатина, гидролиза метилбутиратной боковой цепи, защиты свободного спирта, реакции с ацильным соединением и снятия защиты. Хотя используемые химические превращения являются относительно простыми, они неэффективны, включают много стадий и поэтому вносят вклад в текущую высокую стоимость производства симвастатина ($3 за таблетку).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает способы и материалы, разработанные с целью выгодного применения биологических способов получения ловастатина в получении производного ловастатина, симвастатина. Настоящее изобретение также обеспечивает способы и материалы, разработанные с целью выгодного применения биологических способов, посредством которых получают ловастатин, для получения родственных соединений, таких как производное правастатина, хувастатина. Как было указано выше, биологические способы получения ловастатина при ферментации A. terreus известны в уровне техники. В типовых способах получения ловастатина декалиновую основу и группы HMG-CoA, которые воспроизводят фрагменты молекулы ловастатина, синтезируются ловастатин нонакетидсинтазой (LNKS) и тремя дополнительными ферментами in vivo. 2-метилбутиратная боковая цепь синтезируется ловастатин дикетидсинтазой (LDKS) in vivo. 2-метилбутират ковалентно связан с ацил-переносящим доменом LovF посредством тиоэфирной связи (Фигура 6). Затем ацилтрансфераза LovD способна селективно переносить 2-метилбутират на C8-гидроксильную группу от LDKS в одну стадию с получением ловастатина. Как подробно описано ниже, стало возможным получать симвастатин и родственные соединения как in vitro, так и in vivo, посредством управления указанными процессами.
Варианты осуществления настоящего изобретения включают способы получения симвастатина без использования большого количества химических стадий синтеза, которые в настоящее время применяют при получении указанного соединения. Обычные варианты осуществления изобретения не требуют очистки ловастатина на первой стадии с последующими полусинтетическими методиками, и вместо этого используется единственная стадия ферментации с получением в результате симвастатина. Способы, раскрытые в настоящем описании, разработаны так, чтобы ферментационные предприятия, которые в настоящее время производят ловастатин, могли быть переоборудованы для получения симвастатина и родственных соединений с минимальными модификациями. Материалы, используемые в способах, раскрытых в настоящем описании, относительно недороги, а стадии очистки известны из уровня техники и легко осуществляются.
Специалисты, квалифицированные в данной области техники, поймут, что настоящее описание позволяет выполнить большое разнообразие вариантов осуществления изобретения. Типичным вариантом осуществления изобретения является способ получения симвастатина посредством взаимодействия монаколина J; ацилтиоэфира, который отдает ацильную группу C8-гидроксильной группе монаколина J в присутствии ацилтрансферазы LovD; и LovD ацилтрансферазы; с последующим использованием ацилтрансферазой LovD ацильной группы, источником которой является ацилтиоэфир для региоселективного ацилирования C8-гидроксильной группы монаколина J; в результате чего образуется симвастатин. В типовых вариантах осуществления изобретения ацилтрансфераза LovD имеет аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 2. Другим вариантом осуществления изобретения является способ получения симвастатина, включающий стадии взаимодействия ловастатина; ацилтиоэфира, который отдает ацильную группу C8-гидроксильной группе монаколина J в присутствии ацилтрансферазы LovD; и ацилтрансферазы LovD. В данном варианте осуществления настоящего способа ацилтрансфераза LovD гидролизует ловастатин до монаколина J; с последующим региоселективным ацилированием C8-гидроксильной группы монаколина J; в результате чего образуется симвастатин. В некоторых вариантах осуществления симвастатин получают in vitro в отсутствии выделенного организма.
Как подробно описано ниже, способы и материалы изобретения, которые применяются для получения симвастатина, могут быть приспособлены для получения соединений, структурно подобных симвастатину, например хувастатина. В данном контексте один из вариантов осуществления изобретения относится к способу получения хувастатина, включающему стадии взаимодействия гидролизованного правастатина в форме тетраола; ацилтиоэфира, который отдает ацильную группу C8-гидроксильной группе гидролизованного правастатина в форме тетраола в присутствии ацилтрансферазы LovD; и ацилтрансферазы LovD; с последующим региоселективным ацилированием C8-гидроксильной группы гидролизованного правастатина в форме тетраола ацилтрансферазой LovD, переносящей ацильную группу от ацилтиоэфира, в результате чего образуется хувастатин. Другой вариант осуществления изобретения относится к композиции веществ, включающей: гидролизованный правастатин в форме тетраола; ацилтиоэфир, который отдает ацильную группу C8-гидроксильной группе гидролизованного правастатина в форме тетраола в присутствии ацилтрансферазы LovD; ацилтрансферазу LovD; и хувастатин. Таким образом, варианты осуществления изобретения включают способы получения композиции веществ, включающей симвастатин или хувастатин, как по существу раскрыто и подтверждено примерами в настоящем описании.
В некоторых вариантах осуществления изобретения монаколин J, ацилтиоэфир и ацилтрансфераза LovD взаимодействуют в среде культивирования в присутствии выделенного организма, который продуцирует ацилтрансферазу LovD, и где дополнительно организм представляет собой: Escherichia coli, Aspergillus terreus, Monascus ruber, Monascus purpureus, Monascus pilosus, Monascus vitreus, Monascus pubigerus, Candida cariosilognicola, Aspergillus oryzea, Doratomyces stemonitis, Paecilomyces virioti, Penicillum citrinum, Penicillin chrysogenum, Scopulariopsis brevicaulis или Trichoderma viride. Необязательно выделенный организм представляет собой Aspergillus terreus, который экспрессирует полипептид LovD SEQ ID NO: 1. В некоторых вариантах осуществления Aspergillus terreus не экспрессирует полипептид LovF SEQ ID NO: 3. В альтернативном варианте организм может представлять собой Escherichia coli, которая экспрессирует полипептид LovD SEQ ID NO: 1 или SEQ ID NO: 2. В некоторых вариантах осуществления Escherichia coli не экспрессирует полипептид bioH SEQ ID NO: 4. Как подробно описано ниже, выделенный организм может быть выращен при одних из многих условий культивирования, известных в уровне техники, при этом подходящие условия могут быть выбраны, например, с учетом требований культивирования конкретного используемого организма. В типовых вариантах осуществления изобретения организм выращивают при температуре 30-40°C в течение периода времени, по меньшей мере, от 4 до, по меньшей мере, 48 часов, и при pH 6,5-8,5. В примерах осуществления организм выращивают в среде культивирования, включающей среды LB, F1 или TB.
Необязательно монаколин J, который взаимодействует с другими компонентами в способах изобретения, продуцируется выделенным организмом в среде культивирования, например одним из организмов, указанных выше, который также продуцирует ацилтрансферазу LovD. В альтернативном варианте монаколин J, который взаимодействует с другими компонентами в способах изобретения, продуцируется другим организмом, который продуцирует указанное соединение и добавляется к среде культивирования, и растет вместе с организмом, который продуцирует ацилтрансферазу LovD. В данном контексте множество организмов, которые, как известно из уровня техники, продуцируют монаколин J, может подходить для применения в указанных вариантах осуществления изобретения (см., например Endo et al., J Antibiot (Tokyo). 1985 Mar; 38(3):420-2; и Kennedy et al., 1999 May 21; 284(5418): 1368-72). В другом варианте осуществления изобретения монаколин J получают из альтернативного внешнего источника (например, химического синтеза) и добавляют к ферментационной смеси.
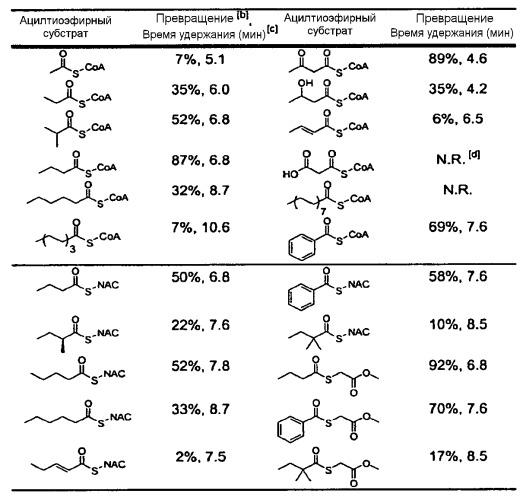
В типовых вариантах осуществления изобретения ацилтиоэфир, который может выступать донором ацильной группы для C8-гидроксильной группы монаколина J в присутствии LovD ацилтрансферазы, получают из внешнего источника (например, процесса химического синтеза) и добавляют к ферментационной смеси. Ряд таких ацилтиоэфиров раскрыт в настоящем описании. Обычно ацилтиоэфир представляет собой бутирил-тиоэфир, N-ацетилцистамин-тиоэфир или метил-тиогликолевый тиоэфир. Необязательно ацилтиоэфир включает ацильные группы с цепью средней длины (C3-C6). В некоторых вариантах осуществления изобретения ацилтиоэфир способен проходить через клеточные мембраны Escherichia coli или Aspergillus terreus, растущих в среде культивирования. Как правило, ацилтиоэфир выбран из группы, состоящей из α-диметилбутирил-S-метил-меркаптопропионата (DMB-S-MMP), диметилбутирил-S-этилмеркаптопропионата (DMB-S-EMP), а также диметилбутирил-S-метилтиогликолята (DMB-S-MTG) и диметилбутирил-S-метилмеркаптобутирата (DMB-S-MMB). В примере осуществления ацилтиоэфир является α-диметилбутирил-S-метил-меркаптопропионатом, который содержится в среде культивирования в концентрации 1 мМ-100 мМ.
В некоторых вариантах осуществления изобретения способ приводит к превращению, по меньшей мере, 95%, 96%, 97%, 98% или 99% монаколина J, добавленного в комбинацию, в симвастатин. Необязательно способ изобретения обеспечивает получение композиции веществ, включающей 0%-1% монаколина J, который был добавлен в комбинацию изначально. Конкретные варианты осуществления способов получения симвастатина и родственных соединений включают дополнительные стадии для очистки указанных соединений. Например, варианты осуществления изобретения могут включать, по меньшей мере, одну стадию очистки, включающую лизис клеток выделенного организма, присутствующего в комбинации. Варианты осуществления могут также включать, по меньшей мере, одну стадию очистки, включающую центрифугирование клеток или лизатов клеток выделенного организма, присутствующего в комбинации. Кроме того, варианты осуществления могут включать, по меньшей мере, одну стадию очистки, включающую осаждение одного или нескольких соединений, присутствующих в комбинации. Один из вариантов осуществления стадии осаждения включает осаждение свободной кислотной формы симвастатина. Необязательно, в таких вариантах осуществления можно затем превращать указанную свободную кислотную форму симвастатина в соль симвастатина. Варианты осуществления изобретения могут также включать, по меньшей мере, одну стадию очистки, включающую фильтрацию одного или нескольких соединений, присутствующих в комбинации. Кроме того, варианты осуществления могут включать, по меньшей мере, одну стадию очистки, включающую анализ с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) одного или нескольких соединений, присутствующих в комбинации.
Варианты осуществления изобретения включают композиции веществ, используемые при осуществлении и/или получаемые посредством способов, раскрытых в настоящем описании. Например, один из вариантов осуществления изобретения относится к композиции веществ, включающей: монаколин J; ацилтиоэфир, который отдает ацильную группу C8-гидроксильной группе монаколина J в присутствии ацилтрансферазы LovD; ацилтрансферазу LovD; и симвастатин. Необязательно композиция дополнительно включает выделенный организм, такой как Escherichia coli, Aspergillus terreus, Monascus ruber, Monascus purpureus, Monascus pilosus, Monascus vitreus, Monascus pubigerus, Candida cariosilognicola, Aspergillus oryzea, Doratomyces stemonitis, Paecilomyces virioti, Penicillum citrinum, Penicillin chrysogenum, Scopulariopsis brevicaulis или Trichoderma viride. В типовых вариантах осуществления организм в композиции представляет собой Aspergillus terreus или Escherichia coli, которые экспрессируют полипептид LovD SEQ ID NO: 1. В одном из вариантов осуществления изобретения организм представляет собой Aspergillus terreus, который не экспрессирует полипептид LovF SEQ ID NO: 3. В другом варианте осуществления изобретения организм представляет собой Escherichia coli, который не экспрессирует полипептид bioH SEQ ID NO: 4. В некоторых вариантах осуществления изобретения выделенный организм в композиции был трансформирован экспрессионным вектором, кодирующим LovD Aspergillus terreus (SEQ ID NO: 1).
Ряд ацилтиоэфиров, которые могут использоваться в композициях изобретения, раскрыт в настоящем описании. Обычно ацилтиоэфир представляет собой бутирил-тиоэфир, N-ацетилцистаминтиоэфир или метилтиогликолевый тиоэфир. Необязательно ацилтиоэфир включает ацильные группы с цепью средней длины (C3-C6). В некоторых вариантах осуществления изобретения ацилтиоэфир способен проходить через клеточные мембраны Escherichia coli или Aspergillus terreus, растущие в среде культивирования. Как правило, ацилтиоэфир выбран из группы, состоящей из α-диметилбутирил-S-метил-меркаптопропионата (DMB-S-MMP), диметилбутирил-S-этилмеркаптопропионата (DMB-S-EMP) и диметилбутирил-S-метилтиогликолята (DMB-S-MTG) и диметилбутирил-S-метилмеркаптобутирата (DMB-S-MMB). В примере осуществления ацилтиоэфир является α-диметилбутирил-S-метил-меркаптопропионатом, который содержится в среде культивирования в концентрации 1 мМ-100 мМ. В некоторых вариантах осуществления изобретения композиция дополнительно включает ловастатин, при этом количество симвастатина в композиции больше, чем количество ловастатина в композиции.
В некоторых вариантах осуществления изобретения дополнительные компоненты и/или стадии методик могут объединять в себе один или несколько способов и материалов, описанных выше. Например, способы могут дополнительно включать использование ферментации при высокой плотности клеток с целью повышения эффективной концентрации ацилтрансферазы LovD, а также оптимизацию условий ферментации или повышение каталитической активности ацилтрансферазы LovD в целях белковой инженерии одного или нескольких тиоэфиров. Много других компонентов или способов могут использоваться в целях повышения продукции симвастатина, либо промежуточных или родственных соединений, которые облегчают получение симвастатина.
Варианты осуществления изобретения также включают изделия и/или наборы, разработанные в целях облегчения осуществления способов изобретения. Обычно такие наборы включают инструкции по использованию элементов набора согласно способам настоящего изобретения. Такие наборы могут включать поддерживающее приспособление, разделенное на ячейки, плотно удерживающее одну или несколько емкостей, таких как флаконы, пробирки и т.п., при этом каждая емкость включает один из отдельных элементов, используемых в способе. Одна из емкостей может включать флакон, например, содержащий ацилтрансферазу LovD и/или А. terreus, а другой флакон при этом содержит тиоэфирное соединение или подобное, оба из которых могут быть добавлены к ферментационной смеси в целях получения симвастатина и/или хувастатина, или подобного. Дополнительные варианты осуществления изобретения описаны ниже.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1. A. Ловастатин. B. Симвастатин. Два соединения отличаются заменой одного метила в α положении.
Фигура 2. Ловастатин (1), Симвастатин (2), Правастатин (5), Хувастатин (6) и родственные соединения.
Фигура 3. Текущий способ производства симвастатина.
Фигура 4. Реакция переноса ацила в A. terreus согласно изобретению. Серин 76 может быть нуклеофилом в активном центре.
Фигура 5. A) Кривая ВЭЖХ (238 нм), показывающая образование 4 в результате LovD-опосредованного переноса ацила. Градиент: 60%B-95%B, 5 мин; 95%B, 15 мин; A: H2O+0,1% ТФУ; B: ацетонитрил+0,1% ТФУ; a) зависимость от времени LovD + монаколин J+бутирил-CoA (0, 1, 3, 6 и 10 часов); b) LovD S76A+монаколин J+бутирил-CoA, 10 часов; c) LovD+бутирил-SNAC, 10 часов; d) LovD+бутирил-SMTG, 10 часов. Условия анализа: 1 мМ монаколин J, 4 мМ бутирил-CoA, 10 мкМ LovD, 50 мМ HEPES, pH 7,9, 25°C. (B) Превращение в зависимости от времени для (◇) бутирил-CoA (♦) бутирил-SNAC, (■) бутирил-SMTG. Истинные значения kcat, приведенные в тексте настоящего описания, представляют собой начальное число оборотов в линейном диапазоне. (C) График Михаэлиса-Ментен катализируемого LovD гидролиза ловастатина до монаколина J. Ход реакции контролировали с помощью ВЭЖХ. kcat: 0,21±0,01 мин-1; Kм: 0,56±0,05 мМ.
Фигура 6. Катализируемый LovD перенос ацила с образованием ловастатина. Донор ацила присоединен к LDKS.
Фигура 7. Ацил-SNAC. Заштрихованный круг обозначает любую функциональную группу.
Фигура 8. Кривая ВЭЖХ (238 нм), показывающая образование симвастатина и ловастатина в результате LovD-опосредованного переноса ацила. Градиент такой же, как описанный в Фигуре 1; a) внутренние стандарты ловастатина и симвастатина; b) монаколин J+α-J-метилбутирил-SNAC; c) монаколин J+α-диметилбутирил-SNAC. Условия анализа: 1 мМ монаколин J, 10 мМ ацил-SNAC, 100 мкМ LovD, 50 мМ HEPES, pH 7,9, 25°C, 6 часов.
Фигура 9. Кривая ВЭЖХ (238 нм), показывающая образование правастатина и хувастатина в результате LovD-опосредованного ацилирования тетраола 7. Градиент: 5%B-95%B, 5 мин; 95%B, 15 мин; A: H2O+0,1% ТФУ; B: ацетонитрил+0,1% ТФУ; a) внутренние стандарты правастатина и 7; b) 7+α-S-метилбутирил-SNAC; c) 7+α-диметилбутирил-SNAC. Условия анализа: 1 мМ монаколин J, 10 мМ ацил-SNAC, 100 мкМ LovD, 50 мМ HEPES, pH 7,9, 25°C, 6 часов.
Фигура 10. Микробное превращение монаколина J в симвастатин.
Фигура 11. Катализируемый LovD гидролиз и катализируемое LovD ацилирование. Фигура 11 охватывает варианты осуществления изобретения, включающие композиции веществ, из которых в присутствии LovD и донора ацила получают хувастатин или симвастатин. Фигура 11 также иллюстрирует способ получения симвастатина, включающий гидролиз ловастатина в присутствии LovD с получением монаколина J. Монаколин J превращается, таким образом, в симвастатин в присутствии донора ацила. Аналогично фигура 11 также иллюстрирует способ получения хувастатина, включающий гидролиз правастатина в присутствии LovD с получением гидролизованного правастатина. Гидролизованный правастатин, таким образом, превращается в хувастатин в присутствии донора ацила.
Фигура 12. Продуцирование хувастатина в микроорганизме, экспрессирующем LovD. На Фигуре 12 приведены примеры осуществления изобретения, включающие продуцирование хувастатина в организме, экспрессирующем LovD.
Фигура 13. (A) Цельноклеточное биокаталитическое превращение симвастатина в кислотной форме из монаколина J в кислотной форме и DMB-S-MMP. Штамм E. coli с оверэкспрессией ацилтрансферазы LovD. Гидролиз DMB-S-MMP с получением DMB-S-MPA является конкурентной реакцией. (B) Верхняя кривая: обычный профиль реагентов и продуктов в эксперименте цельноклеточного превращения. Нижние кривые: стандарты для DMB-S-MMP и DMB-S-MPA. Спектры регистрировали при 238 нм.
Фигура 14. (A) Тонкослойная хроматография, показывающая органические экстракты шестидесяти штаммов E. coli при добавлении DMB-S-MMP. Описание штаммов приведено в Таблице 2. Пластинку ТСХ поместили в 20%-ный ЭА в гексане с целью разделения DMB-S-MMP (верх) и DMB-S-MPA (низ). Среднее пятно соответствует неизвестному соединению. Во всех штаммах, кроме #56, DMB-S-MMP гидролизовался до DMB-S-MPA через 10 часов инкубации. Штамм ΔbioH не гидролизировал DMB-S-MMP. (B) Подтверждение результатов ТСХ проводили с помощью ВЭЖХ. В экстракте штамма ΔbioH следы DMB-S-MPA не были обнаружены. Спектры регистрировали при 234 нм.
Фигура 15. (A) Кинетика Михаэлиса-Ментен превращения BioH в DMB-S-MMP. Приведены усредненные результаты из трех опытов. Значения kcat и Км - 260±45 с-1 и 229±26 мкМ, соответственно. Высокое стандартное отклонение, наблюдаемое при высокой концентрации DMB-S-MMP, может быть обусловлено плохой растворимостью субстрата в буфере (50 мМ HEPES, pH 7,9, 10% ДМСО). (B) Сравнение скорости гидролиза трех различных диметилбутирилтиоэфиров. Реакции проводили при 1 мМ тиоэфира и 10 нМ BioH.
Фигура 16. (A) Сравнение скорости роста и конечной плотности культур для BL21(DE3)/pAW31 (серый ◇) и YT2/pAW31 (без биотина: o; с биотином (0,15 мг/л): ●) в минимальной среде F1. Клетки выращивали до OD600 ~0,5, индуцировали 100 мкМ ИПТГ и ставили в шейкер на 20°C в течение 12 часов. Штамм ΔbioH YT2 требовал добавления биотина, необходимого для поддерживания устойчивого роста клеток в синтетической среде. (B) Сравнение превращения симвастатина в зависимости от времени (15 мМ MJ, 25 мМ DMB-S-MMP). YT2/pAW31 (o) значительно быстрее, чем BL21(DE3)/pAW31 (●) (данные взяты из Xie et al., (2007) Appl Environ Microbiol 73: 2054-2060), достигает 99% превращения. У обоих штаммов лаг-фазу регистрировали сразу после добавления субстрата (0 часов) и незадолго до завершения реакции. Скорости реакции между лаг-фазами являлись линейными. Число оборотов для YT2/pAW31 (1,5 мМ/ч) было в два раза выше, чем для BL21(DE3) (0,75 мМ/ч).
Фигура 17. ВЭЖХ анализ (238 нм) стадий очистки симвастатина. Симвастатин в кислотной форме лактонизировали с образованием симвастатина перед введением. Кривая a: неочищенный экстракт (смесь культуральной жидкости и клеточного экстракта) YT2/pAW31 после завершения реакции (99% превращения MJ в кислотной форме в симвастатин в кислотной форме). Пик при 6,80 соответствует DMB-S-MMP; Кривая b: Неочищенный образец после промывки равным объемом гексана с целью удаления непрореагировавшего DMB-S-MMP и осаждения; Кривая c: Очищенный симвастатин после промывки dH2O и солюбилизации в AcN. Маленький пик, зарегистрированный при 6,7 мин, соответствует симвастатину в кислотной форме, который не полностью лактонизировался (~1%).
Фигура 18. Химические структуры ловастатина в кислотной форме, монаколина J в кислотной форме и симвастатина в кислотной форме. Исследованная биокаталитическая реакция - ферментативное превращение монаколина J в симвастатин (большая стрелка). LovD способен региоселективно ацилировать C8-гидроксильную группу. Два обычно используемых полусинтетических способа показаны пунктирными стрелками.
Фигура 19. Кинетический анализ катализируемого LovD ацилирования монаколина J с получением симвастатина, где DMB-S-MMP используется в качестве ацилтиоэфира. Ось Y выражает каталитическое превращение (V/Eo) (A) кинетика Михаэлиса-Ментен LovD в зависимости от концентрации монаколина J, при постоянной концентрации DMB-SMMP 2 мМ. Ингибирования субстрата не наблюдали. Км (монаколин J) = 0,78±0,12 мМ. (B) Кинетика Михаэлиса-Ментен LovD в зависимости от концентрации DMB-S-MMP, при постоянной концентрации монаколина J 2 мМ. Км (DMB-S-MMP) = 0,67±0,04 мМ. В обоих анализах значение kcat составило 0,66±0,03 мин-1.
Фигура 20. Ферментация и биокатализ при низкой плотности. Штамм E. coli BL21(DE3)/pAW31, экспрессирующий LovD в течение ночи, сконцентрировали в 10 раз до конечной плотности OD600 22. Субстраты монаколин J и DMB-S-MMP добавляли до конечной концентрации 15 и 40 мМ, соответственно. Превращение в течение времени сопровождалось анализом ВЭЖХ. (A) Кривые ВЭЖХ при исследовании в зависимости от времени. Отмеченные пики - 1: монаколин J (в форме лактона); 2: DMB-S-MPA в качестве продукта гидролиза DMB-S-MMP; 3: DMB-S-MMP; и 4: симвастатин (в форме лактона). (B) Превращение монаколина J в симвастатин в зависимости от времени. Конечное превращение за 24 часа составило 99%. Точки кривой соответствуют усредненным значениям двух опытов.
Фигура 21. Ферментация и биокатализ при высокой плотности. (A) Периодическая ферментация (500 мл) в минимальной среде F1. При OD600 (круги) 5,93 (I) температуру ферментации понижали и поддерживали при КТ. ИПТГ добавляли до конечной концентрации 200 мкМ, после чего начинали подачу исходных веществ, которую поддерживали на уровне 0,08 мл/мин. Измеряли эффективные концентрации LovD при различной продолжительности ферментации (квадраты). (B) Число оборотов монаколина J в симвастатин клетками при четырех различных значениях продолжительности ферментации (обозначены 1, 2, 3 и 4) на Фигуре 21A. Клетки переводили в фазу "покоя", промывая 50 мМ HEPES, pH 7,9, или не переводили, не меняя среду.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Описанные или указанные в настоящем описании методы и методики представляют собой общеизвестные и широко используемые в качестве стандартных методик специалистами, квалифицированными в данной области техники, такие как, например, широко используемые методики молекулярного клонирования, описанные в Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers, (1995). При необходимости, методики, включающие использование коммерческих наборов и реактивов, обычно выполняются в соответствии с протоколами и/или параметрами, определенными изготовителем, если не указано иное. Если не определено иное, все термины из уровня техники, примечания и другая научная терминология, используемая в настоящем описании, имеет стандартные значения, известные специалистам в данной области техники, к которым относится настоящее изобретение. В некоторых случаях термины со стандартными значениями определены в настоящем описании в целях ясности и/или в качестве справки, и при включении таких определений в настоящее описание их не следует толковать как существенно отличающимися от общепринятого в данной области техники.
Определения некоторых терминов приведены ниже.
"Ловастатин" (Мевакор) - поликетид, продуцируемый грибом Aspergillus terreus (см., например, A. W. Alberts, J. et. al., Proc. Natl. Acad. Sd. USA., 1980, 77, 3957-3961 и A. Endo, J. Antibiot. 1980, 33, 334-336; а также J. K. Chan, et. al., J. Am. Chem. Soc. 1983, 105, 3334-3336; Y. Yoshizawa, et. al., J. Am. Chem. Soc. 1994, 116, 2693-2694). Ловастатин является фармацевтически важным соединением благодаря его мощной ингибирующей активности в отношении гидроксиметилглутарил-кофермента А редуктазы (HMGR), лимитирующей скорость стадии биосинтеза холестерина, и поэтому широко применяется при лечении гиперлипидемии, гиперхолестеринемии и т.п. Ловастатин также упоминается как Мевакор.
"Симвастатин" - аналог ловастатина. Он находит более широкое применение по сравнению с ловастатином из-за отсутствия нежелательных побочных эффектов и его высокой всасываемости в желудке. Кроме того, сообщалось, что симвастатин предотвращает и снижает риск возникновения болезни Альцгеймера (AD), замедляя синтез Ab42, β-амилоидного пептида, связанного с AD. Из уровня техники известно, что симвастатин может быть получен синтетическим путем посредством прямого метилирования 8'-метилбутирилокси боковой цепи молекулы ловастатина при использовании метилгалогенида в присутствии основания (амида металла). Стадию C-метилирования необходимо проводить при очень низких температурах (от -75 до -30°), используя сильное основание в безводных условиях, что весьма трудно выполнять при массовом производстве (см., например, патент США 5393893, патент США 4582915, патент США 5763646, патент США 5763653, Европейский патент 299656 и Международную патентную публикацию WO 99/45003, содержание которых включено в настоящее описание посредством ссылки). В уровне техники также известны другие способы синтетического получения симвастатина. Например, ловастатин можно гидролизовать избыточным количеством гидроксида лития с целью удаления 2-метилбутириловой боковой цепи и одновременного размыкания 6-членного лактонового кольца с получением триолкислоты. Затем триолкислотное соединение может быть нагрето с получением диоллактона. Гидроксильная группа на лактоновом кольце диоллактона может быть защищена с получением трет-бутилдиметилсилильного эфира, после чего гидроксильная группа в положении C8 кольцевой системы гексагидронафталина может быть ацилирована 2,2-диметилбутановой кислотой в присутствии дициклогексилкарбодиимида, или 2,2-диметилхлорида с получением соединения. Затем на последней стадии защитная т-бутилдиметилсилильная группа соединения может быть удалена с помощью фторида тетрабутиламмония с получением симвастатина (см., например, патент США 4444784, содержание которого включено в настоящее описание посредством ссылки).
Используемое в настоящем описании понятие "производные ловастатина" включает производные или предшественники ловастатина, например правастатин, хувастатин, симвастатин или гидролизованный правастатин в форме тетраола. Понятие "варианты монаколина J" относится к вариантам монаколина J, описанным в уровне техники, например гидролизованному правастатину в форме тетраола или 6-гидрокси-6-деметилмонаколин J и т.п. В некоторых вариантах осуществления изобретения понятие "варианты монаколина J" относится к соединениям монаколина J, имеющим замены в положении C6 на Фигуре 2. При описании таких соединений, как симвастатин, правастатин, монаколин J и варианты, и т.д., специалисты в данной области будут осведомлены, что указанная формулировка охватывает не только указанные соединения, но и соли указанных соединений (например, фармацевтически приемлемые соли, известные в уровне техники). Например, как известно из уровня техники, симвастатин может находиться как в свободной кислотной форме, так и в форме солей натрия, калия или аммония, а также других солей симвастатина, полученных со щелочноземельными элементами, или солей других металлов.
"Aspergillus terreus" или "A. terreus" представляет собой нитчатый аскомицет, обычно присутствующий в почве. Различные штаммы A. terreus известны в уровне техники, например депонированные как, например, ATCC 20542 и ATCC 20541.
Как известно из уровня техники, гены, отвечающие за биосинтез вторичных метаболитов нитчатых грибов, могут образовывать кластер в геноме гриба и упоминаются как "кластеры генов". Например, "ловастатин-продуцирующий кластер генов" может относиться к набору генов, регулирующих синтез ловастатина, который включает P450I (LovA); дегидрогеназу (LovC); эстеразу и ацилтрансферазу (LovD); а также ScPKS или LDKS (LovF). Ранее было определено, что каждый из указанных четырех генов (LovA, LovC, LovD и LovF) требуется для синтеза ловастатина (см., например, патент США 6943017, содержание которого включено в настоящее описание посредством ссылки). LovF (ген LDKS) охарактеризован как ген поликетидсинтазы. LovD является предполагаемым эстераза/карбоксипептидаза-подобным геном. Ранее было выполнено прерывание гена LovF (см., например, Патент США 6943017, содержание которого включено в настоящее описание посредством ссылки). В результате взаимодействия LovD с LovF синтезируется ловастатин, однако для синтеза симвастатина взаимодействия LovD-LovF не требуется. Кроме того, другой ген в ловастатин-продуцирующем кластере генов, LovE, кодирует цинковый палец, который может регулировать транскрипцию других генов. Ловастатин-продуцирующий кластер генов также включает LovB (ген NPKS).
Термины "LDKS" или "ген LDKS" относятся к белку, кодируемому геном LovF, членом ловастатин-продуцирующего кластера генов. LDKS означает ловастатин-дикетидсинтазу. LovF представляет собой ген, который кодирует LDKS. LovF также является геном, который кодирует белок LovF. "Ген LDKS" также относится к гену, который кодирует LDKS. В синтезе ловастатина LDKS синтезирует боковую цепь из пяти атомов углерода монаколина J посредством конденсации между ацетил-CoA и малонил-CoA. Конденсированный дикетид подвергается метилированию и восстановительному сшиванию отдельными доменами LovF с получением α-S-метилбутирилтиоэфира, ковалентно связанного с фосфопантетеиновой субъединицей ацилпереносящего белкового домена (ACP) LovF.
Используемый в настоящем описании термин "ацилтрансфераза LovD" относится к таким полипептидам, как полипептид LovD A. terreus (например SEQ ID NO: 1), который может использовать ацилтиоэфир для региоспецифичного ацилирования гидроксильной группы монаколина J в положении C8 с получением симвастатина. Кроме того, в настоящем описании раскрыто, что указанный фермент LovD может также использовать ацилтиоэфир для региоспецифичного ацилирования C8-гидроксильной группы гидролизованного правастатина в форме тетраола с получением хувастатина.
Ацилтрансферазы LovD включают гомологичные полипептиду LovD A. terreus ферменты (например SEQ ID NO: 1), которые могут быть обнаружены, помимо прочего, например, в кластерах поликетидных генов грибов. Например, в уровне техники можно найти свидетельство, что Mlc в пути биосинтеза компактина катализирует идентичную реакцию переацилирования (см., например, Y. Abe, T. et al., Mol Genet Genomics. 2002, 267, 636-646), тогда как ацилтрансфер