Монометилвалиновые соединения, способные образовывать конъюгаты с лигандами
Иллюстрации
Показать всеИзобретение относится к ауристатиновым пептидам, включая MeVal-Val-Dil-Dap-норэфедрин (ММАЕ) и MeVal-Val-Dil-Dap-Phe (MMAF), и эти пептиды были присоединены к лигандам посредством различных линкеров, включая малеимидокапроил-val-cit-PAB. Полученные конъюгаты "лиганд -лекарственное средство" являются активными in vitro и in vivo. 22 н. и 96 з.п. ф-лы, 19 ил., 12 табл., 33 пр.
Реферат
Ссылки на предшествующие заявки
Настоящая заявка испрашивает приоритет предварительной заявки на патент США, № 60/518534, поданной 6 ноября 2003; предварительной заявки на патент США, № 60/5557116, поданной 26 марта 2004; предварительной заявки на патент США, № 60/598899, поданной 4 августа 2004; и предварительной заявки на патент США, № 60/622455, поданной 27 октября 2004, описание которых включено в настоящее описание посредством ссылки.
1. Предшествующий уровень техники
Настоящее изобретение относится к лекарственному соединению, а в частности к конъюгатам “лекарственное средство-линкер-лиганд”, к соединениям лекарственное средство-линкер и к конъюгатам “лекарственное средство-лиганд”, к композициям, включающим вышеперечисленные соединения и конъюгаты, и к способам их применения для лечения рака, аутоиммунного заболевания или инфекционного заболевания. Настоящее изобретение также относится к конъюгатам “антитело-лекарственное средство”, к композициям, включающим эти конъюгаты, и к способам их применения для лечения рака, аутоиммунного заболевания и инфекционного заболевания. Настоящее изобретение также относится к способам применения соединений, представляющих собой конъюгаты “антитело-лекарственное средство” для in vitro, in situ и in vivo диагностики или обработки клеток млекопитающих или для лечения патологических состояний.
2. Предшествующий уровень техники
Уже много лет проводятся интенсивные исследования по улучшению доставки лекарственных средств и других агентов в клетки, ткани и опухоли-мишени в целях достижения максимальной эффективности при минимальной токсичности. Хотя было предпринято множество попыток разработать эффективные способы доставки биологически активных молекул в клетки, как in vivo, так и in vitro, однако ни одна из них не дала удовлетворительных результатов. Оптимизация конъюгирования лекарственного средства с его внутриклеточной мишенью, а также минимизация внутриклеточного перераспределения лекарственного средства, например, в соседние клетки часто представляет определенные трудности или является неэффективной.
Большинство современных средств, парентерально вводимых пациенту, не нацелены на мишень, что приводит к их системной доставке в клетки и ткани организма, в которых присутствие этих средств не требуется и часто является нежелательным. В результате эти лекарственные средства вызывают нежелательные побочные эффекты, что часто приводит к ограничению доз лекарственного средства (например, химиотерапевтического (противоракового) средства, цитотоксического средства, ингибитора ферментов и противовирусных или противомикробных средств), предназначенных для введения. Хотя пероральное введение лекарственных средств, по сравнению с парентеральным введением, считается удобным и экономичным способом введения, однако и в этом случае проблема неспецифического токсического воздействия лекарственного средства, после его попадания в систему кровообращения, на нормальные клетки остается актуальной. Другие проблемы, возникающие при пероральном введении, связаны с биодоступностью вводимого лекарственного средства и его задержкой в кишечнике, что приводит к дополнительному воздействию лекарственного средства на кишечник, а следовательно, и к повышению риска токсического воздействия на кишечник. В соответствии с этим главной целью настоящего изобретения является разработка способов специфической доставки агентов в клетки и ткани. Преимущества такого лечения заключаются в возможности предотвращения общих физиологических эффектов, связанных с нежелательной доставкой указанных агентов в другие клетки и ткани, такие как неинфицированные клетки. Внутриклеточная доставка может быть достигнута способами, которые обеспечивают аккумуляцию или присутствие активных агентов, то есть активных метаболитов, внутри клеток.
Была разработана терапия с использованием моноклональных антител для целенаправленного лечения пациентов, страдающих раком, иммунологическими и ангиогенными расстройствами.
Использование конъюгатов “антитело-лекарственное средство” в целях локальной доставки цитотоксических или цитостатических агентов, например лекарственных средств для уничтожения или подавления опухолевых клеток при лечении рака (Syrigos & Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz & Springer (1997) Adv. Drg. Del. Rev. 26:151-172; патент США № 4975278), теоретически позволяет осуществлять направленную доставку лекарственного средства в опухоли и обеспечивать их аккумуляцию внутри клеток, тогда как системное введение этих неконъюгированных лекарственных средств может приводить к продуцированию уровней токсичности, которые являются неприемлемыми для нормальных клеток, а также недостаточными для опухолевых клеток, которые необходимо уничтожить (Baldwin et al., 1986, Lancet pp. (Mar. 15, 1986):603-05; Thorpe, 1985, “Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review” in Monoclonal Antobodies 84:Biological And Clinical Applications, A. Pinchera et al. (eds.), p. 475-506). Таким образом, желательно, чтобы максимальная эффективность сочеталась с минимальной токсичностью. Сообщалось, что в этой стратегии могут быть использованы как поликлональные, так и моноклональные антитела (Rowland et al., 1986, Cancer Immunol. Immunother. 21:183-87). Лекарственными средствами, используемыми в этих способах, являются дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., 1986, см. выше). Токсинами, используемыми в конъюгатах “антитело-токсин”, являются бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, и небольшие молекулы-токсины, такие как гельданамицин (Kerr et al., 1997, Bioconjugate Chem. 8(6):781-784; Mandler et al., (2000) Jour of the Nat. Cancer Inst. 92(19):1573-1581; Mandler et al., (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al., (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (1993) Cancer Res. 53:3336-3342). Токсины могут оказывать свое цитоктоксическое и цитостатическое действие в соответствии с механизмами, включающими связывание с тубулином, связывание с ДНК или ингибирование топоизомеразы (Meyer D.L. & Senter P.D. “Recent Advances in Antibody Drug Conjugates for Cancer Therapy” in Annual Report in Medicinal Chemistry, Vol. 38(2003) Chapter 23, 229-237). Некоторые цитотоксические лекарственные средства, при их конъюгировании с крупными антителами или лигандами белков-рецепторов, имеют тенденцию к потере активности или уменьшению активности.
Зевалин (Zevalin®) (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат “антитело-радиоизотоп”, состоящий из мышиного моноклонального антитела IgG1-каппа, направленного против антигена CD20, присутствующего на поверхности нормальных и злокачественных В-лимфоцитов, и радиоактивных изотопов 111In или 90Y, связанных с хелатообразующим комплексом “тиомочевина-линкер” (Wiseman et al. (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al. (2002) Blood 99(12):4336-42; Witzig et al. (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al. (2002) J. Clin. Oncol. 20(15):3262-69). Хотя зевалин обладает активностью против В-клеточной не-ходжкинской лимфомы (НХЛ), однако его введение приводит к тяжелой и хронической цитопении у большинства пациентов. В 2000 г. было дано разрешение на применение препарата милотарг (Mylotarg®) (гемтузумаб озогамицин, Wyeth Pharmaceuticals), то есть конъюгата “антитело-лекарственное средство”, состоящего из антитела против человеческого CD33, связанного с калихеамицином, для лечения острого миелоидного лейкоза путем инъекции указанного препарата (Drugs of the Future (2000) 25(7):686; патенты США № 4970198; 5079233; 5585989; 5606040; 5693762, 5739116, 5767285, 5773001). Кантузумаб мертанзин (Immunogen, Inc.), конъюгат “антитело-лекарственное средство”, состоящий из антитела против человеческого C242, связанного посредством дисульфидного линкера SPP с майтанзиноидным лекарственным средством, DM1, был использован в испытаниях фазы II для лечения раковых опухолей, экспрессирующих CanAg, таких как раковые опухоли толстой кишки, поджелудочной железы, желудка и т.п. MLN-2704 (Millenium Pharm., BZL Biologics, Immunogen Inc.), конъюгат “антитело-лекарственное средство”, состоящий из моноклонального антитела против мембраносвязанного антигена предстательной железы (PSMA), присоединенного к майтанзиноидному лекарственному средству, DM1, находится на стадии исследования его возможного применения для лечения опухолей предстательной железы. Это майтанзиноидное лекарственное средство, DM1, было конъюгировано с мышиным моноклональным антителом ТА.1 посредством не-дисульфидного линкера, SMCC (Chari et al. (1992) Cancer Research 52:127-131). Сообщалось, что указанный конъюгат был в 200 раз менее эффективным, чем соответствующий конъюгат, связанный посредством дисульфидного линкера. В этой работе линкер SMCC рассматривается как “не-расщепляемый”.
Из морского моллюска Dolabella auricularia было выделено несколько короткоцепочечных пептидных соединений, и было обнаружено, что они обладают биологической активностью (Pettit et al. (1993) Tetrahedron 49:9151; Nakamura et al. (1995) Tetrahedron Letters 36:5059-5062; Sone et al. (1995) Jour. Org. Chem. 60:4474). Были также получены аналоги этих соединений, и было обнаружено, что некоторые из них обладают биологической активностью (обзор см. Pettit et al. (1998) Anti-Cancer Drug Design 13:243-277). Так, например, ауристатин Е (патент США № 5635483) представляет собой синтетический аналог натурального морского продукта доластатина 10, т.е. агент, который ингибирует полимеризацию тубулина путем связывания с таким же доменом на тубулине, как и противораковое лекарственное средство винкристин (G.R. Pettit (1997) Prog. Chem. Org. Nat. Prod. 70:1-79). Доластатин 10, ауристатин РЕ и ауристатин Е представляют собой линейные пептиды, имеющие четыре аминокислоты, три из которых являются уникальными для соединений класса доластатинов, и С-концевой амид.
Ауристатиновые пептиды, ауристатин Е (АЕ) и монометилауристатин (ММАЕ), т.е. синтетические аналоги доластатина, были конъюгированы: (i) с химерными моноклональными антителами cBR96 (специфическими к антигену Lewis Y на карциномах); (ii) с сАС10, который является специфичным к CD30, присутствующему на гематологических злокачественных опухолях (Klussman et al. (2004) Bioconjugate Chemistry 15(4):765-773; Doronina et al. (2003) Nature Biotechnology 21(7):778-784; “Monomethylvaline Compounds Capable of Conjugation to Ligands”; Francisco et al. (2003) Blood 102(4):1458-1465; публикация заявки США 2004/0018194); (iii) с антителами против CD20, такими как ритуксан® (WO 04/032828), используемым для лечения CD20-экспрессирующих раковых опухолей и иммунных расстройств; (iv) с анти-EphB2 антителом 2Н9 и с анти-IL-8 антителом, используемым для лечения рака толстой кишки (Mao et al. (2004) Cancer Research 64(3):781-788)); (v) с антителом против Е-селектина (Bhaskar et al. (2003) Cancer Res. 63:6387-6394) и (vi) с другими анти-CD30 антителами (WO 03/043583).
Ауристатин Е, конъюгированный с моноклональными антителами, описан в работе Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, опубликованной 28 марта 2004.
Вопреки in vitro-данным, полученным в клинических исследованиях соединений класса долостатинов и их аналогов, дозы, необходимые для достижения терапевтического эффекта, продуцируют значительную общую токсичность, что снижает их эффективность. В соответствии с этим необходимость в разработке производных доластатина/ауристатина, обладающих значительно меньшей токсичностью, но ценной терапевтической активностью, остается актуальной. Таким образом, настоящее изобретение направлено на устранение этих и других ограничений и проблем, которые до сих пор остаются нерешенными.
Тирозинкиназные рецепторы семейства ErbB являются важными медиаторами роста, дифференцировки и выживания клеток. Это семейство рецепторов включает четыре различных члена, включая рецептор эпидермального фактора роста (EGFR, ErbB1, HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2). Панель анти-ErbB2 антител была охарактеризована с использованием клеточной линии человеческих опухолей молочной железы SCBR3 (Hudziak et al. (1989) Mol. Cell. Biol. 9(3):1165-1172. Максимальное ингибирование достигалось с использованием антитела, называемого 4D5, которое на 56% ингибировало пролиферацию клеток. В этом анализе другие антитела в данной панели антител снижали пролиферацию клеток в меньшей степени. Кроме того, было обнаружено, что антитело 4D5 сенсибилизирует ErbB2-сверхэкспрессирующие клеточные линии опухоли молочной железы с продуцированием цитотоксических эффектов TNF-α (патент США № 5677171). Анти-ErbB2 антитела, обсуждаемые Hudziak et al., были дополнительно охарактеризованы Fendly et al. (1990), Cancer Research 50:1550-1558; Kotts et al. (1990) In vitro 26(3):59А; Sarup et al. (1991) Growth Regulation 1:72-82; Shepard et al. J. (1991) Clin. Immunol. 11(3):117-127; Kumar et al. (1991) Mol. Cell. Biol. 11(2):979-986; Lewis et al. (1993) Cancer Immunol. Immunother. 37:255-263; Pietras et al. (1994) Oncogene 9:1829-1838; Vitetta et al. (1994) Cancer Research 54:5301-5309; Silwkowski et al. (1994) J. Biol. Chem. 269(20):14661-14665; Scott et al. (1991) J. Biol. Chem. 266:14300-5; D'souza et al. Proc. Natl. Acad. Sci. (1994) 91:7202-7206; Lewis et al. (1996) Cancer Research 56:1457-1465 и Schaefer et al. (1997) Oncogene 15:1385-1394.
Другие анти-ErbB2 антитела, обладающие различными свойствами, описаны Tagliabue et al. Int. J. Cancer 47:933-937 (1991); McKenzie et al. Oncogene 4:543-548 (1989); Maier et al. Cancer Res. 51:5361-5369 (1991); Bacus et al. Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al. Proc. Natl. Acad. Sci., USA, 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al. Int. J. Cancer 53:401-408 (1993); в WO94/00136; Kasprzyk et al. Cancer Research 52:2771-2776 (1992); Handcock et al. (1991) Cancer Res. 51:4575-4580; Shawver et al. (1994) Cancer Res. 54:1367-1373; Arteaga et al. (1994) Cancer Res. 54:3758-3765; Harwerth et al. (1992) J. Biol. Chem. 267:15160-15167; в патенте США № 5783186 и Klapper et al. (1997) Oncogene 14:2099-2109.
Скрининг на гомологию позволил идентифицировать два других члена семейства рецепторов ErbB, а именно ErbB3 (патент США № 5183884; патент США № 5480968; KraU.S. et al. (1989) Proc. Natl. Acad. Sci., USA, 86:9193-9197) и ErbB4 (EP 599274; Plowman et al. (1993) Proc. Natl. Acad. Sci., USA, 90:1746-1750; и Plowman et al. (1993) Nature 366:473-475). Оба эти рецептора обнаруживали повышенную экспрессию, по крайней мере, на некоторых клеточных линиях рака молочной железы.
Герцептин® (трастузумаб) представляет собой рекомбинантное ДНК “гуманизованное” моноклональное антитело, которое в клеточном анализе селективно и с высокой аффинностью (Kd=5 нМ) связывалось с внеклеточным доменом белка-рецептора человеческого эпидермального фактора роста -2, HER2 (ErbB2) (патент США № 5821337; патент США № 6054297; патент США № 6407213; патент США № 6639055; Coussens L. et al. (1985) Science 230:1132-9; Slamon D.J. et al. (1989) Science 244:707-12). Трастузумаб представляет собой антитело IgG1-каппа, которое содержит каркасные области человеческого антитела и гипервариабельные области (комплементарность-определяющие области) мышиного антитела (4D5), которое связывается с HER2. Трастузумаб связывается с антигеном HER2 и, тем самым, ингибирует рост раковых клеток. Поскольку трастузумаб является гуманизованным антителом, то это минимизирует любой НАМА-ответ у пациентов. Гуманизованное антитело против HER2 было продуцировано в суспензионной культуре клеток млекопитающих (клеток яичника китайского хомячка, СНО). Протоонкоген HER2 (или с-erbB2) кодирует трансмембранный рецепторный белок размером 185 кДа, структура которого является родственной структуре рецептора эпидермального фактора роста. Сверхэкспрессия белка HER2 наблюдается в 25%-30% первичных опухолей молочной железы и может быть определена путем иммуногистохимической оценки фиксированных опухолевых срезов (Press M.F. et al. (1993) Cancer Res. 53:4960-70). Анализы, проведенные in vitro и на животных, показали, что трастузумаб ингибирует пролиферацию человеческих опухолевых клеток, которые сверхэкспрессируют HER2 (Hudziak R.M. et al. (1989) Mol. Cell. Biol. 9:1165-72; Lewis G.D. et al. (1993) Cancer Immunol. Immunother; 37:255-63; Baselga J. et al. (1998) Cancer Res. 58:2825-2831). Трастузумаб является медиатором антитело-зависимой клеточной цитотоксичности, ADCC (Hotaling T.E. et al. (1996) [abstract]. Proc. Annual. Meeting Am. Assoc. Cancer Res; 37:471; Pegram M.D. et al. (1997) [abstract] Proc. Am. Assoc. Cancer Res; 38:602). In vitro было показано, что опосредуемая трастузумабом ADCC наблюдается преимущественно на HER2-сверхэкспрессирующих раковых клетках по сравнению с раковыми клетками, которые не обнаруживают сверхэкспрессию HER2. Герцептин® представляет собой единственное средство, которое показано для лечения пациентов, страдающих раковыми опухолями молочной железы с метастазами, которые сверхэкспрессируют белок HER2, и для пациентов, проходивших один или несколько курсов химиотерапии по поводу рака с метастазами. Герцептин® в комбинации с паклитакселом показан для лечения пациентов, страдающих раковыми опухолями молочной железы с метастазами, которые сверхэкспрессируют белок HER2, и для пациентов, не проходивших курса химиотерапии по поводу рака с метастазами. Герцептин® является клинически активным у пациентов с ErbB2-сверхэкспрессирующими раковыми метастазирующими опухолями молочной железы, где указанные пациенты, перед противораковой терапией, проходили интенсивный курс лечения (Baselga et al. (1996) J. Clin. Oncol. 14:737-744).
Мышиное моноклональное анти-HER2 антитело ингибирует рост клеточных линий рака молочной железы, при котором наблюдается сверхэкспрессия HER2 на уровне 2+ и 3+ (1-2×106 рецепторов HER2 на клетку), но это антитело не обладало активностью по отношению к клеткам, которые экспрессировали низкие уровни HER2 (Lewis et al. (1993) Cancer Immunol. Immunother. 37:255-263). Принимая во внимание эти наблюдения, антитело 4D5 было гуманизовано (huMab4D5-8, rhuMab HER2, патент США № 5821337; Carter et al. (1992) Proc. Natl. Acad. Sci., USA, 89:4285-4289) и протестировано у пациентов с раковыми опухолями молочной железы, которые сверхэкспрессировали HER2, но при этом прогрессировали после проведения стандартной химиотерапии (Cobleigh et al. (1999) J. Clin. Oncol. 17:2639-2648).
Хотя получение герцептина является выдающимся научным достижением в лечении пациентов с ErbB2-сверхэкспрессирующими раковыми опухолями молочной железы, которые были предварительно подвергнуты интенсивной противораковой терапии, однако некоторые пациенты этой группы не обнаруживали какого-либо ответа или обнаруживали лишь незначительный ответ на лечение герцептином.
Поэтому остается актуальной необходимость в разработке других, имеющих важное клиническое значение способов HER2-направленной противораковой терапии пациентов с HER2-сверхэкспрессирующими опухолями или с другими заболеваниями, ассоциированными с экспрессией HER2, которые не поддаются или плохо поддаются лечению герцептином.
Любые работы, цитируемые в настоящей заявке, не должны рассматриваться как прототипы настоящего изобретения.
3. Описание сущности изобретения
В одном из своих аспектов настоящее изобретение относится к соединениям “лекарственное средство-линкер-лиганд”, имеющим формулу Ia:
| L--(Aa--Ww--Yy-D)P | (Ia) |
или к их фармацевтически приемлемым солям или сольватам,
где: L представляет собой лигандный компонент;
-Аа-Ww-Yy- представляет собой линкерный компонент (LU), где в указанном линкерном компоненте:
-А- представляет собой удлиняющий компонент;
а равно 0 или 1,
каждый из -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
-Y- означает спейсерный компонент,
у равно 0, 1 или 2;
р составляет в пределах от 1 примерно до 20; и
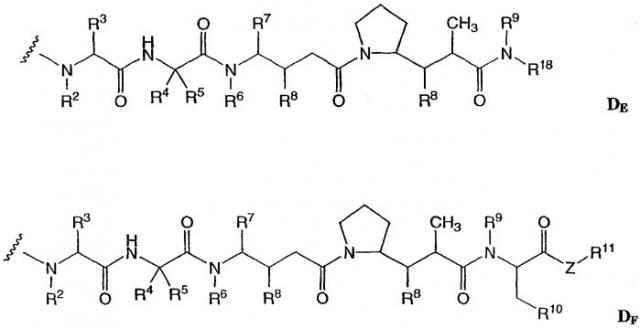
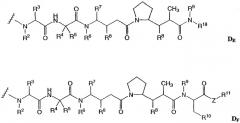
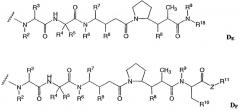
-D представляет собой компонент “лекарственное средство”, имеющее формулы DE и DF;
где в каждом положении независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z представляет собой О, S, NH или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, (СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН, где n равно целому числу от 0 до 6; и
R18 выбран из -С(R8)2-С(R8)2-арила, -С(R8)2-С(R8)2-(С3-С8-гетероцикла) и -С(R8)2-С(R8)2-(С3-С8-карбоцикла).
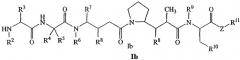
В другом своем аспекте настоящее изобретение относится к лекарственным соединениям формулы Ib:
или к их фармацевтически приемлемым солям или сольватам,
где: R2 выбран из водорода и С1-С8алкила;
R3 выбран из водорода, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из водорода, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла), где R5 выбран из Н и метила, либо R4 и R5, взятые вместе с атомом углерода, с которым они связаны, образуют кольцо формулы -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арильной группы или С3-С8гетероцикла;
Z представляет собой -О-, -S-, -NH- или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)m-СН(R15)2;
m равно целому числу от 1 до 1000;
R13 представляет собой С2-С8-алкил;
R14 представляет собой Н или С1-С8алкил;
каждый из R15 независимо представляет собой Н, СООН, -(СН2)n-N(R16)2, (СН2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
каждый из R16 независимо представляет собой Н, С1-С8алкил или -(СН2)n-СООН, и
n равно целому числу от 0 до 6.
Соединения формулы (Ib) могут быть использованы для лечения рака, аутоиммунного заболевания или инфекционного заболевания у пациента, либо они могут быть использованы в качестве промежуточного соединения для синтеза конъюгатов “лекарственное средство-линкер”, “лекарственное средство-линкер-лиганд” и “лекарственное средство-лиганд”, в которых указанное лекарственное средство является отщепляемым компонентом.
В другом своем аспекте настоящее изобретение относится к композициям, включающим эффективное количество конъюгата “лекарственное средство-линкер-лиганд” и фармацевтически приемлемый носитель или наполнитель.
В другом своем аспекте настоящее изобретение относится к фармацевтическим композициям, включающим эффективное количество соединения “лекарственное средство-линкер” и фармацевтически приемлемый носитель или наполнитель.
В еще одном своем аспекте настоящее изобретение относится к композициям, включающим эффективное количество конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”, и фармацевтически приемлемый носитель или наполнитель.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лечения рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лечения рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования репликации клетки, которая экспрессирует аутоиммунное антитело, где указанный способ включает введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования репликации клетки, которая экспрессирует аутоиммунное антитело, где указанный способ включает введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лизиса или ингибирования репликации клетки, которая экспрессирует аутоиммунное антитело, где указанный способ включает введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам лечения инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам лечения инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам лечения инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам лизиса размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения опухолевых клеток или раковых клеток, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам профилактики рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам профилактики рака, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам предотвращения размножения клеток, экспрессирующих аутоиммунное антитело, где указанные способы включают введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения клеток, экспрессирующих аутоиммунное антитело, где указанные способы включают введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам предотвращения размножения клеток, экспрессирующих аутоиммунное антитело, где указанные способы включают введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам профилактики аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам профилактики аутоиммунного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В еще одном своем аспекте настоящее изобретение относится к способам профилактики инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества соединения “лекарственное средство-линкер”.
В другом своем аспекте настоящее изобретение относится к способам профилактики инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к способам профилактики инфекционного заболевания, включающим введение пациенту, нуждающемуся в этом, эффективного количества конъюгата “лекарственное средство-лиганд”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В другом своем аспекте настоящее изобретение относится к лекарственному соединению, которое может быть использовано в качестве промежуточного соединения для синтеза соединения “лекарственное средство-линкер”, содержащего компонент “лекарственное средство”, отщепляемый от указанного конъюгата “лекарственное средство-лиганд”.
В другом своем аспекте настоящее изобретение относится к соединению “лекарственное средство-линкер”, которое может быть использовано в качестве промежуточного соединения для синтеза конъюгата “лекарственное средство-линкер-лиганд”.
В другом своем аспекте настоящее изобретение относится к соединениям формулы Ia':
| Ab--(Aa--Ww--Yy--D)P | (Ia') |
или к их фармацевтически приемлемым солям или сольватам,
где: Ab-представляет собой антитело, включая антитело, которое связывается с CD30, CD40, CD70 и антигеном Lewis-Y;
А представляет собой удлиняющий компонент;
а равно 0 или 1,
каждый из -W- независимо представляет собой аминокислотный компонент,
w равно целому числу от 0 до 12,
Y означает спейсерный компонент,
у равно 0, 1 или 2,
р составляет в пределах от 1 примерно до 20; и
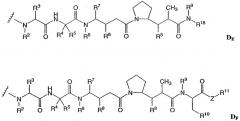
D представляет собой компонент “лекарственное средство”, выбранный из соединений формул DE и DF;
где в каждом положении независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5, взятые вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
каждый из R8 независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и О-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z представляет собой О, S, NH или -NR12, где R12 представляет собой С1-С8алкил;
R11 выбран из Н, С1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или (R13O)