Твердая индивидуальная дозированная лекарственная форма с высоким содержанием 2-этил-6-метил-3-пиридин-3-ола гидрохлорида и способ ее получения
Иллюстрации
Показать всеНастоящее изобретение относится к химико-фармацевтической промышленности и касается твердой индивидуальной дозированной лекарственной формы, обладающей выраженным антистрессорным, умеренным транквилизирующим, ноотропным, антиамнестическим и антигипоксическим действием, включающей в качестве активного компонента эффективное количество 2-этил-6-метил-3-пиридин-3-ола гидрохлорида и фармацевтически приемлемые вспомогательные вещества, которая содержит 65,0-92,5 масс.% 2-этил-6-метил-3-пиридин-3-ола гидрохлорида, 25,6-2,5 масс.% кальция фосфата двузамещенного в качестве наполнителя, 0,4-1,9 масс.% оксипропилцеллюлозы в качестве связующего и 9,0-0,6 масс.% веществ, обеспечивающих текучесть и предотвращающих налипание. Указанная лекарственная форма может быть приготовлена в виде таблетки с риской, которая необязательно покрыта оболочкой. Также изобретение обеспечивает способ получения указанной твердой индивидуальной дозированной лекарственной формы. Заявленное изобретение обладает повышенной биодоступностью и сроком хранения до 5 лет. 2 н. и 1 з.п. ф-лы, 9 пр., 7 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области фармакологии. Более конкретно, изобретение относится к получению твердых дозированных лекарственных форм с высоким содержанием 2-этил-6-метил-3-пиридин-3-ола гидрохлорида (метилэтилпиридинола гидрохлорида), обладающих высокой биологической доступностью и имеющих продолжительный срок годности.
Предшествующий уровень техники
Лекарственные препараты, содержащие метилэтилпиридинол в виде фармацевтически приемлемых солей, обладают выраженным антистрессорным, умеренным транквилизирующим, ноотропным, антиамнестическим и антигипоксическим действием. Вследствие этого их применяют, например, при лечении легких когнитивных расстройств, тревожных и других невротических состояний, нейроциркуляторной дистонии, а также в наркологии для улучшения состояния пациентов, страдающих алкогольной или наркотической зависимостью, как при острой интоксикации, так и на стадии абстиненции.
Известные дозированные формы включают стерильные растворы для инъекций и твердые препараты. Для внутривенного и внутримышечного введения применяют 5% раствор метилэтилпиридинола сукцината (товарные знаки: мексидол, мексиприм, мексифин) в воде для инъекций, необязательно содержащий натрия метабисульфит в качестве антиоксиданта. Препарат помещают в ампулы по 2 или 5 мл. Для перорального введения применяют таблетки, покрытые оболочкой, или твердые капсулы, содержащие 100-125 мг метилэтилпиридинола сукцината и фармацевтически приемлемые вспомогательные вещества.
В патенте РФ 2065299 (опубл. 20.08.1996) раскрыты таблетки, покрытые оболочкой, содержащие 16,7-41,6 масс.% мексидола, 16,7-33,3 масс.% глины белой, такое же количество крахмала картофельного, по 0,3-0,5 масс.% кальция стеарата, кислоты стеариновой и метилцеллюлозы, а также 0,5-1,0 масс.% талька. Таблетка покрыта оболочкой, содержащей (в процентах от массы оболочки) 25,0-50,0% метилцеллюлозы и по 8,3-25% твин-80 и диоксида титана. Несмотря на значительное суммарное содержание крахмала и глины белой (33-67 масс.%) в составе ядра таблетки не удается достичь стабильного качества таблеток, и, начиная со стадии изготовления, ядро желтеет.
В патенте РФ 2144822 (опубл. 27.01.2000) описан состав массы для заполнения желатиновых капсул (по 0,1 г активного компонента на капсулу), содержащей 50 масс.% мексидола, 40,5-50,5 масс.% крахмала картофельного, 2,4-2,8 масс.% поливинилпирролидона, 0,9-1,1 масс.% магния стеарата, 0,9-1,1 масс.% талька.
В патенте РФ 2145855 (опубл. 27.02.2000) раскрыт состав другой массы для заполнения аналогичных капсул. Масса содержит 30-60 масс.% мексидола, 17,0-35 масс.% крахмала картофельного, 2,5-3,5 масс.% поливинилпирролидона, 0,8-1,2 масс.% магния стеарата, 7,7-12,2 масс.% микрокристаллической целлюлозы, 12,0-18,0 масс.% сахара молочного. Основным недостатком предложенных составов является снижение их качества при хранении. Кроме того, высокое содержание сахара молочного и крахмала (от 29% до 53 масс.% суммарно) создает предпосылки для контаминации хранящегося препарата микроорганизмами и продуктами их жизнедеятельности.
В патенте 2205640 (опубл. 10.06.2003) описаны фармацевтические составы, представляющие собой раствор для инъекций, гранулированный порошок для капсулирования и состав для таблетирования, отличающиеся тем, что они дополнительно содержат 0,5-5,0 масс.% янтарной кислоты. В описании изобретения к патенту указано, что янтарная кислота применяется в качестве стабилизатора, а также повышает содержание восстановленного глутатиона, т.е. оказывает дополнительное биологическое действие.
Раскрытый в указанном патенте гранулированный порошок для капсулирования содержит 50,0-60,0 масс.% мексидола, 0,5-5,0 масс.% янтарной кислоты, 0,0-0,2 масс.% трилона Б, 25,0-35,0 масс.% целлюлозы микрокристаллической, 15,0-20,0 масс.% крахмала, 4,0-6,0 масс.% поливинилпирролидона низкомолекулярного, 0,9-1,3 масс.% магния стеарата и 0,8-1,1 масс.% талька. Фармацевтический состав, предназначенный для таблетирования, содержит 50,0-60,0 масс.% мексидола, 0,5-5,0 масс.% ятарной кислоты, 0,0-0,2 масс.% трилона Б, 14,0-25,0 масс.% целлюлозы микрокристаллической, 15,0-25,0 масс.% крахмала, 4,0-6,0 масс.% поливинилпирролидона низкомолекулярного, 0,0-5,0 масс.% натрия крахмала гликолята, 0,8-1,0 масс.% магния стеарата, 0,0-1,0 масс.% талька и 0,0-3,0 масс.% коллидона CL. Предложенные составы стабильны в течение 2 лет.
Главным недостатком всех известных твердых лекарственных форм является невысокое содержание активного компонента (не более 60 масс.%). В частности, следствием этого является увеличение массы и размера таблетки или капсулы, содержащей терапевтически эффективное количество активного компонента. Это может создавать трудности при введении, особенно пациентам, страдающим невротическими расстройствами. Кроме того, необходимость введения существенных количеств вспомогательных веществ и нанесения защитных оболочек сложного состава для обеспечения длительного срока годности увеличивает себестоимость производства готового продукта вследствие повышения доли затрат на материалы и технологическое оборудование.
Таким образом, существует потребность в создании препаратов с высоким содержанием метилэтилпиридинола, имеющих продолжительный срок годности.
Описание изобретения
Целью настоящего изобретения является создание твердых дозированных лекарственных форм с высоким содержанием метилэтилпиридинола гидрохлорида, имеющих продолжительный срок годности и удовлетворяющих всем требованиям Государственной Фармакопеи РФ.
Авторы настоящего изобретения провели обширные исследования для преодоления недостатков известного уровня техники и создали твердые индивидуальные дозированные формы, отвечающие всем требованием Государственной Фармакопеи РФ, содержащие существенно меньшее число компонентов в меньших количествах по отношению к метилэтилпиридинола гидрохлориду в качестве активного компонента.
В соответствии с первым воплощением настоящего изобретения предлагается твердая индивидуальная дозированная форма с высоким содержанием метилэтилпиридинола гидрохлорида, обладающая выраженным антистрессорным, умеренным транквилизирующим, ноотропным, антиамнестическим и антигипоксическим действием, включающая в качестве активного компонента эффективное количество 2-этил-6-метил-3-пиридин-3-ола гидрохлорида и фармацевтически приемлемые вспомогательные вещества, содержащая 65,0-92,5 масс.% 2-этил-6-метил-3-пиридин-3-ола гидрохлорида, 25,6-2,5 масс.% наполнителя, 0,4-1,9 масс.% связующего и 9,0-0,6 масс.% веществ, обеспечивающих текучесть и предотвращающих налипание.
В предпочтительном варианте лекарственной формы наполнители выбраны из группы, состоящей из лактозы, кальция фосфата двузамещенного, микрокристаллической целлюлозы, связующие выбраны из группы, состоящей из крахмала, поливинилпирролидона, оксипропилцеллюлозы, а вещества, обеспечивающие текучесть и предотвращающие налипание, выбраны из группы, состоящей из кальция стеарата, магния стеарата, аэросила.
Термин «твердая индивидуальная дозированная форма» обозначает физически дискретную часть фармацевтической композиции, содержащую определенное количество активного компонента.
Термин «капсула» имеет общепринятое в данной области значение и предпочтительно относится к твердым капсулам, более предпочтительно к твердым желатиновым капсулам.
В первом предпочтительном варианте твердой желатиновой капсулы связующим является оксипропилцеллюлоза, а веществом, обеспечивающим текучесть и предотвращающим налипание, является аэросил.
Во втором предпочтительном варианте твердой желатиновой капсулы связующим является поливинилпирролидон или крахмальный клейстер, а веществом, обеспечивающим текучесть и предотвращающим налипание, является аэросил.
Термин «таблетка» имеет общепринятое в данной области значение и предпочтительно относится к плоскоцилиндрическим таблеткам с риской, более предпочтительно дополнительно покрытым оболочкой.
В предпочтительном варианте таблетки с риской наполнитель выбран из группы, состоящей из лактозы и кальция фосфата двузамещенного, связующее выбрано из группы, состоящей из оксипропилцеллюлозы и поливинилпирролидона, а веществом, обеспечивающим текучесть и предотвращающим налипание, является стеарат магния.
В еще более предпочтительном варианте таблетка покрыта оболочкой Opadry на основе поливинилацетата, причем масса оболочки составляет не более 2,5% от массы лекарственной формы.
Указанные твердые дозированные лекарственные формы могут быть приготовлены общепринятыми способами, например влажным гранулированием, с применением вспомогательных веществ, известных специалисту в данной области: наполнителей, связующих, веществ, обеспечивающих текучесть, прочность, веществ, предотвращающих слипание, покрывных составов и т.д.
В качестве наполнителей могут применяться, например, лактоза, кальций фосфат двузамещенный, микрокристаллическая целлюлоза. Связующими могут являться различные виды крахмала, поливинилпирролидон, оксипропилцеллюлоза. Для обеспечения текучести и препятствования слипанию в композицию могут быть введены кальция стеарат, магния стеарат, аэросил.
Для предохранения активного компонента от окисления, индуцированного действием тепла, света и влаги, его можно вводить в твердые капсулы, например желатиновые капсулы. Альтернативно твердая лекарственная форма в соответствии с настоящим изобретением может быть представлена в виде таблеток, покрытых оболочкой. При выборе покрывной композиции специалист должен руководствоваться технологическими параметрами процесса нанесения покрытия, защитными свойствами, а также требованиями, предъявляемыми к готовой дозированной форме.
В частности, можно применять водные покрывные композиции на основе поливинилового спирта, поливинилацетата и поливинилацетатфталата. Примеры покрывных композиций на основе поливинилового спирта включают, без ограничения, группы продуктов, выпускаемых фирмами DuPont (товарный знак Elvanol) и Sekisui Specialty Chemicals (товарный знак Celvol). Покрывные композиции на основе поливинилацетата и поливинилацетатфталата включают, без ограничения, продукты, выпускаемые BSPI Holdings LLC (товарный знак Opadry). Выбор подходящего продукта находится в компетенции среднего специалиста в данной области. В частности, предпочтительны покрывные композиции Opadry и Opadry II, а для обеспечения большей защиты от атмосферной влаги без ущерба для распадаемости в условиях введения наиболее предпочтительна композиция Opadry amb на основе поливинилацетатфталата.
В соответствии со вторым воплощением настоящего изобретения предлагается способ получения твердой индивидуальной дозированной формы, для осуществления которого:
1) готовят воду очищенную для выполнения всех технологических и вспомогательных операций, удовлетворяющую всем требованиям действующих нормативных документов,
2) готовят раствор увлажнителя, содержащего 5-10 масс.% связующего, увеличивающего сцепление между частицами компонентов смеси для заполнения капсул или таблетирования,
3) проводят раздельный просев метилэтилпиридинола гидрохлорида и, при необходимости, вспомогательных веществ, таких как наполнители, через сита с размером отверстий 0,10-0,25 мм,
4) смешивают просеянные метилэтилпиридинола гидрохлорид и наполнители до получения однородной массы,
5) увлажняют полученную массу раствором увлажнителя до равномерного распределения влаги,
6) увлажненную массу гранулируют,
7) влажные гранулы сушат при температуре 40-50°С до достижения остаточной влажности 1,5-4,0%,
8) высушенные гранулы подвергают сухой грануляции и опудриванию веществом, улучшающим текучесть гранул и снижающим их слипание,
9) полученные гранулы прессуют в таблетки, которые затем обеспыливают и необязательно покрывают оболочкой при температуре ядер таблеток от 30 до 50°С, температуре на входе в аппарат от 50 до 80°С и относительной влажности менее 50%, или
полученными гранулами наполняют капсулы, предпочтительно твердые желатиновые капсулы, и
10) готовые индивидуальные дозированные формы упаковывают и на упаковку наносят маркировку для идентификации препарата и прикладывают указания к применению.
Выбор аппаратуры для выполнения указанных операций находится в пределах компетенции среднего специалиста в данной области, который должен принять во внимание ограничения, налагаемые свойствами метилэтилпиридинола гидрохлорида и вспомогательных веществ на технологические параметры процессов.
В частности, вода очищенная должна удовлетворять всем требованиям нормативных документов, действующих в данной области. Воду такого качества готовят, например, в аквадистилляторе. Сита для просеивания выбирают исходя из особенностей устройства аппаратов для гранулирования, таблетирования или заполнения капсул. Желательно, чтобы размер отверстий сит составлял 0,10-0,25 мм. Для сушки используют, например, сушильные шкафы, во всем объеме которых равномерно поддерживается температура 40-50°С. Таблетирование осуществляют с применением общеизвестных стандартных аппаратов, таких как, например, таблетировочные машины со сменными пуансонами и матрицами.
Нанесение покрывных композиций в виде водной суспензии желательно проводить при температуре ядер таблеток от 30 до 50°С, температуре на входе в аппарат от 50 до 80°С и относительной влажности менее 50%. Чтобы обеспечить сохранение свойств метилэтилпиридинола гидрохлорида на стадии производства и обеспечить требуемую устойчивость готовой лекарственной формы в виде таблетки с пленочным покрытием, следует обеспечить остаточное влагосодержание не более 4%, предпочтительно не более 3%.
Следующие примеры иллюстрируют частные предпочтительные воплощения настоящего изобретения.
Пример 1. Твердые желатиновые капсулы
Для выполнения всех технологических и вспомогательных операций в аквадистилляторе готовят воду очищенную, удовлетворяющую всем требованиям нормативных документов, действующих в данной области. Перемешиванием до полного растворения 5,0 г поливинилпирролидона с 45 мл воды очищенной готовят 10% раствор поливинилпирролидона, применяемый в качестве увлажнителя для увеличения сцепления между частицами компонентов смеси для таблетирования.
Проводят раздельный просев метилэтилпиридинола гидрохлорида, наполнителя на основе кукурузного крахмала и прежелатинизированного крахмала (товарный знак StarCap 1500, зарегистрированный BPSI Holdings, LLC) и микрокристаллической целлюлозы через сита с размером отверстий 0,15 мм. Просеянные метилэтилпиридинола гидрохлорид (0,153 кг), микрокристаллическую целлюлозу (0,003 кг) и наполнитель StarCap 1500 (0,003 кг) смешивают в шаровой мельнице в течение 30 минут.
Далее выполняют влажную грануляцию и сушку, для чего сначала в той же шаровой мельнице к сухой смеси добавляют 10% раствор поливинилпирролидона (3×10 мл) до равномерного распределения влаги. Увлажненную массу гранулируют, пропуская через гранулятор с размером отверстий 1,0 мм. Влажные гранулы сушат в сушильном шкафу при температуре 40°С до достижения остаточной влажности 2,0-3,5%.
Высушенные гранулы далее подвергают сухой грануляции и опудриванию. Для этого высушенные гранулы пропускают через гранулятор с размером отверстий 1,0 мм. Для улучшения текучести гранул и снижения слипания к грануляту добавляют магния стеарат в количестве 1,558 г (1% от общей массы). Опудривание проводят в течение 10 мин.
Затем в аппарате для капсулирования заполняют открытые твердые желатиновые капсулы (размер №1) полученной массой, а затем закрывают капсулы. Готовые наполненные капсулы упаковывают в блистеры (по 10 или 20 штук) или в банки полимерные с винтовой горловиной и навинчиваемой крышкой для лекарственных средств и витаминов (по 30 или 50 штук). На упаковку наносят маркировку для идентификации препарата и прикладывают указания к применению.
Распадаемость: 5-7 минут.
В таблице 1 приведен абсолютный и относительный состав содержимого капсулы.
| Таблица 1 | ||
| Наименование компонентов | Содержание в одной капсуле | |
| г | % | |
| Метилэтилпиридинола гидрохлорид | 0,250 | 92,6 |
| Микрокристаллическая целлюлоза | 0,007 | 2,6 |
| Наполнитель на основе крахмала (StarCap 1500) | 0,005 | 1,9 |
| Поливинилпирролидон | 0,005 | 1,9 |
| Магния стеарат | 0,003 | 1,0 |
| Масса содержимого капсулы | 0,270 | 100,0 |
Пример 2. Твердые желатиновые капсулы
Повторяют методику получения капсул, приведенную в примере 1, применяя для смешивания шаровую мельницу меньшего размера или ступку и пестик. Тщательно гомогенизируют предварительно просеянные порошки метилэтилпиридинола гидрохлорида (2,5 г) и микрокристаллической целлюлозы (1,1 г). Полученную смесь увлажняют необходимым объемом 5,0% водного раствора оксипропилцеллюлозы, гранулируют и сушат до остаточной влажности 1,5-2,5%. Высушенные гранулы размалывают в грануляторе, после чего опудривают 0,31 г аэросила. Полученный гранулят помещают в твердые желатиновые капсулы из расчета 0,250 г мексидола в капсуле.
Распадаемость: 5-7 минут.
В таблице 2 приведен абсолютный и относительный состав содержимого капсулы.
| Таблица 2 | ||
| Наименование компонентов | Содержание в одной капсуле | |
| г | % | |
| Метилэтилпиридинола гидрохлорид | 0,250 | 63,4 |
| Микрокристаллическая целлюлоза | 0,110 | 27,9 |
| Оксипропилцеллюлоза | 0,003 | 0,8 |
| Аэросил | 0,031 | 7,9 |
| Масса содержимого капсулы | 0,394 | 100,0 |
Пример 3. Твердые желатиновые капсулы
Повторяют методику получения капсул, приведенную в примере 2, применяя в качестве связующего 5,0% водный раствор поливинилпирролидона. Распадаемость: 6-8 минут.
В одной капсуле содержится 0,250 г (63,4 масс.%) метилэтилпиридинола гидрохлорида.
Пример 4. Твердые желатиновые капсулы
Повторяют методику получения капсул, приведенную в примере 2, применяя в качестве связующего 5,0% крахмальный клейстер, а для опудривания используют 0,36 г кальция стеарата. Распадаемость: 5-8 минут.
В таблице 3 приведен абсолютный и относительный состав содержимого капсулы.
| Таблица 3 | ||
| Наименование компонентов | Содержание в одной капсуле | |
| г | % | |
| Метилэтилпиридинола гидрохлорид | 0,250 | 62,5 |
| Микрокристаллическая целлюлоза | 0,110 | 27,5 |
| Крахмальный клейстер | 0,004 | 1,0 |
| Кальция стеарат | 0,036 | 9,0 |
| Масса содержимого капсулы | 0,400 | 100,0 |
Пример 5. Таблетки
Для выполнения всех технологических и вспомогательных операций в аквадистилляторе готовят воду очищенную, удовлетворяющую всем требованиям нормативных документов, действующих в данной области. Перемешиванием до полного растворения 5,0 г поливинилпирролидона с 90 мл воды очищенной готовят 5% раствор оксипропилцеллюлозы, применяемый в качестве увлажнителя для увеличения сцепления между частицами компонентов смеси для таблетирования.
Проводят раздельный просев метилэтилпиридинола гидрохлорида и лактозы в качестве наполнителя через сита с размером отверстий 0,15 мм. Просеянные метилэтилпиридинола гидрохлорид (25,0 г) и лактозу (10,0 г) в течение 30 минут смешивают в шаровой мельнице. Полученную массу в той же мельнице увлажняют 5% необходимым объемом 5,0% водного раствора оксипропилцеллюлозы до равномерного распределения влаги. Увлажненную массу гранулируют, пропуская через гранулятор с размером отверстий 1,0 мм.
Влажные гранулы сушат в сушильном шкафу при температуре 45°С до достижения остаточной влажности 1,5-2,5%. Высушенные гранулы далее подвергают сухой грануляции, для чего их пропускают через гранулятор с размером отверстий 1,0 мм, а затем опудривают в течение 10 минут магния стеаратом (0,35 г) для улучшения текучести гранул и снижения их слипания.
Полученные гранулы прессуют в таблетки по 0,350 г на таблеточном прессе «Korsch», снабженном сферическими пуансонами. Таблетки обеспыливают на металлическом сите с размером отверстий 3-4 мм. Получают таблетки массой 0,350 г, содержащие 0,250 г метилэтилпиридинола гидрохлорида.
Распадаемость: 5-7 минут.
В таблице 4 приведен абсолютный и относительный состав таблетки.
| Таблица 4 | ||
| Наименование компонентов | Содержание в одной капсуле | |
| г | % | |
| Метилэтилпиридинола гидрохлорид | 0,250 | 64,1 |
| Лактоза | 0,100 | 25,6 |
| Оксипропилцеллюлоза | 0,005 | 0,4 |
| Магния стеарат | 0,035 | 8,9 |
| Масса таблетки | 0,390 | 100,0 |
Пример 6. Таблетки
Повторяют методику получения таблеток, приведенную в примере 5, применяя в качестве наполнителя кальций фосфат двузамещенный, а в качестве связующего используют 5,0% раствор поливинилпирролидона.
Распадаемость: 6-8 минут.
В одной таблетке содержится 0,250 г (64,1 масс.%) метилэтилпиридинола гидрохлорида.
Пример 7. Таблетки, покрытые оболочкой
Для выполнения всех технологических и вспомогательных операций в аквадистилляторе готовят воду очищенную, удовлетворяющую всем требованиям нормативных документов, действующих в данной области. Перемешиванием до полного растворения 5,0 г поливинилпирролидона с 45 мл воды очищенной готовят 10% раствор поливинилпирролидона, применяемый в качестве увлажнителя для увеличения сцепления между частицами компонентов смеси для таблетирования.
Проводят раздельный просев метилэтилпиридинола гидрохлорида, наполнителя на основе кукурузного крахмала и прежелатинизированного крахмала (товарный знак StarCap 1500, зарегистрированный BPSI Holdings, LLC) и магния стеарата через сита с размером отверстий 0,15 мм. Просеянные метилэтилпиридинола гидрохлорид (425,0 г), StarCap 1500 (25,5 г) и микрокристаллическую целлюлозу (127,5 г) в течение 30 минут смешивают в смесителе, имеющем сигмообразные лопасти. Полученную массу в том же смесителе увлажняют 10% раствором поливинилпирролидона (3×10 мл) при постоянном перемешивании до равномерного распределения влаги. Увлажненную массу гранулируют, пропуская через гранулятор с размером отверстий 1,0 мм.
Влажные гранулы сушат в сушильном шкафу при температуре 40°С до достижения остаточной влажности 2,0-3,5%. Высушенные гранулы далее подвергают сухой грануляции, для чего их пропускают через гранулятор с размером отверстий 1,0 мм, а затем опудривают в течение 10 минут, применяя магния стеарат (3,4 г, 1% от общей массы) для улучшения текучести гранул и снижения их слипания.
Полученные гранулы прессуют в таблетки по 0,350 г на таблеточном прессе «Korsch», снабженном сферическими пуансонами. Полученные таблетки обеспыливают на металлическом сите с размером отверстий 3-4 мм. Масса полученных ядер таблеток 490,0 г (приблизительно 1400 таблеток).
Нанесение покрытия на ядра таблеток начинают с приготовления 20% суспензии комплексной покрывной системы на основе поливинилацетата (товарный знак Opadry, зарегистрированный BPSI Holdings, LLC). К 60 мл очищенной воды при интенсивном перемешивании порциями добавляют порошок Opadry (15,0 г), не допуская его накопления в объеме. Покрывную суспензию перемешивают 15-20 минут, а затем фильтруют через капроновое сито №23.
Ядра таблеток покрывают оболочкой в аппарате барабанного типа при условиях, указанных далее. Температура воздуха на входе: 30±2°С, температура воздуха на выходе: 28±1°С, давление: 2,5±0,5 бар, расход покрывной суспензии через форсунку: 8+1 мл/мин, предварительный прогрев ядер: 10 мин до 45-50°С, время распыления суспензии: 30-40 мин, окончательная сушка ядер - 10 мин. Процесс нанесения покрытия проводят до получения прироста массы 3-5%.
Готовые таблетки, покрытые оболочкой, упаковывают в блистеры (по 10 штук) или в банки полимерные с винтовой горловиной и навинчиваемой крышкой для лекарственных средств и витаминов (по 30 штук). На упаковку наносят маркировку для идентификации препарата и прикладывают указания к применению.
В таблице 5 приведен абсолютный и относительный состав таблетки.
| Таблица 5 | ||
| Наименование компонентов | Содержание в одной | |
| капсуле | ||
| г | % | |
| Метилэтилпиридинола | ||
| гидрохлорид | 0,25 | 70,8 |
| Микрокристаллическая | ||
| целлюлоза | 0,075 | 21,2 |
| Наполнитель на основе | ||
| крахмала (StarCap 1500) | 0,015 | 4,2 |
| Поливинилпирролидон | 0,002 | 0,6 |
| Магния стеарат | 0,002 | 0,6 |
| Покрывной состав Opadry | 0,009 | 2,5 |
| Масса таблетки | 0,390 | 100,0 |
Пример 8. Установление соответствия полученных таблеток требованиям Государственной Фармакопеи РФ.
Из партии таблеток формируют представительную выборку и проводят исследования физико-химических свойств в соответствии с указаниями Государственной Фармакопеи РФ (ГФ XI), ссылки на которые даны в таблице 6.
| Таблица 6 | ||
| Показатель | Норма | Метод испытания |
| Средняя масса | 0,337-0,373 г | ГФ XI, вып.2, с.154 |
| Отклонение от | 18/20:±7,5% | ГФ XI, вып.2, с.154 |
| средней массы | 2/20:±15% | |
| Распадаемость | не более 15 минут | ГФ XI, вып.2, с.154 |
| Однородность | 10/10:±15% или | Спектрофотометрия в УФ-области |
| дозирования | 28/30:±15% | |
| 0/30: не более±25% | ||
| Посторонние примеси | не более 1,5% | ВЭЖХ |
| Микробиологическая чистота | Категория 3А | ГФ XI, вып.2, с.193 и Изм. №2 от 01.01.2002 |
| Количественное содержание | 0,231-0,269 г (0,25±7,5%) | Спектрофотометрия в УФ-области |
В результате исследований выборок из партий таблеток, полученных в соответствии с примерами 4-6, было установлено, что партии удовлетворяют требованиям Издания XI Государственной Фармакопеи РФ.
Пример 9. Установление соответствия полученных таблеток требованиям, предъявляемым к препаратам при хранении
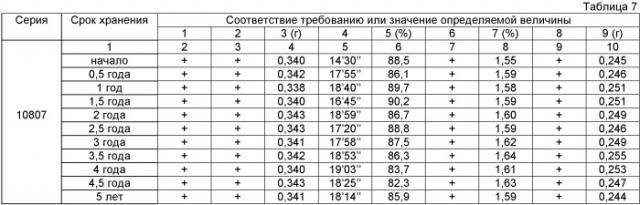
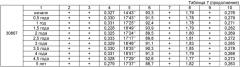
Препарат «Эмоксипин, таблетки, покрытые оболочкой, 250 мг» хранили в плотно закрытых полимерных банках при температуре 25±5°С и относительной влажности окружающего воздуха 75±10%. Через каждые полгода открывали по одной банке из каждой серии препарата и оценивали 10 случайно выбранных таблеток на соответствие требованиям 1-9, перечисленным ниже.
Требование 1 - Описание: Таблетки, покрытые оболочкой оранжевого цвета двояковыпуклой формы. На поперечном разрезе видны два слоя - внутренний (ядро) белого цвета и наружный (тонкая оболочка) оранжевого цвета.
Требование 2 - Подлинность: Удостоверяется методами УФ-спектрофотометрии и тонкослойной хроматографии (ТСХ).
Требование 3 - Средняя масса и отклонение от средней массы содержимого таблеток: от 0,297 до 0,397 г.
Требование 4 - Распадаемость: не более 20' (минут).
Требование 5 - Растворение: в раствор через 45 мин должно перейти не менее 75% метилэтилпиридинола гидрохлорида.
Требование 6 - Посторонние примеси: не более 0,5% (ТСХ).
Требование 7 - Потеря в массе при высушивании: не более 2,0%.
Требование 8 - Микробиологическая чистота: препарат должен быть микробиологически чистым.
Требование 9 - Количественное определение активного вещества: от 0,18 до 0,30 г.
Оценки образцов таблеток, отобранных из 3 различных партий, на соответствие требованиям 1-9 приведены в Таблице 7.
Приведенные выше данные показывают, что препарат «Эмоксипин, таблетки, покрытые оболочкой, 250 мг», полученный в соответствии с настоящим изобретением, имеет срок хранения 5 лет.
1. Твердая индивидуальная дозированная лекарственная форма в виде таблетки, обладающая выраженным антистрессорным, умеренным транквилизирующим, ноотропным, антиамнестическим и антигипоксическим действием, включающая в качестве активного компонента эффективное количество 2-этил-6-метил-3-пиридин-3-ола гидрохлорида и фармацевтически приемлемые вспомогательные вещества, отличающаяся тем, что она содержит 65,0-92,5 мас.% 2-этил-6-метил-3-пиридин-3-ола гидрохлорида, 25,6-2,5 мас.% кальция фосфата двузамещенного в качестве наполнителя, 0,4-1,9 мас.% оксипропилцеллюлозы в качестве связующего и 9,0-0,6 мас.% веществ, обеспечивающих текучесть и предотвращающих налипание.
2. Лекарственная форма по п.1, отличающаяся тем, что таблетка покрыта оболочкой Opadry на основе поливинилацетата, причем масса оболочки составляет не более 2,5% от массы лекарственной формы.
3. Способ получения твердой индивидуальной лекарственной формы по п.1 или 2, отличающийся тем, что при его осуществлении1) готовят воду очищенную для выполнения всех технологических и вспомогательных операций, удовлетворяющую всем требованиям действующих нормативных документов,2) готовят раствор увлажнителя, содержащего 5-10 мас.% связующего, увеличивающего сцепление между частицами компонентов смеси для таблетирования,3) проводят раздельный просев метилэтилпиридинола гидрохлорида и, при необходимости, вспомогательных веществ, таких как наполнители, через сита с размером отверстий 0,10-0,25 мм,4) смешивают просеянные метилэтилпиридинола гидрохлорид и наполнители до получения однородной массы,5) увлажняют полученную массу раствором увлажнителя до равномерного распределения влаги,6) увлажненную массу гранулируют,7) влажные гранулы сушат при температуре 40-50°С до достижения остаточной влажности 1,5-4,0%,8) высушенные гранулы подвергают сухой грануляции и опудриванию веществом, улучшающим текучесть гранул и снижающим их слипание,9) полученные гранулы прессуют в таблетки, которые затем обеспыливают и необязательно покрывают оболочкой при температуре ядер таблеток от 30 до 50°С, температуре на входе в аппарат от 50 до 80°С и относительной влажности менее 50%, и10) готовые индивидуальные дозированные формы в виде таблеток упаковывают, и на упаковку наносят маркировку для идентификации препарата, и прикладывают указания к применению.