Онкогенное ras-специфичное цитотоксическое соединение и способы его применения
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и предназначена для лечения рака. Используются способы и композиция, содержащие 1-[(4-хлорфенил)метил]-1Н-индол-3-карбоксальдегид и/или его аналоги или производные. Группа изобретений позволяет повысить эффективность лечения рака путем ингибирования активности мутантного RAS-белка. 3 н. и 21 з.п. ф-лы, 6 табл., 4 пр., 36 ил.
Реферат
Уровень техники изобретения
I. Область техники, к которой относится изобретение
Настоящее изобретение относится в основном к способам лечения рака, точнее говоря, к небольшим молекулам, которые вызывают гибель клеток и/или подавляют клеточный рост раковых клеток, в частности ras-мутантных и онкогенных раковых клеток.
II. Уровень техники
Мутации, которые приводят к активации трех онкогенных генов семейства ras, H-ras, K-ras и N-ras, часто обнаруживали во множестве типов опухолей, включая 90% случаев рака поджелудочной железы, 50% случаев колоректального рака и 50% случаев аденокарциномы легких, 50% опухолей щитовидной железы и 30% случаев миелоидного лейкоза, а в нормальных клетках подобных мутаций обнаружено не было. Из трех генов семейства ras наиболее часто встречаются в опухолях K-ras мутации, включая аденокарциному поджелудочной железы (70-90%), толстой кишки (50%) и легкого (50%). Разновидности мышей, несущих аллели K-ras, которые могут быть активированы спонтанной рекомбинацией, имеют сильную предрасположенность к ряду опухолевых типов, преимущественно к раку легких с ранним началом. Добавления мутантного гена HRAS(V12) или KRAS(V12) может быть достаточно для того, чтобы привести клетки эпителия поверхности яичников человека, иммортализованные с каталитической субъединицей человеческой теломеразной обратной транскриптазы (hTERT) и ранней геномной области SV40 для образования опухолей у бестимусных мышей. Кроме того, удаление онкогенных H-ras или K-ras, индуцируемых доксоциклином, может вызвать апоптоз опухолевых клеток и уменьшение опухолей у трансгенных мышей. Следовательно, мутации генов семейства ras играют важные роли в образовании опухоли и поддержании злокачественных фенотипов, и подобные мутации генов семейства ras служат важными мишенями противораковой терапии. Кроме того, можно также применять в качестве противовирусных терапевтических средств агенты, которые подавляют функционирование ras генов, потому что активные ras функции требуются для репликации некоторых вирусов, таких как реовирус, вирус гепатита B, вирус герпеса и коксакивирус, и некоторые аденовирусы.
Так как ras белки должны быть перемещены через внутренний листок плазматической мембраны, для того чтобы они взаимодействовали с многообразием мембранных рецепторов и модулировали трансдукцию различных сигнальных путей, которые управляют клеточным ростом, пролиферацией, дифференцированием и гибелью, на подавление ras функции были интенсивно исследованы агенты, которые нарушают посттрансляционные модификации, которые необходимы для направленной доставки ras к плазматической мембране. Например, ингибиторы фарнезилтрансферазы (FTI) были интенсивно исследованы в доклинической и клинической терапии рака. Данный подход, однако, может быть эффективным для предотвращения направленной доставки H-ras к плазматической мембране, но не K-ras и N-ras, потому что в присутствии FTI N- и K-ras белки геранилгеранилируются и переносятся к мембране. Клинические исследования отдельных анализов фазы II и фазы III также показали, что FTI не проявляет значительную моноактивность для рака легких, рака поджелудочной железы, колоректального рака, рака крови и рака простаты. Таким образом, для противораковой терапии требуются новые соединения, которые специфично вызывают гибель клеток или подавляют клеточную пролиферацию Ras-мутированных клеток.
Главной задачей терапии рака является обнаружение терапевтических агентов, которые являются высокоспецифичными к злокачественным клеткам или злокачественным тканям. Благодаря тому, что злокачественные клетки имеют те же самые пути метаболизма, как и нормальные клетки, и они принимаются как «собственные» клетки, несмотря на то, что они содержат многочисленные мутации, лекарственные средства, применяемые сегодня, действуют на клеточные мишени, которые делятся на нормальные и раковые клетки. В результате, применение общепринятой химиотерапии и лучевой терапии обычно ограничивается низким терапевтическим индексом. Фактически, большинство лекарственных средств, применяемых сегодня, были открыты благодаря их способности уничтожать быстро делящиеся раковые клетки in vitro и, таким образом, являются также токсичными по отношению к быстро делящимся нормальным клеткам, таким как кроветворные клетки-предшественники костного мозга и эпителиальные клетки слизистой оболочки желудочно-кишечного тракта (Kaelin, 2005). Тем не менее, благодаря генетическим и эпигенетическим изменениям в раковых клетках является возможным обнаружить селективные к опухоли цитотоксические агенты посредством скрининга синтетической летальности для соединений, которые уничтожают раковые клетки, но не затрагивают нормальные.
Сущность изобретения
Варианты осуществления изобретения относятся к группе соединений (онкразины, от онкогенных Ras ингибирующих соединений), которые оказывают эффекты синтетической летали на раковые клетки, в частности на раковые клетки с онкогеном K-Ras и/или атипичной протеинкиназой C. Онкразиновые соединения могут эффективно уничтожать многообразие клеток рака легких, рака толстой кишки и рака поджелудочной железы с K-Ras-мутациями при низких микромолярных или наномолярных концентрациях, но не уничтожают нормальные клетки с нормальными уровнями K-Ras дикого типа. Цитотоксические эффекты коррелировали с возбуждением апоптоза. Обработка онкразиновыми соединениями привела к аномальному внутриклеточному распределению протеинкиназы C йоты (PKCι или РКС йота), агрегации РНК сплайсингосомы или нарушению процессинга РНК. Подавление K-Ras или РКС йота посредством короткой интерферирующей РНК (киРНК) уменьшает Онкразин-индуцированный апоптоз в раковых клетках, наводя на мысль, что для Онкразин-индуцированного апоптоза необходима активность K-Ras и/или РКС йота. Онкразиновые соединения также могут подавлять экспрессию Raf-1 и TNFα-индуцированную NFκB активацию. Введение in vivo онкразиновых соединений подавляло рост человеческих ксенотрансплантированных опухолей у бестимусных мышей и увеличивало выживаемость животных с опухолью, не вызывая детектируемой токсичности. Более чем из 100 протестированных аналогов около 30 онкразиновых соединений эффективно вызывают цитотоксичность во множестве линий раковых клеток. Предполагается, что данная токсичность вызывает синтетическую летальность или Ras-белок или связанный с Ras метаболический путь. Синтетическая летальность не обязательно зависит от присутствия мутированного Ras-белка или может быть эффективной в клетках, имеющих дикий тип или модификацию Ras, т.е. модификацию, в которой нет патологических последовательностей и которая, таким образом, не рассматривается как «мутантная». Таким образом, онкразиновые соединения могли бы быть многообещающими потенциальными агентами для лечения раков, воспалительных и инфекционных заболеваний.
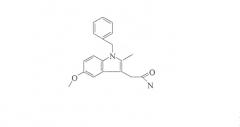
С учетом изложенного выше, для поиска соединений, которые могут специфически убивать ras-мутантные раковые клетки, в вариантах осуществления способов настоящего изобретения можно применять иммортализованные клетки эпителия поверхности яичников человека (названные T29) и их онкогенные производные, видоизмененные либо мутантным H-ras (T29H), либо мутантным K-ras (T29K), для проведения скрининга химической библиотеки (например, библиотеки компании ChemBridge) для соединений, которые могут селективно уничтожать опухолевые клетки. Некоторые соединения можно идентифицировать, так как они могут селективно уничтожать T29K, T29H или и тот и другой, но не уничтожают родительские клетки T29. Одно соединение (1-[(4-хлорфенил)метил]-1H-индол-3-карбоксальдегид или CPMIC, т.е. онкразин-1 от онкогенного Ras ингибирующего соединения 1), которое является высокоспецифичным по отношению к T29K, также очень эффективным для некоторых линий клеток рака легких с K-ras мутациями. Данное соединение не является токсичным по отношению к T29, T29H и H322 (клетки рака легких, дикий тип ras) при концентрации 33 мкМ (самая высокая исследуемая концентрация), но оно может эффективно уничтожать K-ras мутантные T29K или H460 (клетки рака легких) при концентрации 10 мкМ и 1 мкМ соответственно. Онкразин-1 также вызывает апоптоз ras-мутантных клеток, о чем свидетельствуют драматические увеличения клеток, окрашенных иодидом пропидия (PI) или красителем annexin V, деградации каспазы-3 и деградации каспазы-8. Онкразин-1 драматически уменьшает содержание raf-1, серин/треонинкиназы, которая играет решающую роль в rar-опосредованной пролиферации и выживаемости опухолевых клеток. Кроме того, было выяснено, что некоторые аналоги онкразина-1 могут вызывать более мощные Kras-селективные цитотоксические эффекты. В совокупности, данные результаты демонстрируют, что онкразин-1 и его аналоги могут вызывать онкогенные ras-селективные цитотоксические эффекты в отношении рака с минимальной токсичностью для клеток с Ras, допускающим нормальное функционирование, например, его дикий тип и модификации.
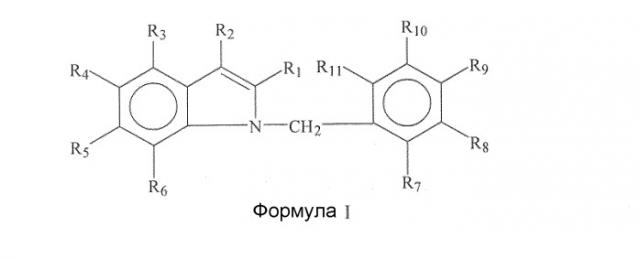
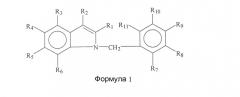
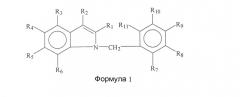
Варианты осуществления изобретения включают соединения и способы, которые могут быть терапевтическими, с пониженным риском токсичности. В основном, соединение будет иметь общую формулу или структуру, представленную формулой I.
В некоторых вариантах осуществления группы R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и/или R11 представляют собой, каждая независимо, -H, гидрокси, амино, циано, галоген, бром, хлор, нитро, меркапто или замещенный или незамещенный C1-C15-алкил, C2-C15-алкенил, C2-C15-алкинил, C6-C15-арил, C7-C15-аралкил, C1-C15-гетероарил, C2-C15-гетероаралкил, C1-C15-ацил, C1-C15-алкокси, C2-C15-алкенилокси, C2-C15-алкинилокси, C6-C15-арилокси, C7-C15-аралкокси, C1-C15-гетероарилокси, C2-C15-гетероаралкилокси, C1-C15-ацилокси, C1-C15-алкиламино, C2-C15-алкениламино, C2-C15-алкиниламино, C6-C15-ариламино, C7-C15-аралкиламино, C1-C15-гетероариламино, C2-C15-гетероаралкиламино, C2-C15-амидо, C1-C15-алкилтио, C6-C15-арилтио, C7-C15-аралкилтио, C1-C15-гетероарилтио, C2-C15-гетероаралкилтио, C1-C15-ацилтио или C0-C15-силил.
В некоторых вариантах осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и/или R11 представляют собой замещенный или незамещенный алкил, алкенил, алкинил, арил, аралкил, гетероарил, гетероаралкил, ацил, алкокси, алкенилокси, алкинилокси, арилокси, аралкокси, гетероарилокси, гетероаралкилокси, ацилокси, алкиламино, алкениламино, алкиниламино, ариламино, аралкиламино, гетероариламино, гетероаралкиламино или амидо.
В некоторых аспектах R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и/или R11 представляют собой, каждая независимо, -H, -CH3, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, -CH(CH2)2, -CH2CH2CH2CH3, -CH(CH3)CH2CH3, -CH2CH(CH3)2, -C(CH3)3, -CH2C(CH3)3, -C6H5, -C6H4CH3, -C6H4CH2CH3, -C6H4CH2CH2CH3, -C6H4CH(CH3)2, -C6H4CH(CH2)2, -C6H3(CH3)2, -C6H3(CH3)CH2CH3, F, Cl, Br, I, -OH, -OCH3, -OCH2CH3, -OCH2CH2CH3, -OCH(CH3)2, -OCH(CH2)2, -OCH2CF3, -OCOCH3, -OC6H5, -NH2, -NHCH3, -NHCH2CH3, -NHCH2CH2CH3, -NHCH(CH3)2, -NHCH(CH2)2, -N(CH3)2, -N(CH3)CH2CH3, -N(CH2CH3)2, -NHCOCH3, -NHCO2C(CH3)3, -CH2F, -CH2C1, -CH2Br, -CH2OH, -CH2OCH3, -CH2OCH2CH3, -CH2OCH2CH2CH3, -CH2OCH(CH3)2, -CH2OCH(CH2)2, -CH2OCH2CF3, -CH2OCOCH3, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CH2NHCH2CH3, -CH2N(CH3)CH2CH3, -CH2NHCH2CH2CH3, -CH2NHCH(CH3)2, -CH2NHCH(CH2)2, -CH2N(CH2CH3)2, -CH2CH2F, -CH2CH2C1, -CH2CH2Br, -CH2CH2I, -CH2CH2OH, -CH2CH2OCOCH3, -CH2CH2NH2, -CH2CH2N(CH3)2, -CH2CH2NHCH2CH3, -CH2CH2N(CH3)CH2CH3, -CH2CH2NHCH2CH2CH3, -CH2CH2NHCH(CH3)2, -CH2CH2NHCH(CH2)2, -CH2CH2N(CH2CH3)2, -CH2CH2NHCO2C(CH3)3, -CH2CH=CH2, -CH2CH=CHCH3, -CH2CH=CHCH2CH3, -CH2CH=CHCH2CH2CH3, -CH2CH=CHCH(CH3)2, -CH2CH=CHCH(CH2)2, -CF3, -CN, -CH=CH2, -CH=CHCH3, -COH, -COCH3, -COCH2CH3, -COCH2CH2CH3, -COCH(CH3)2, -COCH(CH2)2, -COCH2CF3, -COC6H5, -COC6H4CH3, -COC6H4CH2CH3, -COC6H4CH2CH2CH3, -COC6H4CH(CH3)2, -COC6H4CH(CH2)2, -COC6H3(CH3)2, -CO2H, -CO2CH3, -CO2CH2CH3, -CO2CH2CH2CH3, -CO2CH(CH3)2, -CO2CH(CH2)2, -CONH2, -CONHCH3, -CONHCH2CH3, -CONHCH2CH2CH3, -CONHCH(CH3)2, -CONHCH(CH2)2, -CON(CH3)2, -CON(CH2CH3)CH3, -CON(CH2CH3)2, -CONHCH2CF3, -C6H4CH=CH2, -C6H4CH=CHCH3, -C6H4F, -C6H4Cl, -C6H4Br, -C6H4I, -C6H4OH, -C6H4OCH3, -C6H4OCH2CH3, -C6H4OCOCH3, -C6H4OC6H5, -C6H4NH2, -C6H4NHCH3, -C6H4NHCH2CH3, -C6H4CH2C1, -C6H4CH2Br, -C6H4CH2OH, -C6H4CH2OCOCH3, -C6H4CH2NH2, -C6H4N(CH3)2, -C6H4CH2CH2C1, -C6H4CH2CH2OH, -C6H4CH2CH2OCOCH3, -C6H4CH2CH2NH2, -C6H4CH2CH=CH2, -C6H4CF3, -C6H4CN, -C6H4C=CH, -C6H4C=CCH3, -C6H4C=CSi(CH3)3, -C6H4COH, -C6H4COCH3, -C6H4COCH2CH3, -C6H4COCH2CF3, -C6H4COC6H5, -C6H4CO2H, -C6H4CO2CH3, -C6H4CONH2, -C6H4CONHCH3, -C6H4CON(CH3)2, -SH, -SCH3, -SC6H5, -SCH2C6H5, или -SCOCH3.
В некоторых аспектах R1 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегидную, сложноэфирную или кетонную группу; R2 представляет собой алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, спирт, метанол, этанол, пропанол, бутанол, карбонил, альдегид, сложный эфир, кетон, бензил или арил; R3 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R4 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир, кетон, арил, гетероарил, фуранил, индолил, тиофенил, тиазолил, имидазолил, изоксазоил, оксазоил, пиразоил, пирролил, пиразинил, пиридил, пиримидил, пиримидинил, пуринил, циннолинил, бензофуранил, бензотиенил, бензотриазолил, бензоксазолил, хинолин, изоксазолил, изохинолин, циклоалкил, алкенил, циклоалкенил, фенил или пиридил; R5 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, амид, амин, карбонил, альдегид, сложный эфир или кетон; R6 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R7 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R8 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R9 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R10 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; и/или R11 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон.
В частных аспектах R1 представляет собой группу галогена, в частности R1 представляет собой хлор или бром. В следующем аспекте R2 представляет собой гидрокси, алкокси, альдегидную, карбоксильную или карбонильную группу, в частности R2 представляет собой альдегид. Еще в одних аспектах R9 представляет собой хлор, в частности R9 представляет собой бром. Еще в одних аспектах R3 представляет собой группу галогена. В некоторых аспектах R4 представляет собой группу галогена, метиловый эфир или группу метилхинолинового эфира. В следующих аспектах R5 представляет собой метильную или амидную группу. Еще в одних аспектах R6 представляет собой алкильную группу. Еще в одних аспектах R7 представляет собой хлор или бром. В некоторых аспектах R8 представляет собой хлор или бром. В следующих аспектах R9 представляет собой хлор. Еще в одних аспектах R10 представляет собой хлор или бром. Еще в одних аспектах R11 представляет собой хлор.
n в формуле или структуре означает 0, 1, 2, 3, 4, 5 или 6.
В некоторых вариантах осуществления обеспечиваются фармацевтически приемлемая соль или пролекарство соединения. Данное изобретение также обеспечивает оптические изомеры соединений, определяемых формулой или структурой. В некоторых вариантах осуществления оптический изомер соединения, определяемого формулой или структурой, является по существу свободным от других оптических изомеров. В других вариантах осуществления два или более оптических изомера присутствуют в одинаковом составе. В некоторых из данных вариантов осуществления два оптических изомера присутствуют в приблизительно равных количествах. В некоторых вариантах осуществления изобретение обеспечивает рацемическую смесь энантиомерной пары соединений.
В некоторых вариантах осуществления соединения представляют собой 1-[(4-хлорфенил)метил]-1H-индол-3-карбоксальдегид (Онкразин 1), 1-(3-хлорбензил)-1H-индол-3-карбальдегид (Онкразин 27), 1-(4-бромбензил)-1H-индол-3-карбальдегид (Онкразин 29), сульфаниламид, N4-[(1-бензилиндол-3-ил)метилен]-N1-2-тиазолил (Онкразин 42), [1-(3,4-дихлорбензил)-1H-индол-3-ил]метанол (Онкразин 49), 1-(2-фторбензил)-1H-индол-3-карбальдегид (Онкразин 51), 1-[(4-хлорфенил)метил]-1H-индол-3-метанол (Онкразин 60), (1-[3-(трифторметил)бензил]-1H-индол-3-ил)метанол (Онкразин 63), 1-(3-нитробензил)-1H-индол-3-карбальдегид (Онкразин 68), 1-[(3-нитрофенил)метил]-1H-индол-3-метанол (Онкразин 69), 1-[(4-нитрофенил)метил]-1H-индол-3-метанол (Онкразин 71), 1-[(3-хлорфенил)метил]-1H-индол-3-метанол (Онкразин 72); и/или 1-[(4-бромфенил)метил]-1H-индол-3-метанол (Онкразин 73).
В некоторых способах в соответствии с изобретением раковая клетка является опухолевой клеткой. Кроме того, клетку можно вводить в композициях изобретения in vitro, in vivo или ex vivo. Таким образом, раковая клетка может существовать у пациента. У пациента может быть солидная опухоль. В подобных случаях варианты осуществления могут, кроме того, включать выполнение операции пациенту, такой как резекция всей или части опухоли. Композиции можно вводить пациенту до, после или одновременно с операцией. В дополнительных вариантах осуществления композиции пациентам можно также вводить непосредственно, эндоскопически, внутритрахеально, внутрь опухоли, внутривенно, внутрь пораженных тканей, внутримышечно, внутрибрюшинно, регионарно, через кожу, местно, внутриартериально, внутрипузырно или подкожно. Композиции можно вводить 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более раз; и их можно вводить каждые 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 часа; или 1, 2, 3, 4, 5, 6, 7 дней; или 1, 2, 3, 4, 5 недель; или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев.
Способы лечения рака могут, кроме того, включать проведение пациенту химиотерапии или лучевой терапии, которые можно проводить более одного раза. Химиотерапия включает, но не ограничивается, цисплатин (CDDP), карбоплатин, прокарбазин, мехлоретамин, циклофосфамид, камптотецин, ифосфамид, мелфалан, хлорамбуцил, бисульфан, нитросурея, дактиномицин, даунорубицин, доксорубицин, блеомицин, пликамицин, митомицин, этопозид (VP16), тамоксифен, таксотер, таксол, трансплатинум, 5-фторурацил, винкристин, винбластин, метотрексат, гемцитабин, оксалиплатин, иринотекан, топотекан или любой их аналог или производную модификацию. Лучевая терапия включает, но не ограничивается, рентгеновское облучение, ультрафиолетовое облучение, γ-облучение, облучение электронным пучком или микроволнами. Кроме того, в клетку или пациенту можно вводить стабилизирующий агент микротрубочки, включая, но не ограничиваясь, таксан, в рамках способов изобретения. В частности, предполагается, что любое из соединений и/или их производных или аналогов можно применять в данных комбинированных терапиях.
В некоторых вариантах осуществления раковая клетка, введенная в подобной композиции, может быть клеткой мочевого пузыря, крови, кости, костного мозга, мозга, молочной железы, толстой кишки, пищевода, желудочно-кишечного тракта, головы, почки, печени, легкого, носоглотки, шеи, яичника, поджелудочной железы, предстательной железы, кожи, желудка, семенника, языка или матки.
В некоторых аспектах Ras-белок является мутантным Ras-белком, в частности мутантный K-Ras-белок. K-Ras может иметь мутацию при любом аминокислотном остатке в белке и, в частности, аминокислотном остатке глицина 12, глицина 13, глутамина 61 или их комбинации.
Другие способы, рассматриваемые настоящим изобретением, включают способы лечения рака, включающие введение соединения, цитотоксичного к раковой клетке, в концентрации, достаточной для того, чтобы вызвать апоптоз или ингибировать рост раковой клетки; причем цитотоксическое соединение или его соль, метаболит или пролекарство. Способы лечения вирусной инфекции, включают введение противовирусного соединения пациенту, инфицированному или с повышенным риском заражения вирусом, в концентрации, достаточной для того, чтобы уменьшить репликацию или ингибировать развитие вируса у пациента; причем противовирусное соединение выбирают из соединений, описанных в настоящем описании.
Как описано в настоящем описании, термин «IC50» относится к ингибирующей дозе, которая приводит к 50% от максимального полученного ответа.
Варианты осуществления изобретения могут также включать способы модулирования различных клеточных путей метаболизма, включая, но не ограничиваясь, PKC активность в клетке, например PKC зета и/или PKC йота активность; NFκB активацию в клетке; РНК транскрипцию в клетке; РНК сплайсинг в клетке; белковый метаболизм в клетке; синтез белка в клетке; расщепление белка в клетке; Raf-1 активность в клетке или т.п.
Также рассматриваются фармацевтические композиции, содержащие концентрацию одного или более соединений, описанных в настоящем описании, или их фармацевтически приемлемой соли или сложного эфира, достаточную для того, чтобы ингибировать рост раковой клетки или репликацию вируса или модулировать клеточный путь метаболизма в клетке, и фармацевтически приемлемый носитель.
Другие варианты осуществления изобретения рассматриваются в данной заявке. Любой вариант осуществления, рассматриваемый относительно одного аспекта изобретения, применяется также и к другим аспектам изобретения и наоборот. Подразумевают, что варианты осуществления в статье примеров являются вариантами осуществления изобретения, которые применяются ко всем аспектам изобретения.
Термины «ингибирование», «уменьшение» или «предотвращение» или любая вариация данных терминов при использовании в формуле изобретения и/или описании изобретения включают любое поддающееся измерению уменьшение или полное ингибирование для достижения желаемого результата.
Предполагается, что любой вариант осуществления, рассматриваемый в настоящем описании, может быть осуществлен в отношении любого способа или композиции по изобретению и наоборот. Любой вариант осуществления, рассматриваемый в отношении частного типа рака, вирусной инфекции или нарушения, можно применить или осуществить в отношении различных типов рака, вирусной инфекции или нарушений. Кроме того, композиции и комплекты реагентов изобретения можно применять для осуществления способов изобретения.
Во всей данной заявке термин «около» применяется для того, чтобы показать, что величина включает стандартное отклонение ошибки прибора или способа, который нужно применять для определения величины.
Применение термина «или» в формуле изобретения обычно означает «и/или», если ясно не указано иное альтернативное значение или альтернативные значения являются взаимоисключающими, даже если раскрытие предмета изобретения говорит в пользу определения, которое относится только к альтернативным значениям и «и/или».
Используемые в контексте данного описания изобретения и формулы изобретения слова «охватывающий» (и любая форма этого слова, такая как «охватывать» и «охватывает»), «имеющий» (и любая форма этого слова, такая как «иметь» и «имеет»), «включающий» (и любая форма этого слова, такая как «включает» и «включать») или «содержащий» (и любая форма этого слова, такая как «содержит» и «содержать») означают включающий или ничем не ограниченный и не исключают дополнительных элементов или стадий способов, которые не перечислены.
Другие объекты, особенности и преимущества настоящего изобретения будут ясны из следующего подробного описания. Следует понимать, однако, что хотя подробное описание и частные примеры показывают конкретные варианты осуществления изобретения, они даются только для иллюстрации, так как различные изменения и модификации в пределах сущности и объема изобретения станут ясны специалистам в данной области техники из данного подробного описания.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующие чертежи из части настоящего описания изобретения включены для дополнительной демонстрации определенных аспектов настоящего изобретения. Изобретение можно лучше понять исходя из одного или более данных чертежей в совокупности с подробным описанием конкретных вариантов осуществления, представленных в контексте данного изобретения.
Фиг.1A-1C (фиг.1A). Химические структуры 6 соединений, исследованных на эффект дозы (доза-ответ). (Фиг.1B). Эффект дозы некоторых соединений на клетки T29, T29Htl и T29Ktl. Клетки обрабатывали различными концентрациями (лежащими в диапазоне от 0,1 мкМ до 33 мкМ) соединений, перечисленных в A. Жизнеспособность клеток затем определяли посредством SRB анализов. Клетки контроля обрабатывали растворителем (ДМСО), а их величина была принята за 1. (Фиг.1C). Зависимость от времени после обработки клеток T29, T29Ktl и T29Htl соединением 1 в концентрации 33 мкМ. Жизнеспособность клеток затем определяли посредством SRB анализов. Показанные величины представляют среднее значение ± СО 2 проведенных анализов, каждый по четыре раза.
Фиг.2A и 2B. Эффекты Онкразина-1 на клетки человеческого рака легких. (Фиг.2A). Линии клеток человеческого рака легких с различными состояниями онкогенных Ras генов обрабатывали Онкразином-1 в различных концентрациях. Показанные величины представляют среднее значение ± СО 2 проведенных анализов, каждый по четыре раза. (Фиг.2B). Состояние мутаций Ras гена.
Фиг.3A и 3B (фиг.3A). Индукция апоптоза Онкразином-1. Клетки T29, T29Ktl и H460 обрабатывали Онкразином-1 в концентрации 30 мкМ (для T29 и T29Ktl) или 3 мкМ (для H460) и затем собрали из культуры через 12 или 24 часа. Гибель клеток была показана окрашиванием PI и annexin V. От 70% до 90% клеток H460 и T29Ktl окрасились красителями annexin V, PI или и тем и другим. (Фиг.3B). Вестерн-блоттинг. Клетки H460, обработанные 1 мкМ Онкразина-1 в течение различного времени, как показано. Активации каспазы-3 и каспазы-8 показаны посредством вестерн-блоттинга через 12-24 часа после обработки.
Фиг.4A и 4B. Подавление K-Ras, ингибирующее Онкразин-опосредованный апоптоз. (Фиг.4A). Клетки человеческого рака легких H460 обрабатывали либо контрольной киРНК, либо K-Ras киРНК, а затем обрабатывали ДМСО или Онкразином-1 (1 мкМ) в течение 12 часов. Онкразин-индуцированные апоптотические клетки определяли посредством FACS анализа и нормировали по апоптотическим клеткам, обработанным ДМСО. Значение представляет каждый из двух экспериментов. (Фиг.4B). Вестерн-блоттинг киРНК-опосредованного подавления K-Ras.
Фиг.5. Молекулярные изменения резистентных и чувствительных клеток. Клетки T29, T29Ktl и H460 обрабатывали 10 мкМ (для T29 и T29Ktl) или 1 мкМ (для H460) Онкразина-1. Через 12 часов клетки собрали из культуры для Вестерн-блоттинга молекул, показанных в графе справа. Клетки, обработанные ДМСО, использовали в качестве контроля (C). T, клетки, обработанные Онкразином-1.
Фиг.6A-6C. Онкразин-индуцированная агрегация PKC йота (PKCI). Клетки обрабатывали ДМСО или Онкразином-1 в течение 12 часов и для анализа PKC йота и РКС йота было проведено иммуногистохимическое окрашивание в H460 (фиг.6A) и в T29Ktl (фиг.6B) клетках. (Фиг.6C). Сравнение PKCI в T29Ktl, T29 и подавленных T29Ktl клеток.
Фиг.7. Внутриклеточная локализация РКС йота в клетках T29Ktl, обработанных различными противораковыми агентами.
Фиг.8A-8D. Индукция спеклов мега-сплайсингосом Онкразином-1. (Фиг.8A). Клетки T29Ktl обрабатывали Онкразином-1 или облучали, затем определяли внутриклеточную локализацию SC35 и Rad51 посредством окрашивания антител. (Фиг.8B). Совместная локализация РКС йота и SC35, определенная с помощью обычного флуоресцентного микроскопа и (фиг.8C) конфокального микроскопа. (Фиг.8D). Клетки T29Ktl и T29 обрабатывали ДМСО или Онкразином-1, а потом окрашивали ASF/SF2 антителом.
Фиг.9A и 9B. Эффекты РКС йота на Онкразин-индуцированную цитотоксичность. (Фиг.9A). Неустойчивое подавление РКС йота в клетках H460. (Фиг.9B). Устойчивое подавление РКС йота в клетках T29Ktl. Вектор PKC йота киРНК использовали в качестве контроля. Индукцию апоптоза и клеточную жизнеспособность сравнивали по подавленным и контрольным клеткам при обработке Онкразином-1.
Фиг.10A-10D. Эффект Онкразина-1 на экспрессию Raf-1. (Фиг.10A). Клетки H460 обрабатывали различными концентрациями Онкразина-1 и собрали из культуры через 24 часа для Вестерн-блоттинга. (Фиг.10B). Анализ полимеразной цепной реакции на основе обратной транскриптазы (RT-PCR). Клетки H460 обрабатывали 1 мкМ Онкразина-1 в течение различного времени или различными концентрациями в течение 24 часов, как показано. (+, -, положительный и отрицательный контроли). (Фиг.10C). Вестерн-блоттинг показал изменения экспрессии Raf-1 в клетках через 24 часа после обработки ДМСО или Онкразином-1 (10 мкМ). (Фиг.10D). Эффекты дозы Онкразина-1 на устойчивые линии клеток, трансфецированные Raf-1 плазмидами. Родительские клетки H460 и клетки H460, трансфецированные диким типом Raf-1 (Raf-1), конститутивным Raf-1 (Raf-1C) или доминантно-негативным Raf-1 (Raf-1/DN), обрабатывали различными концентрациями Онкразина-1 и определяли жизнеспособность клеток посредством SRB анализа.
Фиг.11A-11C. Подавление TNFα-индуцированной NFκB активации. NFκB репортерный плазмидный анализ. Клетки T29K трансфецировали pNFκB-Luc и pCMV-lacZ. Через 12 часов клетки обрабатывали TNFα (1 нг/мл) без или с (фиг.11A) Онкразином-1 (10 мкМ) или (фиг.11B) Сулиндаком (10 мкМ). Люциферазную активность определяли через 8 часов после обработки и нормировали по бета-галактозидазной активности. (Фиг.11C). Клетки H460 и T29K обрабатывали ДМСО или различными концентрациями Онкразина-1, как показано, в течение 12 часов с или без TNFα (1 нг/мл). NFκB активность исследовали посредством EMSA (анализ изменения электрофоретической подвижности).
Фиг.12. Способ синтеза аналогов Онкразина. Структурные единицы соединения A (содержащие индол) и B (бензилгалогениды) реагировали в присутствии NaH в качестве катализатора.
Фиг.3A и 13B (фиг.13A). ВЭЖХ-МС анализ Онкразина-27 после синтеза и очистки. (Фиг.13B). ЯМР-анализ Онкразина-1.
Фиг.14A и 14B. Противоопухолевая активность in vivo. (Фиг.14A). Подавление опухолевого роста H460 in vivo. Мышей с подкожными опухолями из клеток H460 обрабатывали Онкразином-1 или Онкразином-27, как показано. Объемы опухолей отслеживали с течением времени после обработок. Величины представляют среднее значение ± СО данных от пяти мышей в каждой группе. Значение объема опухоли у мышей, обработанных только Онкразином-1 или только Онкразином-27, значительно отличаются от значений объема опухоли мышей, обработанных растворителем (p<0,05). (Фиг.14B). Средняя выживаемость. Значения выживаемости у мышей, обработанных растворителем, Онкразином-1 и Онкразином-27 составили 24, 32 и 34 дня, соответственно.
Фиг.15A и 15B. Анализ токсичности in vivo. У животных, описанных на фиг.14, забрали кровь через два дня после последней обработки и определяли (фиг.15B) уровни сывороточной аланинтрансферазы (ALT), аспарагинтрансферазы (AST) и (фиг.15A) креатинина. Величины представляют среднее значение трех животных.
Фиг.16A и 16B. Эффект механизма процессинга РНК. (Фиг.16A). Клетки T29, T29Ktl и H460 обрабатывали 10 мкМ Онкразина-1 (T29 и T29Ktl) или 1 мкМ Онкразина-1 (H460). Через 12 часов клетки собрали из культуры для вестерн-блоттинга фосфорилирования РНК полимеразы II и SR-белков. Клетки, обработанные ДМСО, использовали в качестве контроля (C). (T)-клетки, обработанные Онкразином-1. Стрелки показывают уменьшенное фосфорилирование полимеразы II (pPolII) и SR-белков (pSR). (Фиг.16B). Анализ транскрипции in vitro с ядерными экстрактами клеток HeLa (Promega). Анализ проводили, следуя инструкциям производителя. Использованные концентрации показаны в графе сверху. DRB использовали в качестве положительного контроля ингибирования транскрипции.
Подробное описание изобретения
Настоящее изобретение будет описано более подробно в настоящем описании со ссылкой на прилагаемые чертежи, в которых показаны варианты осуществления изобретения. Данное изобретение может, однако, быть осуществлено во множестве различных форм и не следует истолковывать его как ограниченное вариантами осуществления, изложенными в настоящем описании; скорее, данные варианты осуществления предоставляются, с тем чтобы данное раскрытие изобретения было подробным и завершенным и полностью передало объем изобретения специалистам в данной области техники. Одинаковые числа соответствуют одинаковым позициям по всему тексту описания.
I. RAS СОПУТСТВУЮЩИЕ ЗАБОЛЕВАНИЯ И НАПРАВЛЕНИЯ
A. Рак
Онкогенные ras-гены H-ras, K-ras и N-ras часто обнаруживают в различных типах опухолей. Ген K-ras кодирует 2 изоформы сплайсинга, о