Модуляция путей обмена простагландина/циклооксигеназы
Иллюстрации
Показать всеНастоящее изобретение относится к области фармацевтики и медицины и касается применения 7α-гидроксиэпиандростерона или 7β-гидроксиэпиандростерона для приготовления лекарственного средства для лечения воспалительного состояния, выбранного из воспаления, воспалительного заболевания периферических органов, выбранных из печени или почек, воспалительного заболевания дыхательных путей, сахарного диабета, ассоциированной с воспалением боли, воспалительных заболеваний кожи, рассеянного склероза, ревматоидного артрита, остеоартрита и их осложнений. 3 з.п. ф-лы, 14 ил., 18 табл., 7 пр.
Реферат
Настоящее изобретение относится к ряду соединений, которые, как было установлено, модулируют пути обмена, определяющие активность циклооксигеназы и простагландинсинтаз, а также синтез простагландинов, и, таким образом, могут быть использованы для лечения и профилактики различных заболеваний и нарушений, которые оказались невосприимчивыми к предшествующим схемам лечения.
Простагландины (PG), определяемые также как простаноиды, представляют собой широко распространенную группу оксигенированных липидов, которые модулируют функции клеток в физиологическом и патологическом отношении. Биосинтез PG происходит в результате высвобождения из клеточных мембран арахидоновой кислоты (АА), главной жирной кислоты, катализируемого фосфолипазой А2 (PLA2). Высвобожденная арахидоновая кислота (АА) под воздействием циклооксигеназы (СОХ) превращается в неустойчивый оксигенированный промежуточный простагландин (PGH2). Образованный промежуточный простагландин PGH2 может быть превращен в разные простагландины, такие как простагландин Е2 (PGE2), простациклин (PGI2), простациклин F2α (PGF2α) или простагландин D2 (PGD2), под воздействием специфических ферментов, именуемых простагландинсинтазами (например, РGE-синтаза или PGE-S, PGD-синтаза или PGD-S и т.д.).
Циклооксигеназа (СОХ) присутствует в трех изоформах: СОХ-1, СОХ-2 и СОХ-3, которая является сплайсированным вариантом СОХ-1. СОХ-1 в основном экспрессирована в большинстве тканей, в то время как индукция СОХ-2 обычно происходит под воздействием провоспалительных цитокинов и стресса. Полученные результаты неоспоримо доказали, что СОХ-2 отвечает за вредное провоспалительное действие простаноидов. Поэтому ингибирование СОХ-2 считается главной мишенью при создании лекарственных средств для лечения воспалительных заболеваний. Однако исследования показали, что СОХ-2 играет также важную роль в гомеостазе основных органов и тканей.
Недавно выполненные клинические исследования показали, что продолжительное лечение ингибиторами СОХ-2 повышает вероятность инсульта и инфаркта миокарда, которые являются осложнениями, возникающими вследствие блокирования вазозащитного действия PGI2, образуемого под воздействием СОХ-2. Однако блокирование ферментов СОХ также уменьшает продуцирование PGD2. В периферических тканях PGD2 стимулирует вазодилатацию и ингибирует агрегацию тромбоцитов. PGD2 является наиболее распространенным простагландином в головном мозге, и недавно выполненное исследование показало, что РGD2 опосредует нейрозащитное действие в нейронах гиппокампа. Поэтому блокирование СОХ-2-образуемого PGD2 может способствовать повышению вероятности инсульта и инфаркта миокарда, наблюдаемому при проведении клинических испытаний с использованием ингибиторов СОХ-2.
PGD2 существует в течение очень короткого периода времени и подвергается дегидратации in vivo и in vitro с образованием биологически активных простагландинов серии J2, включающих 15-дезоксипростагландин J2 (15d-PGJ2). Данный простагландин является природным химически устойчивым противовоспалительным производным РGD2. 15d-PGJ2 является высокоаффинным лигандом рецептора, активируемого пролифератором пероксисомы, (PPAR) подтипа PPARγ, который представляет собой лигандзависимый ядерный фактор транскрипции, участвующий в целом ряде функций клеток, включая противовоспалительное действие. 15d-PGJ2 подавляет несколько воспалительных генов, таких как гены синтазы оксида азота, простагландин Е-синтазы (PGES) и α-фактора некроза опухолей (TNFα), при помощи PPARγ-зависимых и PPARγ-независимых механизмов. В хондроцитах крыс 15d-PGJ2 почти полностью прекращает стимулируемый цитокинами синтез PGE2 и экспрессию PGES, из чего следует, что 15d-PGJ2 является противовоспалительным мессенджером, который выключает продуцирование провоспалительного простагландина PGE2 в указанных клетках. Независимо от действующего механизма 15d-PGJ2 присутствует in vivo в фазе разрешения воспалительного процесса, что также позволяет предположить его функционирование в качестве регулятора обратной связи воспалительной реакции. Кроме того, установлено, что введение 15d-PGJ2 уменьшает развитие экспериментально вызванного колита у крыс, являющегося моделью воспалительного заболевания кишечника. Поэтому следует ожидать, что соединения и условия, которые смещают баланс в сторону продуцирования простагландинов PGD2 и 15d-PGJ2, должны оказывать противовоспалительное действие.
В центральной нервной системе противовоспалительные действия 15d-PGJ2 могут быть благоприятными при лечении нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и расеянный склероз, а также инсульта, травмы спинного мозга и черепно-мозговой травмы, когда воспаление вызывает поражение головного мозга и гибель клеток. Во всех указанных случаях поражение головного мозга обусловлено чрезмерной активацией микроглии. Микроглия, природные резидентные иммунокомпетентные клетки, играет важную родь в воспалительных процессах, происходящих в центральной нервной системе. Неконтролируемая активация микроглии может оказывать токсическое воздействие на клетки головного мозга вследствие высвобождения разных веществ, таких как воспалительные цитокины (IL-1β, TNF-α, IL-6), NO, PGE2 и супероксид. В результате выполнения нескольких исследований было установлено, что 15d-PGJ2 может подавлять продуцирование воспалительных цитокинов и NO активированными микроглиоцитами, и астроцитами, из чего следует, что простагландины могут играть важную роль в предотвращении поражения головного мозга, обусловленного чрезмерной активацией глиоцитов. Факты, свидетельствующие о том, что введение 15d-PGJ2 до и во время экспериментально вызванного аутоиммунного энцефалита (ЕАЕ), животной модели рассеянного склероза, значительно уменьшает тяжесть ЕАЕ, позволяют далее предположить, что 15d-PGJ2 может эффективно предотвращать поражение головного мозга в случае воспалительных нейродегенеративных заболеваний.
Недавно выполненные исследования показали, что 15d-PGJ2 уменьшает воспаление тканей головного мозга, нарушение поведения и гибель нейронов после внутримозгового кровоизлияния у крыс и защищает головной мозг от реперфузии вследствие ишемии в экспериментальной модели удара. Интравентрикулярное введение 15d-PGJ2 уменьшает объем инфаркта головного мозга, ингибирует апоптоз головного мозга и нейронов, подавляет активацию NF-κВ и повышает уровень гем-оксигеназы-1 (НО-1), сильного эндогенного антиоксиданта, в зависимости от PPARγ. Вышеуказанные результаты, свидетельствующие о нейрозащитном действии 15d-PGJ2 в случае ишемического удара, подтверждены недавно выполненным исследованием, показывающим, что у субъектов, страдающих острым ишемическим ударом, наблюдаются более высокие уровни 15d-PGJ2 в плазме, чем у нормальных субъектов, и что повышенное содержание 15d-PGJ2 в плазме ассоциировано с лучшим неврологическим состоянием на ранней и поздней стадиях заболевания. Повышенное содержание 15d-PGJ2 в плазме было также ассоциировано с меньшим объемом инфаркта, и данный эффект не зависел от других важных прогностических показателей. Поэтому можно предположить, что соединения и условия, смещающие баланс продуцирования простагландинов в сторону 15d-PGJ2, должны оказывать благоприятное воздействие при лечении как хронических воспалительных нейродегенеративных заболеваний, таких как болезнь Альцгеймера (AD), болезнь Паркинсона (PD) и рассеянный склероз, так и острых заболеваний, таких как удар, травма спинного мозга и черепно-мозговая травма.
Болезнь Альцгеймера (AD) является прогрессирующим и смертельным нейродегенеративным заболеванием, характеризующимся отложением внеклеточных бляшек Аβ (β-амилоида) и образованием внутриклеточных сплетений в головном мозге. Бляшки Аβ состоят главным образом из β-амилоида и пептидов Аβ. Накопление Аβ вызывает воспалительную реакцию, которая, как предполагается, способствует патогенезу AD и увеличению поражения нейронов. Кроме того, считается, что повышенные уровни растворимых пептидов Аβ в головном мозге вызывают дисфункцию нейронов и нарушение познавательной способности до отложения бляшек. Поэтому образование пептидов Аβ в головном мозге является главной мишенью при патогенезе AD.
Образование Аβ вызывает протеаза, которая расщепляет более крупный белок-предшественник β-амилоида (βАРР) со стороны N-конца пептида Аβ. Указанная протеаза, именуемая также β-секретазой или АРР-расщепляющим ферментом β-сайта (ВАСЕ1), является трансмембранной аспартилпротеазой. Уровни белка ВАСЕ1 и β-секретазы (С-концевой β-фрагмент) повышены в головном мозге субъектов, страдающих спорадической болезнью Альцгеймера. Поэтому уменьшение продуцирования Аβ в головном мозге субъектов, страдающих болезнью Альцгеймера, является главной терапевтической целью.
В научной литературе сообщалось, что уровни мРНК и белка ВАСЕ1 повышаются под воздействием провоспалительных медиаторов и снижаются лекарственными средствами, которые являются агонистами γ-рецептора, активируемого пролифератором пероксисомы (PPARγ). Недавно было установлено, что уменьшение PPARγ вызывает повышение уровней мРНК β-секретазы в результате увеличения активности промотора гена ВАСЕ1, в то время как сверхэкспрессия PPARγ, а также активаторов PPARγ специфически модулирует транскрипцию ВАСЕ1 путем подавления активности промотора гена ВАСЕ1, из чего следует, что PPARγ может быть ингибитором ВАСЕ1. Кроме того, лечение трансгенных hAPP-мышей агонистами PPARγ снижало уровни как мРНК ВАСЕ1, так и внутриклеточного β-амилоида в нейронах коры головного мозга.
Кроме того, установлено, что сверхэкспрессия PPARγ уменьшает секрецию Аβ в культивируемых клетках в результате активации повсеместного и опосредуемого протеасомой разрушения белка-предшественника βАРР и активация PPARγ непосредственно влияет на устойчивость Аβ, добавляемого в культуру клеток. Такое снижение устойчивости позволяет предположить, что активация PPARγ может вызывать включение механизма быстрого клиренса клеток для амилоидного пептида.
Полученные данные свидетельствуют о значительной роли PPARγ в модуляции образования β-амилоида и наличии защитного механизма, благодаря которому активация PPARγ уменьшает продуцирование пептидов β-амилоида в головном мозге.
15d-PGJ2, высокоаффинный лиганд рецептора, активируемого пролифератором пероксисомы (PPAR) подтипа PPARγ, подавляет несколько воспалительных генов при помощи PPARγ-зависимых и PPARγ-независимых механизмов. Поэтому можно предположить, что условия, при которых увеличивается эндогенное продуцирование 15d-PGJ2, должны подавлять воспалительные процессы в головном мозге и уменьшать образование амилоидного пептида в головном мозге субъектов, страдающих болезнью Альцгеймера. Следовательно, соединения и условия, повышающие эндогенное продуцирование 15d-PGJ2, должны оказывать благоприятное воздействие при лечении болезни Альцгеймера.
Простагландины серии J2 являются сильнодействующими индукторами фактора роста нервов (NGF) и образования фактора роста нервов, выделенного из головного мозга (BDNF), и стимулируют разрастание аксонов под воздействием NGF в культуре клеток. Способность 15d-PGJ2 стимулировать аксоны не связана с PPARγ, так как синтетический агонист и антагонист РPAR-γ не изменяет стимулирующее аксоны действие 15-дезокси-PGJ2. В экспериментах на животных было показано, что введение NGF в желудочки головного мозга защищает холинергические нейроны, стимулирует рост аксонов и улучшает холинергическую функцию. Аналогичным образом, введение NGF в желудочки головного мозга уменьшает гибель нейронов в гиппокампе песчанок, страдающих ишемией головного мозга. Было установлено, что BDNF стимулирует выживание и рост развивающихся нейронов in vitro и улучшает функции двигательных нейронов в животных моделях. У животных, у которых была вызвана ишемия переднего мозга, BDNF уменьшал ишемическое поражение нейронов. К сожалению, из-за плохого проникновения указанных нейротрофинов через гематоэнцефалический барьер клинические испытания не позволили получить значительного эффекта. Однако следует ожидать, что условия или лечение, позволяющие увеличить эндогенные уровни 15d-PGJ2, должны улучшить местное продуцирование указанных факторов роста и стимулировать рост нейронов и, следовательно, облегчить восстановление нейронов в спинном и головном мозге.
Повышенные уровни воспалительных маркеров ассоциированы с ишемией сосудов, и воспаление опосредует патогенез острых синдромов коронарных артерий. Воспаление играет значительную роль в возникновении и развитии атеросклероза, а также может играть главную роль в развитии тромбоза в результате активации процесса коагуляции. Поэтому условия и соединения, уменьшающие воспаление сосудов, могут оказывать благоприятное воздействие на сердечно-сосудистые заболевания, в которых воспаление опосредует гибель или поражение клеток, такие как заболевание коронарной артерии сердца.
мРНК простагландин D-синтазы (PGDS) экспрессирована в сердце. Таким образом, локально продуцируемый PGD2 может вызвать образование 15d-PGJ2 в миоцитах или окружающих клетках. PPARγ также присутствует и функционирует в миоцитах сердца. Недавно выполненное исследование показало, что 15d-PGJ2, природный метаболит PGD2, оказывает противовоспалительное действие в миоцитах сердца, модулируя IL-1β-стимулируемые СОХ-2, РGE-S и iNOS в зависимости от PPAR. 15d-PGJ2 блокировал стимулируемое IL-1β продуцирование PGE2, но не модифицировал стимуляцию IL-1β простагландинов PGI2 или PGF2α, из чего следует, что воздействие лиганда PPARγ является специфическим для PGE-S. Блокирование IL-1β-индуцированного PGE-S под воздействием 15d-PGJ2 предположительно уменьшает продуцирование провоспалительного простагландина PGE2 в ткани сердца. Кроме того, установлено, что 15d-PGJ2 повышает экспрессию гем-оксигеназы-1 (НО-1) в миоцитах сердца и уменьшает величину инфаркта миокарда в животной модели инфаркта миокарда у крыс, вызванного реперфузией при регионарной ишемии. Среди исследованных различных лигандов PPARγ 15d-PGJ2 вызывал наиболее выраженное уменьшение величины инфаркта. Хотя данное действие опосредовано PPARγ, повышенная экспрессия антиоксиданта и цитозащитного белка НО-1 не зависит от PPARγ. В целом полученные результаты позволяют предположить, что условия и соединения, повышающие эндогенные уровни 15d-PGJ2, могут уменьшать воспаление сосудов и, таким образом, оказывать благоприятное воздействие при лечении сердечно-сосудистых заболеваний.
Все больше данных свидетельствуют о том, что жировая ткань является главным источником циркулирующих воспалительных факторов, особенно в случае ожирения. Жир продуцирует провоспалительные адипоцитокины, включающие TNF-α, лептин, PAI-1, IL-6 и ангиотензиноген. TNF-α является главным активатором NFκB. TNF-α ингибирует также передачу сигнала инсулина, вызывая, таким образом, устойчивость к инсулину. Уровни PAI-1 позволяют прогнозировать CAD и диабет и являются основным фактором тромбообразования в случае ожирения. IL-6 стимулирует продуцирование в печени С-реактивного белка (CRP) и способствует повышению уровней высокочувствительного (hs)CRP в сыворотке субъектов, страдающих ожирением. HsCRP позволяет прогнозировать инфаркт миокарда, инсульт, заболевание периферических артерий и внезапную смерть. Ангиотензиноген является предшественником Ang II, который, как хорошо известно, активирует многочисленные механизмы поражения сосудов. Как правило, уровни всех указанных адипокинов повышены у инсулинустойчивых субъектов, страдающих висцеральным ожирением, создающим провоспалительную среду. Поэтому сахарный диабет типа 2 (T2D) и ожирение являются воспалительными состояниями.
Жировая ткань экспрессирует самые высокие уровни PPARγ по сравнению с другими тканями. Лиганды PPARγ стимулируют дифференцировку жировых клеток и поглощение свободных жирных кислот жировой тканью. Указанные лиганды способствуют также ослаблению провоспалительной среды путем уменьшения экспрессии TNF-α, PAI-1 и IL-6 и увеличения экспрессии адипонектина в жире. Таким образом, активация PPARγ непосредственно подавляет воспаление в клетках сосудов и оказывает косвенное воздействие, регулируя экспрессию генов в жировой ткани.
T2D и синдром обмена веществ характеризуются устойчивостью к воздействию инсулина в периферических тканях, включая скелетные мышцы, печень и жировую ткань. Активация PPARγ определенными синтетическими лигандами, такими как тиазолидиндионы, улучшает восприимчивость к инсулину и снижает в крови уровни глюкозы, триглицеридов и свободных жирных кислот, не стимулируя секрецию инсулина, в животных моделях T2D у грызунов. Агонисты PPARγ также снижают устойчивость к инсулину периферических тканей у человека и были эффективно использованы для лечения субъектов, страдающих сахарным диабетом типа 2 (T2D).
15-Дезоксипростагландин J2 (15d-PGJ2) является природным химически устойчивым противовоспалительным простагландином, который, по-видимому, является предполагаемым эндогенным высокоаффинным лигандом рецептора, активируемого пролифератором пероксисомы, подтипа PPARγ. Соединения и условия, которые повышают эндогенное продуцирование 15d-PGJ2, предположительно должны подавлять воспаление сосудов и улучшать восприимчивость к инсулину в случае диабета типа 2.
Провоспалительные цитокины, такие как альфа-фактор некроза опухолей (TNF-α), сверхэкспрессированы в случае псориаза и атопического дерматита. TNF-α играет важную роль в возникновении и развитии воспаления, и недавно полученные экспериментальные данные показывают, что возникновение поражений в экспериментальной модели псориаза опосредовано TNF-α. Полученные данные, позволяющие предположить роль TNF-α в патогенезе псориаза, подтверждены результатами недавно выполненных клинических испытаний, показывающими, что введение моноклонального антитела (mAb) против TNF-α (инфликсимаба) или растворимого гибридного белка рецептора TNF (этанерцепта) вызывает улучшение состояния у больных псориазом.
15d-PGJ2, химически устойчивый метаболит простагландина РGD2, является высокоаффинным лигандом рецептора γ, активируемого пролифератором пероксисомы (РPARγ).
15d-PGJ2 подавляет несколько провоспалительных генов в активированных макрофагах, микроглиоцитах и астроцитах человека, включая гены индуцибельной NO-синтазы (iNOS) и α-фактора некроза опухолей (TNF-α), и указанное подавление по меньшей мере частично зависит от экспрессии PPARγ. Кроме того, установлено, что синтетические лиганды PPARγ, такие как инсулинсенсибилизирующие тиазолидиндионы, улучшают состояние больных псориазом. В целом полученные результаты позволяют предположить, что соединения и условия, повышающие эндогенное продуцирование 15d-PGJ2, могут оказывать эффективное воздействие при лечении псориаза.
Недавно полученные данные показывают, что определенные синтетические агонисты PPARγ обладают умеренной антипролиферативной активностью в отношении многих линий раковых клеток, выделенных из эпителия человека. Кроме того, недавно полученные данные свидетельствуют о том, что нормальные эпителиальные клетки предстательной железы и Т-лимфоциты более устойчивы к апоптозу под воздействием указанных лигандов PPARγ. С учетом вышеуказанного специфического действия в отношении рака возможное использование агонистов PPARγ в качестве химиотерапевтических средств заслуживает серьезного внимания.
Кроме того, установлено, что 15d-PGJ2, природный лиганд PPARγ, обладает противоопухолевым действием. Например, 15d-PGJ2 существенно ингибирует рост клеток и вызывает апоптоз раковых клеток нескольких типов, включая раковые клетки ободочной и прямой кишки, желудка, молочной железы и печени. Механистические исследования позволяют предположить, что указанное ингибирующее рост действие опосредовано механизмами, не зависящими от PPARγ. Однако независимо от действующего механизма соединения и условия, повышающие эндогенные уровни 15d-PGJ2, предположительно должны ингибировать рост и развитие опухоли.
Повышенные уровни простагландина Е2 (PGE2) были обнаружены в различных злокачественных новообразованиях. Различные данные, помимо обнаружения повышенных уровней PGE2 в опухолях, позволяют предположить, что PGE2 играет определенную роль в возникновении и развитии рака. Например, PGE2 может стимулировать пролиферацию и подвижность клеток, ингибируя апоптоз и иммунный надзор. Важно отметить, что PGE2 также может, по меньшей мере частично, индуцировать образование кровеносных сосудов, повышая продуцирование проангиогенных факторов, включая эндотелиальный фактор роста сосудов. С вышеуказанными результатами согласуется тот факт, что более высокие уровни PGE2 в образцах раковой ткани в значительной степени соответствуют возникновению метастазов и повышенной васкуляризации опухоли.
Недавно выполненные исследования с использованием экспериментальных животных также позволяют предположить, что PGE2 может стимулировать канцерогенез. Установлено, что генетическое разрушение рецептора ЕР2 простагландина PGE2 уменьшает число и размер экспериментальных опухолей, при этом другие исследования показали, что лечение моноклональным антителом против PGE2 ингибирует рост трансплантируемых опухолей. Исходя из вышеизложенного, можно ожидать, что соединения и условия, ингибирующие ферментативные пути, вызывающие повышение содержания PGE2 в опухоли, также должны ингибировать рост опухоли.
Синтез PGE2 из арахидоновой кислоты требует двух ферментов, действующих последовательно, циклооксигеназы (СОХ) и простагландин Е-синтазы (PGES). Повышенная экспрессия PGES была обнаружена в нескольких злокачественных новообразованиях человека, из чего с большой вероятностью следует, что аберрантная экспрессия PGES вызывает повышенное продуцирование РGE2, что способствует пролиферации клеток и росту опухоли. Как сообщалось в научной литературе, 15d-PGJ2 почти полностьью ингибирует индуцируемый цитокином синтез PGE2 и экспрессию мембранной PGE-синтазы. Следовательно, соединения и условия, повышающие эндогенные уровни 15d-PGJ2, предположительно должны уменьшать синтез PGE2, а также пролиферацию клеток и рост опухоли и оказывать благоприятное воздействие при лечении рака.
Авторы настоящего изобретения ранее показали, что 7β-гидроксиэпиандростерон (7β-ОН-EPIA), эндогенный 7-гидроксистероид, оба, оказывают нейрозащитное и кардиозащитное действие (WO 02/00224, WO 02/00225 и WO 03/015791). Указанный стероид защищает нервные клетки от гибели in vitro (органотипические культуры среза гиппокампа (OTHSC) и клетки РС12) и головной мозг от поражения в многочисленных экспериментальных моделях in vivo и обеспечивает эффективную защиту от индуцированного регионарной ишемией инфаркта миокарда в перфузированных сердцах крыс. В целом полученные результаты позволяют предположить, что 7β-ОН-EPIA может оказывать благоприятное воздействие в процессе предотвращения и лечения нейродегенеративных заболеваний, таких как удар, травма спинного мозга, черепно-мозговая травма и болезнь Альцгеймера, и сердечно-сосудистых заболеваний, таких как инфаркт миокарда (MI).
Авторы настоящего изобретения недавно показали, что инкубация клеток РС12 с индометацином, ингибитором циклооксигеназы (СОХ), полностью отменяла обеспечиваемую 7β-ОН-EPIA защиту от ишемии. Полученные результаты позволяют предположить, что активность СОХ необходима для нейрозащитного действия 7β-ОН-EPIA.
Авторы настоящего изобретения показали, что инкубация моноцитов клеток крови человека (hMBC) с наномолярными концентрациями 7β-ОН-EPIA вызывает почти 10-кратное увеличение продуцирования простагландина 15-дезокси-Δ12,14-J2 (15d-PGJ2). Подобное действие 7-гидроксистероида, по-видимому, является специфическим для 15d-PGJ2, так как указанный стероид существенно не изменяет продуцирование простагландина Е2 (PGE2) в указанных клетках. В отличие от этого инкубация hMBC с α-фактором некроза опухолей (TNFα) провоспалительного цитокина повышает продуцирование обоих простагландинов примерно в 3 раза. Кроме того, совместная инкубация с TNF-α и 7β-ОН-EPIA вызывает увеличение 15d-PGJ2 аналогично увеличению, наблюдаемому при использовании только 7β-ОН-EPIA, в то время как добавление наномолярных концентраций 7β-ОН-EPIA полностью устраняло увеличение РGE2 под воздействием TNFα.
В научной литературе сообщалось, что 15d-PGJ2 почти полностью ингибирует индуцируемый цитокином синтез PGE2 и экспрессию мембранной PGE-синтазы (mPGES) в хондроцитах крыс, из чего следует, что 15d-PGJ2 является противовоспалительным мессенджером, который выключает продуцирование провоспалительного простагландина PGE2 в указанных клетках. Поэтому полученные результаты могут свидетельствовать о том, что ингибирование TNFα-индуцированного продуцирования провоспалительного простагландина PGE2 под воздействием 7β-ОН-EPIA опосредовано повышенным высвобождением 15d-PGJ2.
15d-PGJ2 является высокоаффинным лигандом рецептора, активируемого пролифератором пероксисомы, (PPAR) подтипа PPARγ, лигандзависимым ядерным фактором транскрипции, участвующим в целом ряде функций клетки, включая противовоспалительное, нейрозащитное, кардиозащитное, метаболическое и противоопухолевое действие. Авторы настоящего изобретения обнаружили, что соединения, такие как 7β-ОН-EPIA, способны избирательно облегчать продуцирование 15d-PGJ2 и, таким образом, могут оказывать благоприятное воздействие в случае воспаления и кожных заболеваний, таких как воспалительное заболевание кишечника и псориаз, в случае неврологических, сердечно-сосудистых заболеваний и нарушений обмена веществ, таких как удар, травма спинного мозга, черепно-мозговая травма, болезнь Альцгеймера, болезнь Паркинсона, заболевание коронарной артерии сердца и диабет типа 2, в которых воспаление вызывает дисфункцию и гибель клеток, и в случае различных типов рака, в которых повышенное продуцирование РGE2 способствует пролиферации клеток и росту опухоли.
Таким образом, одним объектом настоящего изобретения является применение вещества, усиливающего продуцирование 15-дезоксипростагландина J2, для приготовления лекарственного средства, предназначенного для лечения или профилактики состояний, опосредованных повышенными уровнями простагландина Е2 или других метаболитов циклооксигеназы и простагландинсинтазы либо для лечения или профилактики состояний, ухудшение которых обусловлено пониженным уровнем или пониженной доступностью 15-дезоксипростагландина J2.
Другим объектом настоящего изобретения является применение вещества, облегчающего продуцирование 15-дезоксипростагландина J2 и избирательно ингибирующего продуцирование простагландина Е2 в присутствии вызывающего воспаление агента, для приготовления лекарственного средства, предназначенного для лечения или профилактики состояний, опосредованных повышенными уровнями простагландина Е2 или других метаболитов циклооксигеназы-2, либо для лечения или профилактики состояний, ухудшение которых обусловлено пониженным уровнем или пониженной доступностью 15-дезоксипростагландина J2.
Другим объектом настоящего изобретения является применение вещества, усиливающего продуцирование 15-дезоксипростагландина J2, для приготовления лекарственного средства, предназначенного для стимуляции разрастания аксонов или для лечения периферической невропатии.
Периферическая невропатия может возникнуть вследствие лечения химиотерапевтическими средствами, такими как цисплатин, или вследствие других причин, таких как диабетическая невропатия.
Еще одним объектом настоящего изобретения является применение вещества, усиливающего продуцирование 15-дезоксипростагландина J2 и активирующего PPAR-гамма, для приготовления лекарственного средства, предназначенного для лечения состояния, требующего активации PPAR-гамма.
Другим объектом настоящего изобретения является применение соединения, усиливающего продуцирование 15-дезоксипростагландина J2, для приготовления лекарственного средства, предназначенного для лечения или профилактики рака.
Еще одним объектом настоящего изобретения является применение соединения, усиливающего продуцирование 15-дезоксипростагландина J2, для приготовления лекарственного средства, предназначенного для ингибирования пролиферации раковых клеток, индукции апоптоза раковых клеток или торможения роста и развития опухоли.
Раковые клетки, к которым в наибольшей степени относится данный объект настоящего изобретения, включают раковые клетки ободочной и прямой кишки, желудка, молочной железы, печени, предстательной железы, мочевого пузыря, щитовидной железы и пищевода.
Кроме того, соединения по настоящему изобретению могут быть использованы для лечения и профилактики:
боли, ассоциированной с воспалением;
заболеваний периферических артерий (включая нарушения, препятствующие притоку крови к конечностям или вызванные периферическим атеросклерозом) и их осложнений, таких как критическая ишемия конечностей;
заболевания коронарной артерии и его осложнений, таких как ишемическая болезнь сердца (например, стабильная и нестабильная стенокардия) и инфаркт миокарда (MI);
сердечно-сосудистых заболеваний и их осложнений, таких как удар и преходящее ишемическое нарушение мозгового кровообращения (TIA);
ишемии печени и почки, например, атеросклеротического стеноза почечной артерии;
заболеваний обмена веществ, таких как диабет типа 2 и его осложения, такие как заболевания периферических артерий, заболевание коронарной артерии, сосудистые заболевания почки и диабетическая невропатия;
ожирения и его осложнений, таких как диабет типа 2, заболевания периферических артерий и заболевание коронарной артерии;
воспалительных заболеваний дыхательных путей, таких как астма и хроническое обструктивное заболевание легких (COPD), например, хронический бронхит;
хронических нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, рассеянный склероз и периферические невропатии;
острых неврологических дегенеративных состояний, таких как черепно-мозговая травма и травма спинного мозга;
воспалительного заболевания кишечника;
воспалительных заболеваний, характеризующихся дегенерацией суставного хряща, таких как ревматоидный артрит, первичный и вторичный остеоартрит, и их осложений;
ран; и
токсичности или периферических невропатий, вызванных химиотерапевтическими средствами.
Указанные вещества могут быть предпочтительно использованы для лечения сахарного диабета и его осложнений; ишемических заболеваний сосудов; боли, ассоциированной с воспалением; воспалительных заболеваний кожи; травмы спинного мозга; периферической невропатии; рассеянного склероза; воспалительного заболевания кишечника; ревматоидного артрита; синдрома обмена веществ Х, ожирения, акромегалии и заживления ран.
Такие вещества могут быть также пригодны для лечения или профилактики таких состояний, как воспалительные заболевания периферических органов, например, печени и почек, вызванных, например, ишемией печени и почки.
Другие воспалительные состояния, которые можно лечить указанными веществами, включают воспалительные заболевания дыхательных путей, такие как астма, ринит, бронхит и хроническое обструктивное заболевание легких (COPD).
Настоящее изобретение иллюстрировано прилагаемыми чертежами, на которых 7β-гидроксиэпиандростерон определяется как 7β-ОН-EPIA.
На фиг.1 представлены объединенные данные среднего процентного значения гибели клеток, полученные в результате выполнения 4 отдельных экспериментов в примере 1, которые выражены в виде среднего±стандартная ошибка среднего.
На фиг.2 показано среднее процентное значение гибели клеток в отдельных экспериментах, описанных в примере 1.
На фиг.3 показано среднее процентное значение гибели клеток в отдельных экспериментах, описанных в примере 1.
На фиг.4 показано среднее процентное значение гибели клеток в отдельных экспериментах, описанных в примере 1.
На фиг.5(а) и 5(b) показано воздействие повышения концентраций 7β-ОН-EPIA на уровни простагландина PGD2, обнаруженного в супернатантах мононуклеарных клеток периферической крови, инкубированных с 7β-ОН-EPIA, в присутствии и в отсутствие TNF-α, как описано в примере 2.
На фиг.6(а) и 6(b) показано воздействие повышения концентраций 7β-ОН-EPIA на уровни простагландина PGE2, обнаруженного в супернатантах мононуклеарных клеток периферической крови, инкубированных с 7β-ОН-EPIA, в присутствии и в отсутствие TNF-α, как описано в примере 2.
На фиг.7(а) и 7(b) показано воздействие повышения концентраций 7β-ОН-EPIA на уровни простагландина 15d-PGJ2, обнаруженного в супернатантах мононуклеарных клеток периферической крови, инкубированных с 7β-ОН-EPIA, в присутствии и в отсутствие TNF-α, как описано в примере 2.
На фиг.8 показано воздействие введения 7β-гидрокси-EPIA на (А) миелопероксидазу (МРО) и маркеры окислительного стресса, а именно (В) Prot CO, (C) T-образные складки и (D) маркер антиоксидантной защиты GSH в ткани ободочной кишки, как более подробно описано в примере 4.
На фиг.9 показан уровень 15d-PGJ2 в ободочной кишке (А) и количественное определение относительной экспрессии мРНК СОХ-2, mPGES-1 и Н-PGDS (В) в разные периоды времени введения 7β-гидрокси-EPIA в примере 4.
На фиг.10 показано воздействие 7β-гидрокси-EPIA на синтез в ободочной кишке простагландина Е2, D2 и 15d-PGJ2 во время введения DSS в примере 4.
На фиг.11 показана экспрессия в ободочной кишке мРНК СОХ-2, mPGES-1 и H-PGDS во время индукции колита в примере 4.
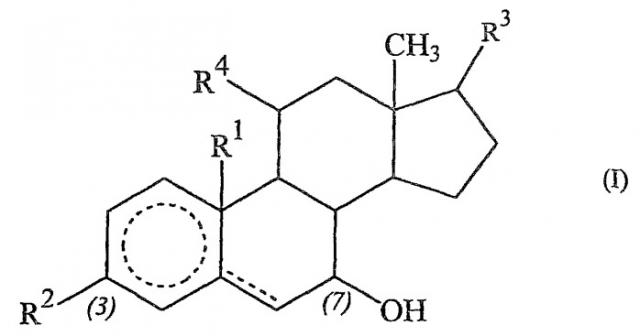
Соединения, которые могут быть использованы в настоящем изобретении, включают соединения формулы (I):
где
пунктирная окружность показывает, что содержащее ее кольцо может быть полностью насыщенным или может иметь одну, две или три углерод-углеродные двойные связи;
пунктирная линия показывает, что указанная связь может быть углерод-углеродной простой или двойной связью;
R1 означает атом водорода или метильную группу;
R2, R3 и R4 имеют одинаковые или разные значения и означают оксогруппу, гидроксильную группу, меркаптогруппу, атом водорода, атом галогена, алкоксильную группу, арилоксигруппу или ацильную группу;
их фармацевтически приемлемые соли и сложные эфиры.
Цифры (3) и (7) в вышеуказанной формуле приведены только для справки и служат для определения использованной системы нумерации. Конечно, когда R2 означает оксогруппу, пунктирная окружность может означать только полностью насыщенное кольцо (в смысле отсутствия двойных связей в кольце) либо одну или две двойные связи.
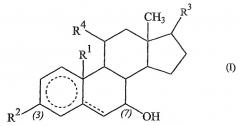
Из указанных соединений предпочтительными соединениями являются соединения формулы (II):
(где R1, R2, R3 и R4 имеют указанные выше значения) и их сложные эфиры.
Другим предпочтительным классом указанных соединений являются соединения формулы (III):
(где R2а означает оксогруппу, гидроксильную группу, меркаптогруппу или атом галогена; и R1, R3 и R4 имеют указанные выше значения) и их сложные эфиры.
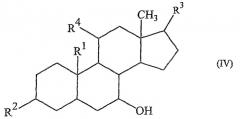
Еще одним предпочтительным классом указанных соединений являются соединения формулы (IV):
(где R1, R2, R3 и R4 имеют указанные выше значения) и их сложные эфиры.
Еще одним предпочтительным классом указанных соединений являются соединения формулы (V):
где R2, R3 и R4 имеют указанные выше значения.
Примеры соединений формулы (II) включают 7-гидрокситестостерон, имеющий формулу (IIa):
и его сложные эфиры. 7-Гидроксильная группа в данном соединении может находиться в альфа- или бета-конфигурации, или может быть использована смесь двух изомеров.
Примеры соединений формулы (III) включают 7α-гидроксидегидроэпиандростерон (7α-гидрокси-DHEA), имеющий формулу (IIIa):
и его сложные эфиры, 7β-аналог, имеющий формулу (IIIb):
и его сложные эфиры, 7β-гидроксипрегненолон, имеющий формулу (IIIc):
и его сложны