Рентгеноконтрастное средство
Иллюстрации
Показать всеРентгеноконтрастное средство (РКС) относится к новым лекарственным препаратам, а именно к средствам контрастирования внутренних органов, и может найти применение в лучевой диагностике при ангиографии, компьютерной томографии и лимфографии для диагностики и лечения опухолей паренхиматозных органов. РКС представляет собой масляное контрастное вещество с вязкостью 15-30 сПз, получаемое из олеиновой кислоты путем ее этерификации и последующего йодирования, и содержит в своем составе не менее 65% этиловые эфиры йод- и дийодоктадекановых кислот, из оставшихся 35% не более 18% - этиловые эфиры олеиновой, линолевой, лауриновой, миристиновой и пальмитиновой кислот и не более 17% - неидентифицированные примеси. РКС обладает высокой рентгеноконтрастностью, сопоставимой с таковой используемого в клинической практике липиодола, имея при этом более низкую вязкость, позволяющую осуществлять безопасное внутрисосудистое введение. 1 пр., 2 ил.
Реферат
Изобретение относится к новым лекарственным препаратам, а именно к средствам контрастирования внутренних органов, и может найти применение в лучевой диагностике при ангиографии, компьютерной томографии и лимфографии для диагностики и лечения опухолей паренхиматозных органов.
Возможности лучевой диагностики увеличиваются при использовании рентгеноконтрастных средств (РКС), но при этом необходимо, чтобы такие препараты обладали способностью поглощать рентгеновские лучи, были бы фармакологически инертны, химически стабильны и органоспецифичны, а также они должны иметь низкую вязкость и токсичность, минимальную осмотическую активность и быстро выводиться из организма. Всем этим требованиям в наибольшей степени удовлетворяют йодированные масляные РКС, поскольку они
- не являются солями и не диссоциируют на ионы в водной среде,
- обладают продолжительным действием,
- легко ассимилируются организмом,
- за счет прочного связывания йода в молекуле РКС не вызывают отравления организма свободным йодом,
- характеризуются низкой всасываемостью стенками сосудов, что снижает их токсическое действие на организм.
В последние годы методы исследования с использованием масляных рентгеноконтрастных веществ нашли широкое применение в экспериментальной и клинической медицине. Традиционными областями их применения стали лимфография, сиалография, рентгеноэндоваскулярная окклюзия и химиоэмболизация злокачественных новообразований различных локализаций и пр.
Однако количество пригодных для этих целей масляных РКС в настоящее время недостаточно. Необходимо создание новых йодсодержащих рентгеноконтрастных препаратов, обладающих хорошим качеством визуализации, низкой токсичностью и вязкостью для снижения вероятности потенциальных осложнений, которые могут возникать при их использовании.
Йодированные масла известны с 1896 года, когда было получено йоднокунжутное масло, названное йодипином. В 1901 г. было изготовлено йодированное маковое масло, получившее название липиодол. Известно около 20 аналогичных препаратов, полученных йодированием растительных масел: рафинированного подсолнечного масла (йодолипол), сурепкового (кампиодол), вышеназванных кунжутного (йодипин), макового (липиодол) и многих других.
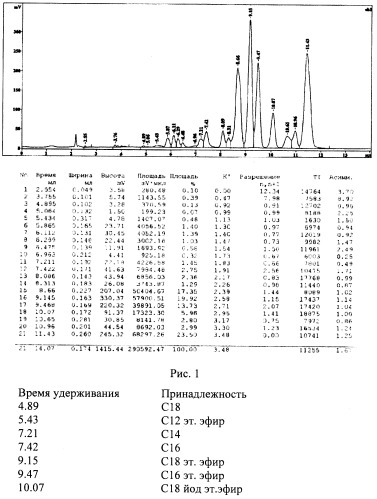
С 1961 г. началось широкое использование масляных РКС для прямой клинической лимфографии, при этом преимущественное применение получил липиодол [C.Maiorovici et al., Pharmazie, 1956, v.4, N2, p.126-130]. Его получают из макового масла, представляющего собой смесь стеариновой, пальмитиновой, олеиновой и линолевой кислот. Масло подвергают йодированию, после чего длительно и тщательно очищают. В клинической практике широкое применение нашел сверхжидкий липиодол (липиодол-флюид), рентгеноконтрастность которого (денситометрическая плотность по шкале Хаунсфилда) равна 2984. Вязкость липиодола составляет 34-70 сПз, уд.вес. - 1.268-1.290 г/мл, содержание йода - 37-39%. [Сертификат соответствия №РОСС FR 02.А 36863 (сертифицировано в Госстандарте России Липиодол Ультра-Флюид)]. Препарат широко применяется для контрастирования внутренних органов, лимфатического русла и лимфатических узлов.
Однако использование липиодола ввиду его высокой вязкости может приводить к жировым эмболиям, а также к уменьшению капиллярного объема легочных артерий - опасного сопутствующего явления. Кроме того, достаточно высокая вязкость препарата приводит к длительной по времени инъекции и требует электрических инжекторов для его введения. Препарат также не дает четких изображений некоторых групп лимфатических узлов. Серьезным недостатком липиодола является сложный состав и высокое содержание в нем неидентифицируемых примесей.
Наиболее близким к предлагаемому является рентгеноконтрастное средство [Патент РФ №2336904 от 27.10.2008 г. на «Рентгеноконтрастное средство], содержащее в своем составе в качестве действующего вещества этиловый эфир дийодлинолевой кислоты, а в качестве стабилизатора - этиловый эфир линолевой кислоты при следующем соотношении компонентов, мас.%:
| этиловый эфир дийодлинолевой кислоты | 95% |
| этиловый эфир линолевой кислоты | 5% |
Этот препарат имеет более низкую вязкость (15-30 сПз) по сравнению с липиодолом. Это обеспечивает большую текучесть препарата по катетеру и сосудам паренхиматозных органов. Препарат обладает высокой рентгеноконтрастностью, умеренным аллергизирующим действием, в диагностических дозах не приводит к иммунотоксическому действию.
Исходным сырьем для получения этого препарата служила линолевая кислота, которую этерифицируют этиловым спиртом в присутствии концентрированной серной кислоты. Полученный этиловый эфир, находящийся в верхнем слое смеси, отделяют и промывают дистиллированной водой до нейтральной реакции, после чего сушат прокаленным сульфатом натрия. Полученное масло подвергают вакуумной разгонке - фракция с температурой кипения 160-170°C представляет собой чистый этиловый эфир линолевой кислоты. Эфир затем иодируют в петролейном эфире водным 57% раствором йодистоводородной кислоты в присутствии фосфорного ангидрида. При взаимодействии фосфорного ангидрида с водой выделяется много тепла, требующего большого количества хладагента, что усложняет и удлиняет процесс. Полученную реакционную массу выдерживают до расслоения: верхний слой содержит эфир дийодлинолевой кислоты, который после отгонки петролейного эфира промывают и сушат. В полученный продукт добавляют 5% исходного этилового эфира линолевой кислоты, в результате получают искомое РКС. Препарат обладает высокой рентгеноконтрастностью, достаточно низкой вязкостью и пригоден для внутрисосудистого введения. Однако процесс получения его трудоемок, энергоемок, но, главное, препарат содержит большое количество (более 50%) неидентифицируемых примесей. На момент создания этого препарата хроматографический анализ его не проводился и высокое содержание в нем неидентифицируемых примесей обнаружено нами после регистрации его хроматограммы для необходимости сопоставления ее с таковыми вновь создаваемых РКС.
На рис.1 представлена хроматограмма РКС прототипа и из таблицы с результатами расчета площадей регистрируемых пиков видно, что сумма неидентифицируемых примесей равна более 50% (см. пики 5.87, 6.11, 6.29, 6.48, 8.09, 8.31, 8.66, 10.65, 10.96 и 11.43, которым соответствуют площади 1.4, 1.39, 1.03, 0.58, 2.36, 1.29, 17.35, 2.80, 2.99 и 23.50, сумма которых составляет 54.69%) и лишь около 45% приходится на идентифицируемые, которые приведены под хроматограммой (см. пики 4.89, 5.43, 7.21, 7.42, 9.15, 9.47, 10.07, которым соответствуют площади 0.13, 0.48, 1.45, 2.75, 19.92, 13.73, 5.96. Сумма этих площадей составляет 44.42%).
Техническая задача настоящего изобретения состояла в получении РКС, представляющего собой легкоидентифицируемое соединение с высокой рентгеноконтрастностью, низкой вязкостью и минимальным содержанием неидентифицируемых примесей за счет использования в качестве исходного сырья для его получения олеиновой кислоты.
Анализ зарубежной литературы свидетельствует об интенсивных исследованиях в области создания более совершенных масляных рентгеноконтрастных препаратов. В нашей стране производство РКС отсутствует и в клинической практике используются только импортные средства. В связи с этим создание отечественных РКС чрезвычайно актуально и явилось задачей настоящего изобретения.
Эта задача решена получением масляного РКС, которое характеризуется тем, что оно представляет собой масляное контрастное вещество с вязкостью 15-30 сПз, получаемое из олеиновой кислоты путем ее этерификации и последующего йодирования с выделением целевого продукта, содержащего не менее 65% этиловых эфиров йод- и дийодоктадекановых кислот, из оставшихся 35% не более 18% - этиловые эфиры олеиновой, линолевой, лауриновой, миристиновой и пальмитиновой кислот и не более 17% - неидентифицированные примеси.
На рис.2 представлена хроматограмма одной из серии получаемого РКС. В соответствии с результатами расчета площадей пиков йодированные эфиры составляют не менее 65% (см. пики 9.44 и 10.73, которым соответствуют площади 27.92 и 37.57, т.е. 66%). Другие идентифицированные продукты представляют собой этиловые эфиры олеиновой, линолевой, лауриновой, миристиновой и пальмитиновой кислот и незначительные количества олеиновой и линолевой кислот (см. приведенные на хроматограмме пики 4.97, 6.62, 6.85, 15.17, 4.05, 5.33, 5.73, 10.08, 7.27, 10.33) и составляют не более 18%. Неидентифицируемые примеси (пики от 7.57 до 9.08) составляют не более 17% (см. пики 7.57, 7.70, 7.82, 7.97, 8.18, 8.37, 8.57, 8.85, 9.08 и соответствующие им площади 3.7, 3.10, 2.37, 3.45, 0.79, 0.19, 1.48, 0.92, 0.32, сумма которых равна 16.32%).
Содержащиеся в предлагаемом РКС неидентифицируемые примеси, количество которых невелико (не более 17%, в то время как в прототипе их более 50%), не оказывают значительного влияния на вязкость препарата в целом, которая равна 15-30 сПз, т.е. сопоставима с вязкостью прототипа и значительно меньше по сравнению с липиодолом. Это делает данное РКС пригодным для безопасного внутрисосудистого введения - в артерии паренхиматозных органов.
Получают заявляемое РКС следующим образом.
Исходным сырьем является олеиновая кислота extra pure (по ЕС-№204-007-1, Чехия) - доступный недорогой продукт (стоимость 1 кг линолевой кислоты составляет 10221 руб., олеиновой - 2200 руб.). Она содержит в своем составе С18 (олеиновая кислота) - не менее 60%, С18 (линолевая кислота) - не более 25%, С12 (лауриновая кислота) - не более 2%, С14 (миристиновая кислота) - не более 2-5%, С16 (пальмитиновая кислота) - не более 9-15%. Торговую олеиновую кислоту предварительно очищают от предельных кислот с С12, С14, С16 вымораживанием при температуре 0-5°C, снижая их количество примерно до 10%. Очищенную таким образом олеиновую кислоту этерифицируют этиловым спиртом в присутствии концентрированной серной кислоты при температуре 80°C при перемешивании в течение 2-3 часов. Реакционную смесь выдерживают до разделения на 2 слоя: верхний слой - смесь этиловых эфиров со спиртом - отделяют, промывают от серной кислоты до нейтральной реакции и подвергают вакуумной (при остаточном давлении 2-3 мм рт.ст.) разгонке - фракция при 190-205°C представляет собой смесь этиловых эфиров олеиновой и линолевой кислот. Полученные этиловые эфиры йодируют газообразным йодистым водородом - предварительно вся технологическая система продувается аргоном до вытеснения воздуха. Газообразный йодистый водород получают реакцией йода с красным фосфором - для этого суспензию красного фосфора в воде по каплям добавляют к водной суспензии порошкообразного йода. Получающийся газообразный йодистый водород током аргона подается барботажем через слой этиловых эфиров олеиновой и линолевой кислот. Реакцию проводят при температуре 4-10°C в течение 2 часов и контролируют по привесу навески, которая должна соответствовать расчетному количеству присоединенного йодистого водорода по непредельным связям этиловых эфиров олеиновой и линолевой кислот. Полученные йодированные этиловые эфиры промывают до нейтральной реакции, обрабатывают насыщенным водным раствором тиосульфата и сушат центрифугированием.
Для получения лекарственной формы из этого препарата (субстанции), который и составил предмет настоящего изобретения и получил торговое название ЛИНОЙОДОЛ, к нему добавляют этиловый эфир олеиновой кислоты из расчета 5 мас.ч. эфира на 100 мас.ч. линойодола.
Состав РКС контролируется хроматографически. Оно имеет следующие свойства (в соответствии с требованиями проекта ФСП предприятия): количество связанного йода - 0.3-0.45 г/мл, плотность - 1.2-1.3 г/см3 (при 20°C), динамическая вязкость - 15-30 сПз (при 20°C), денситометрическая плотность - 2100-3100, неидентифицированные примеси - не более 17%, свободный йод и йодиды отсутствуют.
Приводим результаты доклинического изучения заявляемого РКС.
Объем проводимых испытаний определялся «Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ» (МЗ РФ, М., 2000, 398 с.) и «Правилами доклинической оценки безопасности фармакологических средств (Good Laboratory Practice - GLP)» Дозы препарата в мг/кг брались из расчета на этиловые эфиры йод - и дийодоктадекановых кислот. В качестве препарата сравнения использовался широко применяемый в клинической практике липиодол-флюид.
Изучение безопасности препарата
1. Острая токсичность
Острую токсичность лекарственной формы препарата изучали на половозрелых белых мышах и белых крысах линии Wistar.
В экспериментах на грызунах животных методом рандомизации разбивали на группы. В качестве критерия приемлемости рандомизации считали отсутствие у животных признаков заболеваний и гомогенность групп (по 5 животных) по полу и массе тела (±20%).
Белым мышам препарат вводился внутрибрюшинно, крысам - внутривенно в возрастающих дозах по Литчфолду-Уилкоксону (точность дозирования достигалась изменением объема вводимого препарата). Дозы вещества при внутрибрюшинном введении составили 2000, 3500 и 5000 мг/кг, при внутривенном - 1 000, 2000 и 3000 мг/кг. Объем вводимого препарата не превышал 0,2 мл для мышей и 1,2 мл для крыс.
После острого опыта грызуны наблюдались в течение 14 дней (1-й день - непрерывное наблюдение). Оценивали интегральные показатели:
внешний вид животных (состояние волосяного и кожного покровов, места инъекции), поведение, симптомы интоксикации, прирост массы тела (определение исходной массы, на 7 и 14 сутки), потребление пищи и воды за сутки (определение исходного потребления, на 7 и 14 сутки). Проводили оценку выделительной системы (частота мочеиспускания, цвет мочи), сердечно-сосудистой и дыхательной системы (частота дыхательных движений, частота сердечных сокращений - определение исходной частоты, на 7 и 14 сутки), пищеварительной системы (количество и консистенция фекальных масс - определение исходного количества за сутки, на 7 и 14 сутки), центральной и периферической нервной системы (поведенческие реакции, интенсивность и характер двигательной активности, наличие и характер судорог, координация движений, реакция на тактильные, звуковые, болевые и световые раздражители). Проводили макроскопическое исследование внутренних органов погибших животных (головной мозг, сердце, печень, почки, легкие, селезенка, надпочечники, желудок, кишечник, мочевой пузырь, поджелудочная железа, тимус). При отсроченной гибели проводилось микроскопическое исследование органов.
1.1.Токсикометрия
При внутрибрюшинном введении белым мышам использовали дозы 2000, 3500, 5000 мг/кг. Летальность белых мышей в течение 14 дней наблюдения (самки n=5, самцы n=5) отсутствовала. При внутривенном введении препарата крысам линии Wistar в дозах 1000, 2000, 3000 мг/кг (самки n=5, самцы n=5) летальность наблюдалась (14 дней наблюдения) только при дозе 3000 мг/кг. На протяжении всего периода наблюдения препарат вводился мышам и крысам ежедневно. У выживших животных отклонений от нормы по общему состоянию и поведению отмечено не было.
Расчет острой токсичности по методу пробит-анализа
probit-line zp=4.681*ln(d)+(-4.890)
Дозы (мг/кг)
Эффективная действующая доза (ED): ED16=2296, ED50=2842, ED84=3519. LD50=76.7 мл/кг или 88.2 г/кг
Таким образом, препарат обладает крайне низкой токсичностью.
Летальный исход в группах животных с внутривенным введением препарата происходил в течение первых 15 минут после введения препарата - на фоне заторможенности, выраженной одышки, выделения белой пены из носа происходила остановка дыхания. Клиническая картина свидетельствовала о развитии тромбоэмболии сосудов легких.
1.2. Влияние однократного введения препарата на интегральные и функциональные показатели
На протяжении всего периода наблюдения (14 дней) отклонений от нормы по общему состоянию и поведению у выживших животных опытных групп отмечено не было. При внутривенном введении препаратов в дозе 3000 мг/кг все параметры определялись на выживших животных (2 самки, 2 самца, общее количество животных - 4). В остальных группах (при внутрибрюшинном введении дозы составили 2000, 3500 и 5000 мг/кг, при внутривенном - 1000, 2000 и 3000 мг/кг) параметры определялись на 10 животных на дозу (5 самцов и 5 самок).
Наблюдалась равномерная прибавка массы животных во время всего срока наблюдения, что свидетельствует об отсутствии отсроченного токсического действия препарата. Для регистрации потребления животными воды и пищи в эти же временные сроки через 2 часа после введения препарата крыс на сутки высаживали в обменные клетки. При введении препарата во всех дозах отмечалось небольшое увеличение потребления корма к 14 суткам после введения препарата. В группах животных с внутривенным введением препарата в дозах 2000 и 3000 мг/кг наблюдалось увеличение потребления воды.
Оценка выделительной функции почек у крыс проводилось по количеству суточной мочи. Так же оценивалась частота мочеиспускания, цвет и прозрачность мочи. Моча у животных во всех группах на всех сроках наблюдения была прозрачная, цвет колебался от светло-желтого до темно-желтого. Значимого различия между исходными показателями и суточным количеством мочи после введения препарата выявлено не было.
Параметром оценки сердечно-сосудистой системы крыс была выбрана частота сердечных сокращений (ЧСС). У животных с внутривенным введением препарата в дозе 3000 мг/кг отмечена склонность к тахикардии.
Параметром оценки дыхательной системы крыс была выбрана частота дыхания (ЧД), значимых различий с исходными значениями по параметру ЧД выявлено не было.
Функцию пищеварительной системы оценивали по количеству и консистенции фекальных масс. При внутрибрюшинном и внутривенном введении препарата во всех дозах, изменений по количеству и консистенции фекальных масс зарегистрировано не было
1.3. Патологоанатомические исследования
Животные всех экспериментальных групп по истечении периода наблюдения (14 дней) были выведены из эксперимента. Дозы вещества при внутрибрюшинном введении составили 2000, 3500 и 5000 мг/кг, при внутривенном - 1 000, 2 000, 3000 (по 10 животных на каждую группу - 5 самок, 5 самцов). Внешних различий между животными опытных групп не выявлено.
Шерсть мышей и крыс имела опрятный вид, была блестящей, без очагов облысения. Питание животных удовлетворительное. Кожа и подкожная клетчатка в месте введения препарата изменений не представляли. Инфильтратов, раздражения или некроза тканей в месте введения не наблюдалось.
При макроскопическом исследовании отчетливого влияния препарата на состояние внутренних органов не установлено. При осмотре грудной и брюшной полостей нарушений в расположении внутренних органов не отмечалось. Щитовидная железа плотно прилежала к гортани, имела обычные размеры и плотность, розовато-красный цвет. Тимус имел треугольную форму, беловатый цвет и умеренно плотную консистенцию. Величина и форма сердца были не измененены. Мышца сердца была коричневой, плотной. Поверхность легких имела бледно-розовую окраску; легкие спадались при вскрытии грудной клетки. Ткань на разрезе также имела однородную бледно-розовую окраску. Слизистая оболочка вне легочных бронхов была гладкой, блестящей, бледно-розовой. Желудок имел обычную форму и размеры, просвет был заполнен плотным пищевым содержимым. Слизистая тела желудка была бледно-розовой, блестящей, складчатой. Слизистая тонкой и толстой кишки была блестящей, гладкой. Печень умеренно увеличена. Капсула печени была тонкой, прозрачной. Ткань печени имела коричневатый цвет и умеренно плотную консистенцию. Поджелудочная железа была бледно-розовой, дольчатой. Величина и форма почек не отличались от контроля, капсула легко снималась. Поверхность органа была гладкой, однородной коричнево-сероватой окраски. На разрезе почек четко различались корковое и мозговое вещество. Форма, размеры и плотность надпочечников, яичников или яичек не отличались от обычных. Селезенка имела темно-вишневый цвет, гладкую поверхность и плотную консистенцию. Оболочки головного мозга были тонкими, прозрачными. Вещество головного мозга имело умеренную плотность. Расширения желудочков мозга не наблюдалось.
У крыс с внутривенным введением препарата в дозе 3000 мг/кг (с летальным исходом) при вскрытии животных были обнаружены следующие изменения. В легких на поверхности разреза выступает пенистая жидкость бледно-розового цвета. Сосуды оболочек мозга полнокровны. Печень умеренно увеличена, ткань бледного цвета, зернистой консистенции.
1.4. Резюме по исследованию острой токсичности
Рандомизированное исследование острой токсичности на грызунах - белых нелинейных мышах и белых крысах линии Wistar - показало, что токсические дозы (мг/кг) испытуемого препарата сопоставимы с таковыми у разрешенных к применению рентгеноконтрастных масляных йодосодержащих средств и при однократном внутривенном введении препарата составляют ED16=2296; ED50=2842; ED84=3519. Проведенные испытания свидетельствуют об отсутствии противопоказаний по показателям острой токсичности для медицинского применения препарата.
2. Подострая токсичность
Эксперименты по изучению подострой токсичности препарата выполнялись на 40 половозрелых крысах обоего пола линии Wistar, объединенных в рандомизированные группы для проведения исследования. Исследуемый препарат вводили ежедневно в течение 28 дней внутрибрюшинно в дозах 900 мг/кг и 1800 мг/кг и внутривенно (в хвостовые вены) в следующих дозах: 140 мг/кг и 1400 мг/кг. Каждая группа животных состояла из 5 самцов и 5 самок.
Общая продолжительность наблюдения за животными составила 28 дней. Состояние животных (состояние волосяного и кожного покрова, места инъекции, поведение, интенсивность и характер двигательной активности, наличие и характер судорог, координация движений, симптомы интоксикации) фиксировалось ежедневно. Взвешивание животных, потребление пищи и воды за сутки выполнялось раз в неделю. Физиологические и биохимические исследования проводили до начала опыта (фоновые значения), на 7 и 14 день. После окончания введения препарата животные всех экспериментальных групп были подвергнуты эвтаназии и направлены на вскрытие и патоморфологическое исследование.
2.1. Токсикометрия
При введении препарата в дозах 900 мг/кг внутрибрюшинно и 140 мг/кг внутривенно смертности животных в течение 28-дневного введения препарата отмечено не было. Так как в течение первых 14 суток от момента введения летальности среди животных даже с дозами внутрибрюшинного и внутривенного введения 1800 и 1400 мг/кг не отмечалось, сроки введения препарата продлили до 28 суток. Животные умирали на фоне дыхательной недостаточности при внутривенном введении и на фоне общей интоксикации при внутрибрюшинном введении.
Расчет подострой токсичности при внутрибрюшинном введении осуществлялся Probit-Analys metod Litchfild-Wilcoxon, доза - 1800 мг/кг. Дозы (мг/кг) у самцов составляли ED16=28046 ED50=35622 ED84=45246, у самок - ED16=21570 ED50=32588 ED84=49236.
Результаты проведенных исследований показали, что изучаемое соединение обладает низкой токсичностью при внутрибрюшинном введении. Суммарная летальная доза вещества при внутрибрюшинном введении составила 32588 мг/кг, что соответствует VI классу токсичности (относительно безвредно). Анализ половой чувствительности показал отсутствие статистически значимых различий в сравниваемых группах.
Расчет подострой токсичности при внутривеном введении осуществлялся Probit-Analys metod Litchfild-Wilcoxon, доза - 1400 мг/кг. Дозы (мг/кг) у самцов составляли ED16=23966 ED50=28007 ED84-32729, у самок - ED16-21245 ED50-26928 ED84=32132.
Результаты проведенных исследований показали, что изучаемое соединение обладает низкой токсичностью при внутривенном введении. Полученные данные позволили рассчитать коэффициент кумулятивной активности LD50(N)/LD50(1). который составил около 10, что соответствует очень слабой кумулятивной активности (практически отсутствие). Анализ половой чувствительности показал отсутствие статистически значимых различий в сравниваемых группах.
Таким образом, препарат относится к 4 классу опасности по степени воздействия на организм.
2.2. Влияние на динамику массы тела крыс и потребление корма
Постоянная и положительная динамика массы тела крыс является интегральным показателем здоровья животных. Снижение массы тела у животных с внутрибрюшинном введении до 14 суток возможно объяснить стрессорным действием ежедневного введения препарата. Однако к 28 дню от момента введения отмечалось увеличение массы тела подопытных животных. При внутривенном введении отмечалось статистически достоверное увеличение массы тела крыс во всех группах.
При внутрибрюшинном и внутривенном введении препарата у животных отмечалась потеря аппетита на сроках до 14 суток от момента введения. К 28 суткам показатель нормализовался.
Для регистрации потребления животными воды и пищи в эти же временные сроки через 2 часа после введения препарата крыс на сутки высаживали в обменные клетки. Изменение потребления воды при внутрибрюшинном и внутривенном введении препарата не отмечено.
2.3. Влияние на функциональное состояние почек
Оценка выделительной функции почек проводилось по количеству суточной мочи. Так же оценивалась частота мочеиспускания, цвет и прозрачность мочи. Моча у животных во всех группах на всех сроках наблюдения была прозрачная, цвет колебался от светло-желтого до темно-желтого. Влияния внутрибрюшинного и внутривенного введения препарата на суточное количество мочи у крыс не выявлено.
2.4. Влияние на состояние сердечно-сосудистой системы
Параметром оценки была выбрана ЧСС. У животных с внутрибрюшинным и внутривенным введением препарата имела место склонность к тахикардии.
2.5. Влияние на состояние дыхательной системы
Параметром оценки была выбрана ЧД. У животных с внутрибрюшинным введением препарата отмечено снижение ЧД, в то время как в группах животных с внутривенным введением наблюдается значительное повышение частоты дыхательных движений.
2.6. Влияние препарата на функции пищеварительной системы
Функцию пищеварительной системы оценивали по количеству и консистенции фекальных масс. При внутрибрюшинном и внутривенном введении препарата во всех дозах, изменений по количеству и консистенции фекальных масс зарегистрировано не было.
2.7. Влияние на лабораторные показатели периферической крови
Биохимические и гематологические исследования проводили на 14 и 28 дни от начала введения препаратов. Кровь получали пункцией хвостовой вены или (в конце исследования) после одномоментного гильотинирования животных.
Следует отметить лейкоцитоз и повышение относительного содержания нейтрофилов в периферической крови крыс на 28 день после начала введения, более выраженное при внутрибрюшинном введении препарата, что следует расценивать как признак реактивной воспалительной реакции брюшины (перитонит) в результате длительного введения препарата.
Ежедневное внутривенное и внутрибрюшинное введение препарата не приводит к значимым отклонениям биохимических показателей периферической крови.
2.8. Результаты патоморфологического исследования
Патоморфологические исследования проводились при внутрибрюшинном введении препарата в дозах 900 мг/кг и 1800 мг/кг и внутривенном введении (в хвостовые вены) в следующих дозах: 140 мг/кг и 1400 мг/кг (по 10 животных на каждую группу - 5 самок, 5 самцов).
Крысы в группах внутрибрюшинного введения в дозе 900 мг/кг и внутривенного введения препарата в дозе 140 мг/кг, соответственно, правильного телосложения, удовлетворительного питания. Шерсть блестящая, опрятного вида, очагов облысения не определяется. При внутривенном введении препарата в дозе 1400 мг/кг и внутрибрюшинном введении в дозе 1800 мг/кг у животных шерсть тусклая, неопрятная.
Далее представлены обобщенные патоморфологические данные по крысам всех групп. Случаи расхождения данных по группам сравнения оговариваются дополнительно.
Зубы сохранены. Видимые слизистые оболочки бледной окраски, блестящие. Молочные железы самок без уплотнений на ощупь, выделения из сосков отсутствовали. Половые органы самцов развиты правильно. Деформации или отека конечностей нет. При внутрибрюшинном введении в брюшной полости содержится значительное количество исследуемого вещества, равномерно распределяющегося по всем интрабрюшинным органам. При внутривенном введении грудная и брюшная полости выпота не содержат. Положение внутренних органов грудной и брюшной полостей нарушений не представляет. Париетальный и висцеральный листки плевры и брюшины тонкие, блестящие, гладкие. Подчелюстные лимфатические узлы и слюнные железы овальной формы, бледно-желтого или розоватого цвета, с гладкой поверхностью, тонкой капсулой, не спаяны между собой и подлежащими тканями. Поверхность разреза однородной окраски. Щитовидная железа красноватого цвета, обычной величины и формы, умеренно плотной консистенции. Тимус треугольной формы, беловатого цвета, умеренно плотной консистенции, обычных размеров. Интима аорты гладкая, блестящая, беловатого цвета. Диаметр аорты не изменен. Листки перикарда тонкие, прозрачные, гладкие. Величина и форма сердца изменений не представляют. Левый желудочек сокращен, в правом содержится незначительное количество темной жидкой крови. Клапаны сердца тонкие, блестящие, гладкие. Мышца сердца на разрезе однородной коричневой окраски, умеренно плотная. Просвет трахеи и крупных бронхов не изменен, слизистая оболочка блестящая, гладкая, бледного цвета. Легкие воздушные, без уплотнений на ощупь, бледно-розовой окраски. В случае внутривенного введения препарата в дозе 1400 мг/кг легкие сниженной воздушности, при разрезе выделяется небольшое количество розоватой жидкости.
Слизистая пищевода блестящая, гладкая, бледного цвета. Желудок обычной величины и формы, заполнен пищевым содержимым. Слизистая оболочка железистой части желудка складчатая, розовая, блестящая. Слизистая оболочка тела желудка складчатая, розовая, блестящая. Слизистая оболочка тонкого кишечника бледно-розового цвета, блестящая, гладкая. Слизистая оболочка толстой кишки сероватого цвета, блестящая, гладкая. Печень умеренно увеличена в группах крыс с внутрибрюшинным и внутривенным введением препарата в дозах 1800 и 1400 мг/кг. Поверхность печени гладкая, однородной темно-красной окраски, капсула тонкая прозрачная. Ткань печени на разрезе полнокровная, умеренно плотная. Поджелудочная железа плоской формы, бледно-розового цвета, дольчатая, умеренно плотной консистенции. Селезенка обычной формы, темно-вишневого цвета, умеренно плотной консистенции. Поверхность органа гладкая, капсула тонкая. На разрезе на темно-красном фоне селезенки видны мелкие сероватого цвета фолликулы. В группе животных с внутрибрюшинным введением препарата в дозе 1800 мг/кг отмечалось увеличение селезенки. Величина и форма почек не изменены. Поверхность почек коричневого цвета, гладкая, капсула тонкая, прозрачная легко снимаемая. На разрезе органа хорошо различимы корковое и мозговое вещество. Надпочечники округлой формы, бледно-желтого цвета, с гладкой поверхностью, умеренно плотные. На разрезе четко выделяется темно-окрашенное мозговое вещество. Мочевой пузырь заполнен прозрачной мочой. Слизистая оболочка пузыря гладкая, блестящая, бледной окраски. Тело матки самок обычной плотности, величины и формы. Рога матки тонкие, слизистая - блестящая, бледная. Яичники темно-красного цвета, с неровной поверхностью, умеренно плотные. Яички самцов беловатого цвета, обычных размеров и плотности. Оболочки головного мозга тонкие, прозрачные. Вещество мозга обычной плотности, поверхность мозга гладкая. На фронтальных разрезах мозга отчетливо выделяются серое и белое вещество. Желудочки мозга обычной величины, расширения нет.
2.9. Результаты гистологического исследования
Объекты исследования фиксировали в 10% растворе формалина и заливали в парафин. Для гистологического исследования были представлены препараты головного мозга, печени, сердца, почек и легких в окрасках гематоксилином и эозином, по Ван-Гизону и Суданом III. Окраска Суданом III является селективным методом определения жиров в гистологических средах. Таким образом, обнаружение суданположительных включений свидетельствует о накоплении масляного препарата тканях.
Исследование органов животных, включенных в эксперимент (14-е и 28-е сутки) проводилось по алгоритму, включающему оценку каждого из признаков по пятибальной системе: 0 - нет признака; 1 - минимальная степень выраженности; 2 - слабая выраженность; 3 - умеренная выраженность; 4 - признак выражен; 5 - признак резко выражен.
Изучение органов животных, погибших в ходе эксперимента, выявило резко выраженные нарушения кровообращения в изученных органах, что сопровождалось дистрофическими изменениями паренхиматозных элементов в головном мозгу и печени. При исследовании почек, сердца, головного мозга животных на 14-е и 28-е сутки от введения препарата не получено существенной разницы изученных параметров. Не выявлено зависимости структуры указанных органов от дозы и пути введения, а также от сроков эксперимента.
В печени состояние гепатоцитов характеризовалось большей выраженностью дистрофических изменений на 14-е сутки (варианты белковой дистрофии) по сравнению с 28-ми. Убедительных признаков жировой дистрофии или накопления препарата в печени не выявлено ни у одного животного.
В легких на поздних сроках эксперимента вне зависимости от пути введения препарата постоянно выявлялось накопление жиросодержащих веществ (препарата) в сосудах мелкого калибра и/или макрофагах (у 6 из 7 животных против 2 из 8 на ранних сроках). Это не сопровождалось существенными изменениями структуры бронхов или респираторных отделов. Не было отмечено и обогащения свободными клетками.
2.10. Резюме по подострой токсичности
Полученные данные по подострой токсичности позволяют рекомендовать данный препарат для одно- двукратного системного применения (для лимфографии, для внутрисосудистого введения - эмболизации сосудов при лечении опухолей). Противопоказано внутривенное введение препарата из-за опасности эмболизации сосудов легких и головного мозга, что подтверждается данными гистологических исследований. Многократное введение препарата может вызвать воспалительную реакцию.
3. Изучение аллергенных свойств
Исследование аллергенных свойств препарата проводили в соответствии с «Методическими указаниями по оценке аллергизирующих свойств фармакологических веществ» МЗ РФ, 2000.
Эксперименты проводились на белых крысах линии Wistar с массой тела 200-225 г), белых беспородных мышах с массой тела 18-20 г, морских свинках-альбиносах (масса тела 250-300 г). Животные поступали из питомника РАМН «Рапполово», Санкт-Петербург.
Все экспериментальные животные проходили карантин (акклиматизационный период) длительностью 14 дней. В течение этого периода проводили ежедневный осмотр животных, оценивали поведение и общее состояние, больных или отличающихся по поведению животных отбраковывали. Перед началом эксперимента животные, отвечающие критериям включения в исследование, были распределены на группы с помощью метода рандомизации. Клетки с экспериментальными животными находились в специальных помещениях: световой режим: 12 часов свет, 12 часов - темнота; температура воздуха: 18-20°C; относительная влажность: 50-70%. Ежедневно проводили стерилизацию воздуха с помощью кварцевой лампы.
3.1. Реакция общей анафилаксии (анафилактический шок)
Морским свинкам вводили препарат в эффективной терапевтической дозе (140 мг/кг) и в дозе, в 10 раз ее превышающей (1400 мг/кг): первая инъекция подкожно, две последующие внутримышечно через день в область бедра. Контрольной группе животных вводили физиологический раствор в объеме, соответствующем объему исследуемого препарата.
На 21 день после сенсибилизирующей инъекции животным внутривенно вводили разрешающую дозу препарата, равную суммарной сенсибилизирующей. Аналогичную дозу вводили морским свинкам контрольных групп. Учет интенсивности анафилактического шока проводился в индексах по Wiegle:
++++ - шок со смертельным исходом;
+++ - шок тяжелой степени (общие судороги, асфиксия, животное теряет способность удерживаться на лапах, падает на бок, не погибает);
++ - шок умеренный (небольшие судороги, выраженные явления бронхоспазма);
+ - шок слабый (некоторое беспокойство, учащенное дыхание, почесывание мордочки, непроизвольное мо