Способ получения сульфоксидов
Иллюстрации
Показать всеИзобретение относится к способу получения оптически чистых сульфоксидов. Способ включает взаимодействие несимметричных тиоэфиров, имеющих в своем составе алкильные и/или ароматические заместители, с хиральными комплексами титана, либо молибдена, либо ванадия с тетрадентатными О,N,N,О-донорными лигандами саланового типа, представляющими собой производные бис(салицил)этилендиамина, и окислителем в среде растворителя. Растворитель выбран из группы, включающей метиленхлорид, хлороформ, тетрахлорметан, толуол, метанол либо их смесь. Технический результат - снижение соотношения катализатор/субстрат. 3 з.п. ф-лы, 3 ил., 3 табл., 2 пр.
Реферат
Изобретение относится к области органической химии и гомогенного катализа, а именно к разработке нового каталитического процесса стереоселективного каталитического окисления тиоэфиров для синтеза оптически чистых хиральных сульфоксидов.
Хиральные сульфоксиды находят все более широкое применение в процессах асимметрического синтеза благодаря способности сульфинильной группы служить эффективным хиральным контроллером в образовании С-С и С-Х связей (Прилежаева Е.Н. Химия сульфоксидов и сульфонов // Получение и свойства органических соединений серы, Л.И.Беленький, ред., Москва: Химия, 1998). Кроме того, многие сульфоксиды проявляют биологическую активность, что позволяет использовать их в качестве фармпрепаратов / Kalir A., Kalir H.H. Biological activity of sulfoxides and sulfones // In The Chemistry of Sulfur-Containing Functional Groups, S.Patai, Z.Rappoport, Eds., Wiley: New York, 1993, p.957-975).
Выделяют три общих подхода к синтезу энантиомерно чистых органических соединений: (1) разделение рацемических смесей, например классическое расщепление через диастереомеры, хроматографическре разделение, энзиматическое разделение, кинетическое разделение, (2) химическую модификацию природных хиральных соединений и (3) асимметрический синтез (Julien Legros, Juan R. Dehli, Carsten Bolm. Applications of Catalytic Asymmetric Sulfide Oxidations to the Syntheses of Biologically Active Sulfoxides // Adv. Synth. Catal. 2005, v.347, p.19-31).
Основным подходом к синтезу оптически чистых сульфоксидов в настоящее время является асимметрический синтез, причем наиболее перспективным представляется каталитический асимметрический синтез, поскольку в последнем случае открывается возможность получать много хиральных молекул продукта с использованием всего одной хиральной молекулы катализатора.
На сегодняшний день единственным применяемым в промышленности способом асимметрического каталитического окисления тиоэфиров в сульфоксиды является модифицированный способ Кагана-Модены, в котором катализатором выступает получаемый in situ комплекс титана(IV) с (S,S)-диэтилтартратом. Однако существующие методики требуют присутствия до 30 мол.% титана и 60 мол.% диэтилтартрата, а в качестве окислителя используется токсичный кумилгидропероксид или трет-бутилгидропероксид, обладающий резким запахом (Cotton H., Elebring Т., Larsson M., Li L., Sörensen H., von Unge S. Asymmetric synthesis of esomeprazole // Tetrahedron: Asymmetry, 2000, v.11, p.3819-3825).
Другие известные способы, основанные на применении вместо (S,S)-диэтилтартрата других хиральных лигандов, например 1,2-дифенилэтан-1,2-диола, позволяют снизить соотношение титан:пирметазол до 5 мол.% (Jiang В., Zhao X.-L., Dong J.-J., Wang W.-J., Eur. J. Org. Chem. 2009, p.987-991), при этом в качестве окислителя также используются органические гидропероксиды.
Отметим, что в заявке на изобретение WO 03089408 описан способ получения хиральных замещенных пиридинилметилсульфинильных бензимидазолов и их солей с помощью окисляющего агента в органическом растворителе в присутствии основания и катализатора, состоящего из комплекса титана или ванадия с хиральным монодентатным лигандом. Окислитель при этом выбирается из пероксида водорода, алкилгидропероксидов и алкиларилгидропероксида. Однако использование пероксида водорода и алкиларилгидропероксида не подтверждено примерами, содержащимися в WO 03089408.
В патенте ЕА 009385 описан способ энантиоселективного синтеза отдельных энантиомеров модафинила путем взаимодействия прохирального сульфида с комплексом металла с хиральным лигандом, основанием и окисляющим агентом в среде органического растворителя. При этом в качестве комплекса металла с хиральным лигандом используется хиральный комплекс титана, циркония, марганца или ванадия, который получают из соединения металла, хирального лиганда и воды. При этом окислитель представляет собой пероксид водорода, трет-бутилгидропероксид и гидропероксид кумола. Однако использование пероксида водорода не подтверждено примерами, содержащимися в ЕА 009385. Кроме того, в качестве хиральных лигандов авторы подтвердили примерами только (S,S)-диэтилтартрат и (R,R)-диэтилтартрат.
В патенте WO 2010029950 описаны способы приготовления комплексов титана с саленовыми, салаленовыми и салановыми лигандами, предназначенных для применения в процессах получения оптически активных эпоксисоединений и сульфоксидов. В частности, авторами описан синтез ряда комплексов титана с лигандами, содержащими O-алкильные, О-арильные либо О-алкиларильные заместители в орто-положениях фенильных заместителей арильных колец, в связи с чем эти лиганды следует отнести к достаточно узкому и специфическому классу гексадентатных (O,O,N,N,O,O-донорных). В то же время WO 2010029950 не сообщает о возможности проведения процессов получения оптически чистых сульфоксидов в присутствии комплексов титана, молибдена, ванадия с тетрадентатными O,N,N,O-донорными салановыми лигандами в различных органических растворителях.
Очевидно, для целей получения фармацевтических препаратов, к чистоте и безопасности для человека которых предъявляются повышенные требования, целесообразно максимально снизить количество катализатора - комплекса металла - и воспользоваться наиболее безопасным для человека и окружающей среды (и при этом доступным) окислителем, таким как Н2О2. Кроме того, для достижения наибольшей эффективности желательно (1) максимально упростить технический процесс, например загружать готовый к употреблению катализатор, а не готовить его in situ, (2) повысить количество совершаемых катализатором циклов и соответственно снизить соотношение катализатор/субстрат.
Таким образом, изобретение решает задачу упрощения процесса получения оптически чистых органических сульфоксидов и повышение экологической безопасности этого процесса.
Технический результат - снижение соотношения катализатор/субстрат, использование доступного и экологически безопасного окислителя, например Н2О2.
Задача решается способом получения оптически чистых сульфоксидов, который осуществляют при взаимодействии несимметричных тиоэфиров, имеющих в своем составе алкильные и/или ароматические заместители, с хиральными комплексами титана, либо молибдена, либо ванадия с тетрадентатными О,N,N,О-донорными лигандами саланового типа, представляющими собой производные бис(салицил)этилендиамина, и окислителем в среде любого из перечисленных растворителей: метиленхлорида, хлороформа, тетрахлорметана, толуола, метанола либо их смеси. В качестве хиральных комплексов металлов с тетрадентатными О,N,N,О-донорными лигандами используют предпочтительно хиральные комплексы титана с О,N,N,О-донорными лигандами саланового типа, представляющими собой производные бис(салицил)этилендиамина. Окислителем может быть пероксид водорода либо аддукт пероксида водорода с мочевиной Н2О2·(NH2)2СО. Хиральные комплексы металлов используют заранее приготовленные либо получаемые in situ.
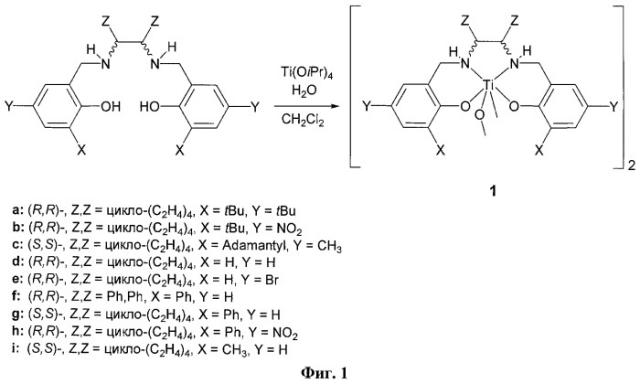
В частности, настоящим изобретением предлагается новый способ получения оптически чистых сульфоксидов, основанный на процессе селективного окисления прохиральных тиоэфиров 30% пероксидом водорода, в присутствии каталитических количеств (≤1 мол.%) хиральных комплексов титана, молибдена или ванадия типа 1 с тетрадентатными О,N,N,О-донорными лигандами саланового типа - производных бис(салицил)этилендиамина (см. Фиг.1, примеры строения салановых лигандов и салановых комплексов титана, где X,Y,Z = алкил, арил, галоген, NO2). В качестве предпочтительных катализаторов используют хиральные комплексы титана.
При этом не требуется использовать никакие дополнительные каталитические добавки, как-то: вода, кислоты, щелочи, соли, комплексы, донорные лиганды и т.д., либо буферные соединения.
Готовить катализаторы можно так, как описано в статье (Bryliakov K.P., Talsi E.P. Titanium-salan-catalyzed asymmetric oxidation of sulfides and kinetic resolution of sulfoxides with H2O2 as the oxidant // Eur. J. Org. Chem., 2008, p.3369-3376) или в Примере 2. В качестве катализаторов можно использовать как заранее приготовленные комплексы титана, так и получаемые in situ.
Было установлено, что комплексы титана, обладающие данным строением, способны катализировать стереоселективное окисление тиоэфиров до сульфоксидов пероксидом водорода, причем лучшим для данной реакции растворителем является метиленхлорид CH2Cl2, т.к. в нем образуются сульфоксиды с наибольшим выходом и энантиомерным избытком.
Сущность изобретения иллюстрируется следующими примерами.
Пример 1.
Получение хиральных алкиларилсульфоксидов окислением соответствующих тиоэфиров пероксидом водорода в присутствии каталитических количеств салановых комплексов титана.
К раствору саланового комплекса титана 1a-i (1 мкмоль или 0.2 мкмоль) в 2 мл CH2Cl2, термостатированному при заданной температуре, добавляют 0.1 ммоль сульфида и необходимое количество 30% водного пероксида водорода одной порцией. Перемешивают полученный раствор на магнитной мешалке до достижения нужной глубины протекания реакции (1-48 ч), контролируя протекание реакции с помощью ТСХ (элюент: EtOAc/гексан).
В реакционную смесь добавляют 1 мл воды. Органическую фазу отделяют и отгоняют растворитель в токе сжатого воздуха. Остаток экстрагируют 8 мл ССl4, экстракт осушают CaSO4 и анализируют с помощью 1Н ЯМР. Энантиомерный избыток (ЭИ) определяют с помощью 1Н ЯМР с хиральным реагентом сдвига Eu(hfc)3.
Пример 2.
Получение хиральных алкиларилсульфоксидов окислением соответствующих тиоэфиров пероксидом водорода в присутствии каталитических количеств салановых комплексов титана, получаемых in situ.
К раствору саланового лиганда a-i (1.68-3.0 мкмоль) в CH2Cl2 добавляют Ti(O-i-Pr)4 (2.0 мкмоль) и перемешивают в течение 30 мин при комнатной температуре. Образец термостатируют при нужной температуре и добавляют 0.1 ммоль сульфида и необходимое количество 30% водного пероксида водорода одной порцией. Перемешивают полученный раствор на магнитной мешалке до достижения нужной глубины протекания реакции (1-48 ч), контролируя протекание реакции с помощью ТСХ (элюент: EtOAc/гексан).
В реакционную смесь добавляют 1 мл воды. Органическую фазу отделяют и отгоняют растворитель в токе сжатого воздуха. Остаток экстрагируют 8 мл CCl4, экстракт осушают CaSO4 и анализируют с помощью 1Н ЯМР. Энантиомерный избыток (ЭИ) определяют с помощью 1Н ЯМР с хиральным реагентом сдвига Eu(hfc)3. Окисление по данному способу показывает более низкую хемо- и энантиоселективность, чем по способу, описанному в примере 1.
Результаты окисления различных сульфидов в присутствии каталитических количеств комплексов 1 приведены в таблице 1.
Выяснилось, что комплексы данного типа являются наиболее подходящими для окисления тиоэфиров с двумя объемными заместителями, такими как PhSCH2Ph. Именно для этого субстрата наблюдался наибольший выход и энантиоселективность реакции, причем наилучшие каталитические свойства показал комплекс 1g (X=Ph, Y=Н) (таблица 1). Энантиомерный избыток образующегося бензилфенилсульфоксида возрастал при увеличении соотношения окислитель/субстрат одновременно с повышением доли сульфона в продуктах реакции (таблица 1, опыты 14-17), что свидетельствовало о существовании кинетического разделения образующихся сульфоксидов в процессе дальнейшего их окисления до сульфона (Bryliakov K.P., Talsi Е.Р. Titanium-salan-catalyzed asymmetric oxidation of sulfides and kinetic resolution of sulfoxides with H2O2 as the oxidant // Eur. J. Org. Chem., 2008, p.3369-3376). Катализатор оказался способен осуществлять не менее 500 каталитических циклов без снижения энантиоселективности (ср. таблица 1, опыты 17-20). Было также показано, что понижение температуры способствует росту селективности по сульфоксиду и энантиомерного избытка (таблица 1, ср. опыты 15 и 21).
Данные о влиянии растворителя и температуры на асимметрическое окисление ряда тиоэфиров приведены в таблице 2. Наилучшим растворителем для данной реакции является CH2Cl2, в то время как использование CHCl3, CCl4, толуола и метанола приводит к более низким значениям энантиомерного избытка получаемых сульфоксидов (примеры 1-5). Показано также, что наилучшим окислителем является пероксид водорода, а применение аддукта пероксида водорода с мочевиной Н2О2·(NH2)2СО (пример 4) приводит к более низким значениям энантиомерного избытка.
В таблице 3 приведены результаты энантиоселективного окисления тиоэфиров пероксидом водорода в присутствии каталитических количеств комплексов ряда переходных металлов с тетрадентатными О,N,N,О-донорными лигандами, получаемых in situ. Показано, что наивысшие величины энантиомерных избытков достигаются в присутствии комплексов титана, в то время как использование комплексов ванадия и молибдена дает более низкие значения энантиомерных избытков.
Явление кинетического разделения сульфоксидов было более подробно изучено на примере двух сульфоксидов: PhS-i-Pr и PhSCH2Ph (Фиг.2). На Фиг.2 показан выход сульфоксида и сульфона и энантиомерный избыток (ЭИ) сульфоксида в зависимости от соотношения окислитель/субстрат при окислении PhS-i-Pr (а) и PhSCH2Ph (b). Катализатор 1g, CH2Cl2, 25°С, сульфид/[1]=100:1.
Было показано, что с ростом соотношения окислитель/субстрат энантиомерный избыток для данных сульфоксидов монотонно возрастает (приближаясь в случае PhSOCH2Ph к 99%), при этом, однако, снижается доля целевого продукта - сульфоксида - в реакционной смеси и возрастает доля продукта дальнейшего окисления сульфоксида - сульфона.
На Фиг.3 представлен выход сульфоксида и сульфона и энантиомерный избыток (ЭИ) сульфоксида в зависимости от соотношения окислитель/субстрат при окислении PhSCH2Ph (а). Содержание сульфида, сульфоксида и сульфона в реакционной смеси по окончании реакции при окислении PhSCH2Ph (b). Катализатор 1g, 5°С, сульфид/[1]=100:1.
| Таблица 1 | |||||||
| Энантиоселективное окисление сульфидов системой комплекс титана 1/H2O2. | |||||||
| № | Комплекс | [O]/[S] [моль/моль] | Сульфид | Время реакции [ч] | Выход сульфоксид/сульфон [%][а] | Селективность [%][b] | ЭИ [%][c] (конфигурация) |
| 1 | 1d | 1.12 | PhSCH3 | 2 | 77.5/12.0 | 87.0 | 45.0 (R) |
| 2 | 1d | 1.12 | p-BrPhSCH3 | 2 | 70.5/10.5 | 87.0 | 42.0 (R) |
| 3 | 1d | 1.28 | PhS-i-Pr | 3 | 52.2/40.0 | 56.6 | 69.5 (R) |
| 4 | 1d | 1.6 | PhSCH2Ph | 3 | 51.0/47.6 | 51.7 | 86.0 (R) |
| 5 | 1e | 1.12 | PhSCH3 | 2 | 76.0/16.5 | 82.0 | 46.7 (R) |
| 6 | 1e | 1.12 | p-BrPhSCH3 | 2 | 68.3/10.7 | 86.5 | 39.0 (R) |
| 7 | 1e | 1.28 | PhS-i-Pr | 3 | 60.5/21.0 | 73.5 | 64.0 (R) |
| 8 | 1e | 1.6 | PhSCH2Ph | 3 | 62.0/34.0 | 64.5 | 74.5 (R) |
| 9 | 1h | 1.28 | PhS-i-Pr | 2.5 | 23.0/3.5 | 85.0 | 4.5 (R) |
| 10 | 1h | 1.12 | PhSCH2Ph | 2.5 | 26.5/3.0 | 90.0 | 4.0 (R) |
| 11 | 1g | 1.12 | p-BrPhSCH3 | 16 | 72.5/13.5 | 84.0 | 16.0 (S) |
| 12 | 1g | 1.12 | PhSiPr | 16 | 47.5/27.0 | 63.5 | 69.0 (S) |
| 13 | 1i | 1.12 | PhSCH2Ph | 2 | 75.0/17.0 | 81.5 | 60.0 (S) |
| 14 | 1g | 0.64 | PhSCH2Ph | 16 | 48.0/4.0 | 92.5 | 82.0 (S) |
| 15 | 1g | 1.12 | PhSCH2Ph | 2 | 75.0/19.0 | 80.0 | 88.0 (S) |
| 16 | 1g | 1.36 | PhSCH2Ph | 4 | 73.5/22.0 | 77.0 | 90.5 (S) |
| 17 | 1g | 1.6 | PhSCH2Ph | 4 | 65.0/34.5 | 65.5 | 97.0 (S) |
| 18 | 1g | 1.6 | PhSCH2Ph | 4 | 63.5/35.5 | 64.0 | 97.0 (S) |
| 19 | 1g | 1.6 | PhSCH2Ph | 24 | 49.5/14.5 | 77.5 | 77.0 (S) |
| 20 | 1g | 1.6 | PhSCH2Ph[d] | 48 | 34.0/3.0 | 91.5 | 60.0 (S) |
| 21 | 1g[e] | 1.12 | PhSCH2Ph | 8 | 76.5/17.5 | 81.0 | 93.5 (S) |
| [Субстрат]:[комплекс титана]=100:1 моль/моль (опыты 1-17 и 19), 500:1 моль/моль (опыт 18), 1000:1 моль/моль (опыт 19), 2000:1 моль/моль (опыт 20). Представлены результаты реакций согласно Примеру 1 при 25°С (опыты 1-18) и +5°С (опыт 19) в CH2Cl2. Начальная концентрация сульфида 0.05 М. | |||||||
| [a] Определены из соотношения сульфида, сульфоксида и сульфона в реакционной смеси по данным 1Н ЯМР. | |||||||
| [b] Селективность по сульфоксиду. | |||||||
| [с] Энантиомерный избыток полученного сульфоксида. | |||||||
| [d] Начальная концентрация сульфида 0.1 М. | |||||||
| [е] При +5°С. |
| Таблица 2 | |||||||||
| Влияние растворителя, температуры на энантиоселективное окисление PhSCH2Ph, PhSiPr и 2-NaphSMe в присутствии катализаторов типа 1 | |||||||||
| № | Комплекс | Темп. [°C] | Растворитель | [O]/[S] [моль/моль] | [S]/[Cat] [моль/моль] | Время реакции [ч] | Выход сульфоксид/сульфон [%][а] | Селективность [а] | ЭИ (конфигурация) [%][b] |
| 1 | 1g | 25 | CHCl3 | 1.6 | 100 | 4 | 58.0/27.5 | 68.0 | 88.0 (S) |
| 2 | 1g | 25 | CCl4 | 1.6 | 100 | 4 | 8.0/7.0 | 53.0 | 57.5 (S) |
| 3 | 1g | 25 | толуол | 1.6 | 100 | 4 | 23.0/26.0 | 47.0 | 66.5 (5) |
| 4 | 1g[c] | 25 | метанол | 1.12 | 50 | 15 | 60.0/3.0 | 95.0 | 14.0 (S) |
| 5 | 1g | 25 | CH2Cl2 | 1.6 | 100 | 4 | 65.0/34.5 | 65.5 | 97.0 (S) |
| 6 | 1d | 0 | CH2Cl2 | 1.12 | 100 | 5 | 71.0/15.5 | 82.0 | 81.0 (R) |
| 7 | 1e | 0 | CH2Cl2 | 1.12 | 100 | 5 | 67.5/10.0 | 87.0 | 75.5 (R) |
| 8 | 1g | 0 | CH2Cl2 | 1.12 | 100 | 5 | 77.5/13.0 | 85.5 | 92.5 (S) |
| 9 | 1d | 0[d] | CH2Cl2 | 1.28 | 100 | 6 | 60.5/31.0 | 66.0 | 72.5 (R) |
| 10 | 1d | 0[e] | CH2Cl2 | 1.28 | 100 | 6 | 85.5/14.0 | 85.5 | 59.0 (R) |
| Начальная концентрация сульфида 0.05 М, если не указано иное. В качестве субстрата использовали PhSCH2Ph, если не указано иное. | |||||||||
| [a] Определены из соотношения сульфида, сульфоксида и сульфона в реакционной смеси по данным 1Н ЯМР. Селективность определена по сульфоксиду. | |||||||||
| [b] Значения энантиомерных избытков (ЭИ) измерены с помощью метода 1Н NMR с хиральным реагентом сдвига Eu(hfc)3 в CCl4. | |||||||||
| [c] В качестве окислителя использовали аддукт пероксида водорода с мочевиной H2O2·(NH2)2CO. | |||||||||
| [d] В качестве субстрата использовали PhSiPr. | |||||||||
| [e] В качестве субстрата использовали 2-NaphSMe. |
| Таблица 3 | |||||||
| Энантиоселективное окисление сульфидов системой лиганд/источник металла/Н2О2 | |||||||
| № | Лиганд/металл | Источник металла | Тиоэфир | Время реакции [ч] | Выход сульфоксид/сульфон [%][а] | Селективность [а] [%] | ЭИ (конфигу-рация) [%] [b] |
| 1 | g/Mo=1.0 | МоО2(асас)2 | PhSCH2Ph | 24 | 79.5/12.0 | 87.0 | 8.5 (R) |
| 2 | g/Mo=1.0 | МоО2(асас)2 | PhSCH3 | 24 | 82.0/10.5 | 88.5 | 0 |
| 3 | a/Mo=1.5 | МоО2(асас)2 | p-CH3PhSCH3 | 24 | 57.0/3.0 | 95.0 | 2.5 (5) |
| 4 | g/V=1.5 | VO(acac)2 | PhSCH2Ph | 15 | 86.0/10.5 | 89.0 | 8.5 (R) |
| 5 | a/V=1.5 | VO(асас)2 | p-CH3PhSCH3 | 4 | 85.8/5.5 | 94.0 | 10.0 (R) |
| 6 | g/V=1.5 | VO(O-n-Bu)3 | p-BrPhSCH3 | 14 | 89.5/6.0 | 93.7 | 2.0 (R) |
| 7 | 2/V=1.5 | VO(O-n-Bu)3 | p-CH3PhSCH3 | 14 | 51.5/6.5 | 89.0 | 6.0 (S) |
| 8 | d/V=1.5[c] | VO(O-n-Bu)3 | p-BrPhSCH3 | 20 | 32.0/4.5 | 87.5 | 37.5 (R) |
| 9 | d/V=1.5 | VO(O-n-Bu)3 | p-CH3PhSCH3 | 14 | 82.0/12.5 | 86.5 | 19.5 (R) |
| 10 | e/V=1.0 | VO(O-n-Bu)3 | p-CH3PhSCH3 | 15 | 85.5/14.0 | 85.9 | 17.0 (R) |
| 11 | e/V=1.0 | VO(O-n-Bu)3 | p-BrPhSCH3 | 15 | 78.0/13.5 | 85.2 | 13.5 (R) |
| 12 | d/Ti=1.0 | Ti(O-i-Pr)4 | PhSCH2Ph | 5 | 62.5/29.5 | 68.0 | 62.5 (R) |
| 13 | e/Ti=1.0 | Ti(O-i-Pr)4 | PhSCH2Ph | 5 | 64.5/26.5 | 70.5 | 62.0 (R) |
| 14 | g/Ti=1.0 | Ti(O-i-Pr)4 | PhSCH2Ph | 2.5 | 62.5/14.5 | 81.0 | 64.0 (S) |
| 15 | g/Ti=1.0 | Ti(O-i-Pr)4 | PhSCH2Ph | 15 | 68.8/17.0 | 80.0 | 60.0 (S) |
| Соотношение [окислитель]:[субстрат]:[металл]=56:50:1. Реакцию вели при 25°С в CH2Cl2. Начальная концентрация сульфида 0.05 М. | |||||||
| [a] Определены из соотношения сульфида, сульфоксида и сульфона в реакционной смеси по данным 1H ЯМР. Селективность определена по сульфоксиду. | |||||||
| [b] Значения энантиомерных избытков (ЭИ) измерены с помощью метода 1Н NMR с хиральным реагентом сдвига Eu(hfc)3 в CCl4. | |||||||
| [c] Реакцию вели в CHCl3 при -12°С без перемешивания. |
Было показано, что понижение температуры позволяет повысить хемо- и стереоселективность окисления PhSCH2Ph (Фиг.3). Так, при проведении каталитической реакции при +5°С был достигнут энантиомерный избыток 98.5% при соотношении окислитель/субстрат 1.34 (при этом выход сульфоксида составил 65.8%). Максимальный выход сульфоксида (72-77%) достигается при соотношении окислитель/субстрат 1.05-1.15, что позволяет рекомендовать использование таких соотношений для проведения препаративных каталитических синтезов.
Таким образом, впервые показано, что салановые комплексы титана способны катализировать окисление тиоэфиров пероксидом водорода с высокой селективностью до 72-77% и энантиоселективностью до 98.5%. Наилучшие результаты были показаны при окислении тиоэфиров с двумя объемными заместителями (такими как PhS-i-Pr и PhSCH2Ph), которые могут рассматриваться в качестве реалистичных моделей биологически активных соединений. Высокий уровень асимметрической индукции достигается в результате одновременного стереоселективного окисления сульфидов/кинетического разделения сульфоксидов. Катализаторы способны выполнять до 500 каталитических циклов без снижения энантиоселективности. Катализаторы данного типа используют хиральные лиганды, приготавливаемые из доступных предшественников, нетоксичный металл, экологически безопасный окислитель. Окисление проводится в предпочтительном растворителе дихлорометане, который благодаря низкой температуре кипения (+39.8°С при 760 торр) легко отгоняется от реакционной смеси. Хемо- и энантиоселективность окисления можно повысить понижением температуры проведения реакции.
1. Способ получения оптически чистых сульфоксидов при взаимодействии несимметричных тиоэфиров, имеющих в своем составе алкильные и/или ароматические заместители, с хиральными комплексами титана, либо молибдена, либо ванадия с тетрадентатными О,N,N,О-донорными лигандами саланового типа, представляющими собой производные бис(салицил)этилендиамина, и окислителем в среде любого из перечисленных растворителей: метиленхлорида, хлороформа, тетрахлорметана, толуола, метанола либо их смеси.
2. Способ по п.1, отличающийся тем, что в качестве хиральных комплексов металлов с тетрадентатными О,N,N,О-донорными лигандами используют предпочтительно хиральные комплексы титана с О,N,N,О-донорными лигандами саланового типа, представляющими собой производные бис(салицил)этилендиамина.
3. Способ по п.1, отличающийся тем, что окислителем может быть пероксид водорода либо аддукт пероксида водорода с мочевиной H2O2·(NH2)2CO.
4. Способ по п.1, отличающийся тем, что хиральные комплексы металлов используют заранее приготовленные либо получаемые in situ.