Фторированные производные катарантина, их получение и применение в качестве прекурсоров димерных алкалоидов vinca
Иллюстрации
Показать всеИзобретение относится к фторированным производным катарантина, соответствующим общей формуле I, в которой: пунктирная линия означает возможность присутствия двойной связи, когда замещение -X отсутствует, либо простой связи, когда -X обозначает замещение группой: Н, R1, R2 и R3 независимо друг от друга представляют собой атом фтора или метилированную группу, и n=2. Изобретение также относится к способу получения указанного производного и к его применению в качестве промежуточного соединения для синтеза фторированных димерных алкалоидов Vinca, в частности винфлунина, котороый, в свою очередь, используется как противораковое средство. 7 н. и 15 з.п. ф-лы.
Реферат
Настоящее изобретение относится к фторированным производным катарантина, к их получению и к их применению в качестве предшественника (прекурсора) фторированных димерных алкалоидов Vinca и, в частности, винфлунина.
Винфлунин 1 представляет собой противораковое средство широкого спектра действия, разработанное лабораториями Pierre Fabre. Эта молекула представляет собой фторированный аналог винорельбина 5 (Navelbine®), который является стандартным лекарством для лечения рака молочной железы и легкого. Структура винфлунина является очень сходной со структурой винорельбина, от которой она отличается только присутствием гем-дифторированной в положении С20' группы, и отсутствием двойной связи С3'-С4'. Винфлунин 1 (Javlor®) является наиболее активным фторированным соединением, открытым в последние годы. В настоящее время он находится в фазе III клинических испытаний при лечении рака молочной железы, мочевого пузыря и легкого и на сегодняшний день объявлен наиболее перспективной молекулой, имеющей происхождение из семейства алкалоидов Vinca.
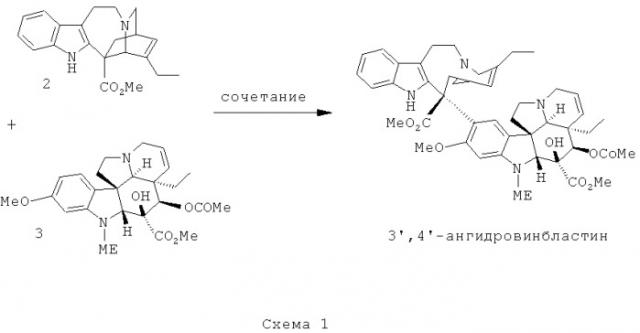
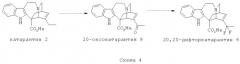
Винфлунин может быть получен из предшественника 3',4'-ангидровинбластина 4, который получают путем сочетания двух субъединиц катарантина 2 и виндолина 3, которые экстрагируют непосредственно из листьев барвинка (схема 1). Альтернативно винфлунин может быть получен путем прямого фторирования винорельбина.
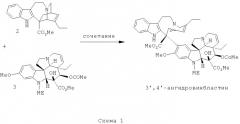
Затем 3',4'-ангидровинбластин 4 может быть преобразован в винорельбин 5 путем сужения кольца или в винфлунин 1 путем введения двух атомов фтора на боковой цепи "северного" фрагмента с последующим сужением кольца (схема 2). Эта реакция фторирования имеет место в сверхкислотной среде (HF-SbF5) в присутствии хлорированного растворителя. Эти условия реакции являются особенно сильнодействующими, приводящими в результате к частичному распаду димерного алкалоида 4 и, следовательно, к падению общего химического выхода этого преобразования. Дифторирование гема в С20' протекает с сопутствующим восстановлением двойной связи С3'-С4. Стереохимический центр, образованный при 4', имеет абсолютную конфигурацию (R). Винфлунин может быть также получен путем фторирования винорельбина 5 (Navelbine®). Его синтез осуществляют путем сужения кольца 3',4'-ангидровинбластина 4.
3',4'-Ангидровинбластин 4 является дорогостоящим продуктом. Стадия фторирования, таким образом, вызывает уничтожение значительного количества этого ценного промежуточного соединения. Эта ситуация является рискованной, приводя в результате время от времени к сильному возрастанию потребности в листьях барвинка. Несколько стратегий находятся в стадии исследования для продолжения разработки винфлунина 1.
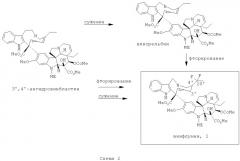
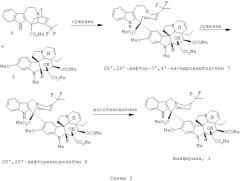
На основании наблюдения, что фторирование 3',4'-ангидровинбластина в сверхкислотной смеси модифицирует только его "северный" фрагмент, который имеет происхождение от катарантина, в объеме настоящего изобретения предложено решение, состоящее во введении атомов фтора непосредственно в каркас катарантина 2. Этот подход обладает рядом преимуществ: он вводит атом фтора на более ранней стадии в синтезе в продукт с меньшей стоимостью, чем 3',4'-ангидровинбластин 4. Затем синтез винфлунина может быть достигнут посредством сочетания, имитирующего биологическое, с виндолином 3. Действительно, 20',20'-дифторкатарантин 6 можно затем подвергать сочетанию с виндолином 3 с получением 3',4'-ангидро-20',20'-дифторвинбластина 7. Последний, наконец, преобразуют в винфлунин 1 в процессе, знакомом специалистам в данной области техники, путем реакции сужения кольца с последующим восстановлением ненасыщенной двойной связи С3'-С4 (схема 3).
Данный подход также дает возможность получения других исходных дифторированных производных (3',4'-ангидро-20',20'-дифторвинбластина 7, 20',20'-дифторвинорельбина 8), которые невозможно получить в общепринятых сверхкислотных условиях. Эти молекулы вызывают все больший интерес, поскольку исследование взаимосвязи структуры и активности показало, что область 4' и 20' алкалоидов Vinca сильно связана с их противоопухолевой активностью. Также в результате сочетания промежуточных соединений синтеза (и производных) фторированного катарантина подобным образом получают другие исходные фторированные производные димерных алкалоидов Vinca.
Таким образом, настоящее изобретение относится к фторированным производным катарантина, соответствующим общей формуле I:
в которой:
- пунктирная линия означает возможность присутствия двойной связи, когда замещение -X отсутствует, либо простой связи, когда -X обозначает замещение группой:
- Н,
- OR,
- NR'R'',
- SR или
- атомом галогена, где R, R' и R'' независимо друг от друга обозначают атом водорода, либо нормальную или разветвленную алкильную группу C1-C6,
- R1, R2 и R3 независимо друг от друга представляют собой атом водорода, фтора или метилированную группу, при условии, что по меньшей мере один из радикалов R1 и R2 представляет собой атом фтора, и
- n=1 или 2.
Настоящее изобретение также относится к применению этих фторированных производных в качестве промежуточных соединений синтеза, полезных для получения фторированных димерных алкалоидов Vinca, в частности, в качестве участников реакции в реакции сочетания с виндолином или с производным виндолина. В частности, винфлунин должен быть получен путем сочетания виндолина и 20,20-20,20-дифторкатарантина, приводящего в результате к 20',20'-дифтор-3',4'-ангидровинбластину, который, в свою очередь, следует подвергать реакции сужения кольца с последующей реакцией восстановления внутрикольцевой двойной связи в положении С3'-С4'.
Введение атомов фтора в катарантин 2 следует рассматривать посредством окисления боковой цепи катарантина и фторирования.
Получение фторированных производных катарантина по изобретению включает, таким образом, стадию окисления боковой цепи катарантина, которую осуществляют в условиях, приводящих к окисленному производному катарантина, соответствующему общей формуле II:
в которой:
- n=1 или 2,
- Х обозначает группу С=O или C=S,
- Y обозначает группу CO2R, SO2R или COR, где R обозначает арильную группу, либо нормальную или разветвленную алкильную группу C1-C4, и
- Z обозначает группу СН-ОН или С=O.
Таким образом, настоящее изобретение относится также к окисленным производным катарантина, соответствующим общей формуле II:
в которой:
- n=1 или 2,
- Х обозначает группу С=O или C=S,
- Y обозначает группу CO2R, SO2R или COR, где R обозначает арильную группу, либо нормальную или разветвленную алкильную группу C1-C4, и
- Z обозначает группу СН-ОН или С=O.
Предпочтительным окисленным производным катарантина в соответствии с формулой II является производное, где:
- n=2,
- Х обозначает группу С=O,
- Y обозначает группу CO2R, где R обозначает нормальную или разветвленную алкильную группу C1-C4, и
- Z обозначает группу СН-ОН или С=O.
Настоящее изобретение также относится к применению этих окисленных производных в качестве промежуточных соединений синтеза, полезных для получения фторированных димерных алкалоидов Vinca, в частности винфлунина. Данное получение включает фторирование окисленного производного катарантина с последующим удалением защиты двух атомов азота, приводящим в результате к фторированному производному катарантина по изобретению. Это получение дополнительно включает реакцию сочетания между указанным фторированным производным и виндолином или производным виндолина. В частности, винфлунин получают в результате сочетания виндолина и 20,20-дифторкатарантина, полученного путем фторирования и удаления защиты двух атомов азота окисленного производного катарантина, как определено выше, для которого n=2, Х=С=O, Y=CO2R, где R является таким, как определено выше, Z=С=O, что приводит в результате к 20',20'-дифтор-3',4'-ангидровинбластину, который, в свою очередь, следует подвергать реакции сужения кольца с последующей реакцией восстановления внутрикольцевой двойной связи в положении С3'-С4'.
Термин "арил" относится здесь к циклической ароматической группе из 5-7 атомов углерода, возможно содержащей гетероатом, в частности атом кислорода или азота, как, например, фенильная или пиридинильная группа.
Таким образом, в качестве примера, 20,20-дифторкатарантин можно синтезировать, как описано ниже.
Активация боковой цепи может быть достигнута путем изомеризации внутрикольцевой двойной связи во внутрикольцевом положении перед последующим введением функциональной группы. Реакцию изомеризации соединения 2 в соединение 10 проводят при парциальном давлении водорода в присутствии палладия на углероде. Затем индольное кольцо защищают в форме метилкарбамата 11, а третичный атом азота в форме амида 12.
Схема 5
Затем двойную связь соединения 12 дигидроксилируют OsO4 и полученный в результате диол 13 дважды активируют в форме циклического сульфата 14. Аллиловый спирт 15 получают под действием тетрабутиламмония фторида с последующей обработкой серной кислотой. Затем функциональную группу спирта окисляют MnO2 и полученный в результате енон 16 дифторируют под действием DeoxofluorTM (бис(2-метоксиэтил)аминосульфида трифторида). Защитную группу индола (карбамат) удаляют под действием карбоната калия в метаноле. Амидную группу 17, наконец, восстанавливают с получением в результате 20,20-дифторкатарантина 6. Последний можно, таким же путем, как катарантин природного происхождения, подвергать сочетанию с виндолином с получением фторированного аналога 3',4'-ангидровинбластина (7), который после сужения кольца образует в результате фторированный аналог винорельбина (8). Наконец, селективное восстановление двойной связи северного фрагмента приводит в результате к образованию винфлунина 1.
В соответствии с одним из вариантов синтеза аллиловый спирт 15 может быть также получен путем первоначальной защиты индольного кольца катарантина 2 метилкарбаматом (соединение 26) и третичного азота в форме амида 27. Последний затем можно окислять непосредственно до аллилового спирта 15 SeO2 (схема 6).
Промежуточные соединения синтеза до 20,20-дифторкатарантина 6 можно использовать путем функциональных перегруппировок, которые приводят в результате не к 20,20-дифторкатарантину, а к его структурным аналогам. Эти аналоги можно, таким же путем, что и катарантин природного происхождения, подвергать сочетанию с виндолином с получением в результате соответствующих фторированных димерных алкалоидов.
Соответственно, начиная с промежуточного соединения 13, в результате окисления функциональной группы вторичного спирта получают кетон 18. В результате фторирования кетоспирта 18 DAST (диэтиламиносульфида трифторидом) образуется дифторспирт 19. Последний можно, после обычных стадий удаления защиты (→20), подвергать сочетанию с виндолином с образованием дифторированного аналога 21 винбластина, который, подобно этому алкалоиду, обладает существенными противораковыми свойствами (схема 7).
Кроме того, введение единственного атома фтора в каркас катарантина возможно от промежуточного соединения 15 (схема 8). Когда последнее обрабатывают DAST, образуется монофторированный продукт боковой цепи (22). Как уже упомянуто выше, этот продукт приводит в результате к монофтор-аналогам 3',4'-ангидро-20'-фторвинбластину 24 и 20'-фторвинорельбину 25, которые могут привести к монофторированному аналогу винфлунина в результате дополнительной стадии восстановления двойной связи.
Наконец, изокатарантин 10 можно также использовать в качестве промежуточного соединения синтеза при получении фторированных димерных алкалоидов Vinca, в частности винфлунина. Данное получение включает реакцию сочетания между указанным изокатарантином и виндолином или производным виндолина.
Таким образом, винфлунин 1 может быть получен путем сочетания виндолина 3 и изокатарантина, приводящего в результате к 4',20'-ангидровинбластину 28. Затем данное промежуточное соединение можно подвергать дифторированию, используя условия, описанные для фторирования 3',4'-ангидровинбластина 4 (J.-C.Jacquesy et al., Journal of Fluorine Chemistry, 2002, 114, 139). Полученный продукт, (4'R)-4'-дезокси-20',20'-дифторвинбластин 30, идентичен продукту, образованному путем фторирования 3',4'-ангидровинбластина 4. Преобразование 30 в винфлунин 1 путем сужения кольца описано в литературе (J.-C.Jacquesy et al., Journal of Fluorine Chemistry, 2002, 114, 139) (Схема 9).
Альтернативно винфлунин 1 может быть также получен путем сужения кольца 4',20'-ангидровинбластина 28, приводящего в результате к соединению 29, с последующим гем-дифторированием в соответствии с такими же способами, как описано выше.
Таким образом, оказывается, что в настоящем изобретении предложена альтернативная стратегия классическому синтезу винфлунина, дающая возможность использовать более эффективный и, следовательно, более экономичный способ. Кроме того, использование фторированных промежуточных соединений катарантина согласно изобретению, например: 20-фторкатарантина 23 и 20,20-дифтор-3-гидро-4-гидроксикатарантина 20, в реакциях сочетания с виндолином 3 позволяет получить новые димерные алкалоиды, обладающие потенциальными противораковыми активностями. Другие конкретные структурные аналоги винорельбина и винфлунина также легко доступны посредством данного способа.
Все способы получения и схемы реакций, описанные здесь выше, детализованы в случае получения фторированных производных катарантина, соответствующих общей формуле (I), в которой n=2. Все соответствующие производные, соответствующие общей формуле (I), в которой n=1, могут быть легко получены способом сужения кольца северного участка димеров, имеющего происхождение от катарантина, с помощью методик, известных специалистам в данной области техники, и, в частности, тех, которые описаны в Andriamialisoa, R.Z.; Langlois, N.; Langlois Y.; Potier P. Tetrahedron, 1980, 36, 3053-3060.
Далее настоящее изобретение описано более подробно с помощью примеров получения, упомянутых здесь ниже путем иллюстрации основных стадий, приводящих в результате к фторированным производным катарантина и, в частности, к 20,20-дифторкатарантину.
Изокатарантин (10)
К суспензии палладия (10% мас./мас.) на углероде (5,7 г, 5,4 ммоль, 0,2 экв.), предварительно активированной водородом в МеОН (150 мл), добавляют (+)-катарантин 2 (9,0 г, 26,8 ммоль, 1 экв.) в растворе в МеОН (100 мл). Реакционную смесь помещают при пониженном давлении в атмосферу водорода (0,3 Бар), затем выделяют и оставляют при пониженном давлении при перемешивании при температуре окружающей среды. За реакцией следят с помощью 1H ЯМР до тех пор, пока исходный продукт не исчезнет (около 2 ч). Затем реакционную смесь фильтруют на целлите 545, затем перекристаллизуют в МеОН с получением соединения 10 (6,5 г, 19,3 ммоль, 72%) в форме полупрозрачных кристаллов.
Химическая формула: C21H24N2O2 М=336 г.моль-1
Rf=0.35 (Гексан/AcOEt 3/7)
F=78°C-81°C
1H ЯМР (CDCl3): 8.08 (sl, 1H, NH); 7.53 (d, J=7.3 Гц, 1H, H-11); 7.26 (d, J=7.3 Гц, 1H, H-14); 7.22-7.10 (m, 2H, H-12 и Н-13); 5.48-5.32 (m, 1H, Н-20); 4.05 (s, 1H, Н-5); 3.73 (s, 3Н, СО2СН3); 3.62-3.46 (m, 1H, H-7); 3.44-3.24 (m, 2H, Н-7 и Н-8); 3.18-3.10 (m, 1H, Н-19); 3.08-2.92 (m, 2H, Н-19 и Н-8); 2.88-2.74 (m, 1H, Н-1); 2.44-2.26 (m, 2H, Н-3); 2.20-2.08 (m, 1H, Н-2); 1.90-1.78 (m, 1H, Н-1); 1.62 (d, J=6.7 Гц, 3Н, Н-21).
13С ЯМР (CDCl3): 175.2; 137.7; 135.9; 129.5; 122.6; 120.1; 119.4; 119.0; 111.2; 111.1; 64.2; 56.1; 53.8; 53.3; 51.1; 38.0; 30.3; 27.9; 22.0; 13.4.
ИК (пленка): 3368, 2916, 2855, 1714, 1461, 1264, 740 см-1.
MS (ESI TOF): 337 [M+H+] (100).
[α]D 20=+35 (с=2,3; CHCl3)
Na-карбометоксиизокатарантин (11)
К суспензии гидрида калия (0,72 г, 6,3 ммоль, 1,5 экв.) в ТГФ (10 мл) при 0°С добавляют по каплям раствор 10 (1,35 г, 4 ммоль, 1 экв.) в ТГФ (20 мл). После 30 минут при перемешивании при 0°С добавляют по каплям метилхлорформиат (0,5 мл, 6,3 ммоль, 1,5 экв.). После 1 ч при перемешивании при 0°С реакционную смесь доводят до температуры окружающей среды и перемешивание поддерживают в течение 18 ч. Добавляют водный раствор насыщенного К2СО3 (10 мл). Водную фазу экстрагируют CH2Cl2 (3×20 мл), органические фазы собирают, высушивают на Na2SO4 и концентрируют в вакууме. Затем сырой продукт очищают хроматографией на силикагеле (элюент: CH2Cl2/MeOH 97/3) с получением 11 (1,3 г, 3,3 ммоль, 82%) в форме белого твердого вещества.
Химическая формула: C23H26N2O4 М=394 г.моль-1
Rf=0,4 (CH2Cl2/MeOH 94/6)
F=62°C-64°C
1H ЯМР (CDCl3): 8.08 (d, J=7.9 Гц, 1Н, Н-11); 7.48 (d, J=7.3 Гц, 1Н, Н-14); 7.38-7.16 (m, 2Н, Н-12 и Н-13); 5.32-5.18 (m, 1Н, Н-20); 4.06 (s, 1Н, Н-5); 3.86 (s, 3Н, CO2CH3); 3.68 (m, 1Н, H-7); 3.54 (s, 3H, СО2СН3); 3.40-3.12 (m, 2Н, Н-7 и Н-8); 2.99 (m, 1Н, Н-19); 2.86 (m, 1Н, Н-19); 2.80-2.65 (m, 2Н, Н-8 и Н-1); 2.44 (d, J=16 Гц, 1Н, Н-3); 2.30 (d, J=16 Гц, 1Н, Н-3); 2.06 (m, 1Н, Н-2); 1.76 (d, J=14 Гц, 1Н, H-1); 1.56 (d, J=6.7 Гц, 3H, H-21).
13С ЯМР (CDCl3): 173.4; 151.8; 138.1; 135.8; 129.5; 124.6; 122.7; 119.7; 118.2; 115.5; 60.6; 57.9; 54.1; 53.0; 52.0; 37.5; 29.7; 27.9; 21.8; 12.6.
MS (ESI TOF): 395 [М+Н+](100).
HRMS (TOF MS ES+):
Значение, вычисленное для C23H27N2O4 395,1971
Обнаруженное значение 395,1956
[α]D 20=+48 (c=1,0; CHCl3)
Na-карбометокси-19-оксоизокатарантин (12)
К 5 мл водного раствора Na2CO3 (675 мг, 6,4 ммоль, 9,3 экв.) добавляют раствор 11 (270 мг, 0,69 ммоль, 1 экв.) в ТГФ (10 мл). Добавляют по каплям раствор йода (800 мг, 3,2 ммоль, 4,6 экв.) в ТГФ (12 мл) при 0°С. Затем реакционную смесь доводят до температуры окружающей среды и перемешивают в течение 18 часов. Затем добавляют насыщенный водный раствор Na2S2O3 (15 мл) и реакционную смесь оставляют при перемешивании на 30 минут. Затем водную фазу экстрагируют CH2Cl2 (3×20 мл). Органические фазы объединяют, высушивают на Na2SO4 и концентрируют в вакууме. Затем сырой продукт очищают хроматографией на силикагеле (Элюент: CH2Cl2/МеОН 98/2) с получением 12 (230 мг, 0,56 ммоль, 82%) в форме белого твердого вещества.
Химическая формула: C23H24N2O5 М=408 г.моль-1
Rf=0,4 (CH2Cl2/MeOH 94/6)
F=94°С-96°С
1H ЯМР (CDCl3): 8.04-7.97 (m, 1Н, Н-11); 7.52-7.43 (m, 1Н, Н-14); 7.36-7.21 (m, 2Н, Н-12 и Н-13); 5.53-5.41 (m, 1Н, Н-20); 4.66 (s, 1Н, Н-5); 4.32-4.17 (m, 1Н, H-7); 3.93 (s, 3Н, CO2CH3); 3.60 (s, 3Н, CO2CH3); 3.28-3.15 (m, 3H, H-7 и Н-8); 2.97 (dd, J=14 Гц и J=1.8 Гц, 1Н, Н-1); 2.84-2.76 (m, 1Н, Н-2); 2.56-2.48 (m, 2Н, Н-3); 2.00-1.89 (m, 1Н, Н-1); 1.59 (d, J=6.7 Гц, 3Н, Н-21).
13С ЯМР (CDCl3): 174.6; 172.0; 151.6; 136.4; 135.1; 132.5; 129.2; 124.9; 122.8; 120.9; 118.1; 117.0; 115.6; 61.5; 60.1; 58.7; 53.2; 52.1; 40.3; 38.9; 37.2; 28.5; 21.2; 20.8; 13.9; 13.1.
MS (ESI TOF): 409 [M+H+] (100); 817 [2M+H+] (34).
[α]D 20=+255 (с=0,4; CHCl3)
(4R,20R)-Na-карбометокси-3-гидро-4,20-дигидрокси-19-оксокатарантин (13)
К раствору 12 (1,26 г, 3,08 ммоль, 1 экв.) в смеси ацетон/вода (8/1) (27 мл) при 0°С добавляют OsO4 в растворе в t-BuOH (2,5%, 1,9 мл, 0,154 ммоль, 0,05 экв.), затем порциями через 15 минут NMO (0,72 г, 6,2 ммоль, 2 экв.). После 15 минут при 0°С реакционную смесь оставляют при перемешивании при температуре окружающей среды в течение 18 ч. Реакцию останавливают добавлением насыщенного водного раствора Na2S2O3 (15 мл) и воды (15 мл) и оставляют при перемешивании на 20 минут. Реакционную смесь экстрагируют CH2Cl2 (4×30 мл). Органические фазы объединяют, высушивают на Na2SO4 и концентрируют в вакууме. Затем сырой продукт очищают хроматографией на силикагеле (Элюент: CH2Cl2/МеОН 97/3) с получением 13 (1,16 г, 2,61 ммоль, 85%) в форме белого твердого вещества.
Химическая формула: C23H26N2O7 М=442 г.моль-1
Rf=0,5 (CH2Cl2/MeOH 9/1)
F=102°C-104°C
1Н ЯМР (CDCl3): 7.98 (d, J=7.9 Гц, 1Н, H-11); 7.44 (d, J=7.9 Гц, 1Н, Н-14); 7.35-7.20 (m, 2Н, Н-12 и Н-13); 4.77 (s, 1Н, H-5); 4.30-4.18 (m, 1Н, H-7); 4.05-3.93 (m, 1Н, H-20); 3.92 (s, 3Н, CO2CH3); 3.63 (s, 3Н, CO2CH3); 3.34-3.08 (m, 3Н, H-7 и Н-8); 2.88 (dd, J=14.0 Гц J=1.8 Гц, 1Н, Н-1); 2.65-2.60 (m, 1Н, Н-2); 2.02-1.74 (m, 3Н, Н-1 и Н-3); 1.16 (d, J=6.1 Гц, 3Н, Н-21).
13С ЯМР (CDCl3): 174.1; 172.5; 151.7; 135.3; 129.0; 125.1; 123.0; 118.2; 117.2; 115.6; 69.8; 59.2; 55.9; 53.4; 53.3; 52.9; 42.1; 38.5; 37.5; 36.7; 21.1; 17.8.
ИК (таблетка KBr): 3402, 2954, 1741, 1657, 1458, 760 см-1
MS (ESI TOF): 443 [M+H+] (11); 465 [M+Na+] (100); 907 [2M+Na+] (36).
HRMS (TOF MS ES+):
Значение, вычисленное для C23H26N2O7Na 465,1638
Обнаруженное значение 465,1631
[α]D 20=+97 (с=0,5; CHCl3)
(4R,20R)-Na-карбометокси-3-гидро-4,20-дигидроксисульфат-19-оксокатарантин (14)
К раствору диола 13 (200 мг, 0,45 ммоль, 1 экв.) в CH2Cl2 (5 мл) при 0°С добавляют триэтиламин (0,15 мл, 1,04 ммоль, 2,3 экв.), затем по каплям тионилхлорид (43 мкл, 0,59 ммоль, 1,3 экв.). После 30 мин при 0°С реакцию останавливают добавлением насыщенного раствора NaCl (5 мл) и воды (5 мл). Водную фазу экстрагируют CH2Cl2 (3×10 мл). Органические фазы объединяют, высушивают на Na2SO4 и концентрируют в вакууме.
Затем сырой продукт помещают непосредственно в смесь 7,5 мл CH3CN и 6,5 мл H2O и энергично перемешивают. Затем последовательно добавляют RuCl3 (5 мг, 0,023 ммоль, 0,05 экв.) и NaIO4 (242 мг, 1,13 ммоль, 2,5 экв.) и через 1 ч 30 мин добавляют Et2O (12 мл). Перемешивание продолжают в течение 10 мин. Водную фазу экстрагируют 3×10 мл Et2O, затем объединенные органические фазы промывают водой (30 мл), насыщенным раствором NaHCO3 (30 мл) и насыщенным раствором NaCl (30 мл). Затем органическую фазу высушивают на Na2SO4 и концентрируют в вакууме. В результате очистки хроматографией на силикагеле (элюент CH2Cl2/MeOH 98/2) получают 14 (137 мг, 0,27 ммоль, 60%) в форме белого твердого вещества.
Химическая формула: C23H24N2O9S М=504 г.моль-1
Rf=0,5 (CH2Cl2/MeOH 95/5)
F=140°C-142°C
1H ЯМР (CDCl3): 7.98 (d, J=7.3 Гц, 1H, Н-11); 7.44 (d, J=7.3 Гц, 1Н, Н-14); 7.37-7.30 (m, 2Н, Н-12 и Н-13); 5.12 (s, 1H, Н-5); 4.75 (q, J=6.7 Гц, 1H, Н-20); 4.24-4.13 (m, 1H, Н-5); 3.99 (s, 3Н, CO2CH3); 3.68 (s, 3Н, CO2CH3); 3.53-3.47 (m, 1H, Н-7); 3.35-2.95 (m, 2Н, H-8); 2.97 (dd, J=14.0 Гц и J=1.6 Гц, 1H, Н-1); 2.90-2.85 (m, 1H, Н-2); 2.45-2.38 (m, 2Н, Н-3); 2.02-1.96 (m, 1Н, Н-1); 1.64 (d, J=6.7 Гц, 3Н, Н-21).
13С ЯМР (CDCl3): 173.2; 171.5; 152.4; 136.1; 134.8; 129.3; 125.6; 123.5; 118.8; 117.5; 116.0; 94.8; 84.9; 56.9; 55.1; 54.0; 53.4; 40.9; 38.4; 37.7; 32.3; 21.2; 15.8.
ИК (таблетка KBr): 1735, 1687, 1459, 1382, 1215, 904 см-1.
MS (ESI TOF): 505 [М+H]+ (100); 1009 [M+Na+] (13).
[α]D 20=+165 (c=0,3; CHCl3)
(20R)-Na-карбометокси-20-гидрокси-19-оксокатарантин (15)
К раствору сульфата 14 (1,59 г, 3,16 ммоль, 1 экв.) в ТГФ (25 мл) добавляют по каплям раствор NBu4F (1M в ТГФ, 6,3 мл, 6,3 ммоль, 2 экв.). После 18 ч перемешивания при температуре окружающей среды добавляют раствор H2SO4 2M в ТГФ (37 мл) и 3,7 мл воды. После 48 ч перемешивания при температуре окружающей среды добавляют насыщенный раствор NaHCO3 (200 мл). Водную фазу экстрагируют AcOEt (4×50 мл), органические фазы объединяют, высушивают на Na2SO4, фильтруют, затем концентрируют в вакууме. Затем сырой продукт очищают хроматографией на силикагеле и 15 (828 мг, 1,95 ммоль, 62%) выделяют в форме белого твердого вещества.
Химическая формула: C23H24N2O6 М=424 г.моль-1
Rf=0,3 (CH2Cl2/MeOH 95/5)
F=188°C-190°C
1Н ЯМР (CDCl3): 7.98 (d, J=7.9 Гц, 1H, H-11); 7.44 (d, J=7.9 Гц, 1H, H-14); 7.35-7.20 (m, 2Н, Н-12 и Н-13); 6.43 (d, J=6.3 Гц, 1H, Н-3); 5.24 (d, J=1.7 Гц, 1H, H-5); 4.41-4.33 (m, 1H, H-20); 4.17-4.03 (m, 1H, H-7); 3.94 (s, 3Н, СО2СН3); 3.57 (s, 3Н, CO2CH3); 3.47-3.17 (m, 4H, H-8, Н-2 и H-7); 2.88 (dd, J=14.0 Гц и J=1.8 Гц, 1H, H-1); 2.02 (dd, J=14.0 Гц и J=1.8 Гц, 1H, Н-1); 1.33 (d, J=6.1 Гц, 3Н, Н-21).
13С ЯМР (CDCl3): 174.1; 173.8; 152.0; 145.3; 136.6; 135.3; 129.3; 128.5; 125.1; 123.1; 118.4; 116.7; 115.8; 67.1; 58.0; 54.3; 53.6; 52.8; 44.0; 40.7; 38.4; 21.3; 21.1.
ИК (таблетка KBr): 3414, 2944, 1743, 1653, 1458, 1437, 1327, 1242, 754 см-1.
MS (ESI TOF): 447 [M+Na+] (100); 871 [2M+Na+] (64).
[α]D 20=+181 (с=0,7; CHCl3)
Na-карбометокси-19,20-диоксокатарантин (16)
Раствор аллилового спирта 15 (100 мг, 0,236 ммоль, 1 экв.) в 8 мл дихлорметана охлаждают до 0°С. К этому раствору в один прием добавляют 140 мг активированного диоксида марганца (16 ммоль, 70 экв.). Полученную черную суспензию перемешивают при 0°С в течение 1 ч 30 мин в атмосфере азота, затем доводят до температуры окружающей среды.
Реакционную смесь фильтруют на целлите 545, затем тщательно промывают, используя дихлорметан. Фильтрат концентрируют при пониженном давлении с получением енона 16 (85 мг, 0,201 ммоль, 85%) в форме белого твердого вещества.
Химическая формула: C23H22N2O6 М=422 г.моль-1
Rf=0,4 (EtOAc)
F=108°C-110°C
1H ЯМР (CDCl3): 8.01 (d, J=8.5 Гц, 1H, H-11); 7.49 (d, J=7.3 Гц, 1H, Н-14); 7.45 (d, J=6.7 Гц, 1H, H-3); 7.37-7.23 (m, 2H, H-12 и Н-13); 5.80 (d, J=1.8 Гц, 1H, Н-5); 4.18-4.02 (m, 1H, Н-7); 3.91 (s, 3Н, CO2CH3); 3.65 (m, 1H, H-2); 3.49 (s, 3H, CO2CH3); 3.48-3.34 (m, 1H, Н-8); 3.32-3.16 (m, 2H, Н-7 и Н-8); 2.82 (dd, J=12.8 Гц и J=2.4 Гц, 1H, Н-1); 2.35 (s, 3H, H-21); 2.07 (dd, J=13.4 Гц и J=3.0 Гц, 1H, Н-1).
13С ЯМР (CDCl3): 193.3; 172.2; 171.6; 151.9; 143.6; 142.3; 135.8; 135.3; 129.2; 125.2; 123.1; 118.4; 117.0; 115.8; 57.3; 53.5; 52.6; 52.5; 45.5; 41.3; 37.4; 24.6; 20.9.
ИК (таблетка KBr): 1740, 1668, 1252, 751 см-1.
MS (ESI TOF): 423 [M+H+] (10); 445 [M+Na+] (100); 867 [2М+Na+] (32).
HRMS (TOF MS ES+):
Значение, вычисленное для C23H22N2O6Na 445,1376
Обнаруженное значение 445,1357
[α]D 20=+183 (c=1,8; CHCl3)
20,20-дифтор-19-оксокатарантин (17)
Фторирование: Na-карбометокси-20,20-дифтор-19-оксокатарантин
Енон 16 (300 мг, 0,71 ммоль, 1 экв.) помещают в раствор в DeoxofluorTM (3 мл, 16,4 ммоль, 23 экв.). Затем добавляют три капли этанола и реакционную смесь оставляют при перемешивании при 80°С на 24 ч. Затем добавляют 0,6 мл DeoxofluorTM (3,3 ммоль, 5 экв.) и две капли этанола и перемешивание продолжают при этой температуре еще в течение 48 ч (за реакцией следят по 1H ЯМР до исчезновения исходного продукта). Реакционную смесь разводят в 200 мл дихлорметана, а затем добавляют 100 мл водного насыщенного раствора К2СО3. Смесь оставляют на 15 мин при перемешивании при температуре окружающей среды, затем водную фазу экстрагируют 3×50 мл дихлорметана. Органические фазы объединяют, высушивают на Na2SO4 и концентрируют в вакууме. Затем сырой продукт очищают двумя фильтрациями на силикагеле (CH2Cl2/МеОН 98/2 и C6H12/AcOEt 6/4), и остаток вступает в следующую стадию.
Химическая формула: C23H22N2O5F2 M=444 г.моль-1
Rf=0,3 (Гексан/AcOEt 40/60)
1H ЯМР (CDCl3): 8.01-7.99 (m, 1H, H-11); 7.53-7.47 (m, 1H, H-14); 7.38-7.28 (m, 2H, H-12 и Н-13); 6.87-6.77 (m, 1H, Н-3); 5.36 (d, J=1.8 Гц, 1H, Н-5); 4.20-4.03 (m, 1H, H-7); 3.93 (s, 3H, CO2CH3); 3.61-3.54 (m, 1H, Н-2); 3.57 (s, 3H, CO2CH3); 3.45-3.20 (m, 3H, H-8 и H-7); 2.93-2.83 (m, 1H, H-1); 2.09-1.98 (m, 1H, H-1); 1.81 (dd, J=18 Гц, J=18 Гц, 3H, H-21).
Удаление защиты индола: 20,20-дифтор-19-оксокатарантин (17)
К раствору вышеописанного защищенного 20,20-дифторкатарантина в 100 мл метанола добавляют в один прием 2 г карбоната калия (14,5 ммоль) и суспензию перемешивают при температуре окружающей среды в течение 18 ч. Затем к реакционной смеси, которая теперь стала прозрачной, добавляют 50 мл воды, и смесь экстрагируют 3×50 мл дихлорметана. Объединенные органические фазы высушивают на Na2SO4 и концентрируют при пониженном давлении. Полученный остаток осаждают в смеси циклогексан/этилацетат 7/3 с получением 17 (118 мг, 0,307 ммоль, 43% в две стадии) в форме белого твердого вещества.
Химическая формула: C21H20F2N2O3 М=386 г.моль-1
Rf=0,3 (CH2Cl2/MeOH 95/5)
1H ЯМР (CDCl3): 7.95 (s, 1H, NH); 7.52 (d, J=Гц, 1Н, Н-11); 7.26 (d, J=Гц, 1H, Н-14); 7.16-7.11 (m, 2Н, Н-12 и Н-13); 6.83 (m, 1H, Н-3); 5.55 (d, J=1 Гц, 1H, Н-5); 4.24 (m, 1H, Н-7); 3.67 (s, 3Н, CO2CH3); 3.58 (m, 1H, H-2); 3.36-3.24 (m, 3H, Н-8 и Н-7); 2.82 (dd, J=13 Гц, J=2 Гц, 1Н, Н-1); 2.27 (dd, J=13 Гц, J=2 Гц, 1Н, Н-1); 1.82 (dd, J=18 Гц, J=18 Гц, 3Н, Н-21).
13С ЯМР (CDCl3): 172.8; 171.6; 139.5 (t, J=30 Гц); 135.8; 135.2 (t, J=9 Гц); 133.8; 127.7; 122.4; 119.7; 119.1 (t, J=233 Гц); 118.4; 110.6; 108.8; 56.3; 53.6; 53.0; 44.0; 42.8; 35.6; 22.4 (t, J=28 Гц); 20.7.
[α]D 20=+155 (с=0,4; CHCl3).
20,20-дифторкатарантин (6)
К раствору 17 (140 мг, 0,36 ммоль, 1 экв.) в 50 мл тетрагидрофурана добавляют в один прием 360 мг боргидрида натрия (9,5 ммоль, 26,5 экв.). Полученную в результате суспензию охлаждают до 0°С и помещают при перемешивании в атмосферу азота. Добавляют по каплям 1,9 мл (14,6 ммоль, 40,5 экв.) трифторборана диэтилэфирата, затем реакционную смесь доводят до температуры окружающей среды и перемешивают в течение 3 ч. Растворитель выпаривают в вакууме и заменяют 30 мл метанола, к которому добавляют 6 мл воды и 4,5 мл 10% раствора соляной кислоты. Все вместе перемешивают при температуре окружающей среды в течение 15 ч. Метанол выпаривают и заменяют 20 мл дихлорметана. Смесь нейтрализуют добавлением 40 мл насыщенного водного раствора гидрокарбоната натрия, затем экстрагируют 3×20 мл дихлорметана. Объединенные органические фазы высушивают на Na2SO4, концентрируют при пониженном давлении. В результате очистки остатка хроматографией на силикагеле (элюент: CH2Cl2/MeOH 98/2) получают 74 мг (0,2 ммоль, 55%) 6 в форме белого твердого вещества.
Химическая формула: C21H22F2N2O2 М=372 г.моль-1
Rf=0,5 (CH2Cl2/MeOH 95/5)
1H ЯМР (CDCl3): 7.68 (s, 1H, NH); 7.53 (d, J=7.5 Гц, 1Н, H-11); 7.27 (d, J=7.5 Гц, 1Н, Н-14); 7.20 (td, J=7.5 Гц, J=1.5 Гц, 1Н, Н-13); 7.14 (td, J=7.5 Гц, J=1.5 Гц, 1Н, Н-12); 6.61 (m, 1Н, H-3); 4.64 (d, J=2 Гц, 1Н, Н-5); 3.72 (s, 3Н, СО2СН3); 3.63 (ddd, J=14 Гц, J=10 Гц, J=5 Гц, 1H, H-7); 3.43 (ddd, J=14 Гц, J=5 Гц, J=5 Гц, 1Н, H-7); 3.32 (ddd, J=17 Гц, J=10 Гц, J=5 Гц, 1Н, Н-8); 3.01 (ddd, J=17 Гц, J=5 Гц, J=5 Гц, 1Н, Н-8); 2.88 (m, 3Н, Н-2 и Н-19); 2.81 (dd, J=13 Гц, J=2 Гц, 1Н, Н-1); 1.84 (dd, J=18 Гц, J=18 Гц, 3H, Н-21); 1.81 (d, J=13 Гц, 1Н, Н-1).
13С ЯМР (CDCl3): 173.4; 143.3 (t, J=28 Гц); 136.1; 135.3; 132.1 (t, J=9 Гц); 128.8; 122.1; 119.7 (t, J=232 Гц); 119.4; 118.3; 110.6; 110.4; 57.0; 55.3; 52.7; 52.3; 47.0; 37.0; 30.8; 22.6 (t, J=28 Гц); 21.6.
SM (ESI TOF): 353 [M-HF+H+] (6); 373 [М+Н+] (100).
[α]D 20=+43 (с=0,4; CHCl3).
(4R)-Na-карбометокси-3-гидро-4-гидрокси-19,20-диоксокатарантин (18)
К раствору оксалилхлорида (0,56 мл, 6,47 ммоль, 2,2 экв.) в CH2Cl2 (25 мл), поддерживаемому при -65°С (внутренняя температура), добавляют по каплям ДМСО (1,15 мл, 16,2 ммоль, 5,5 экв.) в растворе в CH2Cl2 (0,850 мл). Смесь перемешивают в течение 20 мин, затем добавляют раствор диола 13 (1,3 г, 2,94 ммоль, 1 экв.) в CH2Cl2 (25 мл) по каплям, в то время как температуру регулируют между -60°С и -65°С. После 45 мин перемешивания добавляют триэтиламин (3,7 мл, 26,5 ммоль, 9,0 экв.), затем температуру смеси доводят до температуры окружающей среды за период 45 мин. Добавляют воду (20 мл) и рассол (10 мл), затем реакционную смесь экстрагируют CH2Cl2 (3×50 мл). Органические фазы объединяют, высушивают на Na2SO4 и концентрируют в вакууме. Затем сырой продукт очищают флэш-хроматографией на силикагеле (Элюент: CH2Cl2/MeOH 97/3) с получением кетоспирта 18 (647 мг, 1,47 ммоль, 50%) в форме белого твердого вещества и 13 (520 мг, 1,17 ммоль, 40%).
Химическая формула: C23H24N2O7 M=440 г.моль-1
F=123°C-125°C
Rf=0,2 (AcOEt)
1H ЯМР (CDCl3): 7.97 (d, J=8.5 Гц, 1Н, Н-11); 7.44 (d, J=7.3 Гц, 1Н, Н-14); 7.35-7.20 (m, 2H, Н-12 и Н-13); 5.16 (sl, 1Н, ОН); 5.04 (s, 1Н, Н-5); 4.23-4.04 (m, 1Н, H-7); 3.91 (s, 3Н, СО2СН3); 3.48 (s, 3Н, CO2CH3); 3.41-3.35 (m, 2H, Н-7 и Н-8); 3.35-3.11 (m, 1Н, Н-8); 2.85 (dd, J=14.0 Гц и J=1.8 Гц, 1Н, Н-1); 2.79-2.71 (m, 1Н, Н-2); 2.59 (d, J=14.0 Гц, 1Н, Н-3); 2.25 (s, 3Н, Н-21); 2.26-2.15 (m, 1Н, Н-3); 1.91-1.79 (m, 1Н, Н-1).
13С ЯМР (CDCl3): 204.5; 174.3; 173.0; 151.9; 137.1; 135.0; 129.3; 125.1; 123.1; 118.4; 116.6; 115.8; 57.6; 54.9; 53.5; 52.7; 42.1; 38.9; 38.6; 34.9; 24.7; 21.2.
ИК (таблетка KBr): 3270, 2953, 1732, 1652, 1461, 759,747 см-1.
MS (ESI TOF): 441 [M+H+] (100).
HRMS (TOF MS ES+):
Значение, вычисленное для C23H24N2O7Na 463,1481
Обнаруженное значение 463,1472
[α]D 20=+121 (с=0,4; CHCl3)
(4R)-Na-карбометокси-20,20-дифтор-3-гидро-4-гидрокси-19-оксокатарантин (19)
К раствору кетоспирта 18 (44 мг, 0,1 ммоль, 1 экв.) в CH2Cl2 (1 мл) при -78°С добавляют DAST (67 мкл, 0,5 ммоль, 5 экв.). Затем реакционную смесь оставляют при перемешивании при температуре окружающей среды на 18 ч. Затем добавляют по каплям 10% водный раствор NaHCO3 (5 мл) при 0°С, смесь оставляют на 15 мин при перемешивании при температуре окружающей среды, затем водную фазу экстрагируют CH2Cl2 (3×10 мл). Органические фазы объединяют, высушивают на Na2SO4 и концентрируют в вакууме. Затем сырой продукт очищают хроматографией на силикагеле (Элюент: Гексан/AcOEt 6/4) с получением 19 (26 мг, 0,056 ммоль, 56%).
Химическая формула: C22H24F2N2O6 М=462 г.моль-1
Rf=0,3 (EtOAc)
1Н ЯМР (CDCl3): 7.98 (d, J=8.5 Гц, 1Н, Н-11); 7.49 (d, J=7.3 Гц, 1Н, Н-14); 7.36-7.26 (m, 2H, Н-12 и Н-13); 5.74 (s, 1Н, Н-5); 4.21-4.05 (m, 1Н, H-7); 3.97 (s, 3Н, СО2СН3); 3.66 (s, 3Н, CO2CH3); 3.30-3.15 (m, 4H, Н-8, H-7 и Н-1); 2.73 (m, 1Н, Н-2); 2.62-2.52 (m, 1H, Н-1); 2.15-2.05 (m, 1H, H-3); 1.83 (d, J=14 Гц, 1Н, Н-1); 1.66 (dd, J=19 Гц, J=19 Гц, 3H, H-21).
MS (ESI TOF): 485 [M+Na+] (100).
Na-карбометокси-20-фтор-19-оксокатарантин (22)
К раствору DAST (8 мкл, 0,06 ммоль, 1,2 экв.) в CH2Cl2 (0,1 мл) добавляют аллиловый спирт 15 (20 мг, 0,05 ммоль, 1 экв.) в CH2Cl2 (0,7 мл). Затем реакционную смесь оставляют при перемешивании при температуре окружающей среды на 15 мин. Затем добавляют по каплям насыщенный раствор К2СО3 (2 мл) при 0°С, смесь оставляют на 15 мин при перемешивании при температуре окружающей среды, затем водную фазу экстрагируют CH2Cl2 (3×2 мл). Органические фазы объединяют, высушивают на Na2SO4 и концентрируют в вакууме. Затем сырой продукт очищают на препаративной пластине силикагеля (элюент CH2Cl2/MeOH 98/2) с получением 22 (10 мг, 0,023 ммоль, 49%) в форме двух эпимеров А и В (белое твердое вещество).
Химическая формула: C23H23FN2O5 М=426 г.моль-1
Rf=0,4 (CH2Cl2/MeOH 95/5)
1Н ЯМР (CDCl3): 8.02 (d, J=7.9 Гц, 1H, H-11); 7.49 (d, J=7.3 Гц, 1H, H-14); 7.35-7.20 (m, 2H, Н-12 и Н-13); 6.53-6.48 (m, 1H, H-3); 5.26 (d, J=1.8 Гц, 1H A, H-5); 5.22 (d, J=1.8 Гц, 1H В, Н-5); 4.98 (dq, J=47.6 Гц и J=6.1 Гц, 1H, Н-20); 4.20-4.04 (m, 1H, H-7); 3.93 (s, 3H, CO2CH3); 3.59 (s, 3Н, CO2CH3); 3.53-3.48 (m, 1H, Н-7); 3.43-3.19 (m, 3H, H-8 и Н-2); 2.89-2.77 (m, 1H, Н-1); 1.90 (d, J=13.4 Гц, 1H, Н-1); 1.51 (dd, J=23.8 Гц, J=6.7 Гц, 1H А, Н-21); 1.46 (dd, J=23.8 Гц, J=6.7 Гц, 1H В, Н-21).
13С ЯМР (CDCl3): 173.5; 171.8; 171.6; 151.9; 142.1; 141.9; 136.5; 136.4; 135.3; 130.0; 129.3; 125.1; 123.1; 118.3; 116.8; 115.8; 87.7 (d, J=161 Гц); 87.6 (d, J=161 Гц); 57.9; 57.7; 55.2; 54.7; 53.4; 53.3; 52.6; 44.3; 41.1; 40.9; 40.6; 38.7; 37.4; 29.6; 21.5; 21.1; 19.1 (d, J=23 Гц); 18.4 (d, J=23 Гц).
MS (ESI TOF): 465 [M+K+] (100), 891 [2M+K+] (33).
Na-карбометоксикатарантин (26)
Раствор (+)-катарантина 2 (1,0 г, 3,0 ммоль, 1 экв.) в ТГФ (6 мл) добавляют по каплям к суспензии гидрида калия при 0°С (510 мг, 4,5 ммоль, 1,5 экв.) в ТГФ (5 мл). После 1 ч при перемешивании при 0°С добавляют по каплям метилхлорформиат (0,35 мл, 4,5 ммоль, 1,5 экв.). После 30 минут при перемешивании при 0°С добавляют насыщенный водный раствор К2СО3 (10 мл). Водную фазу экстрагируют CH2Cl2 (3×10 мл), органические фазы собирают, высушивают на Na2SO4, фильтруют и концентрируют в вакууме. Затем сырой продукт очищают хроматографией на силикагеле (Элюент: CH2Cl2/MeOH 97/3) с получением 26 (280 мг, 2,1 ммоль, 70%) в форме белого твердого вещества.
Химическая формула: C23H26N2O4 М=394 г.моль-1
1H ЯМР (CDCl3): 8.10 (d, J=7.3 Гц, 1Н, Н-11); 7.49 (d, J=7.3 Гц, 1Н, Н-14); 7.33-7.24 (m, 2Н, Н-12 и Н-13); 5.99 (m, 1Н, Н-3); 4.21 (s, 1Н, Н-5); 3.87 (s, 3H, CO2CH3); 3.65 (m, 1Н, H-7); 3.54 (s, 3H, CO2CH3); 3.23 (m, 1Н, H-8); 3.03-2.85 (m, 3H, Н-7 и Н-19); 2.47 (m, 2Н, Н-2 и H-8); 2.48 (d, J=8.5 Гц, 1Н, Н-1); 2.24 (m, 1Н, Н-20); 1.91 (m, 1Н, Н-20); 1.71 (d, J=10.3 Гц, 1Н, Н-1); 1.08 (d, J=7.3 Гц, 3H, Н-21).
13С ЯМР (CDCl3): 172.9; 151.7; 147.3; 138.6; 135.9; 129.5; 124.5; 123.3; 122.7; 119.6; 118.2; 115.4; 58.5; 55.9; 55.8; 52.9; 52.7; 52.0; 38.2; 31.5; 26.7; 21.9; 10.3.
Na-карбометокси-9-оксокатарантин (27)
К 15 мл водного раствора Na2CO3 (2,07 г, 19,5 ммоль, 9,3 экв.) добавляют раствор 26 (820 мг, 2,1 ммоль, 1 экв.) в ТГФ (30 мл). Добавляют по каплям раствор йода (2,46 г, 9,7 ммоль, 4,6 экв.) в ТГФ (40 мл) при 0°С. Затем реакционную смесь доводят до температуры окружающей среды и перемешивают в течение 18 часов. Затем добавляют насыщенный водный раствор Na2S2O3 (30 мл) и реакционную смесь оставляют при перемешивании на 30 минут. Затем водную фазу экстрагируют CH2