Соли производных пирролопиримидинона и способ их получения
Иллюстрации
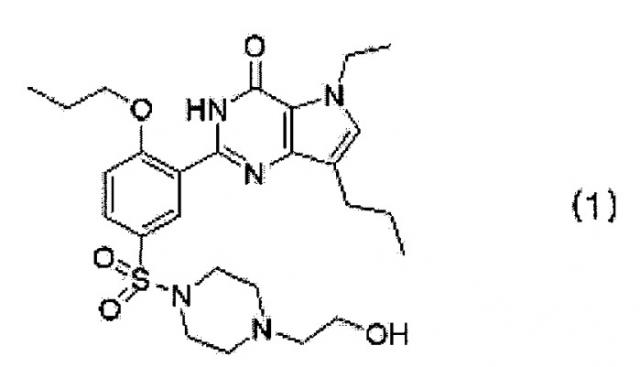
Показать всеИзобретение относится к новым кислотно-аддитивным солям производного пирролопиримидинона, представленного формулой (1),
которые выбирают из гентизатной, малеатной, нитратной, фумаратной и полутартратной солей, которые обладают улучшенными свойствами при их использовании, в частности повышенной стабильностью. Изобретение также относится к способу получения кислотно-аддитивных солей производного пирролопиримидинона, представленного формулой (1), и к фармацевтической композиции, их содержащей, для лечения и профилактики эректильной дисфункции, легочной артериальной гипертензии, хронического обструктивного заболевания легких, доброкачественной гипертрофии предстательной железы и заболеваний нижних мочевыводящих путей. 4 н. и 7 з.п. ф-лы, 30 пр., 7 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к солям производных пирролопиримидинона, которые являются эффективными в качестве ингибиторов PDE-5, и способу их получения.
Уровень техники
В патенте Кореи No. 358083 раскрыты производные пирролопиримидинона, обладающие высокой ингибирующей активностью по отношению к PDE-5, способ их получения, промежуточное соединение, используемое для их получения, и их применение для предотвращения и лечения эректильной дисфункции, легочной артериальной гипертензии, хронического обструктивного заболевания легких, доброкачественной гипертрофии предстательной железы и заболеваний нижних мочевыводящих путей.
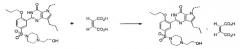
Из раскрытых в патенте Кореи No. 358083 производных пирролопиримидинона, 5-этил-2-{5-[4-(2-гидрокси-этил)пиперазин-1-илсульфонил]-2-н-пропоксифенил}-7-н-пропил-1-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (далее "SK-3530"), представленный следующей формулой (1), является отличным селективным ингибитором PDE-5 в сравнении с другими PDE и проходит клинические испытания по поводу лечения эректильной дисфункции, после того как он уже прошел предклиническую стадию исследований.
Дигидрохлоридная соль (2HCl) SK-3530 проходит предклинические и клинические стадии исследования.
Дигидрохлоридная соль SK-3530 имеет хорошую растворимость и может быть легко стабилизирована для фармацевтического препарата. Но она имеет следующие недостатки.
Во-первых, так как дигидрохлоридная соль SK-3530 является гигроскопичной, она легко поглощает влагу из окружающей среды и изменяет цвет, когда содержание влаги становится высоким. И, ввиду гигроскопичности, для получения стабильного продукта должны быть обеспечены условия применения безводного растворителя и сухого воздуха.
Во-вторых, дигидрохлоридную соль SK-3530 следует хранить при температуре ниже комнатной температуры, так как она не обладает достаточной стабильностью при комнатной температуре. В частности, дигидрохлоридная соль SK-3530 является неустойчивой к действию тепла или света, и поэтому любое продолжительное воздействие тепла или света приводит к образованию различных примесей.
В-третьих, дигидрохлоридная соль SK-3530 вследствие ее некоторых коррозионных свойств может вызвать коррозию штампа во время прессования таблеток. Причина состоит в том, что дигидрохлоридная соль SK-3530 является простой аморфной солью, а не является стабильной кристаллической кислотно-аддитивной солью или ее гидратной формой. Поэтому одна из двух групп хлористо-водородной кислоты с относительно слабой ионной связью может покидать молекулу при жестких условиях.
Как уже упоминалось выше, дигидрохлоридной соли SK-3530 можно придать соответствующую стабильность, необходимую для применения в качестве фармацевтического препарата. Но, вследствие отсутствия у соединения соответствующих физико-химических свойств и стабильности, необходимы некоторые дополнительные технические приемы и затраты.
Авторы настоящего изобретения провели различные исследования с целью решения вышеупомянутых проблем, связанных с применением дигидрохлоридной соли SK-3530. При этом они обнаружили, что кристаллическую кислотно-аддитивную соль SK-3530, подходящую для применения в фармацевтическом препарате, можно получить тогда, когда SK-3530 получают в виде кислотно-аддитивной соли в форме гентизата, малеата, цитрата, фумарата или полутартрата вместо гидрохлорида.
В результате реакции свободного основания SK-3530 с фармацевтически приемлемой кислотой, выбранной из гентизиновой кислоты, малеиновой кислоты, лимонной кислоты, фумаровой кислоты и винной кислоты, авторы настоящего изобретения смогли синтезировать новые соли кислот с достаточной стабильностью к действию температуры, влаги и света. Таким образом, они осуществили настоящее изобретение путем получения новой кристаллической кислотно-аддитивной соли SK-3530, которая демонстрирует достаточную стабильность, и которую легко использовать в фармацевтических препаратах.
Описание изобретения
Целью настоящего изобретения является получение соли SK-3530, удовлетворяющей физическим и химическим требованиям, предъявляемым к фармацевтически приемлемой соли.
Другой целью настоящего изобретения является разработка способа получения удовлетворяющей физическим и химическим требованиям соли SK-3530 путем взаимодействия свободного основания SK-3530 с конкретной кислотой.
Еще одной целью настоящего изобретения является разработка фармацевтической композиции для лечения и профилактики эректильной дисфункции, легочной артериальной гипертензии, хронического обструктивного заболевания легких, доброкачественной гипертрофии предстательной железы и заболеваний нижних мочевыводящих путей, которая содержит приведенную выше соль SK-3530 в качестве активного ингредиента.
Далее приводится более подробное описание настоящего изобретения.
Настоящее изобретение предлагает пять негигроскопичных фармацевтически приемлемых солей, таких как гентизат, малеат, цитрат, фумарат и полутартрат SK-3530, представленного следующей формулой (1), которые обладают превосходной стабильностью и лечебным действием. Они также создают максимальную концентрацию в крови при физиологически приемлемом времени и, поэтому, являются подходящими для лечения и профилактики эректильной дисфункции, легочной артериальной гипертензии, хронического обструктивного заболевания легких, доброкачественной гипертрофии предстательной железы и заболеваний нижних мочевыводящих путей:
Настоящее изобретение также предлагает способ получения соли SK-3530, который включает стадии взаимодействия свободного основания SK-3530, представленного формулой (1), с фармацевтически приемлемой кислотой, выбранной из гентизиновой кислоты, малеиновой кислоты, лимонной кислоты, фумаровой кислоты и винной кислоты.
Способ получения кристаллической кислотно-аддитивной соли SK-3530 согласно настоящему изобретению включает:
растворение или суспендирование кислоты, выбранной из гентизиновой кислоты, малеиновой кислоты, лимонной кислоты, фумаровой кислоты и винной кислоты, с получением раствора кислоты;
смешение раствора кислоты со свободным основанием SK-3530; и
фильтрование, промывку и сушку твердого вещества, полученного в результате перемешивания вышеупомянутой смеси, с получением кристаллической кислотно-аддитивной соли.
При получении смеси свободного основания SK-3530 и кислоты при получении кристаллической кислотно-аддитивной соли SK-3530 согласно настоящему изобретению фармацевтически приемлемая кислота, выбранная из гентизиновой кислоты, малеиновой кислоты, лимонной кислоты, фумаровой кислоты и винной кислоты, может быть добавлена к свободному основанию SK-3530, или свободное основание SK-3530 может быть добавлено к кислоте.
Далее приведено подробное описание каждой стадии способа получения согласно настоящему изобретению.
На первой стадии получения раствора кислоты важным является регулирование концентрации кислоты. Предпочтительно, чтобы концентрацию кислоты регулировали так, чтобы она находилась в интервале 1-30 вес.%, что способствует эффективному проведению в дальнейшем кристаллизации.
На второй стадии получения смеси свободного основания SK-3530 и кислоты, предпочтительно, чтобы кислоту использовали при эквивалентном соотношении от 0,5 до 3,0 по отношению к SK-3530. При получении смеси кислота может быть добавлена к свободному основанию SK-3530, или свободное основание SK-3530 может быть добавлено к кислоте. Свободное основание SK-3530 может быть добавлено в твердом состоянии или растворенное в соответствующем реакционном растворителе. Более конкретно, свободное основание SK-3530 в твердом состоянии или растворенное в соответствующем растворителе может быть добавлено к раствору кислоты с получением смеси. В качестве варианта, раствор кислоты может быть добавлен к свободному основанию SK-3530 в твердой форме или раствору свободного основания SK-3530, растворенного в соответствующем растворителе.
На второй и третьей стадиях в качестве реакционного растворителя используют воду или обычно используемый органический растворитель. В частности, предпочтительно использовать воду или органический растворитель, выбранный из ацетона, метанола, этанола, изопропанола и ацетонитрила, и их комбинации.
На третьей стадии образуется кристаллическая кислотно-аддитивная соль при температуре от -30 до 50°C, предпочтительно - от 0 до 30°C, особенно предпочтительно - при комнатной температуре от 15 до 25°C.
Предлагаемые настоящим изобретением гентизатная, малеатная, цитратная, фумаратная и полутартратная соли SK-3530, представленного формулой (1), удовлетворяют приведенным далее всем пяти физико-химическим требованиям, выдвигаемым для фармацевтически приемлемой соли: (1) низкая гигроскопичность, (2) соответствующая растворимость, (3) более низкая способность таблетки к слипанию, (4) превосходная стабильность и (5) легкость массового производства.
Соответственно, настоящее изобретение включает фармацевтическую композицию для лечения эректильной дисфункции, которая содержит гентизатную, малеатную, цитратную, фумаратную или полутартратную соль вышеупомянутого SK-3530, представленного формулой (1), в качестве активного ингредиента.
Фармацевтическая композиция согласно настоящему изобретению может быть введена перорально или неперорально, и может быть превращена в обычные препаративные формы. Таким образом, она может быть получена в различных лекарственных формах для перорального и неперорального введения. Для получения препарата применяют обычно используемый разбавитель или эксципиент, включающие наполнитель, расширитель, связующее, смачивающее вещество, дезинтегрант, поверхностно-активное вещество, и другие вещества. Твердые лекарственные формы для перорального введения включают таблетку, пилюлю, порошок, гранулу и капсулу. Эти твердые лекарственные формы получают путем смешения, по меньшей мере, одного эксципиента, например крахмала, сахарозы или лактозы, желатина, и других веществ, с активным ингредиентом. Кроме того, в дополнение к простым эксципиентам применяют лубрикант, такой как стеарат магния и тальк. Жидкие лекарственные формы для перорального введения включают суспензию, раствор, эмульсию и сироп. В дополнение к обычно используемому разбавителю, такому как вода и вазелиновое масло, могут быть использованы различные эксципиенты, например смачивающее вещество, подсластитель, ароматизатор, консервант, и другие вещества. Лекарственные формы для неперорального введения включают стерильный водный раствор, неводный раствор, суспензию, эмульсию, лиофилизированный препарат и суппозиторий. Для неводного раствора и суспензии могут быть использованы пропилeнгликоль, полиэтиленгликоль, растительное масло типа оливкового масла, инъецируемый сложный эфир типа этилолеата, и другие вещества. Для основы суппозитория может быть использован Witepsol, Macrogol, Tween 61, жир какао, лауриновый жир, глицерожелатин, и другие вещества.
Доза введения фармацевтической композиции согласно настоящему изобретению может зависеть от возраста пациента, массы тела, пола, способа введения, физического состояния и тяжести заболевания. Эффективная доза введения соли SK-3530 составляет 10,0-200,0 мг, предпочтительно - 20-150 мг, в расчете на массу свободного основания SK-3530.
Наилучший вариант осуществления изобретения
Практические и на настоящий момент предпочтительные варианты осуществления настоящего изобретения иллюстрируются следующими примерами. Однако следует иметь в виду, что специалисты в этой области могут на основе этого описания осуществить модификации и усовершенствования в рамках сущности и объема настоящего изобретения.
Пример 1: Получение гентизатной соли SK-3530
2,44 г гентизиновой кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 8,0 г свободного основания SK-3530 растворяли в 100 мл ацетона и медленно добавляли к раствору гентизиновой кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре, и полученное твердое вещество фильтровали, промывали 20 мл ацетона и сушили под вакуумом при 50°C с получением 7,96 г (выход: 77,1%) белого кристаллического целевого соединения.
1H-ЯМР (300 МГц, DMSO-d6) δ (м.д.) 11,70 (с, 1H), 7,89 (д, 1H), 7,80 (дд, 1H), 7,38 (д, 1H), 7,31 (с, 1H), 7,14 (д, 1H), 6,87 (дд, 1H), 6,71 (д, 1H), 4,37 (кв., 2H), 4,12 (т, 2H), 3,47 (т, 2H), 2,95 (м, 4H), 2,66 (м, 4H), 2,59-2,48 (м, 4H), 1,77-1,59 (м, 4H), 1,35 (т, 3H), 0,96 (т, 3H), 0,92 (т, 3H).
Пример 2: Получение гентизатной соли SK-3530
2,44 г гентизиновой кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 8,0 г свободного основания SK-3530 медленно добавляли к раствору гентизиновой кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре, и полученное твердое вещество фильтровали, промывали 20 мл ацетона и сушили под вакуумом при 50°C с получением белого кристаллического целевого соединения.
Пример 3: Получение гентизатной соли SK-3530
200 мг свободного основания SK-3530 суспендировали в 1 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 61 мг гентизиновой кислоты растворяли в смешанном растворителе ацетона (1 мл) и воды (2 мл) и медленно добавляли к раствору свободного основания SK-3530. Смесь перемешивали в течение 30 минут при комнатной температуре и дополнительно перемешивали в течение 30 минут после добавления 12 мл воды. Полученное твердое вещество фильтровали, промывали 10 мл воды и сушили под вакуумом при 50°C с получением 249 мг (выход: 96,5%) белого кристаллического целевого соединения.
Пример 4: Получение таблетки, содержащей гентизатную соль SK-3530
Безводный гидроортофосфат кальция (315 г) смешивали с микрокристаллической целлюлозой (525 г, 90 мкм) и переносили в барабан смесителя. Затем гентизатную соль SK-3530 (70 г) смешивали с микрокристаллической целлюлозой (187,5 г, 50 мкм) и просеивали через сито в барабан, содержащий вышеупомянутую порошкообразную смесь. Сито очищали с помощью микрокристаллической целлюлозы (525 г, 90 мкм). Безводный гидроортофосфат кальция (315 г) добавляли к смеси и перемешивали в течение 10 минут. Затем к смеси добавляли натрия крахмала гликолят (40 г), и перемешивали в течение 6 минут. И, наконец, добавляли стеарат магния (20 г) и перемешивали в течение 3 минут. Полученную порошкообразную смесь прессовали в таблетку обычным методом.
Пример 5: Получение капсулы, содержащей гентизатную соль SK-3530
Микрокристаллическую целлюлозу (525 г, 90 мкм) смешивали с сухим кукурузным крахмалом. Гентизатную соль SK-3530 (70 г) смешивали с частью предварительной смеси и просеивали через сито. Добавляли оставшийся кукурузный крахмал и после 10 минут смешения проводили просеивание и затем еще дополнительно смешивали в течение 5 минут. Наполняли продуктом капсулу соответствующего размера.
Пример 6: Получение инъекционного раствора, содержащего гентизатную соль SK-3530
Хлорид натрия растворяли в стерильной воде для инъекций и смешивали с пропиленгликолем. Добавляли гентизатную соль SK-3530 и, после растворения, дополнительно добавляли стерильную воду для инъекций с получением раствора с требуемой концентрацией. Полученный раствор фильтровали через стерилизующий фильтр и заполняли им стерильную ампулу, используемую в качестве контейнера для инъекции.
Пример 7: Получение малеатной соли SK-3530
1,44 г малеиновой кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 6,0 г свободного основания SK-3530 медленно добавляли к раствору малеиновой кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре, и 50 мл ацетона удаляли путем конденсации под пониженным давлением. Полученное твердое вещество фильтровали, промывали 20 мл эфира и сушили под вакуумом при 50°C с получением 7,02 г (выход: 96,0%) белого кристаллического целевого соединения.
1H-ЯМР (300 МГц, DMSO-d6) δ (м.д.) 11,73 (с, 1H), 7,94 (д, 1H), 7,84 (дд, 1H), 7,42 (д, 1H), 7,32 (с, 1H), 6,08 (с, 2H), 4,37 (кв., 2H), 4,14 (т, 2H), 3,62 (т, 2H), 3,52-2,70 (м, 10H), 2,57 (т, 2H), 1,79-1,60 (м, 4H), 1,36 (т, 3H), 0,97 (т, 3H), 0,92 (т, 3H).
Пример 8: Получение малеатной соли SK-3530
1,44 г малеиновой кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 6,0 г свободного основания SK-3530 растворяли в 100 мл ацетона и медленно добавляли к раствору малеиновой кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре, и 50 мл ацетона удаляли путем конденсации под пониженным давлением. Полученное твердое вещество фильтровали, промывали 20 мл эфира и сушили под вакуумом при 50°C с получением белого кристаллического целевого соединения.
Пример 9: Получение малеатной соли SK-3530
60 мг свободного основания SK-3530 суспендировали в 1 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 14,4 мг малеиновой кислоты растворяли в смешанном растворителе ацетона (1 мл) и воды (2 мл) и медленно добавляли к раствору свободного основания SK-3530. Смесь перемешивали в течение 1 часа при комнатной температуре, и полученное твердое вещество фильтровали, промывали 20 мл ацетона и сушили под вакуумом при 50°C с получением белого кристаллического целевого соединения.
Пример 10: Получение таблетки, содержащей малеатную соль SK-3530
Безводный гидроортофосфат кальция (315 г) смешивали с микрокристаллической целлюлозой (525 г, 90 мкм) и переносили в барабан смесителя. Затем малеатную соль SK-3530 (70 г) смешивали с микрокристаллической целлюлозой (187,5 г, 50 мкм) и просеивали через сито в барабан, содержащий вышеупомянутую порошкообразную смесь. Сито очищали с помощью микрокристаллической целлюлозы (525 г, 90 мкм). Добавляли к смеси безводный гидроортофосфат кальция (315 г) и перемешивали в течение 10 минут. Затем к смеси добавляли натрия крахмала гликолят (40 г) и перемешивали в течение 6 минут. И, наконец, добавляли стеарат магния (20 г) и перемешивали в течение 3 минут. Полученную порошкообразную смесь прессовали в таблетку обычным методом.
Пример 11: Получение капсулы, содержащей малеатную соль SK-3530
Микрокристаллическую целлюлозу (525 г, 90 мкм) смешивали с сухим кукурузным крахмалом. Малеатную соль SK-3530 (70 г) смешивали с частью предварительной смеси и просеивали через сито. Добавляли оставшийся кукурузный крахмал и после 10 минут смешения проводили просеивание и затем еще дополнительно смешивали в течение 5 минут. Продуктом наполняли капсулу соответствующего размера.
Пример 12: Получение инъекционного раствора, содержащего малеатную соль SK-3530
Хлорид натрия растворяли в стерильной воде для инъекций и смешивали с пропиленгликолем. Добавляли малеатную соль SK-3530 и, после растворения, дополнительно добавляли стерильную воду для инъекций с получением раствора с требуемой концентрацией. Полученный раствор фильтровали через стерилизующий фильтр и заполняли им стерильную ампулу, используемую в качестве контейнера для инъекции.
Пример 13: Получение цитратной соли SK-3530
3,04 г лимонной кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 8,0 г свободного основания SK-3530 растворяли в 100 мл ацетона и медленно добавляли к раствору лимонной кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре, и полученное твердое вещество фильтровали, промывали 20 мл ацетона и сушили под вакуумом при 50°C с получением 10,5 г (выход: 96,4%) белого кристаллического целевого соединения.
1H-ЯМР (300 МГц, DMSO-d6) δ (м.д.) 11,70 (с, 1H), 7,88 (д, 1H), 7,80 (дд, 1H), 7,38 (д, 1H), 7,31 (с, 1H), 4,37 (кв., 2H), 4,12 (т, 2H), 3,44 (т, 2H), 3,00-2,83 (м, 4H), 2,75-2,54 (м, 8H), 2,51-2,47 (м, 4H), 1,75-1,62 (м, 4H), 1,35 (т, 3H), 0,96 (т, 3H), 0,92 (т, 3H).
Пример 14: Получение цитратной соли SK-3530
3,04 г лимонной кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 8,0 г свободного основания SK-3530 растворяли в 100 мл ацетона и медленно добавляли к раствору лимонной кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре, и полученное твердое вещество фильтровали, промывали 20 мл ацетона и сушили под вакуумом при 50°C с получением белого кристаллического целевого соединения.
Пример 15: Получение цитратной соли SK-3530
80 мг свободного основания SK-3530 суспендировали в 1 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 30,4 мг лимонной кислоты растворяли в смешанном растворителе ацетона (1 мл) и воды (2 мл) и медленно добавляли к раствору свободного основания SK-3530. Смесь перемешивали в течение 30 минут при комнатной температуре и дополнительно перемешивали в течение 30 минут после добавления 12 мл воды. Полученное твердое вещество фильтровали, промывали 10 мл воды и сушили под вакуумом при 50°C с получением белого кристаллического целевого соединения.
Пример 16: Получение таблетки, содержащей цитратную соль SK-3530
Безводный гидроортофосфат кальция (315 г) смешивали с микрокристаллической целлюлозой (525 г, 90 мкм) и переносили в барабан смесителя. Затем цитратную соль SK-3530 (70 г) смешивали с микрокристаллической целлюлозой (187,5 г, 50 мкм) и просеивали через сито в барабан, содержащий вышеупомянутую порошкообразную смесь. Сито очищали с помощью микрокристаллической целлюлозы (525 г, 90 мкм). Добавляли к смеси безводный гидроортофосфат кальция (315 г) и перемешивали в течение 10 минут. Затем добавляли к смеси натрия крахмала гликолят (40 г) и перемешивали в течение 6 минут. И, наконец, добавляли стеарат магния (20 г) и перемешивали в течение 3 минут. Полученную порошкообразную смесь прессовали в таблетку обычным методом.
Пример 17: Получение капсулы, содержащей цитратную соль SK-3530
Микрокристаллическую целлюлозу (525 г, 90 мкм) смешивали с сухим кукурузным крахмалом. Цитратную соль SK-3530 (70 г) смешивали с частью предварительной смеси и просеивали через сито. Добавляли оставшийся кукурузный крахмал и после 10 минут смешения проводили просеивание и затем еще дополнительно смешивали в течение 5 минут. Продуктом наполняли капсулу соответствующего размера.
Пример 18: Получение инъекционного раствора, содержащего цитратную соль SK-3530
Хлорид натрия растворяли в стерильной воде для инъекций и смешивали с пропиленгликолем. Добавляли цитратную соль SK-3530 и, после растворения, дополнительно добавляли стерильную воду для инъекций с получением раствора с требуемой концентрацией. Полученный раствор фильтровали через стерилизующий фильтр и заполняли им стерильную ампулу, используемую в качестве контейнера для инъекции.
Пример 19: Получение фумаратной соли SK-3530
1,44 г фумаровой кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 6,0 г свободного основания SK-3530 медленно добавляли к раствору фумаровой кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре и после удаления 50 мл ацетона путем конденсации под пониженным давлением полученное твердое вещество фильтровали, промывали 20 мл эфира и сушили под вакуумом при 50°C с получением 6,92 г (выход: 94,7%) белого кристаллического целевого соединения.
1H-ЯМР (300 МГц, DMSO-d6) δ (м.д.) 11,69 (с, 1H), 7,88 (д, 1H), 7,79 (дд, 1H), 7,37 (д, 1H), 7,30 (с, 1H), 6,62 (с, 2H), 4,37 (кв., 2H), 4,12 (т, 2H), 3,43 (т, 2H), 2,90 (м, 4H), 2,59-2,48 (м, 6H), 2,40 (т, 2H), 1,75-1,59 (м, 4H), 1,35 (т, 3H), 0,96 (т, 3H), 0,92 (т, 3H).
Пример 20: Получение фумаратной соли SK-3530
1,44 г фумаровой кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 8,0 г свободного основания SK-3530 растворяли в 100 мл ацетона и медленно добавляли к раствору фумаровой кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре, и полученное твердое вещество фильтровали, промывали 20 мл ацетона и сушили под вакуумом при 50°C с получением белого кристаллического целевого соединения.
Пример 21: Получение фумаратной соли SK-3530
80 мг свободного основания SK-3530 суспендировали в 1 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 14,4 мг фумаровой кислоты растворяли в смешанном растворителе ацетона (1 мл) и воды (2 мл) и медленно добавляли к раствору свободного основания SK-3530. Смесь перемешивали в течение 30 минут при комнатной температуре и дополнительно перемешивали в течение 30 минут после добавления 12 мл воды. Полученное твердое вещество фильтровали, промывали 10 мл воды и сушили под вакуумом при 50°C с получением белого кристаллического целевого соединения.
Пример 22: Получение таблетки, содержащей фумаратную соль SK-3530
Безводный гидроортофосфат кальция (315 г) смешивали с микрокристаллической целлюлозой (525 г, 90 мкм) и переносили в барабан смесителя. Затем фумаратную соль SK-3530 (70 г) смешивали с микрокристаллической целлюлозой (187,5 г, 50 мкм) и просеивали через сито в барабан, содержащий вышеупомянутую порошкообразную смесь. Сито очищали с помощью микрокристаллической целлюлозы (525 г, 90 мкм). Безводный гидроортофосфат кальция (315 г) добавляли к смеси и перемешивали в течение 10 минут. Затем к смеси добавляли натрия крахмала гликолят (40 г) и перемешивали в течение 6 минут. И, наконец, добавляли стеарат магния (20 г) и перемешивали в течение 3 минут. Полученную порошкообразную смесь прессовали в таблетку обычным методом.
Пример 23: Получение капсулы, содержащей фумаратную соль SK-3530
Микрокристаллическую целлюлозу (525 г, 90 мкм) смешивали с сухим кукурузным крахмалом. Фумаратную соль SK-3530 (70 г) смешивали с частью предварительной смеси и просеивали через сито. Добавляли оставшийся кукурузный крахмал и после 10 минут смешения проводили просеивание и затем еще дополнительно смешивали в течение 5 минут. Продуктом наполняли капсулу соответствующего размера.
Пример 24: Получение инъекционного раствора, содержащего фумаратную соль SK-3530
Хлорид натрия растворяли в стерильной воде для инъекций и смешивали с пропиленгликолем. Добавляли фумаратную соль SK-3530 и, после растворения, дополнительно добавляли стерильную воду для инъекций с получением раствора с требуемой концентрацией. Полученный раствор фильтровали через стерилизующий фильтр и заполняли им стерильную ампулу, используемую в качестве контейнера для инъекции.
Пример 25: Получение полутартратной соли SK-3530
1,19 г винной кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 8,0 г свободного основания SK-3530 растворяли в 100 мл ацетона и медленно добавляли к раствору винной кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре, и полученное твердое вещество фильтровали, промывали 20 мл ацетона и сушили под вакуумом при 50°C с получением 7,6 г (выход: 83,2%) белого кристаллического целевого соединения.
1H-ЯМР (300 МГц, DMSO-d6) δ (м.д.) 11,70 (с, 1H), 7,87 (д, 1H), 7,79 (дд, 1H), 7,38 (д, 1H), 7,31 (с, 1H), 4,36 (кв., 2H), 4,26 (с, 1H), 4,12 (т, 2H), 3,42 (т, 2H), 2,89 (м, 4H), 2,59-2,47 (м, 6H), 2,39 (т, 2H), 1,80-1,56 (м, 4H), 1,35 (т, 3H), 0,96 (т, 3H), 0,92 (т, 3H).
Пример 26: Получение полутартратной соли SK-3530
1,19 г винной кислоты растворяли в 100 мл ацетона, и полученный раствор перемешивали при комнатной температуре. 8,0 г свободного основания SK-3530 медленно добавляли к раствору винной кислоты. Смесь перемешивали в течение 1 часа при комнатной температуре, и полученное твердое вещество фильтровали, промывали 20 мл ацетона и сушили под вакуумом при 50°C с получением белого кристаллического целевого соединения.
Пример 27: Получение таблетки, содержащей полутартратную соль SK-3530
Безводный гидроортофосфат кальция (315 г) смешивали с микрокристаллической целлюлозой (525 г, 90 мкм) и переносили в барабан смесителя. Затем полутартратную соль SK-3530 (70 г) смешивали с микрокристаллической целлюлозой (187,5 г, 50 мкм) и просеивали через сито в барабан, содержащий вышеупомянутую порошкообразную смесь. Сито очищали с помощью микрокристаллической целлюлозы (525 г, 90 мкм). Безводный гидроортофосфат кальция (315 г) добавляли к смеси и перемешивали в течение 10 минут. Затем добавляли к смеси натрия крахмала гликолят (40 г) и перемешивали в течение 6 минут. И, наконец, добавляли стеарат магния (20 г) и перемешивали в течение 3 минут. Полученную порошкообразную смесь прессовали в таблетку обычным методом.
Пример 28: Получение капсулы, содержащей полутартратную соль SK-3530
Микрокристаллическую целлюлозу (525 г, 90 мкм) смешивали с сухим кукурузным крахмалом. Полутартратную соль SK-3530 (70 г) смешивали с частью предварительной смеси и просеивали через сито. Добавляли оставшийся кукурузный крахмал и после 10 минут смешения проводили просеивание и затем еще дополнительно смешивали в течение 5 минут. Продуктом наполняли капсулу соответствующего размера.
Пример 29: Получение инъекционного раствора, содержащего полутартратную соль SK-3530
Хлорид натрия растворяли в стерильной воде для инъекций и смешивали с пропиленгликолем. Добавляли полутартратную соль SK-3530 и, после растворения, дополнительно добавляли стерильную воду для инъекций с получением раствора с требуемой концентрацией. Полученный раствор фильтровали через стерилизующий фильтр и заполняли им стерильную ампулу, используемую в качестве контейнера для инъекции.
Пример испытания 1: Испытание на стабильность
Это испытание проводится для подтверждения устойчивости при хранении соли SK-3530.
1) Устойчивость к действию воды и атмосферному воздействию
В процессе получения конкретной лекарственной формы из лекарственного средства необходимо, чтобы оно было достаточно стабильным. Например, получение таблетки или капсулы требует устойчивости к атмосферному воздействию, а получение инъекционного раствора требует устойчивости к действию воды.
В следующей таблице 1 (25°C, влажность 75%), таблице 2 (40°C, влажность 60%) и таблице 3 (50°C, влажность 75%) представлено содержание суммарных примесей, измеренных с помощью жидкостной хроматографии после хранения дигидрохлоридной (2HCl), гентизатной, малеатной, цитратной, фумаратной и полутартратной солей SK-3530 в течение 1 недели и 3 недель.
| Таблица 1 | |||
| Соли SK-3530 | Содержание примесей (%) при 25°С и влажности 75% | ||
| Исходное | 1 неделя | 3 недели | |
| Дигидрохлоридная соль SK-3530 | 0,20 | 0,24 | 0,31 |
| Гентизатная соль SK-3530 | 0,09 | 0,09 | 0,12 |
| Малеатная соль SK-3530 | 0,12 | 0,12 | 0,12 |
| Цитратная соль SK-3530 | 0,12 | 0,15 | 0,15 |
| Фумаратная соль SK-3530 | 0,02 | 0,02 | 0,03 |
| Полутартратная соль SK-3530 | 0,07 | 0,09 | 0,13 |
| Таблица 2 | |||
| Соли SK-3530 | Содержание примесей (%) при 40°С и влажности 60% | ||
| Исходное | 1 неделя | 3 недели | |
| Дигидрохлоридная соль SK-3530 | 0,20 | 0,24 | 0,38 |
| Гентизатная соль SK-3530 | 0,09 | 0,10 | 0,10 |
| Малеатная соль SK-3530 | 0,12 | 0,12 | 0,12 |
| Цитратная соль SK-3530 | 0,12 | 0,13 | 0,14 |
| Фумаратная соль SK-3530 | 0,02 | 0,02 | 0,05 |
| Полутартратная соль SK-3530 | 0,07 | 0,10 | 0,14 |
| Таблица 3 | |||
| Соли SK-3530 | Содержание примесей (%) при 50°С и влажности 75% | ||
| Исходное | 1 неделя | 3 недели | |
| Дигидрохлоридная соль SK-3530 | 0,20 | 0,27 | 0,42 |
| Гентизатная соль SK-3530 | 0,09 | 0,09 | 0,10 |
| Малеатная соль SK-3530 | 0,12 | 0,15 | 0,19 |
| Цитратная соль SK-3530 | 0,12 | 0,14 | 0,14 |
| Фумаратная соль SK-3530 | 0,02 | 0,02 | 0,05 |
| Полутартратная соль SK-3530 | 0,07 | 0,11 | 0,13 |
2) Испытание на устойчивость к действию света
В следующей таблице 4 и таблице 5 приведены результаты испытания на устойчивость к действию света для дигидрохлоридной (2HCl), гентизатной, малеатной, цитратной, фумаратной и полутартратной солей SK-3530. Суммарное ультрафиолетовое (УФ) излучение составляло 200 ватт-час/м2 и суммарное излучение в видимой части спектра составляло 1080 килолюкс/м2час. Каждую соль хранили в чашке Петри при 25°C и влажности 60%.
| Таблица 4 | |||
| Соли SK-3530 | Содержание примесей (%) | ||
| Исходное | УФ | Видимый | |
| Дигидрохлоридная соль SK-3530 | 0,20 | 5,92 | 1,37 |
| Гентизатная соль SK-3530 | 0,09 | 0,36 | 0,17 |
| Малеатная соль SK-3530 | 0,12 | 0,35 | 0,14 |
| Цитратная соль SK-3530 | 0,12 | 0,37 | 0,14 |
| Фумаратная соль SK-3530 | 0,02 | 0,08 | 0,07 |
| Полутартратная соль SK-3530 | 0,07 | 0,52 | 0,21 |
| Таблица 5 | |||
| Соли SK-3530 | Изменение цвета | ||
| Исходное | УФ | Видимый | |
| Дигидрохлоридная соль SK-3530 | Белый | Коричневый | Желтый |
| Гентизатная соль SK-3530 | Белый | Бледно-желтый | Бледно-желтый |
| Малеатная соль SK-3530 | Белый | Белый | Белый |
| Цитратная соль SK-3530 | Белый | Белый | Белый |
| Фумаратная соль SK-3530 | Белый | Бледно-желтый | Белый |
| Полутартратная соль SK-3530 | Белый | Белый | Белый |
3) Испытание термостабильности
В следующей таблице 6 и таблице 7 приведен результат испытания термостабильности для дигидрохлоридной (2HCl), гентизатной, малеатной, цитратной, фумаратной и полутартратной солей SK-3530. Каждую соль помещали на чашку Петри и выдерживали в сушильном шкафу при 105°C. Наблюдения проводили через 3 часа и 48 часов, содержание примесей измеряли с помощью жидкостной хроматографии.
| Таблица 6 | |||
| Соли SK-3530 | Содержание примесей (%) | ||
| Исходное | 3 часа | 48 часов | |
| Дигидрохлоридная соль SK-3530 | 0,20 | 3,06 | 14,37 |
| Гентизатная соль SK-3530 | 0,09 | 0,09 | 0,13 |
| Малеатная соль SK-3530 | 0,12 | 0,15 | 0,74 |
| Цитратная соль SK-3530 | 0,12 | 0,30 | 1,81 |
| Фумаратная соль SK-3530 | 0,02 | 0,11 | 0,61 |
| Полутартратная соль SK-3530 | 0,07 | 0,14 | 0,70 |
| Таблица 7 | |||
| Соли SK-3530 | Изменение цвета | ||
| Исходное | 3 часа | 48 часов | |
| Дигидрохлоридная соль SK-3530 | Белый | Белый | Желтый |
| Гентизатная соль SK-3530 | Белый | Белый | Белый |
| Малеатная соль SK-3530 | Белый | Белый | Белый |
| Цитратная соль SK-3530 | Белый | Белый | Белый |
| Фумаратная соль SK-3530 | Белый | Белый | Белый |
| Полутартратная соль SK-3530 | Белый | Белый | Белый |
Как видно из таблиц 1-7, гентизатная, малеатная, цитратная, фумаратная или полутартратная соль SK-3530 в соответствии с настоящим изобретением продемонстрировали значительно более высокую стабильность при хранении, устойчивость к действию УФ и видимого света и термостабильность по сравнению с дигидрохлоридной солью SK-3530.
Промышленная применимость
Как описано выше, гентизатная, малеатная, цитратная, фумаратная или полутартратная соль SK-3530 в соответствии с настоящим изобретением является кристаллической кислотно-аддитивной солью, подходящей для фармацевтического препарата, и с превосходной PDE-5 ингибирующей активностью, может быть использована для лечения и профилактики эректильной дисфункции, легочной артериальной гипертензии, хронического обструктивного заболевания легких, доброкачественной гипертрофии предстательной железы и заболеваний нижних мочевыводящих путей.
Были описаны и проиллюстрированы предпочтительные варианты осуществления настоящего изобретения. Однако они не являются ограничениями для настоящего изобретения. Кроме того, следует иметь в виду, что различные модификации и варианты настоящего изобретения могут быть сделаны специалистами в этой области без отклонения от сущности и объема настоящего изобретения, определяемого прилагаемой формулой изобретения.
1. Кислотно-аддитивная соль производного пирролопиримидинона, представленного следующей формулой (1), которую выбирают из гентизатной, малеатной, цитратной, фумаратной и полутартратной