Обладающий способностью облегчать по меньшей мере один симптом воспалительного состояния пептид, содержащая его фармацевтическая композиция и способ лечения атеросклероза с их помощью
Иллюстрации
Показать всеИзобретение относится к новым пептидам, которые обладают способностью облегчать по меньшей мере один симптом атеросклероза. Пептиды имеют высокую стабильность, и их легко вводить пероральным путем. 3 н. и 5 з.п. ф-лы, 31 ил., 17 табл., 5 пр.
Реферат
Данная работа была частично поддержана грантом No HL30568 Национального института сердца, крови и легких Национальных институтов здравоохранения. Правительство Соединенных Штатов Америки может иметь определенные права на данное изобретение.
Область техники, к которой относится изобретение
Данное изобретение относится к области атеросклероза. В частности, данное изобретение имеет отношение к идентификации класса пептидов, которые пригодны для перорального приема и которые облегчают по меньшей мере один симптом атеросклероза или других патологий, характеризующихся воспалительной реакцией.
Уровень техники
Введение статинов (например, MevacorRR, LipitorRR) снизило уровень смертности от сердечного приступа и инсульта примерно на одну треть. Тем не менее, сердечный приступ и инсульт остаются основной причиной смерти и нетрудоспособности, особенно в Соединенных Штатах Америки и в западноевропейских странах. Сердечный приступ и инсульт являются результатом хронического воспалительного состояния, которое называют атеросклерозом.
В развитии сердечно-сосудистого заболевания участвует ряд причинных факторов, включая наследственную предрасположенность к заболеванию, пол, факторы, связанные с образом жизни, такие как курение и диета, возраст, гипертензия и гиперлипидемия, в том числе гиперхолестеринемия. Некоторые из этих факторов, особенно гиперлипидемия и гиперхолестеринемия (высокие концентрации холестерина в крови), обусловливают существенный фактор риска, связанный с атеросклерозом.
Холестерин находится в крови в виде свободного и эстерифицированного холестерина в липопротеиновых частицах, обычно известных как хиломикроны, липопротеинах очень низкой плотности (ЛОНП), липопротеинах низкой плотности (LDLs), липопротеинах высокой плотности (HDLs). На концентрацию общего холестерина в крови влияет (1) всасывание холестерина из пищеварительного тракта, (2) синтез холестерина из составляющих продуктов питания, таких как углеводы, белки, жиры и этанол, и (3) удаление холестерина из крови тканями, особенно печенью, последующее превращение холестерина в желчные кислоты, стероидные гормоны и желчный холестерин.
На поддержание концентраций холестерина в крови влияют как генетические факторы, так и факторы окружающей среды. Генетические факторы включают концентрацию ферментов, лимитирующих скорость реакции, в биосинтезе холестерина, концентрацию рецепторов для липопротеинов низкой плотности в печени, концентрацию ферментов, лимитирующих скорость превращения холестеринов в желчные кислоты, уровни синтеза и секреции липопротеинов и пол субъекта. Факторы окружающей среды, влияющие на гемостаз концентрации холестерина в крови у человека, включают состав диеты, нагрузку в виде курения, физическую активность и применение ряда фармацевтических агентов. Переменные величины диеты включают количество и тип жира (насыщенные и полиненасыщенные жирные кислоты), количество холестерина, количество и тип волокна и, возможно, количество витаминов, таких как витамин С и D, и минералов, таких как кальций.
Окисление липопротеина низкой плотности (ЛНП) принимает большое участие в патогенезе атеросклероза. Показано, что липопротеин высокой плотности (ЛВП) способен защищать от окисления ЛНП, но в некоторых случаях обнаружено, что он ускоряет окисление ЛНП. Важные инициирующие факторы атеросклероза включают продукцию образованных из ЛНП окисленных фосфолипидов.
Нормальный ЛВП обладает способностью препятствовать образованию данных окисленных фосфолипидов, а также инактивировать данные окисленные фосфолипиды после того, как они образовались. Однако в некоторых условиях ЛВП можно превратить из противовоспалительной молекулы в провоспалительную молекулу, которая действительно способствует образованию данных окисленных фосфолипидов.
Как полагают, ЛВП и ЛНП являются частью врожденной иммунной системы (см. статью Navab et at. (2001) Arterioscler Thromb Vase Biol. 21:481-488). Генерация противовоспалительных ЛВП достигается с помощью амфипатических спиральных пептидов класса А, которые имитируют главный белок ЛВП, аполипопротеин A-I (apo A-I) (см., например, WO 02/15923).
Раскрытие изобретения
Данное изобретение представляет новые композиции и способы облегчения симптомов атеросклероза и других воспалительных состояний, таких как ревматоидный артрит, красная волчанка, узелковый полиартериит, остеопороз, болезнь Альцгеймера и вирусные болезни, такие как грипп А.
В ряде вариантов осуществления данное изобретение представляет "выделенные" полипептиды, которые облегчают симптом атеросклероза или других патологий, связанных с воспалительной реакцией, и/или композиции, включающие данные полипептиды.
Таким образом, в одном варианте осуществления данное изобретение представляет пептид, который облегчает один или более симптомов воспалительного состояния, причем пептид включает последовательность аминокислот LAEYHAK (SEQ ID NO:8) или KAHYEAL (SEQ ID NO:644), и пептид включает по меньшей мере одну D-аминокислоту и/или по меньшей мере одну защитную группу. В ряде вариантов осуществления пептид включает D-аминокислоты и/или одну или более защитных групп (например, защитную группу на каждом конце). В различных вариантах осуществления защитная группа(ы) включает одну или более защитных групп из группы, состоящей из амида, алкильных групп из 3-20 атомов углерода, Fmoc, трет-boc, 9-флуоренацетильной группы, 1-флуоренкарбоксильной группы, 9-флуоренкарбоксильной группы, 9-флуоренон-1-карбоксильной группы, бензилоксикарбонила, ксантила (Xan), тритила (Trt), 4-метилтритила (Mtt), 4-метокситритила (Mmt), 4-метокси-2,3,6-триметилбензолсульфонила (Mtr), мезитилен-2-сульфонила (Mts), 4,4-диметоксибензгидрила (Mbh), тозила (Tos), 2,2,5,7,8-пентаметилхроман-6-сульфонила (Рmc), 4-метилбензила (MeBzl), 4-метоксибензила (MeOBzl), бензилоксигруппы (BzlO), бензила (Bzl), бензоила (Bz), 3-нитро-2-пиридинсульфенила (Npys), 1-(4,4-диметил-2,6-диоксоциклогексилиден)этила (Dde), 2,6-дихлорбензила (2,6-DiCl-Bzl), 2-хлорбензилоксикарбонила (2-Cl-Z), 2-бромбензилоксикарбонила (2-Br-Z), бензилоксиметила (Воm), циклогексилоксигруппы (сНхО), трет-бутоксиметила (Bum), трет-бутокси-группы (tBuO), трет-бутила (tBu), ацетила (Ас), пропиловой группы, бутиловой группы, пентиловой группы, гексиловой группы, N-метилантранилила, полиэтиленгликоля (ПЭГ) и трифторацетила (TFA).
В ряде вариантов осуществления данное изобретение представляет пептид, который облегчает один или более симптомов воспалительного состояния, причем пептид: имеет длину в интервале от приблизительно 3 до приблизительно 10 аминокислот; включает последовательность аминокислот, где последовательность содержит кислые и основные аминокислоты, чередующиеся с ароматическими, гидрофобными или незаряженными полярными аминокислотами; включает гидрофобные концевые аминокислоты или концевые аминокислоты, несущие гидрофобную защитную группу, и не является последовательностью LAEYHAK (SEQ ID NO:2), включающей все L-аминокислоты; причем пептид превращает провоспалительный ЛВП в противовоспалительный ЛВП или делает противовоспалительный ЛВП более противовоспалительным. Пептид может необязательно включать одну или более D-аминокислот и/или одну или более защитных групп, например, как описано выше.
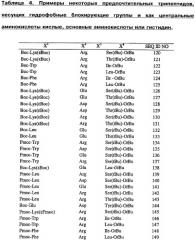
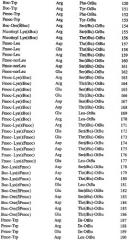
В различных вариантах осуществления данное изобретение представляет пептид, который облегчает один или более симптомов воспалительного состояния, причем пептид включает последовательность аминокислот пептида, находящегося, например, в Таблицах 3 или 14, или его конкатемера. В ряде вариантов осуществления пептид включает по меньшей мере одну D-аминокислоту, в ряде вариантов осуществления пептид включает все D-аминокислоты. В различных вариантах осуществления пептид дополнительно или альтернативно включает по меньшей мере одну защитную группу (например, защитную группу на каждом конце). Некоторые подходящие защитные группы включают, но без ограничения перечисленным, амид, алкильные группы из 3-20 атомов углерода, Fmoc, трет-boc, 9-флуоренацетильную группу, 1-флуоренкарбоксильную группу, 9-флуоренкарбоксильную группу, 9-флуоренон-1-карбоксильную группу, бензилоксикарбонил, ксантил (Xan), тритил (Trt), 4-метилтритил (Mtt), 4-метокситритил (Mmt), 4-метокси-2,3,6-триметил-бензолсульфонил (Mtr), мезитилен-2-сульфонил (Mts), 4,4-диметоксибензгидрил (Mbh), тозил (Tos), 2,2,5,7,8-пентеметилхроман-6-сульфонил (Рmc), 4-метилбензил (MeBzl), 4-метоксибензил (MeOBzl), бензилоксигруппу (BzlO), бензил (Bzl), бензоил (Bz), 3-нитро-2-пиридинсульфенил (Npys), 1-(4,4-диметил-2,6-диоксоциклогексилиден)этил (Dde), 2,6-дихлорбензил (2,6-DiCl-Bzl), 2-хлорбензилоксикарбонил (2-Cl-Z), 2-бромбензилоксикарбонил (2-Br-Z), бензилоксиметил (Воm), циклогексилокси-группу (сНхО), трет-бугоксиметил (Bum), трет-бутокси-группу (tBuO), трет-бутил (tBu), ацетил (Ас), пропиловую группу, бутиловую группу, пентиловую группу, гексиловую группу, N-метилантранилил, полиэтиленгликоль (ПЭГ), трифторацетил (TFA) и т.п.
В ряде вариантов осуществления данное изобретение представляет пептид, который облегчает один или более симптомов воспалительного состояния, причем: пептид включает последовательность аминокислот, выбранную из группы, состоящей из DMT-Arg-Phe-Lys (SEQ ID NO:1), DMT-Arg-Glu-Leu (SEQ ID NO:2), Lys-Phe-Arg-DMT (SEQ ID NO:3) и Leu-Glu-Arg-DMT (SEQ ID NO:4), где DMT представляет собой диметилтирозин. К тому же пептид может включать по меньшей мере одну D-аминокислоту и/или по меньшей мере одну защитную группу, например, как описано выше. В ряде вариантов осуществления пептид представляет собой Вос-диметилтирозин-D-Arg-Phe-Lys (OtВu) (SEQ ID NO:5) или Вос-диметилтирозин-Arg-Glu-Leu (OtBu) (SEQ ID NO:6).
В данном изобретении рассматривают также фармацевтические препараты, включающие любые активные агенты (например, пептиды, органические молекулы и т.п.), описанные в данном контексте, и фармацевтически приемлемый наполнитель. В ряде вариантов осуществления активный агент представляет собой пептид, и пептид приготовлен как препарат с высвобождением в определенное время. В ряде вариантов осуществления препарат приготовлен в виде унифицированного дозированного препарата. В ряде вариантов осуществления препарат приготовлен для введения путем, выбранным из группы, состоящей из перорального введения, назального введения, ректального введения, внутрибрюшинной инъекции, внутрисосудистой инъекции, подкожной инъекции, чрескожного введения, ингаляционного введения и внутримышечной инъекции.
Данное изобретение представляет также способы лечения или профилактики такого состояния, как атеросклероз, рестеноз, коронарное осложнение, ассоциированное с острой фазой ответа на воспаление у млекопитающего, или диабет, причем способ включает введение нуждающемуся в этом млекопитающему одного или более активных агентов (например, пептидов), описанных в данном контексте. В ряде вариантов осуществления активный агент находится в фармацевтически приемлемом наполнителе (например, наполнителе, пригодном для перорального введения) и/или может быть приготовлен в виде унифицированного дозированного препарата. В различных вариантах осуществления применение включает введение активного агента(ов) путем, выбранным из группы, состоящей из перорального введения, назального введения, ректального введения, внутрибрюшинной инъекции, внутрисосудистой инъекции, подкожной инъекции, чрескожного введения и внутримышечной инъекции. В различных вариантах осуществления млекопитающее представляет собой млекопитающее животное (например, человека), у которого диагностирован один или более симптомов атеросклероза, и/или диагностирован риск возникновения инсульта или атеросклероза, и/или имеется или существует риск возникновения коронарного осложнения, ассоциированного с острой фазой ответа на воспаление, и/или имеется или существует риск развития рестеноза, и/или имеется или существует развития риск диабета.
Представлен также активный агент (например, пептид), как описано в данном контексте, предназначенный для применения при лечении состояния, выбранного из группы, состоящей из атеросклероза, рестеноза, коронарного осложнения, ассоциированного с острой фазой ответа на воспаление, у млекопитающего и диабета. В ряде вариантов осуществления данное изобретение представляет применение активного агента (например, пептида), как описано в данном контексте, для изготовления лекарственного средства для терапевтического или профилактического лечения состояния, выбранного из группы, состоящей из атеросклероза, рестеноза, коронарного осложнения, ассоциированного с острой фазой ответа на воспаление, у млекопитающего и диабета.
В ряде вариантов осуществления данное изобретение также представляет стент для доставки лекарственных препаратов в сосуд в теле, включающий: каркас стента, включающий множество образованных в нем резервуаров, и один или более активных агентов, как описано в данном контексте (например, в Таблицах 1-15), и/или маленькие органические молекулы, как описано в данном контексте, находящиеся в резервуарах. В различных вариантах осуществления активный агент представляет собой пептид, включающий последовательность аминокислот 4F (SEQ ID NO:13). В различных вариантах осуществления активный агент содержится в полимере. В ряде вариантов осуществления каркас стента включает металлическую основу (например, из такого материала, как нержавеющая сталь, нитинол, тантал, сплав MP35N, платина, титан, подходящий биосовместимый сплав, подходящий биосовместимый полимер и их комбинация). Резервуары могут необязательно включать микропоры и в ряде вариантов осуществления микропоры, когда они присутствуют, имеют диаметр приблизительно 20 микрон или меньше. В различных вариантах осуществления микропоры, когда они присутствуют, имеют диаметр в интервале от приблизительно 20 микрон до приблизительно 50 микрон. В различных вариантах осуществления микропоры, когда они присутствуют, имеют глубину в интервале от приблизительно 10 до приблизительно 50 микрон. В различных вариантах осуществления микропоры проходят через каркас стента, имея отверстие на внутренней поверхности стента и отверстие на наружной поверхности стента. В ряде вариантов осуществления стент, кроме того, включает закрывающий слой, расположенный на внутренней поверхности каркаса стента, причем закрывающий слой покрывает по меньшей мере часть сквозных отверстий и обеспечивает барьерное свойство для контроля скорости выделения лекарственного препарата из полимера с лекарственным препаратом из внутренней поверхности каркаса стента. В ряде вариантов осуществления резервуары содержат каналы, проходящие вдоль наружной поверхности каркаса стента. В ряде вариантов осуществления полимер включает первый слой полимера с первым лекарственным препаратом, содержащим первый активный агент, соответствующий настоящему изобретению, и полимерный слой, содержащий полимер со вторым лекарственным препаратом, включающим активный агент или другой фармацевтический препарат. В различных вариантах осуществления барьерный слой может быть помещен между полимерными слоями, включающими активный агент(ы), или на поверхности полимерного слоя. В различных вариантах осуществления с каркасом стента соединен катетер. Катетер может необязательно включать средства для расширения стента, например баллон, используемый для расширения стента, капсулу, которая втягивается, обеспечивая расширение стента, и т.п.
Данное изобретение также представляет способ изготовления стента из полимера с лекарственным препаратом, заключающийся в: получении каркаса стента, вырезании множества резервуаров в каркасе стента, нанесении композиции, содержащей один или более активных агентов, описанных в данном контексте, на по меньшей мере один резервуар и высушивании композиции. Способ может далее необязательно включать нанесение полимерного слоя на высушенную композицию и высушивание полимерного слоя.
В ряде вариантов осуществления данное изобретение представляет способ лечения сосудистого состояния, заключающийся в: помещении стента (как описано в данном контексте) в сосуд в теле, расширении стента и выделении по меньшей мере одного активного агента из по меньшей мере одной поверхности стента.
Предложены также способы синтеза различных пептидов, описанные в данном контексте. В ряде вариантов осуществления данное изобретение представляет способ синтеза пептида, причем способ включает: получение по меньшей мере 3 субпоследовательностей различных пептидных фрагментов пептида и связывание субпоследовательностей пептидных фрагментов в жидкой фазе с образованием пептида. В ряде вариантов осуществления длина пептида лежит в интервале от 6 до 37 аминокислот. В ряде вариантов осуществления длина пептида составляет 18 остатков. В ряде вариантов осуществления пептид включает амфипатическую спираль класса А. В различных вариантах осуществления пептид включает последовательность аминокислот D-W-F-K-A-F-Y-D-K-V-A-E-K-F-K-E-A-F (SEQ ID NO:13). В различных вариантах осуществления все три субпоследовательности пептидных фрагментов имеют длину по 6 аминокислот каждая. В ряде вариантов осуществления три субпоследовательности пептидных фрагментов имеют последовательности: D-W-F-K-A-F (SEQ ID NO:645), Y-D-K-V-A-E (SEQ ID NO:646) и K-F-K-E-A-F (SEQ ID NO:647). В ряде вариантов осуществления пептид включает все D-аминокислоты.
Определения
Термины "выделенный", "очищенный" или "биологически чистый", касательно выделенного полипептида, относятся к материалу, который в существенной мере или в основном свободен от компонентов, которые в норме сопровождают его, как обнаружено в его нативном состоянии. Касательно нуклеиновых кислот и/или полипептидов, термин может относиться к нуклеиновым кислотам или полипептидам, которые более не фланкируются последовательностями, как правило, фланкирующими их в естественных условиях. Химически синтезированные полипептиды являются "выделенными", поскольку их не обнаруживают в нативном состоянии (например, в крови, сыворотке и т.п.). В ряде вариантов осуществления термин "выделенный" указывает на то, что полипептид не обнаруживают в естественном состоянии.
Термины "полипептид", "пептид" и "белок" используют взаимозаменяемо в данном контексте в отношении полимера остатков аминокислот. Термины применяют к полимерам аминокислот, в которых один или более остатков аминокислот представляет собой искусственный химический аналог соответствующей естественной аминокислоты, а также к естественным полимерам аминокислот.
Термин "амфипатический спиральный пептид" относится к пептиду, включающему по меньшей мере одну амфипатическую спираль (амфипатический спиральный домен). Некоторые амфипатические спиральные пептиды, соответствующие данному изобретению, могут включать две или более (например, 3, 4, 5 и т.п.) амфипатические спирали.
Термин "амфипатическая спираль класса А" относится к белковой структуре, которая формирует α-спираль, приводящую к сегрегации полярных и неполярных наружных поверхностей с положительно заряженными остатками, находящимися на разделе полярного и неполярного участков, и отрицательно заряженными остатками, находящимися в центре полярной наружной поверхности (см., например, статью Segrest et al. (1990) Proteins: Structure, Function, and Genetics 8:103-117).
"Аполипопротеин J" (apo J) известен под множеством названий, включая кластерин, TRPM2, GP80 и SP 4040 (см. Fritz (1995) стр.112 в монографии: Clusterin: Role in Vertebrate Development, Function, and Adaptation (Кластерин - роль в развитии, функции и адаптации позвоночных животных) (под ред. Harmony JAK), R.G. Landes, Georgetown, TX). Он был впервые описан как гетеродимерный гликопротеин и компонент секретируемых белков культивируемых клеток Сертоли крыс (см. статью Kissinger et al. (1982) Biol Reprod; 27:233-240). Транслируемый продукт представляет собой одноцепочечный белок-предшественник, который подвергается внутриклеточному расщеплению с образованием связанных дисульфидом α-субъединицы молекулярной массы 34 кД и β-субъединицы молекулярной массы 47 кД (см. статью Collard and Griswold (187) Biochem., 26:3297-3303). Он ассоциирован с повреждением клетки, транспортом липидов, апоптозом и может участвовать в очистке клеточного дебриса, вызываемого повреждением или гибелью клетки. Показано, что кластерин связывается с рядом молекул с высокой аффинностью, в том числе с липидами, пептидами и белками и гидрофобным зондом 1-анилино-8-нафталинсульфонатом (см. статью Bailey et al. (2001) Biochem., 40:11828-11840).
Амфипатическая спираль класса G обнаружена в глобулярных белках и, вследствие этого, получила название класс G. Признаком данного класса амфипатической спирали является то, что он имеет случайное распределение положительно заряженных и отрицательно заряженных остатков на полярной наружной поверхности при наличии узкой неполярной наружной поверхности. Вследствие узкой неполярной наружной поверхности данный класс легко не ассоциируется с фосфолипидом (см. статью Segrest et al. (1990) Proteins: Structure, Function, and Genetics. 8:103-117; см. также статью Erratum (1991) Proteins: Structure, Function and Genetics, 9:79). Ряд заменяемых аполипопротеинов обладает аналогичными, но не идентичными с амфипатической спиралью G характеристиками, данный другой класс имеет случайное распределение положительно и отрицательно заряженных остатков на полярной наружной поверхности. Однако, в противоположность амфипатической спирали класса G, которая имеет узкую неполярную наружную поверхность, данный класс имеет широкую неполярную наружную поверхность, которая позволяет данному классу с легкостью связывать фосфолипид, и данный класс обозначают G*, чтобы отличить его от класса G амфипатической спирали (см. статью Segrest et al. (1992) J. Lipid Res., 33: 141-166; см. также раздел Anantharamaiah et al. (1993) стр.109-142 в монографии The Amphipathic Helix, под ред. Epand R.M., CRC Press, Boca Raton, Florida). Компьютерные программы для идентификации и классификации амфипатических спиральных доменов описаны в статье Jones et al. (l992) J. Lipid Res. 33: 287-296, и включают, но без ограничения перечисленным, программу витков спирали (WHEEL или WHEEL/SNORKEL), программу сети спирали (HELNET, HELNET/SNORKEL, HELNET/Angle), программу для введения витков спирали (COMBO или COMBO/SNORKEL), программу для введения сетей спирали (COMNET, COMNET/SNORKEL, COMBO/SELECT, COMBO/NET), консенсусную программу витков (CONSENSUS, CONSENSUS/SNORKEL) и т.п.
Термин "облегчение" при использовании касательно "облегчения одного или более симптомов атеросклероза" относится к уменьшению, предупреждению или устранению одного или более симптомов, характерных для атеросклероза и/или ассоциированных патологий. Данное уменьшение включает, но без ограничения перечисленным, восстановление или удаление окисленных фосфолипидов, уменьшение образования и разрушение атеросклеротических бляшек, уменьшение числа клинических событий, таких как сердечный приступ, стенокардия или инсульт, уменьшение гипертензии, снижение уровня биосинтеза воспалительного белка, снижение уровня холестерина в плазме и т.п.
Термин "энантиомерные аминокислоты" относится к аминокислотам, которые могут существовать по меньшей мере в двух формах, которые представляют собой не накладывающиеся одно на другое зеркальные изображения друг друга. Большинство аминокислот (за исключением глицина) являются энантиомерными и существуют в так называемой L-форме (L-аминокислота) или D-форме (D-аминокислота). Большинство природных аминокислот являются "L"-аминокислотами. Термины "D-аминокислота" и "L-аминокислота" используют в отношении абсолютной конфигурации аминокислоты, а не определенного направления вращения плоскополяризованного света. Использование в данном контексте соответствует стандартному использованию компетентными специалистами в области техники. Аминокислоты обозначают в данном контексте, используя стандартные 1-буквенные или трехбуквенные коды, например, как обозначают в Стандарте ST.25 в Handbook On Industrial Property Information and Documentation (Справочник по информации и документации Промышленной собственности (орган ВОИС)).
Термин "защитная группа" относится к химической группе, которая, будучи присоединенной к функциональной группе в аминокислоте (например, к боковой цепи, α-аминогруппе, α-карбоксильной группе и т.п.), блокирует или маскирует свойства данной функциональной группы. Предпочтительные амино-концевые защитные группы включают, но без ограничения перечисленным, ацетильные или аминогруппы. Другие амино-концевые защитные группы включают, но без ограничения перечисленным, алкильные цепи, как в жирных кислотах, пропеонил, формил и др. Предпочтительные карбоксильные концевые защитные группы включают, но без ограничения перечисленным, группы, которые формируют амиды или сложные эфиры.
Выражение "защищает фосфолипид от окисления окисляющим агентом" относится к способности соединения снижать уровень окисления фосфолипида (или количество образованного окисленного фосфолипида), когда данный фосфолипид контактирует с окисляющим агентом (например, пероксидом водорода, 13-(S)-HPODE, 15-(S)-HPETE, HPODE, HPETE, HODE, НЕТЕ и т.п.).
Термины "липопротеин низкой плотности" или "ЛНП" определяют в соответствии с обычным применением компетентными специалистами в данной области. Как правило, ЛНП относится к комплексу липид-белок, когда его выделяют ультрацентрифугированием, находится в интервале плотности d=1,019 - d=1,063.
Термины "липопротеин высокой плотности" или "ЛВП" определяют в соответствии с обычным применением компетентными специалистами в данной области. Как правило, ЛВП относится к комплексу липид-белок, когда его выделяют ультрацентрифугированием, находится в интервале плотности d=1,063 - d=1,21.
Термин "ЛВП группы I" относится к липопротеину высокой плотности или его компонентам (например, аро A-I, параоксоназе, ацетилгидролазе фактора активации тромбоцитов и т.п.), которые восстанавливают окисленные липиды (например, в липопротеинах низкой плотности) или которые защищают окисленные липиды от окисления окисляющими агентами.
Термин "ЛВП группы II" относится к ЛВП, который представляет пониженную активность или отсутствие активности при защите липидов от окисления или при репарации (например, восстановлении) окисленных липидов.
Термин "компонент ЛВП" относится к компоненту (например, молекулам), который включает липопротеин высокой плотности (ЛВП). Анализы на ЛВП, который защищает липиды от окисления или который репарирует (например, восстанавливает окисленные липиды), также включают анализы на компоненты ЛВП (например, аро A-I, параоксоназу, ацетилгидролазу фактора активации тромбоцитов и т.п.), которые проявляют данную активность.
Термин "человеческий пептид аро A-I" относится к человеческому пептиду аро A-I полной длины или к его фрагменту или домену, включающим амфипатическую спираль класса А.
Термин "реакция моноцитов", как используют в данном контексте, относится к активности моноцитов, характеризующей "воспалительную реакцию", ассоциированную с образованием атеросклеротических бляшек. Реакция моноцитов характеризуется адгезией моноцитов к клеткам стенки сосуда (например, клеткам сосудистого эндотелия), и/или хемотаксисом в субэндотелиальное пространство, и/или дифференцировкой моноцитов в макрофаги.
Термин "отсутствие изменения" касательно количества окисленного фосфолипида означает отсутствие определяемого изменения, более предпочтительно отсутствие статистически значимого изменения (например, по меньшей мере на доверительном уровне 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 98% или 99%). Отсутствие определяемого изменения может также относиться к анализам, в которых уровень окисленного фосфолипида изменяется, но не в такой степени, как в отсутствие белка(ов), описанного в данном контексте, или относительно других положительных или отрицательных контролей.
В данном контексте используют следующие сокращения: РАРС: L-α-1-пальмитоил-2-арахидоноил-sn-глицеро-3-фосфохолин; POVPC: 1-пальмитоил-2-(5-оксовалерил)-sn-глицеро-3-фосфохолин; PGPC: 1-пальмитоил-2-глутарил-sn-глицеро-3-фосфохолин; PEIPC: 1-пальмитоил-2-(5,6-эпоксиизопростан Е2)-sn-глицеро-3-фосфохолин; ChC18:2: холестериллинолеат; ChC18:2-ООН: холестериллинолеат гидропероксид; DMPC: 1,2-дитетрадеканоил-rac-глицерол-3-фосфохолин; РОN: параоксоназа; HPF: стандартизованное поле под большим увеличением; РАРС: L-α-1-пальмитоил-2-арахидоноил-sn-глицеро-3-фосфохолин; BL/6: C57BL/6J; C3H:C3H/HeJ.
Термин "консервативная замена" используют в отношении белков или пептидов, чтобы отразить замены аминокислот, которые существенно не изменяют активность (специфичность (например, в отношении липопротеинов) или аффинность связывания (например, для липидов или липопротеинов)) молекулы. Как правило, консервативные замены аминокислот включают замену одной аминокислоты другой аминокислотой с близкими химическим свойствами (например, зарядом или гидрофобностью). Каждая из следующих шести групп включает аминокислоты, которые представляют собой типичные консервативные замены друг для друга: 1) аланин (А), серин (S), треонин (Т); 2) аспарагиновая кислота (D), глутаминовая кислота (Е); 3) аспарагин (N), глутамин (Q); 4) аргинин (R), лизин (K); 5) изолейцин (I), лейцин (L), метионин (М), валин (V) и 6) фенилаланин (F), тирозин (Y), триптофан (W).
Термины "идентичный" или процент "идентичности" в контексте двух или более последовательностей нуклеиновых кислот или полипептидов относятся к двум или более последовательностям или субпоследовательностям, которые одинаковы или имеют определенный процент остатков аминокислот или нуклеотидов, которые одинаковы при сравнении и выравнивании для получения максимального соответствия, как измеряют, используя один или следующие алгоритмы сравнения последовательностей или путем визуальной проверки. Касательно пептидов, соответствующих данному изобретению, идентичность последовательностей определяют для полной длины пептида.
При сравнении последовательностей, как правило, одна последовательность служит эталонной последовательностью, с которой сравнивают тест-последовательности. При использовании алгоритма сравнения последовательностей тест- и эталонную последовательности вводят в компьютер, если необходимо, задают координаты субпоследовательностей и задают параметры программы алгоритма последовательности. Затем алгоритм сравнения последовательностей рассчитывает процент идентичности последовательностей для тест-последовательности(ей) относительно эталонной последовательности на основе заданных параметров программы.
Можно провести оптимальное выравнивание последовательностей для сравнения, например, посредством алгоритма локальной гомологии, предложенного в статье Smith & Waterman, Adv. Appl. Math. 2:482 (1981), посредством алгоритма выравнивания гомологий, предложенного в статье Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), посредством исследования методом аналогий, предложенным в статье Pearson & Lipman (1988) Proc. Natl. Acad. ScL USA 85:2444, с помощью компьютеризированных осуществлений данных алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics Software Package, Genetics Computer Группа, 575 Science Dr., Madison, WI) или путем визуальной проверки (см. в основном Ausubel et al., выше).
Одним из примеров используемого алгоритма является PILEUP. PILEUP создает выравнивание множества последовательностей из группы родственных последовательностей, используя прогрессивные попарные выравнивания, чтобы показать родство и процент идентичности последовательностей. Он также строит древо или дендрограмму, показывающую образование кластеров связей, используемых для создания выравнивания. В PILEUP используют упрощение метода прогрессивного выравнивания, предложенного в статье Feng & Doolittle (1987) J. Mol. Evol. 35:351-360. Используемый метод аналогичен методу, описанному в статье Higgins & Sharp (1989) CABIOS 5:151-153. Программа может проводить выравнивание до 300 последовательностей, максимальной длины 5000 нуклеотидов или аминокислот каждая. Процедуру множественного выравнивания начинают с попарного выравнивания двух наиболее близких последовательностей, получая кластер их двух выровненных последовательностей. Затем данный кластер подвергают выравниванию со следующей наиболее близкой последовательностью или кластером выровненных последовательностей. Два кластера последовательностей выравнивают простым удлинением попарного выравнивания двух отдельных последовательностей. Конечное выравнивание получают серией постепенных попарных выравниваний. Программу осуществляют обозначением специфических последовательностей и координат их аминокислот или нуклеотидов на участках сравнения последовательностей и обозначением параметров программы. Например, эталонную последовательность можно сравнить с другими тест-последовательностями с целью определения родства по проценту идентичности последовательностей, используя следующие параметры: вес гэпа по умолчанию (3,00), вес длины гэпа по умолчанию (0,10) и взвешенные концевые гэпы.
Другим примером алгоритма, который подходит для определения процента идентичности последовательностей и близости последовательностей, является алгоритм BLAST, который описан в статье Altschul et al. (1990) J. Mol. Biol. 215:403-410. Программа для проведения анализов BLAST имеется в открытом доступе в National Center for Biotechnology Information (Национальный центр информации в области биотехнологии) (http://www.ncbi.nlm.nih.gov/). Данный алгоритм включает, во-первых, идентификацию часто встречающихся пар последовательностей (HSPs) посредством обнаружения коротких групп символов длины W в запрашиваемой последовательности, которые либо соответствуют, либо удовлетворяют некоторому значению Т положительно оцениваемого порога при выравнивании с группой символов такой же длины в последовательности базы данных. Т соответствует пороговому значению результата для соседних групп символов (см. статью Altschul et al., выше). Данные наиболее распространенные исходные соседние группы символов работают как затравки для начала поиска с целью обнаружения более длинных включающих их HSPs. Затем наиболее распространенные группы символов удлиняют в обоих направлениях вдоль последовательности настолько, насколько может быть увеличено кумулятивное выравнивание. Кумулятивные показатели баллов рассчитывают, используя для нуклеотидных последовательностей параметры М (поощрительный балл для пары совпадающих остатков; всегда >0) и N (штрафной балл для несовпадающих остатков; всегда <0). Для последовательностей аминокислот используют матрицу баллов, чтобы рассчитать кумулятивный показатель баллов. Удлинение наиболее распространенных групп символов в каждом направлении прекращают, когда: кумулятивный показатель баллов выравнивания снижается до количества Х от своей максимально достигнутой величины; кумулятивный показатель баллов доходит до нуля или ниже вследствие накопления одного или более выравниваний остатков с отрицательным результатом или достигнут конец любой из последовательностей. Параметры алгоритма BLAST W, Т и Х определяют чувствительность и скорость выравнивания. В программе BLASTN (для нуклеотидных последовательностей) используют по умолчанию длину группы символов (W) 11, ожидание (Е) 10, М=5, N=-4 и сравнение обеих нитей. Для последовательностей аминокислот в программе BLASTP используют по умолчанию длину группы символов (W) 3, ожидание (Е) 10 и матрицу баллов BLOSUM62 (см. статью Henikoff & Henikoff (1989) Proc. Natl. Acad. ScL USA 89: 10915).
Кроме расчета процента идентичности последовательности алгоритм BLAST проводит также статистический анализ близости двух последовательностей (см., например, статью Karlin & Altschul (1993) Proc. Natl. Acad. Sci. USA, 90:5873-5787). Одной из единиц измерения близости, представляемой алгоритмом BLAST, является минимальная суммарная вероятность (Р(N)), которая представляет собой показатель вероятности, с которой могло бы случайно встречаться соответствие двух нуклеотидных или аминокислотных последовательностей. Например, считают, что нуклеиновая кислота близка эталонной последовательности, если минимальная суммарная вероятность при сравнении анализируемой нуклеиновой кислоты с эталонной нуклеиновой кислотой меньше чем приблизительно 0,1, более предпочтительно меньше чем приблизительно 0,01 и наиболее предпочтительно меньше чем приблизительно 0,001.
Краткое описание чертежей
На Фигуре 1 представлено сравнение эффекта D4F (см. статью Navab, et al. (2002) Circulation, 105:290-292) и пептида 336 аро J, полученного из D-аминокислот (D-J336*), на предупреждение ЛНП-индуцированной активности хемотаксиса моноцитов in vitro в эксперименте с соинкубированием. Данные представляют собой среднее ±SD числа мигрирующих моноцитов в девяти полях под большим увеличением микроскопа в культурах в