Способ определения показателя суммарной антиоксидантной активности биологических объектов методом катодной вольтамперометрии
Иллюстрации
Показать всеИзобретение относится к области медицины и описывает вольтамперометрический способ определения суммарной активности антиоксидантов, включающий процесс восстановления вещества на электроде в растворе электролита, где в качестве модельной реакции используют процесс электровосстановления кислорода, который проводят на стеклоуглеродном электроде на фоне фосфатный буфер рН 6,86 в водной среде, 0.1М NaClO4 в апротонной среде или 0.9% NaCl в сыворотке крови, регистрацию катодных волн одноэлектронного восстановления кислорода ведут в режиме дифференцирования при скорости развертки потенциала 50 мВ/с, суммарную антиоксидантную активность определяют по относительному изменению тока электровосстановления кислорода в интервале потенциалов от 0 до 1.0 В от времени взаимодействия суммарного содержания антиоксидантов в образце с кислородом и его активными радикалами (t), используя кинетический критерий. Способ позволяет повысить чувствительность, точность, экспрессность определения, требует небольшой пробоподготовки, используя растворенный в фоновом растворе кислород. Кроме того, способ позволяет оценить оптимальные дозы того или иного препарата, обладающие наибольшей антиоксидантной активностью, определить стабильность исследуемых образцов во времени. 1 пр., 3 табл., 2 ил.
Реферат
Способ относится к области определения суммарной антиоксидантной активности в биологических объектах. Способ может быть использован для определения суммарной антиоксидантной активности сыворотки крови, гомогенатов тканей человека и животных, что в свою очередь позволяет по данному показателю оценивать общий антиоксидантный статус организма, эффективность лечения и профилактики оксидативного стресса организма (недостаток антиоксидантов).
В данной области известны различные способы определения суммарной активности антиоксидантов.
Известен электрохимический способ определения суммарной антиоксидантной способности объектов искусственного и природного происхождения, который заключается в кулонометрическом титровании общего количества антиоксидантов в объектах электрогенерированным бромом. По результатам титрования рассчитывают величину бромной антиоксидантной способности, мерой которой служит количество электричества в кулонах, отнесенных к 100 г (100 мл) образца (И.Ф.Абдуллин, Е.Н.Турова, Г.К.Будников. Кулонометрическая оценка антиоксидантной способности экстрактов чая электрогенерированным бромом. // Журнал аналитической химии, 2001, т.56, №6, с.627-629).
Недостатком метода является то, что данный способ позволяет исследовать лишь водорастворимые формы антиоксидантов и те из них, которые реагируют с бромом. Кроме того, для исследований требуется не менее 100 г (100 мл) исследуемого образца.
Известен способ циклической вольтамперометрии для оценки суммарной антиоксидантной активности образцов, который заключается в съемке циклических вольтамперограмм аскорбиновой кислоты. Изменение величины площади под анодным пиком окисления аскорбиновой кислоты в присутствии антиоксидантов служило основной величиной для определения суммарной антиоксидантной способности образцов (S.Chevion, М.А.Roberts, M.Chevion. The use of cyclic voltammetry for the evaluation of antioxidant capacity.// Free radical biology and medicine, 2000, v.28, N 6, p.860-870).
Недостатком способа является небольшая точность и воспроизводимость метода, т.к. аскорбиновая кислота сама окисляется со временем в растворе. Кроме того, данный способ предполагает использование высокоэффективной жидкостной хроматографии в сочетании с электрохимическим детектированием, что усложняет метод, делает его дорогостоящим.
Наиболее близок к теме изобретения вольтамперометрический способ определения суммарной антиоксидантной активности (Короткова Е.И., Карбаинов Ю.А. Вольтамперометрический способ определения активности антиоксидантов. // Патент РФ №2224997 от 6.06.2002 г.) - прототип.
Сущность метода состоит в съемке вольтамперограмм тока электровосстановления кислорода на ртутно-пленочном электроде в трехэлектродной электрохимической ячейке. В качестве электрода сравнения и вспомогательного электрода использовались хлорид-серебряные электроды. По результатам вольтамперограмм строился график зависимости относительного изменения тока электровосстановления кислорода в присутствии антиоксидантов от концентрации антиоксиданта в растворе. Тангенс угла наклона этой зависимости и служил критерием суммарной антиоксидантной активности объектов исследования.
Недостатком этого способа явилось использование металлической ртути в качестве рабочего электрода, что является небезопасным при проведении анализа. Кроме того, измерения необходимо было проводить в одном концентрационном диапазоне для всех типов антиоксидантов, тогда как широко известно, что ряд антиоксидантов активны в разных концентрационных диапазонах и их нельзя сравнивать друг с другом, используя данный критерий.
Задачей данного изобретения является разработка эффективного, экспрессного, универсального способа определения суммарной антиоксидантной активности биологических объектов на стеклоуглеродном электроде, используя кинетический критерий оценки показателя суммарной антиоксидантной активности биологических объектов.
Поставленная задача решается вольтамперометрическим способом определения суммарной активности антиоксидантов, включающим процесс восстановления вещества на электроде в растворе электролита, отличающийся тем, что в качестве модельной реакции используют процесс электровосстановления кислорода, который проводят на стеклоуглеродном электроде на фоне фосфатный буфер pH 6,86 в водной среде, 0.1 М NaClO4 в апротонной среде или 0.9% NaCl в биологических объектах, регистрацию катодных волн одноэлектронного восстановления кислорода ведут в режиме дифференцирования при скорости развертки потенциала 50 мВ/с, суммарную антиоксидантную активность определяют по относительному изменению тока электровосстановления кислорода в интервале потенциалов от 0 до -1.0 В от времени взаимодействия суммарного содержания антиоксидантов в образце с кислородом и его активными радикалами (t), используя кинетический критерий.
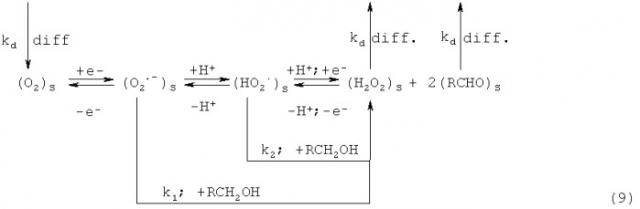
В основе способа лежит процесс электровосстановления кислорода, протекающий на стеклоуглеродном электроде при средних значениях скорости развертки потенциала (V=20-80 мВ/с) в несколько стадий с генерацией на поверхности электрода активных форм кислорода:
Суммарный процесс:
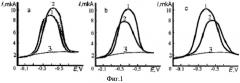
При оценке влияния природы антиоксидантов на процесс электровосстановления кислорода было замечено, что они по-разному влияют на данный процесс, при этом сами не являясь электрохимически активными в данной области потенциалов (Е=-0.1÷-0.9 B). В таблице 1 приведены исследуемые антиоксиданты и БАВ как искусственного, так и природного происхождения, условно разделенные на 3 группы, различающиеся по характеру влияния на процесс ЭВ O2. На фиг.1 приведены вольтамперограммы, характеризующие влияние антиоксидантов различных групп на процесс ЭВ O2.
Первая группа веществ увеличивает ток ЭВ O2 и сдвигает потенциал в сторону отрицательных значений (каталаза) (фиг.1а). К данной группе относится фермент антиоксидантной природы (каталаза), а также гуминовые кислоты, порфирины, фталоцианины металлов. Все эти вещества очень разные по своей природе, однако их объединяет одно общее свойство: все они относятся к металлокомплексам, имея в своей структуре ионы переходных металлов. Это свойство как раз и обуславливает каталитический характер влияния на процесс ЭВ O2. Сдвиг потенциала полуволны тока ЭВ O2 в отрицательную область позволил предположить наличие механизма EC* с последующей реакцией диспропорционирования продукта реакции и частичной регенерацией деполяризатора: молекулярного кислорода:
Данный механизм можно назвать каталитическим или ферментативным.
Вторая группа веществ наиболее многочисленная и изучена более подробно, т.к. именно эти вещества относят к классическим антиоксидантам и их широко используют в качестве добавок в пищевой, косметической, фармацевтической промышленности. Все из указанных веществ уменьшали ток ЭВ O2, сдвигая потенциал в положительную область (фиг.1b), проявляя механизм ЕС с последующими химическими реакциями взаимодействия антиоксидантов с активными кислородными радикалам:
Данный механизм можно назвать антирадикальным.
Третья группа веществ также уменьшает ток ЭВ O2, но сдвигает потенциал в отрицательную область (фиг.1c), увеличивая перенапряжение процесса. Предполагается, что вещества этой группы взаимодействуют преимущественно по СЕ механизму с молекулярным кислородом, растворенным в электролите, или СЕС механизму с предшествующей и последующей химическими реакциями взаимодействия антиоксиданта с молекулярным кислородом и продуктами его восстановления:
Данный механизм можно трактовать как антиокислительный.
Таким образом, в зависимости от характера протекания процессов и вида вольтамперограмм можно выделить преимущественный механизм взаимодействия антиоксидантов с кислородом и/или его активными радикалами.
Для расчета суммарной антиоксидантной активности используем кинетический критерий.
К-кинетический критерий отражает количество активных кислородных радикалов, прореагировавших с антиоксидантом (или суммарным содержанием антиоксидантов биологического объекта) за минуту времени. Размерность: мкмоль/л·мин.
Формула:
где I - ток электровосстановления кислорода в присутствии сыворотки крови в растворе, мкА, I0 - ток электровосстановления кислорода в отсутствии сыворотки крови в растворе, мкА, C0 - исходная концентрация кислорода в фоновом растворе, мкмоль/л, t - время протекания реакции, мин. Тангенс угла наклона полученной зависимости, умноженный на исходную концентрацию молекулярного кислорода в растворе (справочная величина), является показателем суммарной антиоксидантной активности исследуемого биологического объекта.
В качестве сравнения был взят метод спектрофотометрии, широко используемый в биохимических исследованиях для определения суммарной антиоксидантной активности объектов. Спектрофотометрическая методика (СФМ) определения антиоксидантной активности основывалась на способности антиоксидантов конкурировать с нитросиним тетразолием (НСТ) за супероксидные анион радикалы кислорода, образующиеся в результате аэробного взаимодействия восстановленной формы никотинамидадениндинуклеотида (НАД·Н) и феназинметасульфата (ФМС). В результате этой реакции НСТ восстанавливается с образованием формазана (синего цвета). В присутствии антиоксидантов процент восстановления НСТ уменьшается.
Количественные параметры протекающей реакции определяются путем измерения оптической плотности реакционной смеси при длине волны 560 нм.
В таблице 2 представлены результаты сравнительных определений показателя суммарной антиоксидантной активности сыворотки крови здорового человека (выборка из 50 результатов), измеренного двумя различными методами.
Полученные результаты хорошо коррелируют между собой. Однако спектрофотометрическая методика показала заниженные результаты, что также подтверждалось и на образцах стандартных антиоксидантов. Вольтамперометрическая методика определения показателя суммарной антиоксидантной активности сыворотки крови человека оказалась более чувствительной, удобной в работе, требовала меньше реактивов для проведения анализа и меньшей пробоподготовки, что, несомненно, указывало на ее конкурентные преимущества.
В данном исследовании использовалась сыворотка крови 10-ти пациентов мужского пола, в возрасте от 23 до 42 лет с диагнозом синдрома алкогольной зависимости 2 ст., 10-ти пациентов мужского пола в возрасте от 30 до 40 лет с диагнозом шизофрении, 10-ти пациентов мужского пола в возрасте от 40 до 50 лет с диагнозом депрессии, проходивших стационарное лечение в областной психиатрической больнице г.Томска. В ходе эксперимента троекратно брали кровь на анализ в течение 10 дней в процессе лечебных мероприятий. Методика проведения исследований была идентична.
При исследовании суммарной АОА сыворотки крови пациентов с диагнозом алкоголизма использовался метод катодной вольтамперометрии. В таблице 3 представлены результаты определения показателя суммарной АОА сыворотки крови пациентов с диагнозом алкоголизма 2 ст. по 10-ти пациентам.
На фиг.2 представлены результаты зависимости средних значений показателя суммарной антиоксидантной активности сыворотки крови больных алкоголизмом в динамике лечения.
Низкая антиоксидантная активность сыворотки крови пациентов при поступлении в стационар (К=0,181±0,042 мкмоль/л·мин), по-видимому, объясняется депрессивным состоянием организма после периода длительного употребления алкоголя. Токсические эффекты этанола истощают протекторные системы крови. Снижение суммарной антиоксидантной активности сыворотки после ряда внутривенных вливаний (полиионная смесь), вероятно, связано с повышением общей гидратации организма и понижением уровня веществ антиоксидантной природы (К=0.092±0,014 мкмоль/л·мин). На завершающем этапе лечения (6-9 день пребывания в стационаре) наблюдалось значительное повышение суммарной АОА сыворотки крови для всех исследуемых пациентов, что объясняется детоксикацией организма, восстановлением нормального уровня питания пациентов, устранением вегетативных расстройств (реланиум, витамины C, E, A, B6) и в целом улучшением соматического состояния пациентов. Вероятно, это связано с увеличением секреции веществ антиоксидантной природы (аскорбиновая кислота, токоферол, мочевая кислота) в крови больных алкоголизмом. Однако необходимо отметить, что даже на заключительном этапе терапии средний уровень суммарной антиоксидантной активности сыворотки больных алкоголизмом (0,625±0,044 мкмоль/л·мин) оставался значимо ниже аналогичного показателя здоровых доноров (0,9-1,1 мкмоль/л·мин). В этой связи представляется оправданным более широкое использование антиоксидантов в терапии больных алкоголизмом и продолжение исследований данного направления.
Для пациентов, больных шизофренией, получены следующие данные по оценке суммарной антиоксидантной активности сыворотки крови, представленные в таблице 3.
Показатель суммарной антиоксидантной активности сыворотки крови пациентов в патологии шизофрении до лечения существенно ниже, чем для здоровых людей (таблица 2). В процессе 10-ти дней лечения данный показатель немного увеличивается, но в значительно меньшей степени, чем при заболевании алкоголизмом. Это косвенно говорит о том, что при патологии шизофрении меняется нормальный метаболизм организма, что ведет к необратимым последствиям. Но положительная динамика все же наблюдается в процессе лечения. Для более существенных выводов по эффективности лечения заболевания требуется более обширный статистический материал.
Выявлено также, что показатель суммарной антиоксидантной активности сыворотки крови человека зависит от длительности заболевания, возраста пациента. Например, в начальной стадии заболевания (пациент под шифром 6 в таблице 3) показатель антиоксидантной активности имеет значение, более близкое к показателю здорового человека.
Способ отличается наибольшей безопасностью, т.к. произошла замена ртутно-пленочного электрода на стеклоуглеродный.
Данный способ одинаково эффективен как в анализе биологических объектов (плазма, сыворотка крови), так и в водных и неводных (спиртовых, апротонных) средах экстрактах растений, продуктов питания и других объектов. Способ не требует длительной пробоподготовки. Достаточно перевести образец в растворимое состояние в водной, спиртовой или апротонной среде, поэтому способ экспрессен и не требует дорогостоящей аппаратуры. Для пробоподготовки сыворотки крови у пациентов в условиях клинической лаборатории осуществляли забор 5 мл венозной крови. Кровь помещали в бюкс, закрывали крышкой и устанавливали в центрифугу. Центрифугирование проводили при 1500 об/мин в течение 10 мин после этого кровь отслаивается от сыворотки и производят забор 2 мл сыворотки крови для анализа. Время проведения одного определения не более 15 минут. Способ не требует добавления в раствор посторонних веществ, т.к. используется растворенный кислород в исследуемом водном или неводном растворе. Ток электровосстановления кислорода в исходном растворе соответствует его растворимости в используемом растворителе при нормальных условиях.
Для определения суммарной антиоксидантной активности в данном способе используется метод катодной вольтамперометрии. В качестве прибора можно использовать полярограф или вольтамперометрический анализатор любого типа с подключенной к нему электрохимической ячейкой, состоящей из рабочего стеклоуглеродного электрода и хлорид-серебряного электрода сравнения, опущенных в раствор фонового электролита. В качестве фонового электролита для водных сред использовался фосфатный буфер pH 6,86, для апротонных сред 0.1 М NaClO4, для биологических объектов 0.9% NaCl (физиологический раствор).
Перед проведением эксперимента необходимо подготовить рабочий электрод: рабочую поверхность (стеклографитовую поверхность) обрабатывают в течение (1-2) с концентрированной азотной кислотой, промывают дистиллированной водой и проводят очистку поверхности при помощи лезвия или липкой ленты путем удаления верхних поверхностных слоев.
Подготовленные электроды хранить в чистом сухом стаканчике.
Подготовленные к работе рабочий стеклоуглеродный электрод и хлорид-серебряный электрод сравнения опускаются в раствор фонового электролита (5 мл) и подключаются к прибору. Исследуемые образцы переводят в растворимое состояние в водной, спиртовой или апротонной среде, растворяя 1 г (1 мл) образца в 50-100 мл растворителя.
Методика эксперимента заключается в съемке вольтамперограмм первой волны катодного тока электровостановления кислорода в области потенциалов от 0 до -0.1 B без добавления и с последующим добавлением приготовленного раствора исследуемого образца. Используется режим дифференциальной катодной вольтамперометрии, скорость развертки потенциала W=50 мВ/с. Устанавливают время 10-30 с - перемешивание раствора с помощью вибрации электродов и 10-30 с - успокоение раствора перед съемкой. Рекомендуется строго контролировать время перемешивания и успокоения раствора для повышения точности определения.
По результатам эксперимента строят график зависимости относительного тока электровосстановления кислорода от времени взаимодействия суммарного содержания антиоксидантов в образце с кислородом и его активными радикалами (t):
,
где I - текущее значение тока электровосстановления кислорода в присутствии образца в растворе, Io - ток электровосстановления кислорода в фоновом электролите в отсутствие образца в растворе (начальное значение), C - концентрация образца в растворе (г/мл), V - общий объем исследуемого раствора (мл). По данному графику выбирается линейный участок кривой (в области малых концентраций), тангенс угла наклона которого служит коэффициентом суммарной антиоксидантной активности образца (К).
| Таблица 1 | |||
| Способ определения показателя суммарной антиоксидантной активности биологических объектов методом катодной вольтамперометрии | |||
| № группы | 1 группа | 2 группа | 3 группа |
| Названия веществ | Металлокомплексы (каталаза, фталоцианины, порфирины металлов, гуминовые кислоты) | Соединения фенольной природы (витамины A, E, C, B, аскорбаты металлов, флавоноиды, кумарины, коэнзим Q10, экстракты растений) | N, S, Se - содержащие биологически активные вещества (Se содержащие БАД, производные антипирина и антипириламида) |
| Влияние на ЭВ O2 | Увеличение тока ЭВ O2, сдвиг потенциала в отрицательную область | Уменьшение тока ЭВ O2, сдвиг потенциала в положительную область | Уменьшение тока ЭВ O2, сдвиг потенциала в отрицательную область |
| Предполагаемый электродный механизм | Механизм ЕС* с последующей реакцией диспропорционирования | Механизм ЕС | Механизм СЕС |
| Примечание: E - электродная стадия процесса, C - химическая реакция. |
| Таблица 2 | |||
| Номер образца сыворотки крови человека без видимых патологий | К, мкмоль/л·мин | Δ, % | |
| спектрофотометрический метод | вольтамперометрический метод | ||
| 1 | 0.83 | 0.85 | 2.30 |
| 2 | 0.95 | 1.01 | 6.12 |
| 3 | 0.93 | 0.97 | 4.21 |
| 4 | 0.87 | 0.91 | 4.49 |
| 5 | 0.92 | 1.00 | 8.33 |
| Таблица 3 | |||
| Шифр пациента | К, мкмоль/л·мин | ||
| поступление в стационар | период детоксикации (2 дня в стационаре) | после 10-ти дней лечения в стационаре | |
| 1 | 0.11±0,04 | 0.08±0,02 | 0.82±0,03 |
| 2 | 0.21±0,03 | 0.11±0,04 | 0.81±0,05 |
| 3 | 0.02±0,01 | 0.02±0,01 | 0.15±0,04 |
| 4 | 0.41±0,03 | 0.12±0,04 | 0.72±0,04 |
| 5 | 0.25±0,05 | 0.15±0,02 | 0.63±0,03 |
| 6 | 0.32±0,02 | 0.11±0,03 | 0.54±0,06 |
| 7 | 0.02±0,01 | 0.02±0,01 | 0.44±0,04 |
| 8 | 0.32±0,05 | 0.13±0,05 | 0.65±0,05 |
| 8 | 0.21±0,04 | 0.13±0,04 | 0.75±0,04 |
| 10 | 0.04±0,02 | 0.04±0,01 | 0.35±0,03 |
Вольтамперометрический способ определения суммарной активности антиоксидантов, включающий процесс восстановления вещества на электроде в растворе электролита, отличающийся тем, что в качестве модельной реакции используют процесс электровосстановления кислорода, который проводят на стеклоуглеродном электроде на фоне фосфатный буфер рН 6,86 в водной среде, 0,1М NaCIO4 в апротонной среде или 0,9% NaCI в сыворотке крови, регистрацию катодных волн одноэлектронного восстановления кислорода ведут в режиме дифференцирования при скорости развертки потенциала 50 мВ/с, суммарную антиоксидантную активность определяют по относительному изменению тока электровосстановления кислорода в интервале потенциалов от 0 до 1,0 В от времени взаимодействия суммарного содержания антиоксидантов в образце с кислородом и его активными радикалами (t), используя кинетический критерий, отражающий количество активных кислородных радикалов, прореагировавших с антиоксидантом, или суммарным содержанием антиоксидантов биологического объекта за минуту времени: мкмоль/л мин где I - ток электровосстановления кислорода в присутствии сыворотки крови в растворе, мкА;I0 - ток электровосстановления кислорода в отсутствии сыворотки крови в растворе, мкА;С0 - исходная концентрация кислорода в фоновом растворе, мкмоль/л,t - время протекания реакции, мин;тангенс угла наклона полученной зависимости, умноженный на исходную концентрацию молекулярного кислорода в растворе (справочная величина), является показателем суммарной антиоксидантной активности исследуемого биологического объекта.