Способ устранения костных дефектов с восстановлением в них костной ткани
Иллюстрации
Показать всеИзобретение относится к медицине и может быть применимо для устранения костных дефектов. Закрепляют над костным дефектом биоинженерную конструкцию, которая представляет собой гибридный имплантат в виде пористой мембраны из политетрафторэтилена с многофункциональным, биосовместимым, нерезорбируемым покрытием МБНП, легированным элементами М-Са-Р-С-О-N, или М-Са-С-О-N, где М - металл, выбранный из ряда, включающего Ti, Zr, Hf, Mb, Та, на поверхности которого культивируют аутогенные или аллогенные стромальные клетки, выделенные из жировой ткани или костного мозга. Способ позволяет сформировать полноценный регенерат, обеспечить возможность замещения обширных костных дефектов. 2 з.п. ф-лы, 12 ил.
Реферат
Изобретение относится к области медицины, к разделу клеточных технологий с использованием биогибридных имплантатов из ряда биоинженерных конструкций для применения в черепно-мозговой хирургии и травматологии, а именно к способам устранения костных дефектов с восстановлением в них костной ткани, устранения костных дефектов различных отделов черепа или их поврежденных частей.
Проблемы хирургического устранения костных дефектов, особенно дефектов плоских костей черепа, в том числе костей свода черепа, являются одними из самых трудных в своем решении и остаются актуальными на современном этапе, поэтому применение клеточных технологий в сочетании с гибридными имплантатами в этой области медицины является своевременным и необходимым.
Известно устройство для эндопротезирования дефектов костей черепа и способ устранения костных дефектов, включающий закрытие дефекта пластиной с отверстиями для прорастания костной тканью и под крепежные элементы, при этом пластина выполнена из оксидированного металла толщиной 0,15-0,35 мм с возможностью конгруэнтного покрытия дефекта костей черепа, по всей площади пластины в шахматном порядке расположены перфорационные отверстия диаметром 1,5-2,0 мм с расстоянием между центрами в ряду 4 мм, а между рядами 3 мм, а фиксирующие элементы, выполненные в виде омегообразных скобок из металла с памятью формы, располагаются в упомянутых отверстиях по краю пластины (RU 2133113 С1, А61В 17/80, 20.07.1999).
Более усовершенствованный способ для закрытия дефектов костей свода черепа представлен в патенте RU 2308909 С1, А61АВ 2/28, 27.10.2007, с использованием устройства, которое состоит из круглой или овальной пластины, выполненной из оксидированного титана, с расположенными по всей площади пластины в шахматном порядке перфорационными отверстиями диаметром 1,5-2,0 мм с расстояниями между центрами в ряду 4 мм, а между рядами 3 мм для прорастания костной тканью и под крепежные элементы в виде омегообразных скобок из металла с памятью формы.
Известные устройства трудоемкие в исполнении, не обеспечивают стабильной остеоинтеграции вследствие их коррозирования и по этой же причине постепенно теряют качество высокой биосовместимости с костной тканью, что со временем приводит к отторжению имплантата.
Известен способ устранения дефектов костей, включающий удаление измененных тканей, заполнение дефекта трансплантатом и фиксацию его в области дефекта, при этом в качестве трансплантата используют пористый губчатый костный матрикс, заполненный (импрегнированный) аутологичными костномозговыми фибропластами, в концентрации не менее 107 клеток в 1 см3, выращенными в культуре (SU 1400616 A1, A61B 17/56, 07.06.1988). Известный способ успешно используется для лечения больных остеомиелитом. Однако использование губчатого костного матрикса ограничивает применение способа для устранения дефектов костей черепа.
Известен способ для хирургического лечения заболеваний внутренних органов с использованием имплантата, который содержит клеточную суспензию, помещенную в иммуноизолированное вместилище, выполненное в виде сплошного объема сферической или уплощенной формы из пористого никелида титана с поперечным размером пор, не превышающим 0,5 мкм, через которые осуществляется обмен веществ клеточной суспензии, соответствующей заболевшему органу, к которому не проникают иммунные клетки, поскольку их размеры превышают размеры пор (RU 2143867 С1, A61F 2/02, 10.01.2000). Известный способ направлен на лечение заболеваний внутренних органов и позволяет увеличить срок службы имплантата благодаря высокой биомеханической совместимости. Одним из недостатков имплантата является слабая поверхностная адгезия используемой клеточной культуры с недостаточно устойчивой ее фиксацией на поверхности никелида титана, что может привести к постепенной обратной диффузии культуры по сквозным каналам ячеек за пределы пористого каркаса. В известном патенте нет сведений об использовании заявленной конструкции для устранения костных дефектов. Что касается пористого никелида титана, то при его использовании в черепно-мозговой хирургии ему характерны те же недостатки, что и для изобретений RU 2133113 и RU 2308909.
Известен способ иммобилизации остеогенных стромальных стволовых клеток костного мозга на пористом каркасе, сущность которого заключается в следующем: культивацию остеогенных стромальных стволовых клеток костного мозга проводят после их выделения с высокой степенью очистки от сопутствующих форменных элементов из аспирата костного мозга без его предварительной механической и ферментативной обработки и применения микроносителей в монослойной культуре; поверхность пористого каркаса покрывают двойным протеиновым гидрофильным остеогенным слоем путем инкубации заготовки в растворе коллагена в уксусной кислоте и затем в среде DMEM, содержащей раствор желатиноля и β-глицерофосфат; пористый каркас представляет собой биологически инертный металлический сплав никелида титана с проницаемой сквозной пористой структурой с размерами ячеек 300-400 мкм и соединяющих их каналов 25-35 мкм в диаметре; суспензию очищенных и выращенных в монослойных культурах остеогенных стромальных стволовых клеток наносят на пористый каркас перед использованием ex tempore посредством диффузионного осаждения на гидрофильную проницаемую поверхность (RU 2329055 С2, А61K 35/28; C12N 5/08; A61F 2/02, 20.07.2007). Использование известного способа позволяет создать трехмерную монокультуру остеогенных стромальных стволовых клеток костного мозга с заданными параметрами количества и плотности форменных элементов с пролонгированной пролиферативной активностью и тканевой дифференцировкой для моделирования тканевой структуры и репаративной функции губчатой кости.
Полученную заготовку по известному изобретению из пористого никелида титана, пропитанную клеточной суспензией остеогенных стромальных стволовых клеток костного мозга, можно классифицировать как «биоинженерную конструкцию», обладающую высокими остеогенными свойствами. Однако известный имплантат обладает недостаточно высокой степенью адгезии по отношению к клеточной культуре, что ограничивает его использование в области челюстно-лицевой и черепно-мозговой хирургии. О других недостатках имплантата из металлического сплава было уже сказано выше.
Термин «биоинженерная конструкция» в медицине возник сравнительно недавно и распространен среди специалистов, практикующихся в области лечения дефектов костей с применением клеточной технологии (W. Zhang et al. "Reconstructing Mandibular Defects with Autologous Bioengineered Tooth and Bone"), по материалам журнала Science Daily, Apr. 5, 2008, портал «Вечная молодость» http://www.vechnayamolodost.ru/; У.В.Вольперт, О.О.Янушевич, А.С.Григорьян, Н.Н.Мальгинов, А.И.Воложин. «Заживление костных дефектов ветви нижней челюсти кроликов под биоинженерными конструкциями из титана и золотого сплава с ксеногенными мезенхимальными стволовыми клетками» // Стоматология, 2009, №1, с.30).
Авторы А.С.Григорьян и А.К.Топоркова монографии «Проблемы интеграции имплантатов в костную ткань» // Москва, Техносфера, 2007, с.8, так определяют термин биоинженерные конструкции: «биоинженерные конструкции (гибридные имплантаты) - это комплексы из «неживого» материала и живой материи, используемые для замещения утраченных органо-тканевых структур пациентов. При этом восполнение «отсутствующего» органо-тканевого образования осуществляется как за счет специфической структуры «неживой» подложки, так и за счет трансплантированной клеточной или тканевой составляющей биоинженерной конструкции».
Технической задачей предлагаемого изобретения является создание нового способа устранения костных дефектов с восстановлением в них костной ткани с использованием биоинженерной конструкции.
Техническим результатом способа является повышение степени адгезии, остеоинтеграции и биологической совместимости конструкции по отношению к живым тканями.
Технический результат достигается тем, что способ устранения костных дефектов с восстановлением в них костной ткани за счет индукции репаративного остеогенеза в области костных дефектов заключается в том, что в области дефекта удаляют костные осколки, помещают и закрепляют над костным дефектом биоинженерную конструкцию, которая представляет собой гибридный имплантат в виде пористой мембраны из политетрафторэтилена с многофункциональным, биосовместимым, нерезорбируемым покрытием МБНП, легированным элементами М-Са-Р-С-O-N или M-Ca-C-O-N, где М - металл, выбранный из ряда, включающего Ti, Zr, Hf, Nb, Та, на поверхности которого культивируют аутогенные или аллогенные стромальные клетки, выделенные из жировой ткани или костного мозга. В качестве легирующего металла покрытие имплантата содержит преимущественно титан, а размер пор мембраны из политетрафторэтилена составляет 200-500 мкм.
Гибридный имплантат, который включает основу (пористую мембрану) из политетрафторэтилена (ПТФЭ) и поверхностный слой покрытия толщиной не менее 50 мм, модифицированный легирующими элементами M-Ca-C-O-N, M-Ca-P-C-O-N, где М - Ti, Zr, Hf, Nb, Ta, получен авторами предлагаемого изобретения и защищен патентом RU 2325191 C1, A61L 27/06; 27/14, 27/56, 27.05.2008.
В указанном патенте представлены характеристики гибридных имплантатов на основе ПТФЭ с покрытием из культуры клеток, выделенной из кожно-мышечных фибробластов эмбрионов человека. В опытах in vitro с использованием люминесцентной микроскопии и метода сканирующей электронной микроскопии (СЭМ) было показано, что на поверхности нерезорбируемого полимерного материала политетрафторэтилена с покрытием при культивировании на них эмбриональных фибробластов происходят адгезия и распластывание клеток. На образцах имплантационного материала без покрытия эти процессы отсутствовали. Имплантаты из ПТФЭ с покрытием не токсичны, обладают высокой биосовместимостью, высоким остеоинтеграционным потенциалом к живым тканям, что свидетельствует о том, что они могут использоваться в качестве основы для создания биоинженерных конструкций (гибридных имплантатов), а сами покрытия можно определить как многофункциональные, биосовместимые, нерезорбируемые покрытия МБНП по отношению к живым тканями. МБНП получают путем магнетронного распыления соответствующих мишеней на поверхность пористого ПТФЭ.
Исходя из этих данных можно сделать вывод о перспективности использования в клинических условиях пористого ПТФЭ с МБНП в качестве абиологического носителя клеточной культуры в биоинженерных конструкциях для хирургического устранения дефектов костей, в частности костей черепа и его свода.
Следует отметить, что сам по себе ПТФЭ, являясь высокобиосовместимым нерезорбируемым пластическим материалом, обладающим высоким уровнем интеграции в тканевой среде, удобный, легкий и не подверженный коррозии, в отличие от металлических имплантатов, не может обеспечить адгезию клеток на его поверхности, что препятствует их культивированию на имплантатах из ПТФЭ. Эта проблема решается нанесением на поверхность ПТФЭ описанного выше покрытия.
Таким образом, термин «биоинженерные конструкции» подразумевает тип гибридных имплантатов, биологическая составляющая которых представлена клеточными популяциями, еще не вошедшими в стадию тканево-органной дифференциации.
Сущность предлагаемого способа заключается в следующем.
На поверхность МБНП абиологического гибридного имплантата из пористого ПТФЭ в виде мембраны культивируют клеточную культуру (популяцию). В данном изобретении клеточную популяцию культивировали из стромальных клеток жировой ткани (СКЖТ) кролика. Полученную биоинженерную конструкцию помещают и закрепляют над искусственно созданным дефектом, например, черепа кролика при постоянном наблюдении за состоянием животного.
Устранение дефекта проводили с использованием биоинженерной конструкции, которая представляла собой пористую мембрану гибридного имплантата из ПТФЭ с МБНП, содержащим Ti-Ca-C-O-N, с размерами пор ПТФЭ 200 мкм и Ti-Ca-P-C-O-N, с размерами пор ПТФЭ 500 мкм, МБНП, на поверхности которой была культивирована клеточная популяция из стромальных клеток жировой ткани.
С целью определения эффективности адгезии и роста клеток культуры на поверхности биоинженерных конструкций обеих групп наблюдений оценивали результаты эксперимента in vitro с помощью люминесцентной микроскопии и СЭМ.
Для оценки остеогенной дифференцировки клетки на МБНП сажали в концентрации 2,5×104 клеток/см2 в 6-луночные планшеты и культивировали до достижения конфлюэнтного слоя. Затем среду культивирования меняли на остеогенную. Дифференцировку клеток оценивали через 14 суток по гистологической окраске на активность щелочной фосфатазы (NBT/BCIP Stock solution (Roche Diagnostics)), окраске на кальцификацию внеклеточного матрикса (Alizarin Red S (Sigma)) и иммуногистохимическому окрашиванию на экспрессию остеогенных белков.
Для определения экспрессии клетками культуры различных белков использовалось иммунногистохимическое окрашивание антителами: антиостеопонтин, антиостеокальцин, антиостеонектин (Chemicon).
Клетки промывали фосфатно-солевым буфером (ФСБ) 3 раза, затем фиксировали в 4%-ном растворе параформальдегида (Fluka) в течение 15 мин. Далее клетки отмывали от фиксатора в течение 50 мин в 4-х сменах ФСБ (рН 7.4). Антитела разводили блокирующим раствором следующего состава: 5% бычьего сывороточного альбумина (Sigma), 0,1% Trition X-100 (Sigma) на 1 М растворе ФСБ в концентрациях, рекомендованных производителем антител. Препараты инкубировали с антителами в течение 12-16 часов при +4°С. Окрашивание вторыми антителами - Alexa-488 или А1еха-546 (Molecular Probe) - проводили согласно инструкции производителя.
Результаты культивирования клеток, на биоинженерной конструкции с наноструктурированным МБНП, легированным элементами Ti-Ca-C-O-N или Ti-Ca-P-C-O-N через 14 суток после культивирования в остсогенной среде, изученные с помощью люминесцентной микроскопии, показали, что поверхность имплантатов была покрыта биопленкой из фибропластоподобных клеток. На образце конструкции без покрытия клетки на поверхности имплантата отсутствуют.
На фиг.1 и 2 представлены электронограммы СЭМ биоинженерных конструкций на основе пористого ПТФЭ с МБНП, содержащим Ti-Ca-C-O-N (размер пор ПТФЭ составляет 200 мкм), фиг.1, и с МБНП, содержащим Ti-Ca-P-C-O-N (размер пор ПТФЭ составляет 500 мкм), фиг.2, на поверхности которого нанесена клеточная популяция.
Исследования с использованием СЭМ показали, что на поверхности биоинженерных конструкций располагаются многочисленные многоотросчатые распластавшиеся фибробластоподобные клетки, наделенные цитологическими характеристиками (фиг.1 и 2), на которых видно их плотное расселение на поверхности конструкции. На поверхности контрольных образцов без покрытия клетки отсутствовали.
Контрольные опыты с окраской клеток на щелочную фосфатазу показали, что СКЖТ кролика после 14 суток культивирования в остеогенной среде на МБНП биоинженерной конструкции образуют многослойные участки, где усиливается экспрессия щелочной фосфатазы - положительная окраска на активность щелочной фосфатазы.
Иммуногистохимический анализ экспрессии специфических белков остеогенеза выявил, что клетки находятся на начальных стадиях дифференцировки, поскольку обнаруживалась экспрессия остеопонтина и остеонектина. Экспрессия остеокальцина, позднего маркера остеогенной дифференцировки, отсутствовала.
При использовании в МБНП циркония и других металлов, указанных в формуле, были получены результаты, близкие к титану.
Анализ полученных данных подтверждает, что совокупность признаков, характеризующая биоинженерную конструкцию, обусловливает положительный эффект культивирования стромальных клеток из жировой ткани на поверхности конструкции. По условиям эксперимента высеянная на биоинженерной конструкции с МБНП культура клеток подвергалась со вторых суток и по 14-е культивирования остеогенетическому коммитированию.
Для использования биоинженерной конструкции in vivo в опытах на животных были предварительно изучены фенотипические характеристики популяций клеток на МБНП поверхности конструкции с предшественниками костных клеток (коммитированные стромальные клетки).
Известно, что предшественники костных клеток и сами остеобласты наделены рядом специфических фенотипических характеристик (Полежаев Л.В. Замещение дефектов черепа регенерирующей костью. // Вопр. нейрохир., 1982, т.2, 53-56). Одной из них является экспрессия костного изофермента щелочной фосфатазы. Кроме того, в клетках предшественниках остеогенной дифференцировки с помощью иммуногистохимических методов обнаруживаются остсопонтин, остеонектин и остеокальцин.
Согласно полученным данным, в клетках на поверхности образцов были обнаружены признаки экспрессии как щелочной фосфатазы, так и остеопонтина и остеонектина, однако реакция на остеокальцин была отрицательной.
Сущность способа культивирования клеток на МБНП конструкции заключается в следующем.
Аутологичные СКЖТ выделяли из подкожной жировой ткани паховой области у кроликов (объем жировой ткани до 5-6 см3).
Кусочки жировой ткани промывали в солевом растворе Хэнкса (Биолот) с антибиотиками (пенициллин 200 ед./мл, стрептомицин 200 ед./мл), затем измельчали ножницами и инкубировали в растворе 0.1% коллагеназы I типа (Worthington) при 37°С и постоянном перемешивании в течение 90 мин, фермент ингибировали добавлением 10% фетальной телячьей сыворотки (ФТС, Биолот). Зрелые адипоциты отделяли центрифугированием при 300g в течение 10 мин. Клеточный осадок 2 раза отмывали от фермента в среде DMEM (Sigma), содержащей 10% ФТС. Суспензию клеток фильтровали через нейлоновый фильтр и центрифугировали в градиенте плотности Histopaque-1077 (Sigma) при 400g в течение 30 мин при комнатной температуре для получения фракции мононуклеарных клеток. Суспензию клеток отмывали в среде DMEM три раза. Клетки культивировали до первого пассирования в среде DMEM, содержащей 20% сыворотки, затем культуры переводили на среду DMEM, содержащей 10% ФТС.
На 3-м пассаже культуры СКЖТ пассировали на имплантаты. Через 24 часа среду культивирования меняли на остеогенную и проводили остеогенную стимуляцию с помощью специфической культуральной среды следующего состава: среда DMEM, 10% ФТС, 0,01 мкМ 1,25-дигидроксивитамин D3 (Sigma), 50 мкМ аскорбат-2-фосфат (Sigma), 10 мМ β-глицерофосфат (Sigma). Смену среды проводили каждые 3 сут. В индукционной среде клетки культивировали в течение 14 дней. За сутки до операции, имплантаты с индуцированными к остеогенной дифференцировке СКЖТ кролика переводили на среду без сыворотки.
Таким образом, результаты проведенных испытаний свидетельствуют о том, что описанный способ получения биоинженерных конструкций на основе мембран из ПТФЭ с наноструктурированным покрытием (Ti-C-Ca-P-O-N) + стромальные клетки из жировой ткани или из костного мозга, включая предшественники стволовых клеток, коммитированные остеогенной стимуляцией, позволяет получить образцы, отвечающие требованиям дальнейших биомедицинских испытаний в опытах in vivo на модели экспериментально воспроизведенных дефектов теменной кости у кроликов.
Биоинженерные конструкции в опытах на животных
В опытах на лабораторных животных (кроликах) использовали экспериментальную модель для изучения остеоиндуцирующей потенции испытуемых материалов, а именно критические дефекты свода черепа кроликов 1×1×0,5 см, которые, как известно, спонтанно полностью не заживают.
В основной группе на поверхности свода черепа над костным дефектом указанных размеров двумя титановыми микровинтами фиксировали биоинженерные конструкции описанного выше типа с культурой аутогенных СКЖТ, предварительно полученных из жировой ткани подопытных животных и культивированных на мембранах (пластинах) из пористого ПТФЭ с покрытиями Ti-Ca-P-C-O-N (либо Ti-Ca-C-O-N). Величина пор ПТФЭ составляла 200 и 500 мкм, соответственно. В группе сравнения дефекты свода черепа закрывали абиологическими (без нанесения культуры клеток) гибридными имплантатами из ПТФЭ с покрытиями того же состава.
Тканевый материал, полученный из экспериментов, подвергали гистологической обработке, парафиновые срезы окрашивали гематоксилин-эозином и проводили их иммуногистохимическое изучение, используя маркеры-антитела на остеопонтин и остеокальцин с целью идентификации новообразованных костных структур, а также определения степени их дифференциации.
Результаты гистоморфологического и иммуногистохимического исследования тканевого материала с использованием биоинженерной конструкции представлены на фиг.3-8, а абиологического гибридного имплантата (контрольные опыты без клеточной популяции) представлены на фиг.9-12.
При использовании биоинженерной конструкции у подопытных животных в сроки 2 и 6 мес наблюдалось образование под биоинженерными конструкциями новой костной ткани, замещающей дефект кости, на всем их протяжении. На фиг.3 (×25) представлена микрофотограмма, на которой под биоинженерной конструкцией с культурой СКТЖ (сдвоенные стрелки) виден слой новообразованной костной ткани (стрелки углом), прикрывающей костный дефект.
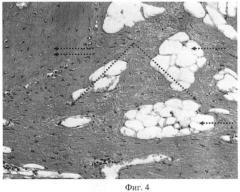
На фиг.4 (×100) представлена микрофотограмма, на которой видно, что новообразованная костная ткань, замещающая костный дефект, состоит из двух фракций: нижняя, прилежащая к дефекту кости, - это зрелая плотная костная субстанция (сдвоенные стрелки), и незрелая трабекулярная грубоволокнистая костная ткань (стрелки углом), прилежащая к мембране ПТФЭ, с преимущественно грубоволокнистым матриксом. Межтрабекулярные пространства заполнены жировой тканью (одинарные стрелки).
Следует заметить, что между описанными выше зрелой и низкодифференцированной костными формациями располагалась узкая полоска матрикса, пропитанного гомогенным оксифильным веществом остеоида (сдвоенные стрелки), что видно на микрофотограмме имплантата с культурой СКТЖ, фиг.5 (×400). В целом матрикс трабекулярных структур имел выраженное грубоволокнистое строение, фиг.6 (×200).
В поры ПТФЭ биоинженерной конструкции интенсивно прорастала клеточноволокнистая соединительная ткань, содержащая кровеносные сосуды. Нa значительном протяжении в порах ПТФЭ-основы в значительных количествах обнаруживались новообразованные костные трабекулы, местами они проникали в пористый имплантат на всю его глубину, что видно на микрофотограмме фиг.7 (×100).
На микрофотограмме фиг.8 (х200) видно прорастание костных структур (одинарные стрелки) в поры мембраны ПТФЭ с МБНП и культурой СЖТК. Снизу к мембране прилежит новообразованная костная ткань (стрелки углом), заполняющая костный дефект.
На микрофотограмме фиг.9 (×25) контрольного имплантата без культуры СКТЖ видно, что под пористой мембраной из ПТФЭ с МНБП (стрелки углом) располагается фиброзная пластинка (одинарные стрелки), закрывающая костный дефект. В поры мембраны ПТФЭ врастают тяжи грубоволокнистой соединительной ткани (сдвоенные стрелки). Т.е. в группе сравнения под абиологическими гибридными имплантатами в костных дефектах формируется фиброзная соединительнотканная пластинка, замещающая экспериментально воспроизведенный костный дефект.
На микрофотограмме имплантата без культуры СКТЖ помимо пластинки из грубоволокнистой соединительной ткани в костном дефекте можно видеть также участки рыхлой соединительной ткани, а также небольшие костные осколки, фиг.10 (×25). Дефект в кости прикрыт фиброзной пластинкой (стрелки углом). В дефекте виден костный осколок (одинарная стрелка).
На фиг.11 (×200) и фиг.12 (×200) представлены еще микрофотограммы (контроль) имплантатов без культуры СКТЖ. Видна фиброзная пластинка (одинарная стрелка на фиг.12), прикрывающая костный дефект, костные осколки (сдвоенные стрелки) в дефекте кости. Кое-где отмечалось врастание тяжи грубоволокнистой соединительной ткани в поры мембраны из ПТФЭ (одинарная стрелка). Пластинка из грубоволокнистой соединительной ткани (стрелки углом), прикрывающая костный дефект, и костный осколок (сдвоенные стрелки).
При гистохимическом исследовании биоинженерных конструкций с культурой СКТЖ показано, что с антителами на значительных участках грубоволокнистого матрикса незрелой трабекулярной кости обнаруживалась положительная реакция на остеопонтин, выражавшаяся в сером окрашивании костного матрикса.
В более зрелых участках кости по контрасту с соседними трабекулярными структурами реакция на остеопонтин была отрицательной. В прилежащих наслоениях остеоидного вещества эта реакция также была негативной.
Вещество костных структур в порах ПТФЭ было остепонтин-положительным.
Реакция на остеокальцин была слабо положительной в небольших участках зрелой костной ткани, определенно положительной в матриксе незрелых трабекулярных образований и очень яркой в костных структурах, развившихся в порах ПТФЭ.
Большая часть матрикса незрелой трабекулярной костной ткани дает негативную реакцию на остеокальцин, лишь в некоторых участках реакция слабо положительная (сдвоенные стрелки).
Матрикс новообразованной трабекулярной костной ткани метится маркером остеокальцина положительно, придавая его окраске серый оттенок.
Следует отметить, что в отдельных участках незрелых трабекулярных костных структур остеокальцин обнаруживался в цитоплазме вытянутых фибробластоподобных клеток, которые расценивались нами как активные остеогенные элементы.
Таким образом, приведенные данные показали, что под биоинженерными конструкциями из пористого ПТФЭ с МНБП (состава Ti-Ca-P-C-O-N либо Ti-Ca-C-O-N), фиксированными над критическими костными дефектами свода черепа кроликов, формируется полноценный костный регенерат, закрывающий на всем протяжении указанные дефекты. Это свидетельствует об исключительно высоком потенциале остсоиндукции, которым обладают биоинженерные конструкции, что подтверждает достижение технического результата.
Кроме того, из приведенных данных можно сделать вывод и о том, что уровень коммитирования клеток, который достигается при описанном методе культивирования СКЖТ, позволяет получить популяцию преостеобластически дифференцированных клеток, обладающую столь мощным остеогенетическим потенциалом, что его оказывается достаточно для того, чтобы осуществить регенерацию костной ткани в объемах критических костных дефектов свода черепа, костная ткань которого, как известно, обладает относительно низким репарационным потенциалом.
Таким образом, на основании полученных данных можно сделать вывод об использовании нового отечественного конкурентоспособного материала для хирургическою устранения обширных дефектов свода черепа и плоских костей лицевого скелета, что является прогрессивным шагом в области хирургической медицины.
1. Способ устранения костных дефектов с восстановлением в них костной ткани за счет индукции репаративного осгеогенеза в области костных дефектов, заключающийся в том, что над костным дефектом закрепляют биоинженерную конструкцию, которая представляет собой гибридный имплантат в виде пористой мембраны из политетрафторэтилена с многофункциональным, биосовместимым, нерезорбируемым покрытием МБНП, легированным элементами М-Са-Р-С-О-N, или М-Са-С-О-N, где М металл, выбранный из ряда, включающего Ti, Zr, Hf, Nb, Та, на поверхности которого культивируют аутогенные или аллогенные стромальные клетки, выделенные из жировой ткани или костного мозга.
2. Способ по п.1, отличающийся тем, что в качестве легирующего металла покрытие имплантата содержит преимущественно титан.
3. Способ по п.1, отличающийся тем, что размер нор мембраны из политетрафторэтилена составляет 200-500 мкм.