Антагонисты cxcl13 и их применение для лечения воспалительных заболеваний
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к терапии, и может быть использовано для лечения нарушений, связанных с активностью CXCL13 в клетке, ткани, органе или организме животного, где нарушения представляют собой хроническое обструктивное заболевание легких (COPD) или системную красную волчанку. Для этого в клетку, ткань, орган или организм животного вводят антагонист CXCL13 в количестве, эффективном для ингибирования активности CXCL13 совместно с антагонистом TNFα в количестве, эффективном для ингибирования активности TNFα в указанной клетке, ткани, органе или организме животного. Группа изобретений позволяет лечить хроническое обструктивное заболевание легких и системную красную волчанку за счет совместного использования моноклональных антител, специфических для CXCL13 и TNFα, что ведет к уменьшению инфильтрации В-клеток, экспрессирующих CD4, а также снижает связанное с гломерулонефритом содержание белка в моче у животного с симптомами системной красной волчанки. 2 н. и 17 з.п.ф-лы, 8 ил., 3 табл., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к антагонистам CXCL13 и способу применения антагонистов CXCL13 для лечения легочных нарушений, симптомов и состояний, а также родственных заболеваний и состояний. Более конкретно, изобретение относится к способам лечения таких заболеваний путем применения антагонистов CXCL13 отдельно или вместе с антагонистами TNFα, таких как интерферирующие РНК, ДНКзимы и антитела против CXCL13, включая определенные участки или варианты, специфические, по меньшей мере, в отношении одного белка или его фрагмента, в количестве, эффективном для ингибирования активности CXCL13. Настоящее изобретение также относится к способу применения антагонистов CXCL13 и антагонистов TNFα для лечения животного с другими воспалительными заболеваниями, такими как системная красная волчанка.
Уровень техники
Астма представляет собой комплексное, хроническое заболевание с генетическим и природным компонентом (1). Оно характеризуется обратимой обструкцией дыхательных путей, гиперреактивностью дыхательных путей, воспалением и ремоделированием дыхательных путей (2). Установлено, что астмой страдает 15 миллионов американцев, и заболеваемость и смертность, ассоциированные с ней, возрастают в промышленно развитых странах (3, 4). Воспаление дыхательных путей у астматиков-аллергиков связано с инфильтрацией на слизистой субпопуляции CD4+ Т-клеток, относящихся к Т-хелперным клеткам (Th)2, и эозинофилов (5, 6). Взаимодействие между данными клетками приводит к продукции различных медиаторов провоспаления, вовлеченных в патогенез астмы (7, 8). Другими формами астмы являются такие формы, которые возникают в результате больших нагрузок, воздействия вирусов, приема аспирина и у людей определенных профессий. Несмотря на то, что в механизме, ответственном за развитие данных форм астмы, могут принимать участие Th2-лимфоциты и цитокины, он может «запускаться» различным образом (9-12). Многие цитокины и хемокины вовлечены в патогенез астмы (13, 14). В частности, цитокины Th2-клеток (интерлейкин 4, 5, 9 и 13) играют важную роль в развитии аллергических заболеваний, включая астму.
Хроническое обструктивное заболевание легких (COPD) является хроническим воспалением легких, характеризующимся инфильтрацией нейтрофилов, макрофагов, В- и Т-клеток. Данные иммунокомпетентные клетки активируются под воздействием различных цитокинов и хемокинов, которые высвобождаются в легких в ответ на длительное воздействие токсических газов и частиц (15). Бронхит и эмфизема, наряду с необратимой обструкцией дыхательных путей, являются клиническими проявлениями заболевания. Отсутствуют известные средства, которые замедляли бы быструю потерю функции легких, характерную для COPD.
Недавно было установлено, что прогрессирование COPD тесно связано с паренхимальной инфильтрацией естественными и адаптивными иммунными клетками воспаления, образующими эктопические лимфоидные фолликулы, содержащие герминативный центр. Наличие лимфоидных фолликулов связано с процессом ремодуляции, в результате которого утолщаются стенки дистальных малых отделов дыхательных путей (16). На основании этих данных можно с уверенностью предположить о возможной патологической роли эктопических лимфоидных фолликулов в развитии COPD.
При попытке выявить новые гены, вовлекаемые в патогенез астмы, исследователи использовали технологию ДНК-микроматриц для определения профиля генов, различным образом экспрессирующихся на животных моделях астмы (17, 18). Технология микроматриц представляет собой эффективный инструмент, поскольку она позволяет провести анализ экспрессии тысяч генов одновременно, а также ее можно автоматизировать с получением высокопроизводительного формата. При многофакторных заболеваниях, таких как астма, результаты анализа с помощью микроматриц могут обеспечить профиль экспрессии генов, который может оказаться очень полезным при разработке новых лекарственных препаратов. Также было показано, что она является очень действенной для идентификации новых генов и получения информации для генов с неизвестной функцией (19).
CXCL13 (также известный как BLC (хемокин хоминга В-клеток) или ВСА-1 (хемокин 1-аттрактант В-клеток) или Angie 2)) представляет собой хемотактический фактор, который является наиболее сильным и избирательным аттрактантом В-клеток. Он также способствует миграции некоторых Т-клеток и макрофагов через рецептор CXCR5 (20). CXCL13 экспрессируется в фолликулах пейеровских бляшек, селезенки и лимфатических узлов, и полагают, что он имеет значение для развития и гомеостаза фолликулов (21).
В течение ряда лет наблюдали, что в местах хронического воспаления структура воспалительного инфильтрата (Т-, В-клетки и стромальные клетки) имеет общие структурные признаки с лимфоидной тканью, при этом образуются так называемые эктопические лимфоидные фолликулы (21). Кроме того, высокая эктопическая продукция CXCL13 ассоциирована со скоплением лимфоцитов и образованием эктопических лимфоидных фолликулов при хронических воспалительных заболеваниях, таких как ревматоидный артрит (21), синдром Шенгрена (22), различные формы волчанки, такие как системная красная волчанка (23, 24), язвенный колит (25, 26), рассеянный склероз (27-29), диабет 1 типа (30-32) и аутоиммунные заболевания щитовидной железы (33, 34). Несмотря на то, что точная патогенетическая роль эктопических лимфоидных фолликулов не ясна, имеются данные, на основании которых можно предположить о значении последних в переходе из острого в хроническое, устойчивое воспаление за счет локального скопления лимфоцитов в воспаленной ткани (35). Следовательно, разрушение или элиминация эктопических лимфоидных фолликулов будет обеспечивать новый лечебный подход в отношении воспалительных заболеваний. CXCL13 представляет идеальную модель для терапии за счет его высокой экспрессии в эктопических лимфоидных фолликулах и его роли в поддержании микроструктуры и привлечении В-клеток.
Системная красная волчанка (SLE или волчанка) представляет собой хроническое аутоиммунное заболевание, которое потенциально является разрушающим и в некоторых случаях фатальным, поскольку иммунная система атакует собственные клетки и ткани организма, приводя к развитию воспаления и повреждению тканей. SLE может поражать любой орган в организме, но чаще всего страдают сердце, суставы, кожа, легкие, кровеносные сосуды, печень, почки и нервная система.
Ген CXCL13 (номер доступа в GenBank No. NM_006419, SEQ ID NO:1) находится в хромосоме 4q21 человека. CXCL13 относится к семейству хемокинов СХС. CXCL13 имеет ключевое значение для формирования/развития лимфоидных органов, образования фолликулов из В-клеток и рекрутинга В-клеток. Он эктопически продуцируется на высоком уровне в воспаленных тканях при многих хронических воспалительных заболеваниях, и полагают, что он играет важную роль в поддержании локальной активации В- и Т-клеток и воспаления.
Экспрессию генов можно модулировать несколькими различными путями, включая применение миРНК (siRNA), мшРНК (shRNA), антисмысловых молекул и ДНКзимов. Как миРНК, так и мшРНК функционируют через путь, связанный с РНКи (RNAi), и их успешно используют для подавления экспрессии генов. Вначале РНКи открыли в гельминтах, и сообщение Fire и Mello о явлении «сайленсинга» гена, связанного с дсРНК (dsRNA), первоначально касалось растений, и полагали, что оно представляет путь борьбы с инфекцией, вызванной РНК-содержащими вирусами, у растительных клеток. На данном пути длинный вирусный продукт дсРНК процессируется в более мелкие фрагменты размером 21-25 п.о. под действием DICER-подобного фермента, и затем двухцепочечная молекула разворачивается и превращается в РНК-индуцированный сайленсинг-комплекс (RISC). Аналогичный путь был выявлен в клетках млекопитающих с заметной разницей, заключающейся в том, что размер молекул дсРНК должен быть менее чем 30 п.о., чтобы избежать индукции так называемого ответа интерферона, который не является ген-специфическим и приводит к полному прекращению синтеза белка в клетке.
Можно сконструировать синтетические миРНК, конкретно нацеленные на один ген, и их можно легко ввести в клетки in vitro или in vivo. мшРНК являются ДНК-эквивалентами молекул миРНК, и они обладают тем преимуществом, что включаются в геном клеток и затем реплицируются во время каждого митотического цикла.
ДНКзимы также использовали для модуляции экспрессии гена. ДНКзимы представляют собой каталитические молекулы ДНК, расщепляющие одноцепочечную РНК. Они являются высоко избирательными для последовательности РНК-мишени, и в результате этого их можно использовать для снижения экспрессии определенных генов посредством направленного воздействия на матричную РНК.
Следовательно, имеется потребность в идентификации и характеристике новых способов диагностики и лечения, связанных с CXCL13, для легочных нарушений, таких как астма, и связанных с заболеваниями и состояниями. Кроме того, существует потребность в идентификации и характеристике новых способов лечения заболеваний, таких как системная красная волчанка.
Сущность изобретения
Настоящее изобретение относится к агонистам и/или антагонистам CXCL13 или его рецептора, CXCR5, и/или одному или обоим их действиям (далее «антагонисты CXCL13») и способу применения антагонистов CXCL13, включая антитела против CXCL13 и их определенные участки или варианты, специфические, по меньшей мере, для одного белка CXCL13 или его фрагмента, для лечения связанных с легкими заболеваний. Данные антагонисты CXCL13 можно вводить вместе с антагонистами TNFα, такими как антитела к TNFα, например, инфликсимаб и другие. Антагонист CXCL13, такой как моноклональное антитело, подавляет локальный рекрутинг В- и Т-клеток и последующую активацию с обеспечением новой стратегии для борьбы с хроническими воспалительными заболеваниями, опосредованными иммунной системой.
В одном варианте осуществления антагонист CXCL13 представляет собой антитело, которое специфически связывается с CXCL13 или его рецептором. Конкретное преимущество таких антител заключается в том, что они способы связываться с CXCL13 или его рецептором таким образом, что предотвращается их действие. Таким образом, в способе по настоящему изобретению используются антитела, обладающие желательным нейтрализующим свойством, которое делает их идеально подходящими для медикаментозной и профилактической терапии болезненных состояний, ассоциированных с различными нарушениями, связанными с легкими, у человека и не относящихся к человеку пациентов. Следовательно, настоящее изобретение относится к способу лечения связанного с легкими заболевания или состояния у пациента, нуждающегося в таком лечении, который включает введение пациенту количества нейтрализующего CXCL13 антитела для подавления связанного с легкими заболевания или состояния.
В другом аспекте изобретение относится к способам модуляции активности CXCL13 или его рецептора, включающим контактирование клетки со средством (например, антагонистом или агонистом), которое модулирует (ингибирует или стимулирует) активность или экспрессию CXCL13 или его рецептора таким образом, что активность или экспрессия в клетке модулируется. В предпочтительном варианте осуществления таким средством является антитело, которое специфически связывается с CXCL13 или его рецептором. В других вариантах осуществления модулятором является пептид, пептидомиметик или другая малая молекула.
В другом варианте осуществления настоящее изобретение относится к способу лечения связанного с легкими заболевания или состояния у пациента, нуждающегося в таком лечении, который включает введение пациенту количества нейтрализующего CXCL13 антитела или другого антагониста вместе с одним или несколькими антагонистами TNFα для ингибирования связанного с легкими заболевания или состояния.
Настоящее изобретение также относится к способам лечения субъекта, страдающего легочным или родственным заболеванием, в которых заболевание можно купировать модуляцией количества или активности CXCL13. Также настоящее изобретение относится к способам лечения субъекта, страдающего заболеванием, характеризующимся аномальной активностью CXCL13 или кодирующего его полинуклеотида, путем введения субъекту средства, которое является модулятором активности CXCL13 или модулятором экспрессии CXCL13.
В одном варианте осуществления модулятором является полипептид или соединение с малой молекулой. В другом варианте осуществления модулятором является полинуклеотид. В конкретном варианте осуществления антагонист CXCL13 представляет молекулу миРНК, молекулу мшРНК или ДНКзим, способные предупреждать продукцию CXCL13 клетками.
Другим аспектом изобретения является способ лечения животного с системной красной волчанкой, включающий введение антагониста CXCL13 животному и введение антагониста TNF-альфа животному; в котором каждый антагонист вводят в количестве, эффективном для того, чтобы вызвать ослабление симптома системной красной волчанки у животного. В одном варианте осуществления данного способа антагонист CXCL13 представляет собой связывающееся с CXCL13 антитело или связывающийся с CXCL13 фрагмент антитела, и антагонист TNF-α представляет собой связывающееся с TNF-α антитело или связывающийся с TNF-α фрагмент антитела.
В другом варианте осуществления данного способа животное представляет собой млекопитающее. В другом варианте осуществления данного способа млекопитающим является человек. В еще одном варианте осуществления данного способа вводимое количество каждого антитела или связывающего фрагмента антитела составляет от примерно 25 мг на кг массы тела животного до примерно 40 мг на кг массы тела животного. В еще одном варианте осуществления данного способа симптомом системной красной волчанки является количество периартериальных очагов лимфоцитарных инфильтратов, обнаруженных при исследовании тканей почек. В еще одном варианте осуществления данного способа симптомом системной красной волчанки является соотношение общего белка в моче к общему креатинину в моче. В еще одном варианте осуществления данного способа антагонист CXCL13 представляет собой связывающееся с CXCL13 антитело или связывающийся с CXCL13 фрагмент антитела, и антагонист TNF-α представляет собой связывающееся с TNF-α антитело или связывающийся с TNF-α фрагмент антитела. В еще одном варианте осуществления данного способа антагонист CXCL13 представляет собой связывающееся с CXCL13 антитело или связывающийся с CXCL13 фрагмент антитела, и антагонист TNF-α представляет собой связывающееся с TNF-α антитело инфликсимаб.
Настоящее изобретение дополнительно обеспечивает любое изобретение, описанное в данном документе.
Краткое описание фигур
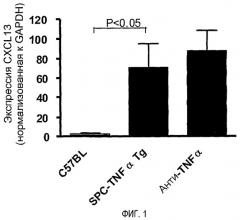
На фигуре 1 показано, что уровни транскриптов мРНК CXCL13 повышены в пораженных тканях легких.
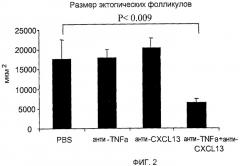
На фигуре 2 показано, что совместное лечение моноклональными антителами, специфичными для TNF-α и CXCL13, ослабляет симптомы заболевания легких, как определено по размеру эктопических фолликулов в пораженных тканях легких.
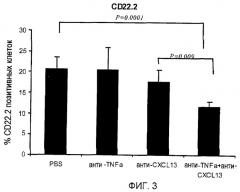
На фигуре 3 показано, что совместное лечение моноклональными антителами, специфичными для TNF-α и CXCL13, уменьшает инфильтрацию В-клеток, экспрессирующих CD22.2, в ткани легких.
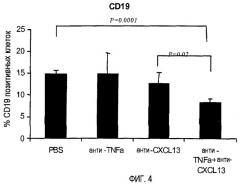
На фигуре 4 показано, что совместное лечение моноклональными антителами, специфичными для TNF-α и CXCL13, уменьшает инфильтрацию В-клеток, экспрессирующих CD19, в ткани легких.
На фигуре 5 показано, что совместное лечение моноклональными антителами, специфичными для TNF-α и CXCL13, уменьшает инфильтрацию В-клеток, экспрессирующих CD45R/B220, в ткани легких.
На фигуре 6 показано, что совместное лечение моноклональными антителами, специфичными для TNF-α и CXCL13, уменьшает инфильтрацию В-клеток, экспрессирующих CD4, в ткани легких.
На фигуре 7 показано, что совместное введение mAb, специфичных для CXCL13 и TNF-α, снижает связанное с гломерулонефритом содержание белка в моче мышей NZB/W F1 с симптомами системной красной волчанки (SLE) до уровней ниже, чем у не подвергавшихся лечению контрольных мышей NZB/W F1, которые получали только забуференный фосфатом физиологический раствор (PBS).
На фигуре 8 показано, что совместное введение mAb, специфичных для CXCL13 и TNF-α, снижает тяжесть заболевания почек, ассоциированного с системной красной волчанкой (SLE), у мышей NZB/W F1 с симптомами SLE до уровня ниже, чем у не подвергавшихся лечению контрольных мышей NZB/W F1, которые получали только раствор PBS.
Подробное описание изобретения
Определения
Последующие определения приведены для иллюстрации и определения значения и объема различных терминов, используемых для описания настоящего изобретения.
«Активность», биологическая активность и функциональная активность полипептида относится к активности, проявляемой CXCL13 или его рецептором в ответ на специфическое взаимодействие с другим белком или молекулой, как определено in vivo, in situ или in vitro, согласно стандартным методикам. Такие виды активности могут быть прямой активностью, такой как ассоциация с ферментативной активностью или ферментативная активность на втором белке, или опосредованная активность, такая как клеточный процесс, опосредованный взаимодействием белка со вторым белком или серией взаимодействий в виде внутриклеточной передачи сигналов или каскада процесса коагуляции.
«Антитело» включает любой полипептид или пептид, содержащий молекулу, которая включает, по меньшей мере, область молекулы иммуноглобулина, такую как, без ограничения, по меньшей мере, одна определяющая комплементарность область (CDR) тяжелой или легкой цепи, или его связывающую лиганд область, вариабельную область тяжелой или легкой цепи, константную область тяжелой или легкой цепи, каркасную область, или любой их участок, фрагмент или вариант. Термин «антитело» дополнительно предназначен для включения антител, фрагментов, полученных в результате расщепления, их определенных участков и вариантов, включающих миметики антител или содержащих участки антител, которые имитируют структуру и/или функцию антитела или его специфического фрагмента или участка, включая одноцепочечные антитела, антитела с одним доменом и их фрагменты. Например, фрагменты антител включают, но не ограничиваются ими, Fab (например, полученные путем расщепления папаином), Fab' (например, полученные путем расщепления пепсином и неполного восстановления) и F(ab')2 (например, полученные путем расщепления пепсином), facb (например, полученные путем расщепления плазмином), pFc' (например, полученные путем расщепления пепсином или плазмином), Fd (например, полученные путем расщепления пепсином, неполного восстановления и реагрегации), Fv или scFv (например, полученные методами молекулярной биологии) (см., например, Colligan et al., eds. Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2001); Colligan et al., eds. Current Protocols in Polypeptide Science, John Wiley & Sons, Inc., NY (1997-2001)).
«Химерные» или «слитые» молекулы представляют нуклеиновые кислоты или полипептиды, которые получены объединением, например, одного или нескольких антагонистов CXCL13 (или их фрагментов) с дополнительной нуклеиновокислотной последовательностью(ями). Такие комбинированные последовательности можно ввести в соответствующий вектор и экспрессировать с получением химерного или слитого полипептида.
«Комплемент» нуклеиновокислотной последовательности или «комплементарный» нуклеиновокислотной последовательности по изобретению относится к полинуклеотидной молекуле, имеющей комплементарную последовательность основания и обратную ориентацию по сравнению с первым полинуклеотидом.
«Фрагмент» является вариантом полипептида с аминокислотной последовательностью, которая полностью является такой же, как часть, но не вся аминокислотная последовательность антагониста CXCL13, или вариантом полинуклеотида с нуклеиновокислотной последовательностью, которая полностью является такой же, как часть, но не вся нуклеиновокислотная последовательность полинуклеотида антагониста CXCL13. Фрагменты могут включать, например, усеченные полипептиды или их варианты, такие как непрерывные ряды остатков, которые включают гетерологичную амино- и/или карбоксиконцевую аминокислотную последовательность. Также сюда входят антагонисты CXCL13, полученные в результате деградации, с использованием клетки-хозяина или в клетке-хозяине. Другие приведенные в качестве примеров фрагменты характеризуются структурными или функциональными признаками, такие как фрагменты, содержащие альфа-спираль или области, образующие альфа-спираль, бета-складки или области, образующие бета-складки, витки или области, образующие витки, спирали или области, образующие спирали, гидрофильные области, гидрофобные области, альфа-амфипатические области, бета-амфипатические области, гибкие области, образующие поверхность области, связывающие субстрат области, внеклеточные области и области с высоким показателем антигенности.
«Идентичность», как это известно в данной области, представляет взаимосвязь между двумя или более полипептидными последовательностями, или двумя или более полинуклеотидными последовательностями, как определено путем сравнения последовательностей. В данной области «идентичность» также означает степень сходства последовательностей между полипептидными или полинуклеотидными последовательностями, как определено по совпадению между полосами таких последовательностей. «Идентичность» и «гомологию» можно легко рассчитать известными способами, включая, но не ограничиваясь ими, способы, описанные в Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A.M. and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G.,, Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., M Stockton Press, New York, 1991; и Carillo, H. and Lipman, D., Siam J. Applied Math., 48:1073 (1988). Кроме того, можно установить процентную идентичность по данным выравнивания аминокислотной и нуклеотидной последовательности, полученных с использованием дефолтовых параметров для компонента AlignX Vector NTI Suite 8.0 (Informax, Frederick, MD).
Разработаны предпочтительные способы определения идентичности с получением максимального совпадения между тестируемыми последовательностями. Способы определения идентичности и гомологии кодифицированы в широко доступных компьютерных программах. Предпочтительные компьютерные программы для методов определения идентичности и гомологии между двумя последовательностями включают, но не ограничиваются ими, программу GCG (Devereux, J., et al., Nucleic Acids Research 12(1):387 (1984)); BLASTP, BLASTN и FASTA (Atschul, S.F. et al., J. Molec. Biol., 215:403-410 (1990)). Программа BLAST Х является общедоступной от NCBI и других источников (BLAST Manual, Altschul, S., et al., NCBINLM NIH Bethesda, Md. 20894: Altschul, S., et al., J. Mol. Biol., 215:403-410 (1990). Для определения идентичности можно использовать хорошо известный алгоритм Smith Waterman.
Предпочтительные параметры сравнения полипептидных последовательностей включают следующие:
(1) Алгоритм: Needleman and Wunsch, J. Mol. Biol., 48:443-453 (1970) Матрица сравнения: BLOSSUM62 от Hentikoff and Hentikoff, Proc. Natl. Acad. Sci, USA, 89:10915-10919 (1992)
Гэп штраф: 12
Длина штрафуемого гэпа: 4
Программа, пригодная для данных параметров, является широкодоступной в виде «гэп» программы Genetics Computer Group, Madison Wis. Указанные выше параметры являются дефолтовыми параметрами для сравнений пептидных последовательностей (с отсутствием штрафов для концевых гэпов).
Предпочтительные параметры сравнения полинуклеотидных последовательностей включают следующие:
(1) Алгоритм: Needleman and Wunsch, J. Mol. Biol. 48:443-453 (1970)
Матрица сравнения: совпадения=+10, ошибочные совпадения=0
Гэп штраф: 50
Длина штрафуемого гэпа: 3
Доступна в виде: «гэп» программы Genetics Computer Group, Madison Wis. Это дефолтовые параметры для сравнений нуклеиновокислотных последовательностей.
В качестве примера, полинуклеотидная последовательность может быть идентичной последовательности, которая на 100% является идентичной, или она может содержать определенное целое число изменений нуклеотидов по сравнению со ссылочной последовательностью. Такие изменения выбраны из группы, состоящей из делеции, замены, включая транзицию и трансверсию, или вставки, по меньшей мере, одного нуклеотида, и где изменения могут иметь место в 5'- или 3'-концевых положениях ссылочной нуклеотидной последовательности, или где угодно между данными концевыми положениями, расположенные либо индивидуально среди нуклеотидов в ссылочной последовательности, либо в одной или нескольких смежных группах в ссылочной последовательности. Число нуклеотидных изменений определяют умножением общего числа нуклеотидов в последовательности на численный процент соответствующей процентной идентичности (деленный на 100) и вычитанием полученного производного из общего числа нуклеотидов в последовательности, или:
n.sub.n.ltorsim.x.sub.n-(x.sub.n.y.),
где n.sub.n. представляет число нуклеотидных изменений, x.sub.n представляет общее число нуклеотидов в последовательности, и y равно, например, 0,70 для 70%, 0,80 для 80%, 0,85 для 85%, 0,90 для 90%, 0,95 для 95% и т.д., и где любое производное x.sub.n, не равное целому числу, и y округляют до наиболее близкого целого числа перед вычитанием из x.sub.n.
Изменения полинуклеотидной последовательности, кодирующей последовательность, могут привести к несмысловой, ошибочно смысловой мутации или мутации со сдвигом рамки считывания в данной кодирующей последовательности и, тем самым, к изменению полипептида, кодированного полинуклеотидом, после таких изменений. Аналогично, полипептидная последовательность может быть идентична ссылочной последовательности, которая на 100% является идентичной, или она может включать определенное целое число аминокислотных изменений по сравнению со ссылочной последовательностью, так что процентная идентичность составляет менее 100%. Такие изменения выбраны из группы, состоящей из делеции, замены, включая консервативную и неконсервативную замену, или вставки, по меньшей мере, одной аминокислоты, и где изменения могут иметь место в амино- или карбоксиконцевых положениях ссылочной полипептидной последовательности, или где угодно между данными концевыми положениями, расположенные либо индивидуально среди аминокислот в ссылочной последовательности, либо в одной или нескольких смежных группах в ссылочной последовательности. Число аминокислотных изменений для данной % идентичности определяют умножением общего числа аминокислот в последовательности на численный процент соответствующей процентной идентичности (деленный на 100) и вычитанием полученного производного из общего числа аминокислот в последовательности, или:
n.sub.а.ltorsim.x.sub.а-(x.sub.а.y.),
где n.sub.а. представляет число аминокислотных изменений, x.sub.а представляет общее число аминокислот в последовательности, и y равно, например, 0,70 для 70%, 0,80 для 80%, 0,85 для 85% и т.д., и где любое производное x.sub.а, не равное целому числу, и y округляют до наиболее близкого целого числа перед вычитанием из x.sub.а.
«Нуклеиновые кислоты» являются полимерами нуклеотидов, в которых нуклеотид содержит основание, связанное с сахаром, где сахара, в свою очередь, связаны друг с другом посредством, по меньшей мере, бивалентной молекулы, такой как фосфорная кислота. В природных нуклеиновых кислотах сахар представляет собой или 2'-дезоксирибозу (ДНК), или рибозу (РНК). Поли- или олигонуклеотиды, не относящиеся к природным, содержат модифицированные основания, сахара или связывающие молекулы, но, как правило, представляют собой миметики комплементарной природы естественных нуклеиновых кислот, по аналогии с которыми они сконструированы. Примером олигонуклеотида, не относящегося к природному, является антисмысловая молекула, которая имеет фосфоротиоатный остов. Как правило, «олигонуклеотид» относится к молекуле нуклеиновой кислоты, содержащей менее чем 30 нуклеотидов.
«Полипептид» является полимером из аминокислотных остатков, соединенных пептидными связями, и пептид, как правило, относится к аминокислотным полимерам из 12 или менее остатков. Пептидные связи могут быть получены естественным путем, т.е. с использованием нуклеиновокислотной матрицы, или синтетически с использованием способов, известных в данной области.
«Белок» является макромолекулой, содержащей одну или несколько полипептидных цепей. Белок может дополнительно содержать заместители, присоединенные к боковым группам аминокислот, но не участвующие в образовании пептидных связей. Обычно, белки, экспрессированные эукариотическими клетками, также содержат углеводы. Белки определяют в данном документе по их аминокислотной последовательности или остова, и заместители не указывают, известные или нет.
Термин «рецептор» означает молекулу, обладающую способностью оказывать влияние на биологическую активность, например, в клетке, в результате взаимодействия со специфическим лигандом или партнером по связыванию. Для связанных с клеточной мембраной рецепторов характерно наличие внеклеточного связывающего лиганд домена, одного или нескольких мембранных пространственных или трансмембранных доменов и внутриклеточного домена-эффектора, который, как правило, вовлечен в сигнальную трансдукцию. Связывание лиганда с клеточными мембранными рецепторами вызывает изменения во внеклеточном домене, которые передаются по клеточной мембране, прямое или опосредованное взаимодействие с одним или несколькими внутриклеточными белками, и изменяет свойства клеток, такие как ферментная активность, форма клетки или профиль экспрессии генов. Рецепторы также могут быть не связаны с клеточной поверхностью и могут быть цитозольными, ядерными или высвобождаемыми из клетки в целом. Не связанные с клеткой рецепторы называются растворимыми рецепторами.
Все публикации или патенты, цитируемые в данном документе, полностью включены в описание путем ссылки, специально или нет обозначенные соответственно, поскольку они демонстрируют уровень техники на время создания настоящего изобретения и/или обеспечивают описание и представление настоящего изобретения. Публикации относятся к любым научным или патентным публикациям, или любой другой информации, доступной в любом медийном формате, включая все записанные, электронные или печатные форматы. Последующие источники полностью включены в данный документ путем ссылки: Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY (1987-2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor, NY (1989); Harlow and Lane, antibodies, a Laboratory Manual, Cold Spring Harbor, NY (1989); Colligan, et al., eds., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1984-2001); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY (1987-2001).
Биологическая функция CXCL13
Были выявлены новая экспрессия и новая функция CXCL13, и его биологическая функция в формировании/развитии лимфоидных органов, образовании В-клеточных фолликулов и рекрутинге В-клеток при различных заболеваниях человека и на моделях животных. Впервые была установлена связь эктопической экспрессии с образованием лимфоидных фолликулов, ассоциированных с заболеваниями легких, в частности, но без ограничения, COPD.
Композиции CXCL13 могут содержать одну или несколько изоформ белка, их иммуногенные участки или полинуклеотиды, кодирующие такие участки. Альтернативно, терапевтическая композиция может содержать клетку, которая экспрессирует белок CXCL13, или Т-клетку, которая является специфической для клеток, экспрессирующих полипептид, кодированный геном, или другой тип агонистов; и антагонисты, такие как нейтрализующие моноклональные антитела (mAb), лекарственные препараты на основе нуклеиновых кислот, или соединения с малой молекулой к любому участку ДНК, РНК или белка CXCL13. Данные композиции можно применять, например, для профилактики и лечения ряда опосредованных иммунной системой воспалительных заболеваний. Также раскрываются диагностические и прогностические способы, основанные на детектировании белка CXCL13 или мРНК, кодирующей такой белок, в пробе.
CXCL13 и его рецепторные белки, полипептиды и молекулы нуклеиновых кислот, кодирующие их, включают семейство молекул с определенными консервативными структурными и функциональными свойствами. Каждая из этих молекул включена в определение CXCL13. Используемый в данном документе термин «семейство» относится к двум или более белкам или молекулам нуклеиновой кислоты, имеющим общую или аналогичную структуру доменов и обладающим достаточной идентичностью аминокислотных и нуклеотидных последовательностей, определенных в данном документе. Члены семейства могут происходить от одного или различных видов. Например, семейство может включать два или более белков человека, или может включать один или несколько белков человека, или один или несколько белков, не относящихся к человеческим.
Домен, который может присутствовать в белках CXCL13, представляет сигнальную последовательность. Используемый в данном документе термин «сигнальная последовательность» включает пептид длиной, по меньшей мере, примерно из 10 аминокислотных остатков, который находится на аминоконце связанных с мембраной белков и который содержит, по меньшей мере, примерно 45% гидрофобных аминокислотных остатков, таких как аланин, лейцин, изолейцин, фенилаланин, пролин, тирозин, триптофан или валин. В предпочтительном варианте осуществления сигнальная последовательность содержит, по меньшей мере, примерно от 10 до 35 аминокислотных остатков, предпочтительно примерно от 10 до 20 аминокислотных остатков, и имеет, по меньшей мере, примерно 35-60%, более предпочтительно 40-50% и еще более предпочтительно, по меньшей мере, примерно 45% гидрофобных остатков. Сигнальная последовательность служит для направления белка, содержащего такую последовательность, к липидному бислою. Таким образом, в одном варианте осуществления белок CXCL13 может содержать сигнальную последовательность. Данная сигнальная последовательность отщепляется во время процессинга зрелого белка.
Белки CXCL13 содержат внеклеточный домен. Используемый в данном документе термин «внеклеточный домен» относится к участку белка, который находится не с цитоплазматической стороны липидного бислоя клетки, когда нуклеиновая кислота, кодирующая белок, экспрессируется в клетке.
Кроме того, белок CXCL13 содержит трансмембранный домен. Используемый в данном документе термин «трансмембранный домен» относится к аминокислотной последовательности длиной, по меньшей мере, примерно из 15 аминокислотных остатков и которая содержит, по меньшей мере, примерно 65-70% гидрофобных аминокислотных остатков, таких как аланин, лейцин, фенилаланин, пролин, тирозин, триптофан или валин (Eric, et al., Proc. of Sixth Int. Conf. on Intelligent Systems for Molecular Biology, p. 175-182). В предпочтительном варианте осуществления трансмембранный домен содержит примерно 15-30 аминокислотных остатков, предпочтительно примерно 20-25 аминокислотных остатков, и имеет, по меньшей мере, примерно 60-80%, более предпочтительно 65-75% и еще более предпочтительно, по меньшей мере, примерно 70% гидрофобных остатков.
Белки CXCL13 содержат цитоплазматический домен, в частности, включая белки с карбоксиконцевым цитоплазматическим доменом. Используемый в данном документе термин «цитоплазматический домен» относится к участку белка, который находится с цитоплазматической стороны липидного бислоя клетки, когда нуклеиновая кислота, кодирующая белок, экспрессируется в клетке. Белки CXCL13 обычно содержат различные сайты потенциальных посттрансляционных модификаций (часто они находятся во внеклеточном домене).
Антагонисты CXCL13
Используемый в данном документе термин «антагонисты CXCL13» относится к соединениям, которые ингибируют или нейтрализуют биологическую активность CXCL13 или его рецептора, CXCR5. Такие антагонисты осуществляют это действие различными путями. Одна группа антагонистов CXCL13 связывается с белком CXCL13 с достаточной аффинностью и специфичностью для нейтрализации биологических эффектов CXCL13. В данную группу молекул входят антитела и фрагменты антител (например, такие молекулы, как F(ab) или F(ab')2). Другая группа антагонистов CXCL13 включает фрагменты белка CXCL13, мутеины или малые органические молекулы, т.е. пептидомиметики, которые связываются с CXCL13 или партнерами по связыванию с CXCL13, тем самым, подавляя биологическую активность CXCL13. Антагонист CXCL13 может относиться к любой из данных групп, при условии, что он является соединением, ингибирующим биологическую активность CXCL13. Антагонисты