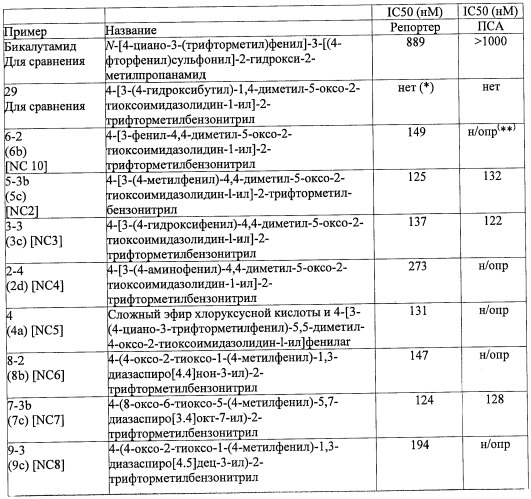
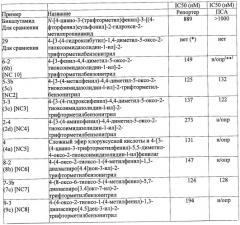
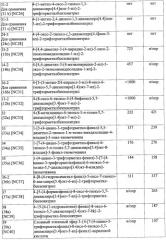
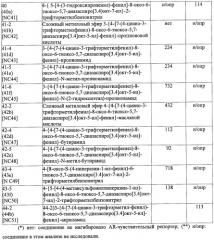
Диарилтиогидантоиновые соединения
Иллюстрации
Показать всеНастоящее изобретение относится к диарилтиогидантоиновым соединениям формулы , где R1 и R2 вместе с атомом углерода, к которому они присоединены, являются циклоалкильной группой, состоящей из 4-5 атомов углерода, где R3 выбирают из группы, состоящей из диметилкарбамоилалкила и цианоалкила, и где R4 представляет собой водород или фтор. Также изобретение относится к фармацевтической композиции на основе заявленных соединений, к их способу синтеза и их применению. Технический результат: получены новые диарилгидантоиновые производные, полезные при лечении гормонорезистентного рака простаты. 7 н. и 22 з.п. ф-лы, 25 ил., 11 табл., 5 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к диарилгидантоиновым соединениям, включающим диарилтиогидантоины, способам их синтеза и их применению при лечении гормонорезистентного рака простаты. Эта заявка включает путем отсылки заявку PCT/US2006/011417 того же правообладателя.
Уровень техники
Рак простаты - наиболее часто встречающийся тип рака и вторая причина смерти от рака у мужчин в западных странах. Если рак локально ограничен, заболевание может быть вылечено хирургическим путем или облучением. Однако в 30% случаев такой рак возникает вновь в виде удаленных метастазов, а в других случаях при диагностировании выявляют запущенное заболевание. Запущенное заболевание лечат путем кастрации и/или введения антиандрогенов, с помощью так называемой андрогенной депривационной терапии. Кастрация снижает уровень циркулирующих андрогенов и уменьшает активность рецептора андрогенов (AR). Введение антиандрогенов блокирует функцию AR путем конкуренции и прекращения связывания андрогенов, следовательно, путем снижения активности AR. Хотя и эффективные вначале, эти способы лечения быстро прекращают действие, и рак становится гормонорезистентным.
Недавно было обнаружено и подтверждено, что суперэкспрессия AR является причиной гормонорезистентного рака простаты. Смотри работу Chen, CD., Welsbie, D.S., Tran, С, Baek, S.H., Chen, R., Vessella, R., Rosenfeld, M.G., and Sawyers, C.L., Molecular determinants of resistance to antiandrogen therapy, Nat. Med., 10: 33-39, 2004, которая включена сюда путем отсылки. Суперэкспрессии AR достаточна для того, чтобы вызвать прогрессирование рака простаты от гормоночувствительной до гормонорезистентной стадии, что позволяет предположить, что более совершенные ингибиторы AR по сравнению с использующимися в настоящее время лекарственными средствами могут замедлить прогрессирование рака простаты. Было показано, что AR и связывание его лигандов необходимы для роста гормонорезистентного рака простаты, что указывает на то, что AR по-прежнему является мишенью этого заболевания. Также было продемонстрировано, что суперэкспрессия AR превращает антиандрогены из антагонистов в агонисты в случае гормонорезистентного рака простаты (антагонист AR ингибирует активность AR, а агонист стимулирует активность AR). Результаты этой работы объясняют, почему эмаскуляция и антиандрогены не в состоянии предотвратить прогрессирование рака простаты и раскрывают неизвестные свойства гормонорезистентного рака простаты.
Бикалутамид (торговая марка: касодекс) - наиболее часто применяемый антиандроген. Несмотря на то что он обладает ингибирующим действием на AR в случае гормоночувствительного рака простаты, он прекращает подавлять AR, когда рак становится гормонорезистентным. Две слабые стороны современных антиандрогенов являются причиной неспособности предупреждать прогрессирование рака простаты из гормоночувствительной стадии в гормонорезистентное заболевание и эффективно лечить гормонорезистентный рак простаты. Одна сторона связана с их слабыми антагонистическими активностями, а другая - с их сильными агонистическими активностями, когда AR суперэкспрессируется в случае гормонорезистентного рака простаты. Поэтому более совершенные ингибиторы AR с более сильными антагонистическими активностями и минимальными агонистическими активностями необходимы для того, чтобы отсрочить прогрессирование заболевания, и для того, чтобы лечить смертельноопасный гормонорезистентный рак простаты.
Нестероидные антиандрогены, такие как бикалутамид, имели преимущества по сравнению со стероидными соединениями, применяемыми при раке простаты, так как они более селективны и имели меньше побочных эффектов. Этот класс соединений был описан во многих патентах, таких как Патент США №4,097,578, Патент США №5,411,981, Патент США №5,705,654, Международных заявок по процедуре РСТ WO 97/00071 и WO 00/17163, и опубликованной патентной заявке США №2004/0009969, все они включены сюда путем отсылки.
Патент США №5,434,176 включает широкую формулу изобретения, которая включает большое количество соединений, но пути синтеза представлены только лишь для небольшой части этих соединений, а фармакологические данные представлены только для двух из них, и специалист в этой области техники не смог бы легко додумать их для других специфических соединений.
Так как механизм гормонорезистентного рака простаты неизвестен, не существует биологической системы для тестирования этих соединений, описанных в этих патентах, в отношении их действия в случае гормонорезистентного рака простаты. В частности, способность суперэкспрессии AR в случае гормонорезистентного рака простаты переключать ингибиторы из антагонистов в агонисты не установлена. Некоторые новые свойства гормонорезистентного рака простаты сообщены в заявках РСТ US04/42221 и US05/05529, которые включены сюда путем отсылки. В международной заявке РСТ US05/05529 представлена методология идентификации антагонистических и агонистических свойств соединений в отношении рецепторов андрогенов. Однако для каждого полученного соединения необходимо выбирать требующий большого времени способ определения антагонистических и агонистических свойств соединения. То есть не существует способа для точного предсказания характеристик, имеющих значение для лечения рака простаты, только лишь на основании химической структуры соединения.
Было сообщено, что некоторые соединения являются ингибиторами лиганд-связывающего домена (LBD) рецептора андрогенов (AR). Некоторые из них применяли в качестве лекарственных средств при лечении рака простаты, например, бикалутамид (касодекс). Были обнаружены некоторые соединения, связывающиеся с AR LBD, например тиогидантоины, RU59063 и BTID (Teutsch, G.; Goubet, F.; Battmann, Т.; Bonfils, A.; Bouchoux, F.; Cerede, E.; Gofflo, D.; Gaillard-Kelly, M.; Philibert. D. J. Steroid Boichem. Molec. Biol 1994, 48, 111-119; Van Dort, M. E.; Robins, D. M.; Wayburn, B. J. Med Chem. 2000,43,3344-3347).
Существует необходимость в новых тиогидантоиновых соединениях, обладающих желаемыми фармакологическими свойствами, и синтетических путях их получения. Так как активности чувствительны к небольшим структурным изменениям, одно из соединений может быть эффективно при лечении рака простаты, тогда как второе соединение может быть неэффективным, даже если оно отличается от первого соединения лишь немного, скажем, заменой единственного заместителя.
Обнаружение соединений, которые обладают высокой эффективностью в качестве антагонистов андрогенной активности и которые обладают минимальной агонистической активностью, должно победить гормонорезистентный рак простаты (HRPC) и избавиться или замедлить прогрессирование гормоночувствительного рака простаты (HSPC). Таким образом, в этой области техники существует необходимость обнаружения селективных модуляторов рецептора андрогеенов, таких как модуляторы, которые являются нестероидными, нетоксичными и тканеспецифичными.
Раскрытие изобретения
Изобретение предоставляет серию соединений, обладающих сильными антагонистическими активностями с минимальными агонистическими активностями в отношении AR. Эти соединения ингибируют рост гормонорезистентного рака простаты.
Специфические соединения изобретения включают:
Изобретение также обеспечивает фармацевтическую композицию, включающую терапевтически эффективное количество соединения, соответствующего любому из предшествующих соединений, или их фармацевтически приемлемой соли и фармацевтически приемлемый носитель или разбавитель.
Изобретение включает способ лечения гиперпролиферативного нарушения, включающий введение такой фармацевтической композиции субъекту, нуждающемуся в таком лечении, осуществляющий, таким образом, лечение гиперпролиферативного нарушения. Гиперпролиферативное нарушение может быть гормонорезистентным раком простаты. Дозировка может быть в диапазоне примерно от 0,001 мг на кг массы тела в день до примерно 100 мг на кг массы тела в день, примерно от 0,01 мг на кг массы тела в день до примерно 100 мг на кг массы тела в день, примерно от 0,1 мг на кг массы тела в день до примерно 10 мг на кг массы тела в день, или около 1 мг на кг массы тела в день.
Соединение можно вводить с помощью внутривенной инъекции, с помощью инъекции в ткань, внутрибрюшинно, перорально или назально. Композиция может быть в форме, выбираемой из группы, состоящей из раствора, дисперсии, суспензии, порошка, капсулы, таблетки, пилюли, капсулы с высвобождением во времени, таблетки с высвобождением во времени и пилюли с высвобождением во времени.
Вводимое соединение может быть выбрано из группы, состоящей из NC54, NC55, NC56 или NC57 или их фармацевтически приемлемой соли. Вводимое соединение может быть NC53 или его фармацевтически приемлемой солью.
Изобретение обеспечивает способ синтеза NC54, включающий смешивание N-метил-2-фтор-4-(1,1-диметил-цианометил)-аминобензамида и 4-изотиоцианат-2-трифторметилбензонитрила в DMF и нагревание для образования первой смеси и обработку, указанную выше.
Изобретение также обеспечивает способ синтеза NC55, включающий смешивание N-метил-2-фтор-4-(1-цианоциклопентил)аминобензамида, 4-изотиоцианат-2-трифторметил бензонитрила и DMF и нагревание с обратным холодильником для образования первой смеси и обработку, указанную выше.
Изобретение, кроме того, обеспечивает способ синтеза NC56, включающий смешивание N,N-диметил 4-[4-(1-цианоциклобутиламино)фенил]бутанамида, 4-изотиоцианат-2-трифторметилбензонитрила и DMF и нагревание с обратным холодильником для образования первой смеси и обработку, указанную выше.
Изобретение обеспечивает способ синтеза NC57, включающий смешивание DMSO, дихлорметана и оксалилхлорида для образования первой смеси, добавление 4-(4-(7-(4-циано-3-(трифторметил)фенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3.4]октан-5-ил)фенил)бутанамида к первой смеси для образования второй смеси; добавление триэтиламина ко второй смеси для образования третьей смеси; нагревание третьей смеси и остановку реакции с помощью водного раствора NH4Cl для образования четвертой смеси; экстракцию органического слоя из четвертой смеси и выделение соединения из органического слоя.
В одном воплощении соединение имеет формулу:
R1 и R2 независимо являются метилом или вместе с атомом углерода, к которому они присоединены, циклоалкильной группой, состоящей из 4-5 атомов углерода, R3 выбирают из группы, состоящей из карбамоила, алкилкарбамоила, карбамоилалкила, алкилкарбамоилалкила, циано и цианоалкила, и R4 представляет собой водород или фтор.
В одном воплощении фармацевтическая композиция включает терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель или разбавитель.
Соединение, например, может иметь формулу
или
Фармацевтическая композиция может включать терапевтически эффективное количество соединения NC54 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель или разбавитель. Фармацевтическая композиция может включать терапевтически эффективное количество соединения формулы NC55 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель или разбавитель.
В одном воплощении способ лечения гиперпролиферативного нарушения включает введение фармацевтической композиции по п.2 субъекту, нуждающемуся в таком лечении, осуществляющий, таким образом, лечение гиперпролиферативного нарушения.
Композиция, например, может быть в форме, выбираемой из группы, состоящей из раствора, дисперсии, суспензии, порошка, капсулы, таблетки, пилюли, капсулы с высвобождением во времени, таблетки с высвобождением во времени и пилюли с высвобождением во времени. Соединение можно вводить с помощью внутривенной инъекции, с помощью инъекции в ткань, внутрибрюшинно, перорально или назально. Композицию можно вводить при дозировке соединения, составляющей примерно от 0,001 мг на кг массы тела в день до примерно 100 мг на кг массы тела в день. Композицию можно вводить при дозировке соединения, составляющей примерно от 0,01 мг на кг массы тела в день до примерно 100 мг на кг массы тела в день. Композицию можно вводить при дозировке соединения, составляющей примерно от 0,1 мг на кг массы тела в день до примерно 10 мг на кг массы тела в день. Композицию можно вводить при дозировке соединения, составляющей около 1 мг на кг массы тела в день.
Существует способ лечения рака простаты, включающий введение фармацевтической композиции субъекту, нуждающемуся в таком лечении, осуществляющий, таким образом, лечение рака простаты. Фармацевтическая композиция может предотвращать транскрипцию мРНК простат-специфического антигена. Фармацевтическая композиция может предотвращать транслокацию в ядро белка рецептора андрогенов. Фармацевтическая композиция может дестабилизировать белок рецептора андрогенов. Композицию можно вводить перорально. Композиция может быть в форме, выбираемой из группы, состоящей из капсулы, таблетки и пилюли.
В одном воплощении соединение может быть представлено NC54, NC55, NC56, NC57, фармацевтически приемлемой солью любого из них или их смесью.
Способ синтеза диарильного соединения, имеющего формулу
включает смешивание соединения I
Соединение I
с соединением II
Соединение II
в первом полярном растворителе для образования смеси, нагревание смеси, добавление к смеси второго полярного растворителя, того же самого или отличающегося от первого полярного растворителя, и водного раствора кислоты, нагревание смеси с обратным холодильником, охлаждение смеси и смешивание с водой, и отделение диарильного соединения из смеси. R51 может включать алкильную цепь, состоящую из 1-4 атомов углерода. R52 может быть циано, гидрокси, метилкарбамоилом, метилкарбамоил-замещенным алкилом, метилсульфонкарбамоил-замещенным алкилом, метиламинометилом, диметиламинометилом, метилсульфонилоксиметилом, метоксикарбонилом, 3-циано-4-трифторметилфенилкарбамоилом, карбамоил-замещенным алкилом, карбоксиметилом, метоксикарбонилметилом, метансульфонилом, 4-циано-3-трифторметилфенилкарбамоил-замещенным алкилом, карбокси-замещенным алкилом, 4-метансульфонил-1-пиперазинилом, пиперазинилом, гидроксиэтилкарбамоил-замещенным алкилом или гидроксиэтоксикарбонил-замещенным алкилом. R53 может быть выбран из группы, состоящей из F и Н.
В одном воплощении R51 включает алкильную цепь, состоящую из 1-2 атомов углерода, R52 выбирают из группы, состоящей из карбамоила и метилкарбамоила, a R53 представляет собой F.
Способ синтеза соединения, имеющего формулу:
может включать смешивание 4-изотиоцианат-2-трифторметилбензонитрила и N-метил-4-(1-цианоциклобутиламино)-2-фторбензамида в диметилформамиде для образования первой смеси, нагревание первой смеси для образования второй смеси, добавление спирта и кислоты ко второй смеси для образования третьей смеси, нагревание с обратным холодильником третьей смеси для образования четвертой смеси, охлаждение четвертой смеси, смешивание четвертой смеси с водой и экстракцию органического слоя, и выделение соединения из органического слоя.
Способ синтеза соединения по п.4 [NC54] может включать смешивание N-метил-2-фтор-4-(1,1-диметил-цианометил)-аминобензамида и 4-изотиоцианат-2-трифторметилбензонитрила в DMF и нагревание для образования первой смеси, добавление спирта и кислоты к первой смеси для образования второй смеси, нагревание с обратным холодильником второй смеси, охлаждение второй смеси, смешивание второй смеси с водой и экстракцию органического слоя, и выделение соединения из органического слоя.
Способ синтеза соединения по п.6 [NC55] может включать смешивание N-метил-2-фтор-4-(1-цианоциклопентил)аминобензамида, 4-изотиоцианат-2-трифторметилбензонитрила и DMF и нагревание с обратным холодильником для образования первой смеси, добавление спирта и кислоты к первой смеси для образования второй смеси, нагревание с обратным холодильником второй смеси, охлаждение второй смеси, смешивание второй смеси с водой и экстракцию органического слоя, и выделение соединения из органического слоя.
Способ синтеза соединения по п.8 [NC56] может включать смешивание N,N-диметил 4-[4-(1-цианоциклобутиламино)фенил]бутанамида, 4-изотиоцианат-2-трифторметилбензонитрила и DMF и нагревание с обратным холодильником для образования первой смеси, добавление спирта и воды к первой смеси для образования второй смеси, нагревание с обратным холодильником второй смеси, охлаждение второй смеси, смешивание второй смеси с водой и экстракцию органического слоя, и выделение соединения из органического слоя.
Способ синтеза соединения по п.9 [NC57] может включать смешивание DMSO, дихлорметана и оксалилхлорида для образования первой смеси, добавление 4-(4-(7-(4-циано-3-(трифторметил)фенил)-8-оксо-6-тиоксо-5,7-диазаспиро[3.4]октан-5-ил)фенил)бутанамида к первой смеси для образования второй смеси, добавление триэтиламина ко второй смеси для образования третьей смеси, нагревание третьей смеси и остановку реакции с помощью водного раствора NH4Cl для образования четвертой смеси, экстракцию органического слоя из четвертой смеси, выделение соединения из органического слоя.
Способ может включать обеспечение, по меньшей мере, одного диарилтиогидантоинового соединения; количественную оценку ингибирования активности рецептора андрогенов для соединения и определение того, превышает ли ингибирование первый заданный уровень; количественную оценку стимуляции активности рецептора андрогенов в гормонорезистентных раковых клетках для соединений и определение того, находится ли стимуляция ниже второго заданного уровня; отбор соединения, если ингибирование превышает первый заданный уровень, а стимуляция находится ниже второго заданного уровня. Заданные уровни могут быть такими, как у бикалутамида. Количественная оценка ингибирования может включать измерение ингибирующей концентрации (IC50) в AR-чувствительной репортерной системе или в системе, секретирующей простат-специфический антиген. Количественная оценка стимуляции может включать измерение кратности индукции увеличивающимися концентрациями в AR-чувствительной репортерной системе или в системе, секретирующей простат-специфический антиген. Количественная оценка ингибирования и/или стимуляции может включать оценку влияния соединения на рост опухоли у животного. Стадия количественной оценки ингибирования и/или стимуляции активности рецептора андрогенов может включать измерение аффинности связывания рецептора андрогенов в отношении соединения. Стадия количественной оценки ингибирования и/или стимуляции активности рецептора андрогенов может включать количественную оценку предотвращения вовлечения рецептора андрогенов во взамодействие, по меньшей мере, с одним из энхансера простат-специфического антигена и промотора простат-специфического антигена. Стадия количественной оценки ингибирования и/или стимуляции активности рецептора андрогенов может включать количественную оценку предотвращения транслокации рецептора андрогенов в ядро. Стадия количественной оценки ингибирования и/или стимуляции активности рецептора андрогенов может включать количественную оценку дестабилизации белка рецептора андрогенов.
Способ может включать контакт клетки млекопитающих, способной экспрессировать простат-специфический антиген с достаточным количеством диарилтиогидантоинового соединения для того, чтобы предотвратить транскрипцию мРНК простат-специфического антигена. Диарилтиогидантоиновое соединение может быть выбрано из группы, состоящей из NC53, NC54, NC55, NC56 и NC57. Соединение может предотвратить образование транскрипционного комплекса гена простат-специфического антигена. Соединение может предотвратить образование комплекса андроген-рецепторного белка с геном простат-специфического антигена. Соединение может предотвратить образование комплекса РНК-полимеразы II с геном простат-специфического антигена.
Способ включает контакт клетки млекопитающих с достаточным количеством диарилтиогидантоинового соединения для того, чтобы предотвратить транслокацию андроген-рецепторного белка в ядро и/или дестабилизировать белок рецептора андрогенов.
Краткое описание фигур
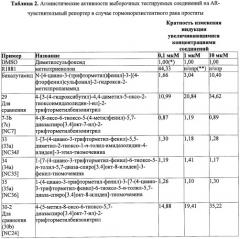
Фигуры, приведенные ниже, представляют результаты фармакологического исследования определенных соединений.
Фигура 1 представляет собой график, показывающий, что бикалутамид демонстрирует агонистическое действие на LNCaP-AR. Агонистические активности бикалутамида при AR-суперэкспрессирующем гормонорезистентном раке простаты. AR-суперэкспрессирующие клетки LNCaP обрабатывали увеличивающимися концентрациями DMSO в качестве среды-растворителя или бикалутамида в отсутствие R1881. Измеряли активности AR-чувствительного репортера.
Фигура 2 представляет собой график, показывающий анализ антагонистического действия бикалутамида на LNCaP-AR. Агонистические активности бикалутамида при гормоночувствительном раке простаты. Клетки LNCaP обрабатывали увеличивающимися концентрациями DMSO в качестве среды-растворителя или бикалутамида в отсутствие R1881. Измеряли активности AR-чувствительного репортера.
Фигура 3 представляет собой график, показывающий действие соединений на LNCaP-AR.
Фигура 4 представляет собой график, показывающий ингибирующий эффект на LNCaP-AR.
Фигура 5. Ингибирующий эффект на экспрессию ПСА в AR-суперэкспрессирующей модели ксенотрансплантата LNCaP. Мышам перорально вводили среду-растворитель, 0,1, 1 или 10 мг образца 7-3b (NC7) на кг массы тела в течение 44 дней один раз в день. Через 44 дня воздействия изолировали опухоли, экстрагировали опухолевые лизаты и с помощью ELISA в опухолевом лизате определяли уровень ПСА.
Фигура 6 представляет собой график зависимости объема опухоли как функции от времени воздействия средой-растворителем, касодексом и NC53.
Фигура 7 представляет собой график размера опухоли. AR-суперэкспрессирующие клетки LNCaP вводили подкожно в боковую поверхность живота кастрированных мышей SCID. Когда опухоли достигали примерно 100 кубических мм, животных случайным образом разделяли на пять групп. В каждой группе было по девять животных. После того как опухоль у них достигала этого объема, им каждый день перорально давали или среду-растворитель, или бикалутамид, или NC53 в количестве 10 или 50 мг/кг. Опухоли измеряли в трех направлениях, по ширине, длине и глубине, используя штангенциркуль.
Фигура 8 демонстрирует экспериментальные результаты измерения размеров опухоли. На 18 день животных фотографировали с помощью оптической CCD-камеры спустя 3 часа после приема последней дозы. ROI перемещали над опухолью для измерения активности люциферазы в фотонах/секунду. Правые панели представляют собой измерения ROIs.
Фигура 9 представляет собой график, показывающий фармакокинетические кривые для NC53 при внутривенном (верхняя кривая) и пероральном введении (нижняя кривая).
Фигура 10 представляет собой график поляризации флуоресценции как функции от логарифма концентрации, который отражает сродство связывания некоторых соединений с рецепторами андрогенов крысы.
Фигура 11 представляет изображения, отражающие состояние комплексообразования рецептора андрогенов и РНК-полимеразы II с энхансером ПСА и промотором ПСА, если добавляли касодекс или NC53.
Фигура 12 представляет изображения, отражающие то, что рецептор андрогенов переносится в ядро в присутствии касодекса, но не в присутствии NC53.
Фигура 13 представляет изображения, отражающие то, что рецептор андрогенов переносится в ядро в присутствии касодекса, но не в присутствии NC53.
Фигура 14 представляет изображения, отражающие то, что рецептор андрогенов разрушается в присутствии NC53.
Фигура 15 представляет собой гистограмму, показывающую массу простаты после обработки различными соединениями. 10, 25, или 50 мг соединения на килограмм массы тела в день вводили, как указано в обозначениях гистограммы. Соединения вводили здоровым мышам FVB. После обработки соединением в течение 14 дней определяли массу урогенитального тракта путем удаления и взвешивания семенных пузырьков, простаты и мочевого пузыря. Каждое соединение вводили трем мышам, чтобы получить результаты, представленные с помощью «усов» на гистограмме. Часть мышей не обрабатывали соединением: данные приведены в обозначениях как «необработанные». Другой набор мышей обрабатывали только средой-растворителем: данные представлены в обозначениях как «среда-растворитель».
Фигура 16 представляет собой график, показывающий анализ ПСА, проведенный в соответствии с экспериментальным протоколом, представленным на фигуре 6.
Фигура 17 представляет собой график, показывающий эффект различных дозовых режимов NC53 на объем опухоли.
Фигура 18 представляет собой график, показывающий скорость эмиссии фотонов, ассоциированную с активностью люциферазы на 17 день в сравнении со скоростью в день 0 после обработки соединением NC53 в дозах 0,1; 1 и 10 мг на килограмм массы тела в день и без обработки соединением NC53.
Фигура 19 представляет результаты эксперимента, в котором мышам SCID путем инъекции вводили клеточную линию LN-AR (HR) для индукции роста опухоли. Одну группу мышей обрабатывали соединением NC53 в дозе 10 мг на килограмм массы тела в день; другую группу мышей обрабатывали только средой-растворителем. (А) Относительный объем опухоли как функция времени показан для каждой группы мышей. (В) Изображения для каждой группы мышей, выполненные с использованием фотонной эмиссии, связанной с активностью люциферазы на 31 день, показаны в виде цветных контуров. (С) Скорость фотонной эмиссии, связанной с активностью люциферазы, показана для нескольких промежутков времени для каждой группы мышей.
Фигура 20 представляет собой график, показывающий поглощение ПСА, ассоциированное с клетками LN-AR, обработанными различными концентрациями соединений NC53, NC54, NC55 и NC57 и средой-растворителем.
Фигура 21 представляет собой график, показывающий поглощение ПСА, ассоциированное с клетками LN-CaP, обработанными различными концентрациями соединений NC7, NC48, NC53, бикалутамида и DMSO.
Фигура 22 представляет результаты эксперимента, проведенного с нетрансгенными мышами дикого типа (WT), кастрированными мышами с трансгеном люциферазы (Cast) и некастрированными мышами с трансгеном люциферазы (Intact). Показаны результаты для кастрированных мышей с трансгеном люциферазы, обработанных имплантированной тестостероновой гранулой, отдающей 12,5 мг на килограмм массы тела в день с 90-дневным периодом высвобождения (T/Cast), и показаны результаты для некастрированных мышей с трансгеном люциферазы, обработанных имплантированной тестостероновой гранулой, отдающей 12,5 мг на килограмм массы тела в день с 90-дневным периодом высвобождения (Intact+T). Показаны результаты для кастрированных мышей с трансгеном люциферазы, обработанных имплантированной тестостероновой гранулой и бикалутамидом (BIC+T/Cast) или соединением NC53 (NC53+T/Cast) в количестве 10 мг на килограмм массы тела в день в день. (А) Урогенитальный тракт, взвешенный на 14 день. (В) Эмиссия фотонов на 14 день. Во всех случаях не была индуцирована гормонорезистетная стадия заболевания.
Фигура 23 представляет собой график, показывающий поглощение ПСА, измеренное в клетках LN-AR после обработки различными дозами нескольких соединений.
Фигура 24 - таблица, в которой представлены некоторые характеристики соединений. Фигура 15 также представляет собой график фармакокинетических характеристик нескольких соединений в виде функции концентраций соединений в сыворотке крови от времени.
Фигура 25 представляет собой график люциферазной активности клеточной линии LIAR, к которой добавляли различные соединения, вводимые в диапазоне концентраций от 125 нМдо 1000 нМ.
Осуществление изобретения
Ниже детально обсуждаются воплощения изобретения. В описанных воплощениях для ясности применяют специальную терминологию. Однако изобретение не ограничено выбранной таким образом специальной терминологией. Специалисту в этой области техники будет ясно, что без отступления от сущности и объема изобретения можно использовать другие эквивалентные термины. Все источники, процитированные в тексте заявки, включены сюда путем отсылки, как если бы каждая такая публикация в индивидуальном порядке была включена в описание путем отсылки.
Синтез диарилгидантоиновых соединений
Пример 56 [NC54]
Реакции, чувствительные к воздуху или влаге, приведенные ниже, проводили в атмосфере аргона, с применением высушенной в сушильном шкафу стеклянной посуды и стандартных методик, использующих шприцы и мембраны. За реакциями следили с помощью кремнеземных пластинок для тонкослойной хроматографии (SiO2, TLC) в ультрафиолетовом свете (254 нм) с последующей визуализацией с помощью окрашивающего раствора пара-анизальдегида или нингидрина. Колоночную хроматографию проводили на силикагеле 60. Спектр 1Н-ЯМР, если специально не оговорено, измеряли при 400 МГц в CDCl3 и результаты, как указано ниже, приведены в м.д. (5) относительно внутреннего стандарта (TMS, 0,0 м.д.): химический сдвиг (мультиплетность, интегрирование, константа взаимодействия в Гц).
Периодную кислоту (1,69 г, 7,41 ммоль) растворяли в ацетонитриле (25 мл) при энергичном перемешивании, затем в полученном растворе растворяли триоксид хрома (0,16 г, 1,60 ммоль). К указанному выше раствору при перемешивании добавляли 2-фтор-4-нитротолуол (0,33 г, 2,13 ммоль). В экзотермической реакции сразу же образовывался белый осадок. После перемешивания в течение 1 часа жидкий супернатант реакционной среды декантировали в колбу и растворитель удаляли с помощью выпаривания. Остатки экстрагировали дихлорметаном (2×30 мл) и водой (2×30 мл). Органический слой высушивали над MgSO4 и концентрировали для получения 2-фтор-4-нитробензойной кислоты (формула 37) (0,32 мг, 81%) в виде твердого вещества белого цвета. 1Н-ЯМР δ 8,06 (ddd, 1Н, J=9,9, 2,2 и 0,3), 8,13 (ddd, 1Н, J=8,6, 2,2 и 0,9), 8,25 (ddd, 1Н, J=8,6, 7,0 и 0,3).
К раствору 2-фтор-4-нитробензойной кислоты (формула 37) (0,20 г, 1,10 ммоль) в DMF (5 мл), охлажденному до -5°C, медленно добавляли тионилхлорид (0,15 г, 1,30 ммоль). Смесь дополнительно перемешивали в течение еще 1 часа при -5°C. В реакционную среду добавляли избыток метиламина (свежеперегнанного из 40%-ного водного раствора). Вторую смесь перемешивали дополнительно еще в течение 1 часа. К смеси, которую промывали солевым раствором (2×50 мл), добавляли этилацетат (50 мл).
Органический слой высушивали над MgSO4 и концентрировали для получения N-метил-2-фтор-4-нитробензамидина (формула 38) (0,18 г, 85%) в виде твердого вещества желтого цвета. 1Н-ЯМР (ацетон-d6) δ 3,05 (d, 3Н, J=4,3), 6,31 (dd, 1Н, J=13,5 и 2,1), 6,40 (dd,1H, J и 2,1), 7,64 (dd, 1H, J=8,6 и 8,6).
Смесь N-метил-2-фтор-4-нитробензамида (формула 38) (0,18 г, 0,91 ммоль) и железа (0,31 г, 5,60 ммоль) в этилацетате (5 мл) и уксусной кислоте (5 мл) нагревали с обратным холодильником в течение 1 часа. Частицы твердого вещества отфильтровывали. Фильтрат промывали водой и экстрагировали этилацетатом. Органический слой высушивали над MgSO4, концентрировали и остаток очищали с помощью колоночной хроматографии на SiO2 (дихлорметан:ацетон, 95:5) для получения N-метил-2-фтор-4-аминобензамида (формула 39) (0,14 г, 92%) в виде твердого вещества не совсем белого цвета. 1Н-ЯМР (ацетон-d6) δ 2,86 (d, 3Н, J=4,3), 5,50 (br s, 2Н), 6,37 (dd, 1Н, J=14,7 и 2,1), 6,50 (dd, 1Н, J=8,6 и 2,1), 7,06 (br s, 1Н), 7,68 (dd, 1H, J=8,8 и 8,8).
Смесь N-метил-2-фтор-4-аминобензамида (формула 39) (96 мг, 0,57 ммоль), ацетонцианогидрина (0,3 мл, 3,14 ммоль) и сульфата магния (50 мг) нагревали до 80°C и перемешивали в течение 12 часов. К среде добавляли этилацетат (25 мл) и затем промывали водой (2×25 мл). Органический слой высушивали над MgSO4 и концентрировали и остаток очищали с помощью колоночной хроматографии на SiO2 (дихлорметан:ацетон, 95:5) для получения N-метил-2-фтор-4-(1,1-диметил-цианометил)-аминобензамида (формула 40) (101 мг, 75%) в виде твердого вещества белого цвета. 1H-ЯМР δ 1,74 (s, 6Н), 2,98 (dd, 3Н, J=4,8 и 1,1), 6,58 (dd, 1Н, J=14,6 и 2,3), 6,63 (dd, 1Н, J=8,7 и 2,3), 6,66 (br s, 1 Н), 7,94 (dd, IН, J=8,7 и 8,7).
4-Амино-2-трифторметилбензонитрил (2,23 г, 12 ммоль) добавляли порциями в течение 15-17 минут в хорошо перемешиваемую гетерогенную смесь тиофосгена (1 мл, 13 ммоль) в воде (22 мл) при комнатной температуре. Перемешивание продолжали дополнительно в течение еще 1 часа. Реакционную среду экстрагировали хлороформом (3×15 мл). Объединенную органическую фазу высушивали над MgSO4 и выпаривали досуха при пониженном давлении для получения желаемого продукта 4-изотиоцианат-2-трифторметилбензонитрила (формула 41) в виде твердого вещества коричневатого цвета и применяли в таком виде на следующей стадии (2,72 г, 11,9 ммоль, 99%). 1Н-ЯМР δ 7,49 (dd, 1Н, J=8,3 и 2,1), 7,59 (d, 1Н, J=2,1), 7,84 (d, 1Н, J=8,3).
Смесь N-Метал-2-фтор-4-(1,1-диметил-цианометил)-аминобензамида (формула 40)-(30 мг, 0,13 ммоль) и 4-изотиоцианат-2-трифторметилбензонитрила (формула 41) (58 мг, 0,26 ммоль) в DMF (1 мл) нагревали при микроволновом излучении при 100°C в течение 11 часов. К смеси добавляли метанол (20 мл) и водный раствор 1 N НСl (5 мл). Вторую смесь нагревали с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры реакционную смесь выливали в холодную воду (50 мл) и экстрагировали этилацетатом (50 мл). Органический слой высушивали над MgSO4, концентрировали и остаток очищали с помощью колоночной хроматографии на SiO2 (дихлорметан:ацетон, 95:5) для получения NC54 (формула 42) (15 мг, 25%) в виде бесцветного кристаллического вещества. 1Н-ЯМР δ 1,61 (s, 6Н), 3,07 (d, 3Н, J=4,1), 6,71 (m, 1Н), 7,15 (dd, 1Н, J=11,7 и 2,0), 7,24 (dd, 1Н, J=8,4 и 2,0), 7,83 (dd, 1Н, J=8,2 и 2,1), 7,95 (d, 1H, J=2,1), 7,99 (d, 1H, J=8,2), 8,28 (dd, 1H, J=8,4 и 8,4).
Пример 57
Смесь N-метил-2-фтор-4-аминобензамида (формула 39) (62 мг, 0,37 ммоль), циклопентанона (0,07 мл, 0,74 ммоль) и TMSCN (0,1 мл, 0,74 ммоль) нагревали до 80°С и перемешивали в течение 13 часов. К среде добавляли этилацетат (2×20 мл) и затем промывали водой (2×20 мл). Органический слой высушивали над MgSO4 и концентрировали и остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан:ацетон, 95:5) для получения N-метил-2-фтор-4-(1-цианоциклопентил)аминобензамида (формула 43) (61 мг, 63%) в виде твердого вещества белого цвета. 1Н-ЯМР δ 7,95 (dd, 1H, J=8,8, 8,8 Гц), 6,65 (br s, 1Н), 6,59 (dd, 1 Н, J=8,8,2,3 Гц), 6,50 (dd, 1 Н, J=14,6, 2,3 Гц), 4,60 (br s, 1Н), 2,99 (dd, 3H, J=4,8, 1,1 Гц), 2,36-2,45 (m, 2H), 2,10-2,18 (m, 2H), 1,82-1,95 (m, 4H).
Смесь N-Метил 2-фтор-4-(1-цианоциклопентил)аминобензамида (формула 43) (57 мг, 0,22 ммоль) и 4-изотиоцианат-2-трифторметил бензонитрила (0,15 г, 0,65 ммоль) в DMF (3 мл) нагревали при микроволновом излучении (открытый сосуд) при 130°C в течение 12 часов. К этой смеси добавляли метанол (20 мл) и водный раствор 1 N НСl (5 мл). Вторую смесь нагревали с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры реакционную смесь выливали в холодную воду (50 мл) и экстрагировали этилацетатом (50 мл). Органический слой высушивали над MgSO4, концентрировали и остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан:ацетон, 95:5) для получения 4-(3-(4-циано-3-(трифторметил)фенил)-4-оксо-2-тиоксо-1,3-диазаспиро[4.4]нонан-1 -ил)-2-фтор-N-метилбензамида, NC55 (формула 44) (8 мг, 7%) в виде твердого вещества бледно-желтоватого цвета. 1Н-ЯМР δ 8,28 (dd, 1Н, J=,8,4, 8,4 Гц), 7,98 (d, 1Н, J=8,3 Гц), 7,96 (d, 1Н, J=1,