Конъюгаты rgd-пептидов и фотосенсибилизаторов порфирина или (бактерио)хлорофилла и их применение
Иллюстрации
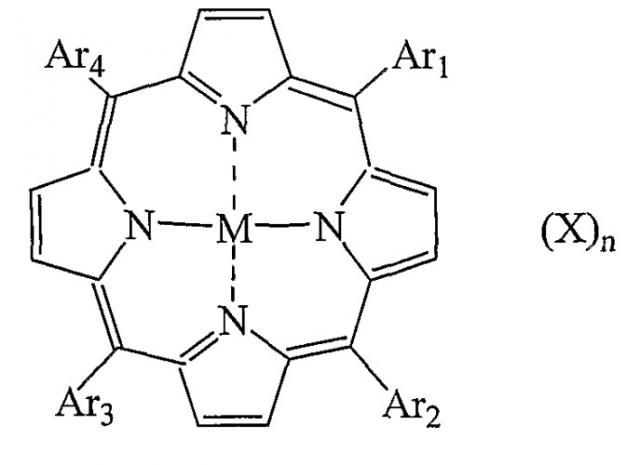
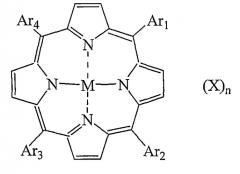
Показать всеИзобретение относится к фотосенсибилизаторам, а именно к конъюгату RGD-содержащего пептида или RGD-пептидомиметика и фотосенсибилизатора, выбранного из тетраарилпорфирина формулы:
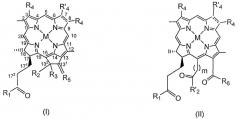
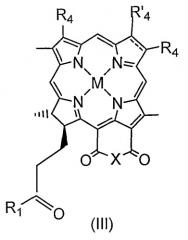
или хлорофилла или бактериохлорофилла формул I, II или III;
в котором тетраарилпорфирин или указанное производное хлорофилла или бактериохлорофилла формулы I, II или III содержит, по меньшей мере, один остаток RGD-содержащего пептида или RGD-пептидомиметика. Значения М и радикалов соответствуют указанным в формуле изобретения. Также предложены фармацевтическая композиция, способ диагностики опухолей динамической флуоресцентной визуализацией, молекулярная магнитно-резонансная томография (МРТ) для диагностики опухолей и способ фотодинамической терапии опухолей. Изобретение позволяет получить конъюгат RGD-содержащего пептида или RGD-пептидомиметика и фотосенсибилизатора, который применяется в способах фотодинамической терапии и диагностики опухолей. 6 н. и 17 з.п. ф-лы, 75 ил., 43 пр., 5 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к фотосенсибилизаторам и, в частности, к новым конъюгатам производных порфирина, хлорофилла и бактериохлорофилла с пептидами, содержащими RGD-мотив, или с RGD-пептидомиметиками, к их получению и их применению в способах фотодинамической терапии и диагностики опухолей и различных сосудистых заболеваний, таких как возрастная дегенерация желтого пятна, в условиях in vivo.
Определения и сокращенные обозначения
AMD: возрастная дегенерация желтого пятна; Bchlа: бактериофилла: пентациклический 7,8,17,18-тетрагидропорфирин с 5 изоциклическим кольцом, центральным атомом Mg, фитилом или геранилгеранилом в положении 173, СООСН3 группой в положении 132, атомом Н в положении 132, метильными группами в положениях 2, 7, 12, 18, ацетильной группой в положении 3 и этильной группой в положении 8, соединение 1 в данном документе; Bphe: бактериофеофитин (Bchl, в котором центральный атом Mg замещен на два атома Н); Bpheid: бактериофеофорбид (С-172-свободная карбоновая кислота, полученная из Bphe, без центрального атома металла); Chl: хлорофилл; ЕС: эндотелиальные клетки; ECM: внеклеточный матрикс; NIR: ближняя область инфракрасного света; Pd-Bpheid: Pd-бактериофеофорбида; ФДТ: фотодинамическая терапия; RGD-4С: циклический нонапептид CDCRGDCFC-NH2; родобактериохлорин: тетрациклический 7,8,17,18-тетрагидропорфирин, содержащий СН2СН2СООН группу в положении 17, -СООН в положении 13, метильные группы в положениях 2, 7, 12, 8 и этильные группы в положениях 3 и 8; ROS: молекулы реакционноспособного кислорода; VTI: направленная на сосуды визуализация; VTP: направленная на сосуды ФДТ.
В заявке использовали систему нумерации IUPAC для производных бактериохлорофилла. С использованием данной номенклатуры природные бактериофиллы имеют два эфира карбоновой кислоты в положениях 132 и 172, однако они эстерифицированы в положениях 132 и 172.
Уровень техники
Фотодинамическая терапия (ФДТ) представляет собой нехирургическое лечение опухолей, в которой объединяются нетоксичные лекарственные препараты и безопасное фотосенсибилизирующее облучение с образованием цитотоксичных реакционноспособных молекул кислорода in situ. Данный метод является более избирательным по сравнению с обычной химиотерапией опухолей и лучевой терапией.
ФДТ опухолей включает комбинацию введенного фотосенсибилизатора и локальную доставку света, сами по себе оба фактора являются безвредными агентами, но в присутствии молекулярного кислорода они способны продуцировать цитотоксичные молекулы кислорода (ROS), которые могут приводить к инактивации клеток. Будучи бинарной терапевтической системой, ФДТ обеспечивает более высокую специфичность и обладает потенциалом проявления большей избирательности, но является не менее деструктивной по сравнению с обычно используемой химиотерапией или лучевой терапией (Dougherty et al., 1998; Bonnett et al., 1999; Kessel and Dougherty, 1999; Mazon, 1999; Hahn and Glatstein, 1999).
Порфирины в клинике применялись в качестве основных фотосенсибилизирующих средств. Оптимальное проникновение света в ткани происходит при 650-800 нм. Натриевая соль порфимера (Photofrin®, торговое название Axcan Pharma Inc.) является первым в мире официально разрешенным для применения средством для фотодинамической терапии, которое получают из гематопорфирина-IX обработкой кислотами, и оно получило разрешение Федерального управления по контролю за продуктами питания и лекарственными препаратами для лечения карциномы пищевода и эндобронхиальной немелклеточной карциномы легких, представляет собой комплекс мономеров, димеров и высших олигомеров.
Большое количество работ было посвящено синтезу индивидуальных чистых соединений так называемых сенсибилизаторов «второго поколения» - которые поглощают в длинноволновой области света; была хорошо установлена их структура и время их удерживания в опухолевых клетках существенно отличается от их удерживания в коже и нормальных тканях. Для оптимизации эффективности лекарственных препаратов на основе порфирина в целях терапии и диагностики было предложено несколько производных порфирина, в которых, например, имелся центральный атом металла (иной чем Mg) в виде комплекса с четырьмя пиррольными циклами, и/или периферические заместители в пиррольных циклах были модифицированы и/или макроцикл был дигидрирован в производные хлорофилла (хлорины) или тетрагидрирован в производные бактериохлорофилла (бактериохлорины).
За счет их интенсивного поглощения в благоприятных областях спектра (650-850 нм) и их легкой деградации после проведения лечения хлорофилл (Chl) и бактериохлорофилл (BChl) были признаны в качестве превосходных сенсибилизаторов для ФДТ опухолей, и они обладают более совершенными свойствами по сравнению с порфиринами. Бактериохлорофиллы обладают потенциальными преимуществами по сравнению с хлорофиллами, поскольку они имеют интенсивные полосы поглощения в ближней инфракрасной области света при значительно более длинных волнах, чем производные хлорофилла.
Направленное действие на сосуды опухолей
Направленные фотодинамические реагенты для деструкции сосудистой сети опухолей, в противоположность самим опухолевым клеткам, могут предложить терапевтические преимущества, поскольку рост и развитие опухолевых клеток критически зависят от постоянной доставки кислорода и питательных веществ (Ruoslahti, 2002). Подобное повреждение сосудов включает образование тромба и дальнейшее ограничение перфузии крови через опухоль (Huang et al., 1997). Кроме того, предполагается, что направленность на слой эндотелиальных клеток сосудов опухоли (ЕС) приводит к усилению проникновения терапевтических макромолекул в опухолевую строму (Huang et al., 1997; Burrows and Thorpe, 1994). Несмотря на то, что кровеносные сосуды опухолей могут изменяться под влиянием микроокружения опухоли и приобретать ассоциированный с опухолью «почерк», они не являются злокачественными и, вероятно, в меньшей степени становятся резистентными к лекарственным препаратам. Кроме того, в том случае, когда агент с направленным действием против сосудов также активен и против опухолевых клеток, то можно ожидать дополнительные преимущества в отношении эффективности. Таким образом, при объединении антиваскулярных свойств с противоопухолевой цитотоксической активностью в одном препарате можно ожидать повышение его эффективности и, следовательно, необходимая эффективная цитотоксическая доза будет ниже. Было показано, что в дополнении к ЕС опухолевые клетки в одном случае составляют часть люминальной мозаики опухолевых кровеносных сосудов (Ruoslahti, 2002; Chang et al., 2000). Следовательно, полагают, что данные опухолевые клетки непосредственно «омываются» кровью и свободно контактируют с терапевтическими макромолекулами, которые иначе не могут пройти через эндотелиальный барьер.
Избирательное направленное действие на сосуды может основываться на различной чувствительности и последующей ответной реакции на воздействие терапевтических средств у опухолевых и нормальных кровеносных сосудов. Альтернативно различный эндоцитоз может способствовать избирательному поглощению цитотоксических и других терапевтических средств. На основании результатов недавно проведенных исследований было высказано предположение о наличии специфических органных/тканевых свойств сосудистых ЕС (Ruoslahti, 2002). Кровеносные сосуды в различных тканях, вероятно, экспрессируют тканеспецифические эндотелиальные маркеры, которые большей частью остаются неизвестными. Патологические процессы, такие как воспаление, ишемия и злокачественное преобразование, также могут накладывать свой «почерк» на соответствующую сосудистую сеть (Ruoslahti, 2002; Ruoslahti and Rajotte, 2000; Ruoslahti, 2000; Rajotte et al., 1998; Arap et al., 1998). Биохимические показатели, которые характеризуют кровеносные сосуды в опухолях, могут включать связанные с ангиогенезом молекулы, такие как некоторые интегрины. Интегрины αvβ3, αvβ5 и α5β1 были идентифицированы в экспрессирующих профилях, типичных для ангиогенных сосудистых ЕС, ассоциированных с опухолями, ранами, воспалительной тканью, и во время ремоделирования сосудов (Brooks et al., 1994a; Brooks et al., 1994b; Brooks et al., 1995; Elceiri and Cheresh, 1999). Также в этом отношении были описаны рецепторы факторов роста эндотелиальных клеток, протеазы, пептидазы, клеточные поверхностные протеогликаны и компоненты внеклеточного матрикса (ЕСМ) (Ruoslahti, 2000). Данный богатый набор гетерогенных молекул и процессов может обеспечивать новые возможности для направленной доставки лекарственных препаратов.
Для достижения данной цели шел поиск различных стратегий. Циркулирующие пептиды, пептидомиметики или антитела, направленные на специфические сайты-мишени в сосудистой сети, являются привлекательными в качестве носителей для лекарственных препаратов и диагностических средств; они обеспечивают теоретические преимущества по сравнению с конъюгатами, которые направлены непосредственно на опухолевые клетки, большей частью расположенные под физиологическими барьерами, такими как стенка кровеносных сосудов.
Chaleix et al., 2003 раскрывают синтез конъюгатов RGD-порфирина в качестве потенциальных кандидатов для применения в ФДТ, в которых неметаллированный порфириновый цикл замещен в каждом из положений 10, 15, 20 4-метилфенилом или ацетилированным глюкозилфенилом и в положении 5 остатком линейного RGD-содержащего пептида, связанного с макроциклом через спейсер.
Избирательное поглощение RGD-содержащих пептидов эндотелиальными и опухолевыми клетками, опосредованное интегринами α v β 3 и α v β 5
Мотив аргинин-глицин-аспарагиновая кислота Arg-Gly-Asp (RGD) компонентов ЕСМ, подобно фибронектину (Pierschbacher and Ruoslahti, 1984) и витронектину, связывается с интегринами (Ruoslahti and Pierschbacher, 1987; D'Souza SE et al., 1991; Joshi et al., 1993; Koivunen et al., 1994). Опосредованная интегрином адгезия приводит к внутриклеточным сигнальным событиям, которые регулируют выживаемость, пролиферацию и миграцию клеток. Известно 25 интегринов и, по меньшей мере, восемь из которых связываются с RGD-мотивом в качестве основной распознающей последовательности в их лигандах.
Данные, полученные при скрининге RGD-содержащих пептидов методом фагового дисплея (Pasqualini and Ruoslahti, 1996), свидетельствуют об их избирательном связывании с эндотелиальным слоем в опухолевых кровеносных сосудах (Ruoslahti, 1996; Pasqualini et al., 1997). Поскольку сообщалось, что экспрессия интегринов является высокой в активированных, но в большей степени ограничивается в покоящихся ЕС, то небольшие синтетические RGD-содержащие пептиды были предложены в качестве антагонистов, нарушающих рост сосудистого эндотелия и опухолевых клеток. Также RGD-пептиды ингибируют передачу сигналов, оказывают влияние на миграцию клеток и индуцируют регрессию и апоптоз опухолевых клеток (Su et al., 2002). RGD-аналоги применяют для визуализации опухолей (Haubner et al., 2001), для антиангиогенных подходов (Kawaguchi et al., 2001; Pasqualini et al., 2000) и для направленной доставки радионуклеотидов (van Hagen et al., 2000) и химиотерапевтических препаратов (Arap et al., 1998; Zitzmann et al., 2002).
Также интегрины экспрессируются на злокачественных клетках и, следовательно, играют важную роль в инвазии, метастазировании, пролиферации и апоптозе раковых клеток. Метастатическое распространение опухолевых клеток в предпочтительные органы может представлять собой явление клеточного хоминга, который зависит от адгезивного взаимодействия опухолевых клеток и органно-специфических эндотелиальных маркеров (Ruoslahti and Rajotte, 2000). Посредством связывания интегрина с эндотелиальными или опухолевыми клетками RGD-пептиды способны модулировать передвижение клеток в условиях in vivo ингибированием соединения ЕСМ опухолевых клеток и ЕС опухолевых клеток, которое является обязательным для метастатического процесса. Результаты нескольких исследований показали, что RGD-содержащие соединения могут нарушать метастатические процессы опухолевых клеток в условиях in vitro (Goligorsky et al., 1998; Romanov and Goligorsky, 1999) и в условиях in vivo (Saiki et al., 1989; Hardan et al., 1993).
Пептиды, которые являются специфическими для отдельных интегринов, представляют большой интерес и возможное медицинское значение. Интегрин αvβ3 был первым интегрином, для которого была показана связь с ангиогенезом в опухолях. RGD-пептиды, которые специфически блокируют интегрин αvβ3, являются потенциальными ингибиторами ангиогенеза в опухолях и сетчатке, остеопороза и их можно использовать для направленной доставки лекарственных препаратов к сосудистой сети опухолей (Assa-Munt et al., 2001). Сочетание противоопухолевого препарата доксорубицина или проапоптотического пептида со связывающимся с интегрином αvβ3 RGD-пептидом обеспечило соединения, которые были более активными и менее токсичными по сравнению с немодифицированными препаратами при тестировании против опухолевых ксенотрансплантатов у мышей (Ruoslahti, 2000; Arap et al., 1998; Arap et al., 2002; Ellerby et al., 1999).
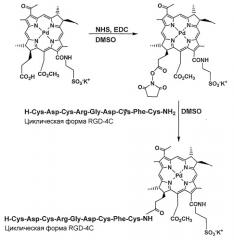
В патенте США №6576239, Европейском патенте 0927045 В1 и заявке WO 98/010795 (все принадлежат Burnham Institute, заявители: E. Ruoslahti and R. Pasqualini) раскрывается конъюгат, содержащий опухолевый пептид хоминга, включающий аминокислотную последовательность RGD или NGR, в котором указанный опухолевый пептид хоминга связан с терапевтическим или диагностическим фрагментом, при условии, что указанная группа не является фаговой частицей. Терапевтический фрагмент может представлять цитотоксическое средство или противоопухолевый химиотерапевтический препарат, такой как доксорубицин. Конъюгат избирательно попадает к ангиогенной сосудистой сети при введении в условиях in vivo. Пептид хоминга опухолей может представлять пептид длиной из 20-30 аминокислот или из 50-100 аминокислот, линейный или циклический. Одним предпочтительным пептидом является циклический нонапептид CDCRGDCFC или Н-Cys*-Asp-Cys*-Arg-Gly-Asp-Cys*-Phe-Cys*-NH2.
Избирательная сосудистая ответная реакция, индуцированная в опухолях фотодинамической терапией (ФДТ)
В последние годы заявителями сообщалось о применении новых производных бактериохлорофилла (Bchl) в качестве сесибилизаторов при ФДТ в научной литературе (Zilberstein et al., 2001; Schreiber et al., 2002; Gross et al., 1997; Zilberstein et al., 1997; Rosenbach-Belkin et al., 1996; Gross et al., 2003a; Koudinova et al., 2003; Preise et al., 2003; Gross et al., 2003b) и в патентных публикациях: патент США №5726169, патент США №5650292, патент США №5955585, патент США №6147195, патент США №6740637, патент США №6333319, патент США №6569846, патент США №7045117, патент Германии 4 121 876, Европейский патент 1 246 826, WO 2004/045492, WO 2005/120573. Спектры, фотофизические и фотохимические свойства производных Bchl сделали их оптимальными молекулами для восприятия света с наличием явных преимуществ по сравнению с другими сенсибилизаторами, которые используются в настоящее время для ФДТ. Данные производные Bchl в большинстве своем являются полярными и остаются в кровотоке в течение очень короткого периода времени, практически без проникновения в другие ткани (Brandis et al., 2003). Следовательно, данные соединения представляют хорошие кандидаты для направленной на сосуды ФДТ, основанной на кратковременном (5-10 мин) внутрисосудистом взаимодействии со светом и более высокой чувствительности опухолевых сосудов к продуцированному ФДТ цитотоксическому эффекту ROS.
Результаты недавно проведенных заявителями исследований показали, что основная фотосенсибилизация имеет место внутри сосудов с быстрым развитием ишемических окклюзий и стаза во время облучения светом. Также данный процесс вызывает фотохимически индуцированное перокисление липидов (LPO) и раннюю гибель ЕС, которые преимущественно имеют место в сосудистой сети опухолей (Gross et al., 2003a; Koudinova et al., 2003). За счет независимого от света протекания свободнорадикальных цепных реакций наряду с развивающейся гипоксией LPO и гибель клеток распространяются ниже сосудистой зоны с вовлечением целого интерстиция опухолей до достижения полного некроза опухолей примерно в течение 24 ч после ФДТ. Следовательно, основное действие ФДТ заключается в блокировании поставки крови и индукция гипоксии, которая инициирует, как вторичное явление, серию молекулярных и патофизиологических событий, которые в итоге приводят к элиминации опухоли.
Митохондрии, лизосомы, плазматические мембраны и ядра клеток расцениваются в качестве потенциальных мишеней при ФДТ. Поскольку большинство сенсибилизаторов для ФДТ не накапливается в ядре клетки, то при ФДТ в целом имеется очень низкая вероятность повреждения ДНК, мутаций и карциногенеза. Гидрофильные сенсибилизаторы, вероятно, поглощаются пиноцитозом и/или эндоцитозом и, следовательно, попадают в лизосомы или эндосомы. Затем воздействие света будет делать лизосомы проницаемыми таким образом, что сенсибилизаторы и гидролитические ферменты высвобождаются в цитозоль (Dougherty et al., 1998).
При ФДТ в течение нескольких минут после воздействия света можно наблюдать повреждение плазматической мембраны. Данный тип повреждения проявляется в набухании, вытекании содержимого из везикул, содержащих ферменты-маркеры плазматической мембраны, цитозольные ферменты и лизосомальные ферменты, снижении активного транспорта, деполяризации плазматической мембраны, ингибировании активности ферментов плазматической мембраны, изменении уровня внутриклеточного Ca2+, положительной и отрицательной регуляции поверхностных антигенов, LPO, которые могут привести к перекрестному сшиванию и повреждению транспортеров многих препаратов (Dougherty et al., 1998).
Сообщения о том, что ФДТ может быстро индуцировать апоптоз, в условиях in vitro и in vivo, обеспечили понимание природы механизма гибели клеток под действием света. Понимание механизма апоптоза после ФДТ является результатом сообщений, указывающих на наличие связи между фотоповреждением митохондрий и апоптозом. Результаты недавно проведенных заявителями исследований показали, что фотосенсибилизаторы на основе Bchl индуцируют активацию апоптотического пути. Однако, вероятно, апоптоз не является причиной гибели клеток, поскольку ингибирование апоптотического пути не спасает клетки (Mazor et al., 2003, неопубликованные данные).
Цитируются следующие патенты и заявки на патент заявителей настоящего изобретения, содержание которых включено в полном объеме в данный документ для сведения: патент США №5726169, патент США №5650292, патент США №5955585, патент США №6147195, патент США №6740637, патент США №6333319, патент США №6569846, патент США №7045117, патент Германии 41 21 876, Европейский патент 1 246 826, WO 2004/045492, WO 2005/120573.
Сущность изобретения
Настоящее изобретение относится к конъюгату RGD-содержащего пептида или RGD-пептидомиметика и фотосенсибилизатора, выбранного из группы, состоящей из порфирина, хлорофилла и бактериохлорофилла, исключая конъюгаты, в которых фотосенсибилизатор является неметаллированным порфирином, замещенных, по меньшей мере, в каждом из положений 10, 15, 20 4-метилфенилом или ацетилированным глюкозилоксифенилом и в положении 5 остатком линейного RGD-содержащего пептида, связанного с порфириновым макроциклом через спейсер.
В одном варианте осуществления фотосенсибилизатор представляет порфирин, предпочтительно тетраарилпорфирин. В другом варианте осуществления фотосенсибилизатор представляет хлорофилл или бактериохлорофилл предпочтительно формул I, II и III.
Изобретение дополнительно относится к диагностической, терапевтической или радиотерапевтической композиции для визуализации, ФДТ или лучевой терапии тканей или органов, содержащей эффективное количество конъюгата фотосенсибилизатор-RGD-пептид по изобретению и фармацевтически приемлемый носитель.
Конъюгаты по изобретению можно использовать в способах диагностики опухолей с использованием различных диагностических методов и в способах фотодинамической терапии опухолей и сосудистых заболеваний и в лучевой терапии опухолей.
Краткое описание фигур
На фиг.1А-1С приведены характеристические спектры конъюгата 11. Фиг.1А: определение масс-спектрометрией. Фиг.1В: анализ спектрофотометрией. Фиг.1С: результаты ВЭЖХ после синтеза (конъюгат 11 представляет пик под номером 3).
На фиг.2А-2С приведены характеристические спектры конъюгата 9. Фиг.2А: электронный спектр в ацетоне. Фиг.2В: масс-спектр: ESI-MS(+) 679(M),702 (M+Na) m/z.
На фиг.3А-3В показана очистка и характеристика Eu-RGD-4C. Фиг.3А: хроматография Eu-RGD-4C (один пик). Фиг.3В: масс-спектрометрия (молекулярная масса изотиоцианатофенил-DTPA-Eu-RGD-4C=1498, стрелки).
На фиг.4 приведены результаты теста оценки связывания с рецептором. Активность специфического связывания свободного Eu-RGD-4C с рецептором интегрина оценивали с использованием клеток H5V при отсутствии (общее связывание) или в присутствии 1 мкМ RGD-4C (неспецифическое связывание).
На фиг.5 показан анализ Scatchard связанного (В) или свободного (F) Eu-RGD-4C результатов теста оценки связывания с рецептором, которые приведены на фиг.4.
На фиг.6 приведены результаты твердофазного рецепторного теста, с помощью которого оценивали связывание Eu-RGD-4C с выделенным рецептором интегрина αvβ3. Использовали разрешенную во времени флуорометрию для определения флуоресценции.
На фиг.7А-7В показано действие RGD-4C на отделение эндотелиальных клеток H5V.
Морфологические изменения клеток регистрировали с использованием световой микроскопии. 5% округленных клеток (n=200) после инкубации при отсутствии (фиг.7А) и 99% таких клеток в присутствии RGD-4C (фиг.7В). После замещения среды на свежую порцию и инкубации в течение 3 ч при 37°С % округленных клеток (n=200) при отсутствии и в присутствии RGD-4C составил соответственно 6 и 8% (не показано).
На фиг.8 показано действие RGD-4C на отделение клеток HUVEC. Морфологические изменения клеток регистрировали с использованием световой микроскопии. Верхние панели а-е представляют результаты фазово-контрастной микроскопии отделения клеток в присутствии RGD-4C в возрастающих концентрациях (а: контроль; b: 25 мкМ; с: 50 мкМ; d: 100 мкМ; е: 200 мкМ). На нижних панелях показано восстановление клеток через 24 ч после замены среды на свежую порцию.
На фиг.9 представлено поглощение клетками и локализация в клетках конъюгата 24 в эндотелиальных клетках H5V, что показано на транс-фотографиях (а), флуоресцентном снимке (b) (длина волны экстинкции: 520 нм; длина волны эмиссии: 780 нм) и при совмещении фотографии и снимка (с).
На фиг.10 приведена серия флуоресцентных снимков, показывающих поглощение клетками и локализацию в клетках конъюгата 24 и соединения 8 в эндотелиальных клетках H5V через 20 мин (верхние панели) или 2,5 ч (нижние панели) после инкубации с соединениями в среде, содержащей 10 или 75% FCS (длина волны экстинкции: 520 нм; длина волны эмиссии: 780 нм). а) соединение 8, 10% FCS; b) соединение 24, 10% FCS; с) соединение 8, 75% FCS; b) соединение 24, 75% FCS.
На фиг.11А-11D приведена серия графиков, показывающих биологическое распределение конъюгата 24, введенного в/в самцам голых мышей CD-1 с опухолевыми ксенотрансплантатами крысиной глиомы С6 (11А; на каждую временную точку приходилось 6 мышей), с мышиной карциномой ободочной кишки CT26luc (11В; на каждую временную точку приходилось 2 мыши) и с мышиной карциномой молочной железы 4T1luc (11С; на каждую временную точку приходилось 3 мыши), мышей убивали в указанные периоды времени. Концентрацию Pd в различных органах определяли ICP-MS. Прямоугольники представляют временные окна, наиболее подходящие для ФДТ и визуализации.
На фиг.12 показано биологическое распределение соединения 8, введенного в/в (в хвостовую вену) самцам голых мышей с опухолевыми ксенотрансплантатами крысиной глиомы С6, мышей убивали в указанные периоды времени. Концентрацию Pd определяли ICP-MS.
На фиг.13 показано биологическое распределение Cu-конъюгата 15 у мышей с опухолью молочной железы MDA-MB-231. Животных убивали в указанные периоды времени. Концентрация Cu показана на выбранные периоды времени, после вычитания значения на 0 время, в виде среднего значения по трем животным.
На фиг.14А-14В представлены графики, показывающие биологическое распределение конъюгата 42 (который содержит RAD-мотив), введенного в/в самцам голых мышей с опухолевыми трансплантатами мышиной карциномы ободочной кишки CT26luc, мышей убивали в указанные периоды времени. Концентрацию Pd в различных органах определяли ICP-MS. На фиг.14А приведены результаты ICP-MS для конъюгата 42. На каждую временную точку приходилось 2 мыши. На фиг.14В приведены те же результаты с выделением определенных интересующих органов (кровь, опухоль, печень, почки и мышечная ткань) по сравнению с результатами, полученными для RGD-конъюгата 24 (см. фиг.11А-11D).
На фиг.15 приведено сравнение NIR флуоресцентного изображения целого тела после введения соединения 8 (верхние панели) или конъюгата 24. Данные снимки показывают флуоресценцию мыши с ксенотрансплантатом крысиной глиомы С6 на внутренней поверхности правой задней конечности (а) через 4 ч, (b) через 24 ч, (с) через 48 ч и (d) через 72 ч после введения конъюгата 24 или соединения 8 в дозе 200 нмоль. Опухоли указаны стрелками, и все снимки нормализованы к одному масштабу.
На фиг.16А-16С приведена фотография (16А), флуоресцентный снимок (16В) и люминесцентный снимок (люцифераза+люциферин; 16С) мыши с подкожным ксенотрасплантатом карциномы ободочной кишки CT26luc (трансфектированной люциферазой) на правой передней конечности через 24 ч после введения конъюгата 24 в дозе 200 нмоль. Флуоресцентные и люминесцентные снимки получали с использованием системы IVIS.
На фиг.17А-17С приведены фотографии (17А) и флуоресцентные снимки (17В) и биолюминесцентные снимки (17С) двух мышей с подкожными трасплантатами мышиной карциномы молочной железы 4T1luc (трансфектированной люциферазой) на правой передней конечности через 24 ч после введения конъюгата 24 в дозе 200 нмоль.
На фиг.18 представлен флуоресцентный снимок мыши с ксенотрансплантатом карциномы яичников MLS через 8 (левая панель) и 14 ч (правая панель) после в/в введения конъюгата 31. Флуоресцентные и люминесцентные снимки получали с использованием системы IVIS.
На фиг.19 представлены флуоресцентные снимки двух мышей с ксенотрансплантатом крысиной глиомы С6 через 24 ч после введения одного конъюгата 24 (левая мышь) или через 1 ч после введения циклоRGDfK пептида в дозе 8,5 мкмоль (правая мышь). Каждую мышь снимали сверху (верхняя панель, слева) и сбоку (верхняя панель, справа). На фотографиях также показано электронное увеличение изображения (нижняя панель). Кружки на флуоресцентных снимках указывают локализацию опухолевого ксенотрансплантата крысиной глиомы С6.
На фиг.20 приведены черно-белые фотографии (верхние панели) и флуоресцентные снимки (нижние панели) самцов голых мышей CD-1 с ксенотрансплантатами CT26luc на внутренней поверхности задней конечности через 24 ч после введения RGD-конъюгата 24 (панели а, с) или RAD-конъюгата 42 (панели b, d). Опухоли указаны стрелками, и все снимки нормализованы к одному масштабу. Флуоресцентные снимки делали с использованием системы IVIS.
На фиг.21 приведены черно-белые фотографии (верхние панели) и флуоресцентные снимки (нижние панели) мышей с ксенотрансплантатами (а) OVCAR 8, (b) CT26luc, (c) MLS и (d) 4T1luc на внутренней поверхности задней конечности через 24 ч после введения конъюгата 24. Опухоли указаны стрелками, и все снимки нормализованы к одному масштабу.
На фиг.22 приведена фотография (верхний снимок, снятый цифровой камерой) и флуоресцентный снимок (нижний снимок) местонахождения конъюгата 24 в метастазах легких опухоли молочной железы 4T1luc у мыши-самки BALB/c через 24 ч после в/в введения конъюгата 24 (в дозе 15 мг/кг). Сигнал NIR флуоресценции от местонахождения конъюгата 24, зарегистрированный с использованием системы Imaging System Xenogen IVIS® 100.
На фиг.23А-23I приведена серия фотографий (а), биолюминесцентных (b) и флуоресцентных (с) снимков метастазов CT26luc в легких у самцов голых мышей CD-1 через 24 ч (А,В), 9 ч (C,D), 4 ч (E,F) после в/в введения конъюгата 24 (в дозе 15 мг/кг). Снимки G, H представляют изображение метастазов CT26luc в легких у самцов голых мышей CD-1, которым не вводили конъюгат. На снимке I самцы голых мышей CD-1 без метастазов легких через 24 ч после в/в введения конъюгата 24. Средний снимок представляет сигнал биолюминесценции, воспроизведенный в результате взаимодействия люциферина с трансфектированными люциферазой опухолевыми клетками. На правом снимке сигнал NIR флуоресценции, происходящий от конъюгата 24, полученный с использованием системы Imaging System Xenogen IVIS® 100. Стрелки указывают на метастазы легких.
На фиг.24 приведены черно-белые фотографии (а), биолюминесцентные (b) и флуоресцентные (с) снимки самцов голых мышей с первичной опухолью на внутренней поверхности левой конечности и метастазами в области около лимфатического узла через 24 ч после в/в введения конъюгата 24 (в дозе 15 мг/кг). Средний снимок представляет сигнал биолюминесценции, воспроизведенный в результате взаимодействия люциферина с трансфектированными люциферазой опухолевыми клетками. На правом снимке сигнал NIR флуоресценции, происходящий от конъюгата 24, с использованием системы Imaging System Xenogen IVIS® 100. Стрелки указывают на метастазы в лимфатических узлах.
На фиг.25А-25С показана кривая зависимости доза-эффект на клетках H5V, инкубированных в течение 90 мин при 37°С с конъюгатом 23 и соединением 10 в концентрации 0-25 мкМ в различных средах: 10% FCS в среде (фиг.25А), культуральной среде DMEM/F12 (фиг.25В) или 10 мкМ BSA в среде (фиг.25С). Выживаемость клеток определяли с использованием теста оценки жизнеспособности с окрашиванием нейтральным красным. Точки представляют средние результаты по трем значениям.
На фиг.26А-26D показаны кривые зависимости доза-эффект на клетках H5V, инкубированных в течение 90 мин при 37°С с соединением 10 (фиг.26А, 26В) или конъюгатом 23 (фиг.26С, 26D) в концентрации 0-25 мкМ при отсутствии или в присутствии избытка свободного циклоRGDfK (от 100-кратного до 1 мМ) в различных средах (10% FCS в среде (фиг.26А, 27С) или 10 мкМ BSA в среде (фиг.26В, 26D)). Выживаемость клеток определяли с использованием теста оценки жизнеспособности с окрашиванием нейтральным красным. Точки представляют средние результаты по трем значениям.
На фиг.27А-27В показаны кривые зависимости доза-эффект на клетках H5V, инкубированных в течение 15 мин при 37°С (фиг.27А) или 4°С (фиг.27В) с конъюгатом 23 в концентрации 0-20 мкМ в 10% FCS в среде при отсутствии или в присутствии избытка свободного циклоRGDfK (от 100-кратного до 1 мМ). Выживаемость клеток определяли с использованием теста оценки жизнеспособности с окрашиванием нейтральным красным. Точки представляют средние результаты по трем значениям.
На фиг.28 показана кривая зависимости доза-эффект на клетках H5V, инкубированных в течение 2 ч при 37°С с конъюгатом 24 в концентрации 0-25 мкМ в культуральной среде DMEM/F12 с 10% FCS. Выживаемость клеток определяли с использованием теста с нейтральным красным. Точки представляют средние результаты по трем значениям.
На фиг.29 показана кривая зависимости доза-эффект на клетках H5V, инкубированных в течение 90 мин при 37°С с конъюгатом 11 или соединением 8 (Pd-MLT) в концентрации 0-20 мкМ в 10 мкМ BSA в среде. Выживаемость клеток определяли с использованием теста оценки жизнеспособности с окрашиванием нейтральным красным. Точки представляют средние результаты по трем значениям.
На фиг.30А-30В показаны кривые зависимости доза-эффект на клетках H5V, инкубированных в течение 90 мин при 37°С с конъюгатом 11 (фиг.30А) или соединением 8 (фиг.30В) в концентрации 0-10 мкМ в 10 мкМ BSA в среде при отсутствии или в присутствии избытка RGD-4C (1 мМ). Выживаемость клеток определяли с использованием теста оценки жизнеспособности с окрашиванием нейтральным красным. Точки представляют средние результаты по трем значениям.
На фиг.31А-31Е приведены изображения опухолевых ксенотрансплантатов глиомы С6, обработанных конъюгатом 24 или соединением 8. Самцов голых мышей CD-1 с ксенотрансплантатами глиомы С6 обрабатывали следующим образом: 31А - конъюгат 24 в/в вводили в дозе 15 мг/кг, 15 мин облучение светом (90 Дж/см2) через 8 ч после введения препарата; верхние панели: (а) перед ФДТ; (b) через 2 суток после ФДТ; (с) через 3 суток после ФДТ; (d) через 4 суток после ФДТ; нижние панели: (а) через 7 суток после ФДТ; (b) через 9 суток после ФДТ; (с) через 14 суток после ФДТ; (d) через 18 суток после ФДТ. 31В - конъюгат 24 в/в вводили в дозе 24 мг/кг, 10 мин облучение светом (60 Дж/см2) через 8 ч после введения препарата; а, b, c и d в верхних и нижних панелях, как для фиг.31А. 31С - темновой контроль - конъюгат 24 в/в вводили без облучения светом; (а) перед ФДТ; (b) через 5 суток после ФДТ. 31D - световой контроль - облучение светом без введения фотосенсибилизатора; (а) перед ФДТ; (b) через 5 суток после ФДТ. 31Е - контроль неконъюгированный фотосенсибилизатор - соединение 8 в/в вводили в дозе 9 мг/кг, 10 мин облучение светом (60 Дж/см2) через 8 ч после введения препарата; (а) перед ФДТ; (b) через 11 суток после ФДТ. Снимки делали в указанные периоды времени после ФДТ.
На фиг.32А-Е представлены результаты терапии при применении конъюгата 24 в дозе 15 мг/кг, 10 мин облучение светом (60 Дж/см2) через 8 ч после введения препарата мышам с опухолями CT26luc. 32А - конъюгат 24 в/в вводили мышам в дозе 15 мг/кг, 10 мин облучение светом (60 Дж/см2) через 8 ч после введения препарата; (а) перед ФДТ; (b) через 1 сутки после ФДТ; (с) через 4 суток после ФДТ; (d) через 8 суток после ФДТ; (е) через 12 суток после ФДТ; (f) через 19 суток после ФДТ. 32В - совмещенные снимки, сделанные после в/в введения люциферина мыши, описанной для фиг.32А, с использованием системы IVIS. Первый снимок черно-белый, который представляет фотографию животного. Второй снимок цветное совмещение испущенных фотонов. Все снимки нормализованы к одному масштабу; (а) перед ФДТ; (b) через 1 сутки после ФДТ; (с) через 4 суток после ФДТ; (d) через 8 суток после ФДТ. 32С - количественное определение сигнала биолюминесценции (фотон/сек/см2) по данным, приведенным на фиг.32В. 32D - контроль с одним соединением 8: мышам в/в вводили соединение 8 и через 8 ч облучали светом; (а) перед ФДТ; (b) через 2 суток после ФДТ. 32Е - контроль со смесью соединения 8 и циклоRGDfK: мышам в/в вводили смесь соединения 8 с циклоRGDfK и через 8 ч облучали светом; (а) перед ФДТ; (b) через 2 суток после ФДТ. 32F- контроль с одним циклоRGDfK: мышам в/в вводили циклоRGDfK и через 8 ч облучали светом; (а) перед ФДТ; (b) через 2 суток после ФДТ. Снимки делали в указанные периоды времени после ФДТ.
На фиг.33 представлена кривая Kaplan-Mayer для протоколов, приведенных в таблице 5, отмеченных звездочкой.
На фиг.34А-34В показан флуоресцентный клон карциномы молочной железы MDA-MB-231-RFP (резистентный к гигромицину) соответственно после экспозиции в течение 1 и 3 сек.
На фиг.35А-35В показаны два показательных примера локальной реакции человеческой карциномы молочной железы MDA-MB-231-RFP к ФДТ. Мышам с ксенотрансплантатами MDA-MB-231-RFP (~0,5 см3) в области спины в/в вводили конъюгат 13 в дозе 7,5 мг/кг и облучали светом через 8 ч через кожу. 35А - фотографии, сделанные на (а) 0 сутки (перед обработкой) и после обработки на (b) 1, (с) 4, (d) 7, (e) 12 и (f) 90 сутки. На 4 сутки имел место частичный некроз, на 7 сутки опухоли становились плоскими, через 90 суток рана заживала и животное выздоравливало. Справа фотографии мыши на 0 сутки и через 90 суток. 35В - красное флуоресцентное изображение всего тела самцов голых мышей CD-1 с ортотопической опухолью MDA-MB-231-RFP. Фотографии сделаны в те же периоды времени, что и приведенные на фиг.35А. Через 90 суток после обработки сигнал отсутствовал.
На фиг.36 показано накопление конъюгата 13 в ортотопической человеческой первичной опухоли молочной железы MDA-MB-231-RFP (размер опухолей ~1 см3). Снимки делали в период от 15 мин до 24 ч после введения препарата. Верхние панели - красное флуоресцентное изображение целого тела самок голых мышей с ортотопической опухолью MDA-MB-231-RFP. Нижние панели - NIR флуоресцентное изображение целого тела самок голых мышей по накоплению конъюгата 13. Отсутствовало специфическое накопление препарата в опухоли в течение первых 24 ч. а-i - 15 мин; 1 ч; 2 ч; 3 ч; 4,5 ч; 6 ч; 7,5 ч; 9 ч; 24 ч.
На фиг.37 показано накопление конъюгата 13 в ортотопической человеческой первичной опухоли молочной железы MDA-MB-231-RFP (размер опухолей ~1 см3). Снимки делали в период от 1 до 6 суток после введения препарата. Верхние панели - красное флуоресцентное изображение целого тела самок голых мышей с ортотопической опухолью MDA-MB-231-RFP. Нижние панели - NIR флуоресцентное изображение целого тела самок голых мышей по накоплению конъюгата 13. Имело место накопление препарата в опухоли с максимальной концентрацией в опухоли, начиная со 2 суток после введения препарата. а-i - 1