Способ определения антибактериальной активности хитозана
Иллюстрации
Показать всеИзобретение относится к биохимии. Предложен способ определения антибактериальных свойств хитозана путем оценки его минимальной бактериостатической и/или бактерицидной концентрации. Готовят комплексные буферные растворы на основе трех органических кислот MES, ACES и TES с различным уровнем рН. Готовые буферные растворы добавляют в емкости. Затем готовят двукратные разведения хитозана в емкостях с буферными растворами. Добавляют к растворам хитозана в буфере аликвоты бактериальной суспензии в жидкой питательной среде. Инкубируют растворы в течение 24 ч при оптимальной для роста бактерий температуре. Определяют после проведения инкубации минимальную бактериостатическую и/или минимальную бактерицидную концентрацию хитозана посредством определения наличия роста культуры или уменьшения количества выживших клеток соответственно. Изобретение позволяет определять антибактериальные свойства хитозана в широком диапазоне значений рН от 5,50 до 8,00 при отсутствии необходимости использования различающихся по химическому составу буферов. 5 ил., 2 пр.
Реферат
Изобретение относится к микробиологии и может быть использовано для определения антибактериальных свойств хитозана путем оценки его минимальной бактериостатической и/или бактерицидной концентраций в широком диапазоне уровней кислотности среды.
Стандартное определение антибактериальной активности веществ сводится к оценке их минимальной бактериостатической и/или минимальной бактерицидной концентраций в отношении бактерий, которое заключается в приготовлении в емкостях растворов исследуемых веществ с различными концентрациями посредством двукратных разведений в заранее подобранных буферных растворах, последующем добавлении в емкости бактериальной суспензии в жидкой питательной среде, инкубации при оптимальной для роста бактериальной культуры температуре, определении после завершения инкубации наличия или отсутствия роста культуры для оценки бактериостатического эффекта вещества и/или уменьшения количества живых клеток для оценки бактерицидного эффекта вещества. При этом за минимальную бактериостатическую концентрацию вещества принимают ту минимальную концентрацию вещества, при которой не наблюдается визуального роста бактериальной культуры - раствор не мутнеет, не появляется осадок из бактериальных клеток и т.п. За минимальную бактерицидную концентрацию вещества принимают ту минимальную концентрацию вещества, при которой количество живых бактериальных клеток по сравнению с их количеством в первоначальном инокуляте уменьшается в 1000 и более раз (на 99,9% и более), или иное количество раз в зависимости от методических требований. Количество живых клеток определяют посредством посева аликвот суспензий на твердые питательные среды с последующим подсчетом выросших колоний.
Однако имеющиеся на сегодня методы оценки минимальных бактериостатических и/или минимальных бактерицидных концентраций веществ в отношении бактерий являются малопригодными для исследования антибактериальной активности хитозана - природного поликатиона, состоящего из остатков D-глюкозамина и N-ацетил-D-глюкозамина, соединенных 1,4-β-гликозидными связями. Поскольку, во-первых, хитозан является полиаминосахаридом, вследствии чего его антибактериальные свойства сильно зависят от кислотности среды, которая определяет положительный заряд его свободных аминогрупп. Во-вторых, молекулы хитозана различаются своей степенью полимеризации, которая определяет их константу диссоциации рКа, поэтому при одинаковых условиях кислотности среды имеет место различная степень заряда молекул с различной молекулярной массой. В-третьих, хитозан, являющийся природным сополимером ацетилглюкозамина и глюкозамина, представляет собой гетерогенную группу веществ, различающихся по молекулярной массе (или степени полимеризации), степени ацетилирования, расположению ацетилированных звеньев вдоль полимерной цепи, вязкости [2, 3]. Таким образом, антибактериальные свойства зависят как от сочетаний нескольких основных физико-химических характеристик самого хитозана и кислотности среды, но одновременно для различных образцов антибактериальная активность может иметь различный характер изменения при изменении кислотности среды. Кроме того, обычно антибактериальные свойства веществ на практике исследуются при значениях рН в диапазоне от слабокислых (рН 5,50) до слабощелочных (рН 8,00), однако, в исследованиях по антибактериальной активности хитозанов не используются буферные системы, непрерывно перекрывающие данный диапазон. Чаще всего используется натрий-ацетатный или калий-ацетатный буферные системы, которые обладают буферными свойствами только до значения рН 6,5 [4]. Иногда используют буферную систему, основанную на натриевой соли морфолинэтансульфоновой кислоты, которая создает буферную систему в диапазоне рН от 5,50 до 6,70 [5]. Применению натрий- или калий-фосфатного растворов, которые обладают хорошими буферными свойствами как в слабокислой, так и в слабощелочной области, препятствует склонность хитозана выпадать в осадок при взаимодействии с фосфатами. Таким образом, на сегодняшний момент отсутствует единый подход к оценке бактериостатических и/или минимальных бактерицидных концентраций хитозана, который бы учитывал высокую степень варьирования его антибактериальных свойств в зависимости от кислотности среды.
Задачей заявленного изобретения является разработка способа, позволяющего определять антибактериальные свойства хитозана путем оценки его минимальной бактериостатической и/или бактерицидной концентрации в широком диапазоне уровней кислотности среды (от 5,50 до 8,00).
Поставленная задача достигается путем разработки способа определения антибактериальных свойств хитозана путем оценки его минимальной бактериостатической и/или бактерицидной концентрации, который предусматривает подготовку комплексных буферных растворов на основе трех органических кислот - морфолинэтансульфоновой - MES (morpholineethanesulfonic acid), N-(2-ацетамидо)-2-аминоэтансульфоновой -ACES (N-(2-acetamido)-2-aminoethanesulfonic acid), 2-[трис(гидроксиметил)метиламино]-1-этансульфоновой - TES (2-[Tris(hydroxymethyl)methylamino]-1-ethanesulfonic acid) в эквимолярном соотношении (1 часть MES, 1 часть ACES, 1 часть TES) с различным уровнем рН в пределах от 5,50 до 8,00, которые создаются посредством добавления к водному раствору данных органических кислот необходимого количества концентрированного раствора гидроксида натрия, добавления готовых буферных растворов в емкости (например, лунки планшета), приготовления двукратных разведений хитозана в емкостях с буферными растворами, добавления к растворам хитозана в буфере аликвот бактериальной суспензии в жидкой питательной среде, инкубации растворов в течение 24 ч при оптимальной для роста бактерий температуре, оценки после проведения инкубации минимальных бактериостатических и/или минимальных бактерицидных концентраций хитозана посредством определения наличия роста культуры или уменьшения количества выживших клеток соответственно.
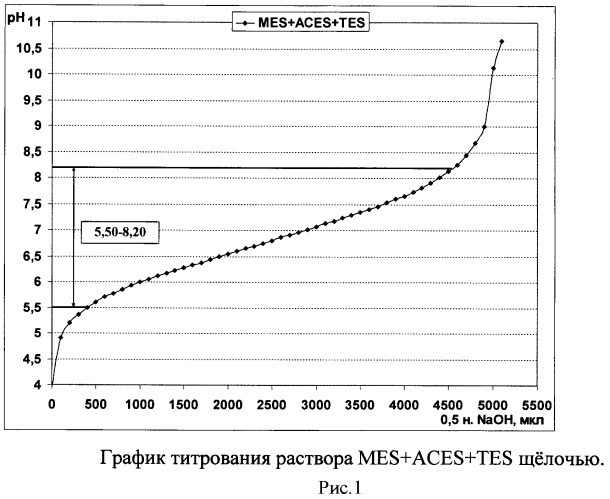
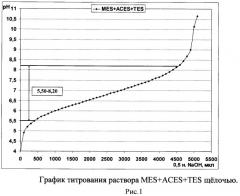
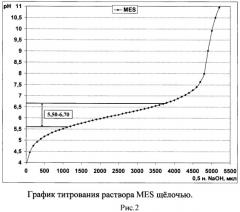
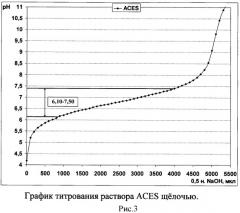
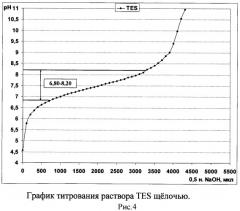
Комплексная буферная система на основе MES, ACES и TES позволяет поддерживать кислотность среды в интервале значений рН от 5,50 до 8,00 (рис.1), состоящем из интервалов значений рН, которые стабильно поддерживают данные кислоты по отдельности (рис. 2-4). Таким образом, использование комплексного буферного раствора MES-ACES-TES-Na позволяет оценивать антибактериальную активность хитозана в том диапазоне кислотности среды, который недоступен для образования другими известными буферными системами на основе иных компонентов и подходящих для создания растворов хитозанового полимера без выпадения его в осадок.
Техническим результатом заявленного изобретения является разработка способа определения антибактериальных свойств хитозана путем оценки его минимальной бактериостатической и/или бактерицидной концентрации в широком диапазоне уровней кислотности среды, обладающего хорошей воспроизводимостью результатов и отсутствием необходимости использования различающихся по химическому составу буферов для создания различающихся по уровню кислотности растворов.
Пример 1. Определение минимальных бактериостатических концентраций в зависимости от рН среды для хитозанов с различной степенью полимеризации в отношении Staphylococcus epidermidis. В 96-луночный круглодонный планшет вносят по 50 мкл 0,15 М MES-ACES-TES-Na буфера. В вертикальный стрип №1 вносят буфер с рН 5,50; в вертикальный стрип №2 вносят буфер с рН 5,75; в вертикальный стрип №3 вносят буфер с рН 6,00; в вертикальный стрип №4 вносят буфер с рН 6,25; в вертикальный стрип №5 вносят буфер с рН 6,50; в вертикальный стрип №6 вносят буфер с рН 6,75; в вертикальный стрип №7 вносят буфер с рН 7,00; в вертикальный стрип №8 вносят буфер с рН 7,25; в вертикальный стрип №9 вносят буфер с рН 7,50; в вертикальный стрип №10 вносят буфер с рН 7,75; в вертикальный стрип №11 вносят буфер с рН 8,00. В верхние лунки каждого стрипа вносят по 50 мкл водного раствора хитозана со степенью полимеризации, равной 4 (из расчета конечной концентрации 1000 мкг/мл). Образцы хитозанов со степенью полимеризации 34 и 116 наносим в другие планшеты, заполненные буферными растворами по аналогичной схеме. Производим последовательные двукратные разведения хитозана посредством переноса 50 мкл смеси из первой лунки во вторую и так далее. Нижние лунки каждого стрипа не используют в разведении хитозана и оставляют их в качестве отрицательного контроля. Потом добавляют во все лунки по 100 мкл мясопептонного бульона, содержащего суспензию бактерий S. epidermidis (из расчета конечной концентрации 2x105 КОЕ/мл). Инкубируют планшеты в течение 24 ч при 37°С. После инкубации оценивают минимальные бактериостатические концентрации для каждого из образцов хитозана посредством визуальной (или с помощью спектрофотометра) регистрации отсутствия/наличия роста бактериальной культуры в лунках планшета с различной концентрацией полимера. Полученные результаты приведены на рисунке 5.
Пример 2. Определение минимальных бактерицидных концентраций в зависимости от рН среды для хитозанов с различной степенью полимеризации в отношении Staphylococcus epidermidis проводят аналогично примеру 1, но после инкубации оценивают количество живых бактериальных клеток в лунках планшета и сравненивают с их количеством в первоначальном инокуляте.
ЛИТЕРАТУРА
1. Liu X.F., Guan Y.L., Yang D.Z., Li Z., Yao K.D. Antibacterial action of chitosan and carboxymethylated chitosan. J. Appl. Polym. Sci. 2001. V.79. P.1324-1335.
2. Tharanathan R.N., Kittur F.S. Chitin - the undisputed biomolecule of great potential. Crit. Rev. Nutr. 2003. V.43. P.61-87.
3. Куликов С.Н., Тюрин Ю.А., Албулов А.И., Лопатин С.А., Варламов В.П. Антибактериальная активность хитозана: практика и теория. / Материалы 9-й международной конференции «Современные перспективы в исследовании хитина и хитозана», Ставрополь, 13-17 октября 2008 г., С.184-187.
4. Герасименко Д.В., Авдиенко И.Д., Банникова Г.Е., Зуева О.Ю., Варламов В.П. Антибактериальная активность водорастворимых низкомолекулярных хитозанов в отношении различных микроорганизмов. Прикл. биохим. микробиол. 2004. Т.40. №3. С.301-306.
5. Raafat D., Bargen K.,Haas A., Sahl H. Insight into the mode of action of chitosan as an antibacterial compound. Appl. Env. Microbiol. 2008. V:74. №12. P.3764-3773.
Способ определения антибактериальных свойств хитозана путем оценки его минимальной бактериостатической и/или бактерицидной концентрации, характеризующийся тем, что используют комплексные буферные растворы на основе трех органических кислот MES, ACES и TES, которые добавляют в емкости, затем готовят двукратные разведения хитозана в емкостях с буферными растворами, добавляют к растворам хитозана в буфере аликвоты бактериальной суспензии в жидкой питательной среде, инкубируют растворы в течение 24 ч при оптимальной для роста бактерий температуре, определяют после проведения инкубации минимальную бактериостатическую и/или минимальную бактерицидную концентрацию хитозана посредством определения наличия роста культуры или уменьшения количества выживших клеток соответственно.