Способ проведения исследования для диагностики злокачественного новообразования
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к онкологии. Для диагностики злокачественного новообразования проводят исследование цитологического препарата методом атомно-силовой микроскопии (АСМ). При проведении АСМ измеряют вертикальные размеры клеточных элементов, нормируют эти размеры. Подсчитывают значения характеристических функций от нормированных размеров измеренных клеточных элементов. На основании критерия близости подсчитанных значений характеристических функций их референтным значениям, поставленным в соответствие тем или иным заболеваниям, в том числе злокачественным новообразованиям, ставят или исключают диагноз злокачественного новообразования. Способ повышает достоверность диагностики злокачественного новообразования за счет объективизации данных цитологического исследования, повышения точности и воспроизводимости измерений. 4 з.п. ф-лы, 2 ил., 1 пр.
Реферат
Изобретение относится к медицине, в частности к онкологии, и описывает процедуру проведения диагностического исследования, включающего в себя измерения элементов цитологических препаратов, математическое моделирование условий пробоподготовки цитологических препаратов и учет вариабельности этих условий и позволяющего установить или исключить диагноз злокачественного новообразования различной локализации.
Известен целый ряд способов и исследований с применением оптической микроскопии, проведение которых позволяет подтвердить или опровергнуть диагноз злокачественного новообразования. Среди них одно из самых значимых мест занимает цитологическое исследование биоптата или соскоба из очага поражения. Однако данное исследование на некоторых своих этапах является субъективным (оценка относительных и абсолютных размеров клеточных элементов, трудности учета неизбежной вариабельности условий подготовки материала, что приводит к вариабельности как цветовых, так и размерных характеристик клеток препарата).
Известен подход к распознаванию в процессе диагностического поиска трехмерной структуры исследуемой ткани на основе компьютерного анализа изображений последовательных гистологических срезов (Rene Albert, Tomas Schinderwolf, Irith Baumann, Harry Harms., Three-Dimensional Image Processing for Morphometric Analysis of Epithelium Sections. Cytometry 13:759-765 (1992)). Способ содержит в себе два возможных источника погрешностей, которые могут оказаться критическими при исследовании деталей клетки: во-первых, объемная структура клетки не измеряется прямо, а строится программой, во-вторых, точность построения ограничена снизу толщиной срезов, которые готовит микротом. Попытки повысить точность за счет использования ультрамикротомов приводят к необходимости применения указанных дорогостоящих устройств, а также к быстрому росту трудоемкости на гистологическом этапе и к росту вычислительной сложности программных алгоритмов. В качестве примера укажем, что для построения трехмерного образа клетки размером 10 микрометров (довольно обычный и не самый большой размер) с разрешением 10 нанометров (типичное разрешение, достигаемое предлагаемым способом исследований) необходимо с высокой точностью (10 нанометров) подготовить, микроскопировать и совместно обработать программным алгоритмом не менее 1000 гистологических препаратов.
Предложенный способ направлен на преодоление недостатков ранее известных способов проведения исследования для установки или исключения диагноза злокачественного новообразования.
Целью изобретения является создание способа, регламентирующего проведение нового вида исследования, позволяющего с высокой объективностью и достоверностью установить или исключить диагноз злокачественного новообразования.
Технический результат, достигаемый при использовании предложенного способа, заключается в объективизации данных цитологического исследования, повышении достоверности выявления раковых клеток в цитологических образцах ткани, повышении точности и воспроизводимости измерений.
Указанный технический результат достигается за счет использования следующих преимуществ предложенного способа по сравнению с ранее известными способами:
1. Повышение разрешающей способности до нескольких нанометров как по горизонтали, так и по вертикали. Для сравнения: в силу теоретических ограничений разрешающая способность оптической микроскопии составляет 200-300 нанометров по горизонтали. Измерение высоты объектов средствами оптической микроскопии невозможно.
2. Построение объемного образа клетки с указанной высокой точностью осуществляется в ходе непосредственных измерений единственного цитологического препарата, а не в результате математической обработки множества плоских изображений отдельных препаратов, как это производится в упомянутом выше способе. Это приводит к кардинальному уменьшению трудоемкости получения результата на этапе пробоподготовки (один препарат, а не тысячи). Кроме того, учет непосредственно измеренной объемной информации открывает доступ к использованию в процессе диагностического поиска различных выработанных ранее объективных характеристик поверхностей клеточных элементов, таких как шероховатость.
3. Математическое моделирование и учет вариабельности условий подготовки препарата (нормировка).
Все три указанных преимущества достигаются применением в процессе проведения исследования атомно-силовой микроскопии (АСМ).
Известен способ проведения исследования для установки или исключения диагноза злокачественного новообразования (способ принят за ближайший аналог изобретения), включающий проведение АСМ и основанный на изучении сил адгезии мембран клеток к зонду атомно-силового микроскопа (Igor Sokolov et al., Towards Nonspecific Detection of Malignant Cervical Cells with Fluorescent Silica Beads, Small. 2009 Oct; 5(20):2277-84). Данный способ основан на предположении, что силы адгезии различаются для раковых клеток и здоровых клеток той же локализации. Однако описанный в вышеуказанном источнике способ также не лишен недостатков: так, наиболее информативной для распознания раковых клеток является разница в силах адгезии, определяемых лиганд-рецепторными взаимодействиями. Это значит, что на зонд должен быть прикреплен лиганд, комплементарный к рецепторам, находящимся в большом (по сравнению со здоровой тканью) количестве на исследуемом образце. Как минимум это приводит к появлению дорогостоящей операции прикрепления к серийно выпускаемому промышленностью зонду нужных лигандов. Кроме того, данный способ не имеет указанных выше трех преимуществ перед известными ранее способами (разрешающая способность, непосредственное измерение объемных параметров, учет особенностей пробоподготовки).
Предложенный способ осуществляется следующим образом:
Для постановки диагноза используются цитологические препараты, окрашенные и неокрашенные, полученные путем соскоба, тонкоигольной биопсии и других манипуляций, позволяющих получить цитологический материал.
На первом этапе исследования осуществляется выбор характеристических функций от морфологических параметров клеток. Функции выбираются так, чтобы их значения различались для злокачественных процессов определенной локализации и для тех состояний органов и тканей той же локализации, с которыми необходимо проводить дифференциальный диагноз на этапе диагностического поиска. Примерами характеристических функций являются: толщина цитоплазмы, высота ядра, отношение высоты ядра к высоте цитоплазмы, параметры шероховатости поверхностей клеточных элементов (ядра, цитоплазмы) и т.п., то есть вертикальные размеры (высоты) элементов клетки, измеренные посредством АСМ, и математические функции от этих размеров (например, их отношение друг к другу).
Далее для каждой функции выполняются измерения клеточных элементов и вычисления значений этой функции на материале клеток, в отношении которых другими способами установлена их принадлежность к злокачественным или такая принадлежность опровергнута. При этом вычисляются средние значения функций и стандартные отклонения значений функций, соответствующие тем или иным состояниям исследуемой ткани. Среднее значение и стандартное отклонение определяют тот интервал значений характеристической функции для конкретного состояния ткани, при попадании в который делается вывод о наличии указанного состояния. При выборе характеристических функций предпочтение следует отдавать тем, которые имеют непересекающиеся интервалы для различных клинически значимо различающихся состояний. Введение процедуры нормировки приводит к уменьшению стандартных отклонений и тем самым повышает точность дифференциальной диагностики.
На втором этапе проводят исследование цитологического препарата (или набора препаратов), содержащего клетки подозрительного на наличие злокачественного процесса очага поражения. Данный этап включает в себя измерения клеточных элементов путем АСМ, подсчет характеристических функций и собственно постановку диагноза. Постановка диагноза осуществляется на основе того, в какой из интервалов (определенных на первом этапе) попадают значения характеристических функций, подсчитанных для данного конкретного препарата (или набора препаратов).
Первый этап исследования выполняется один раз для каждой локализации (щитовидная железа, молочная железа, шейка матки и т.д.). Второй этап выполняется не менее одного раза для каждого цитологического препарата, подвергаемого исследованию.
Предложенное исследование не предполагает каких-либо специальных требований к пробоподготовке цитологических препаратов. Наоборот, одним из преимуществ изобретения является возможность получения дополнительной (по сравнению с тем, что дает световая микроскопия) информации из рутинных препаратов, которые могут быть приготовлены в любой цитологической лаборатории. Поэтому в предложенный способ проведения исследования дополнительно включены процедуры нормировки результатов измерений, которые переносят выполнение задач стандартизации высот (вертикальных размеров) с этапа пробоподготовки на этап обработки информации. Процедуры нормировки выполняются как на первом этапе, так и на втором.
Процедура нормировки является необходимой частью проводимого исследования по следующим причинам:
Если в процессе подготовки цитологического препарата он какое-то время находится в гипотонической среде, сквозь мембраны клеток внутрь проникает вода и размеры клеток увеличиваются. В силу разницы концентраций сухого вещества в цитоплазме клетки и в ее ядре указанное увеличение происходит в разной степени для различных клеточных элементов. Если время пребывания в гипотонической среде и/или выраженность гипотоничности растворов при пробоподготовке варьируются для разных порций биологического материала, взятых в одно время из одного патологического очага, вертикальные размеры одних и тех же клеточных элементов могут оказаться разными, что приведет к диагностическим ошибкам. Следовательно, необходимо корректировать эти размеры для элиминации возможностей диагностических ошибок: «сильно» уменьшать для тех препаратов, которые подверглись интенсивному воздействию гипотонического раствора, «немного» уменьшать для тех, которые подверглись не очень интенсивному воздействию, и увеличивать, если воздействия гипотонического раствора в процессе пробоподготовки не было, а напротив, имело место «подсушивающее» действие гипертонического раствора. Это и есть процедура нормировки, осуществление которой возможно разными способами. Нами в предложенном способе исследования процедура нормировки осуществляется с использованием эритроцитов, которые встречаются в большинстве цитологических препаратов. В случае их отсутствия в препарате их можно в препарат подмешать, взяв следы крови если не из очага поражения, то из любого здорового места.
Эритроциты чутко реагируют на «осмотическую историю» пробоподготовки: их форма меняется от «кратера» с дном на уровне подложки до практически «таблетки» с небольшим углублением посередине.
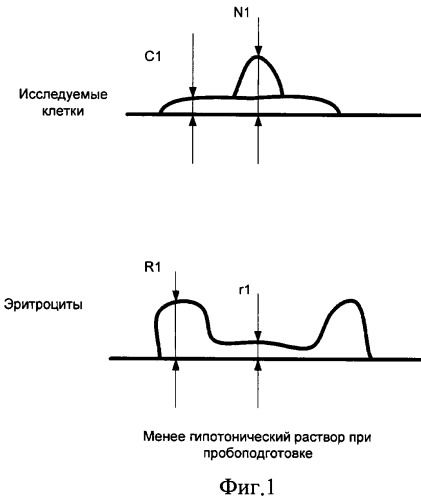
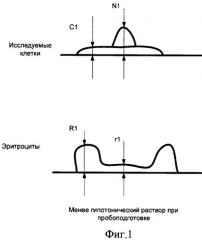
Нами предложено при использовании вертикальных размеров клеточных элементов в вычислениях для установки диагноза наличия или отсутствия злокачественного новообразования подвергать их преобразованию (нормировке) путем умножения измеренной величины на число (нормирующий множитель), зависящее от характерных размеров эритроцитов в препарате, например от средней высоты дна кратера над подложкой (см. фиг 1, фиг.2). Для определения этих характерных размеров эритроцитов предложено в ходе диагностического исследования измерять с применением АСМ не только клетки исследуемого очага, но и эритроциты, находящиеся совместно с указанными клетками в цитологическом препарате.
Таким образом, нами введено понятие «нормирующий множитель». Физический смысл этого понятия - величина, показывающая на сколько необходимо умножить измеренное значение высоты клеточного элемента для того чтобы получить нормированное значение. Из смысла введенного понятия следуют очевидные требования к любой процедуре вычисления данного множителя:
1. «Нормировочный множитель» должен монотонно неубывающе зависеть от степени насыщенности эритроцитов того же цитологического препарата жидкостью (от степени «набухания» эритроцитов - ρ).
2. Процедура нормировки должна быть построена таким образом, чтобы после ее выполнения нормированная высота клеточного элемента данной клетки получалась бы одной и той же при любой степени набухания эритроцитов. Выполнение этого требования и означает элиминацию зависимости высот клеточных элементов от предыстории подготовки цитологического препарата с воздействием гипотонических или гипертонических растворов. Очевидно, такие преобразования всегда существуют; например это преобразование, приводящее высоту клеточного элемента к высоте данного элемента живой клетки в нативном состоянии.
Целью введения процедуры нормировки не является нахождение способа вычисления нативных величин клеточных элементов. Цель введения процедуры нормировки - уменьшение вариабельности высот клеточных элементов, измеренных для разных цитологических препаратов или участков одного препарата с различными осмотическими предысториями.
Выше введено понятие «нормировочного множителя» как отношения
где Энорм - нормированная высота клеточного элемента,
Эизм - измеренная высота клеточного элемента.
Теперь введем понятие «нормировочного коэффициента». Будем искать нормирующее преобразование (которое должно отвечать условиям 1 и 2) в виде конкретного аналитического выражения. «Нормировочным коэффициентом» будет один из коэффициентов этого выражения.
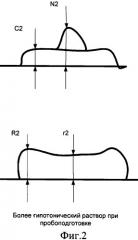
Введем несколько условных обозначений. Пусть имеется несколько (не менее двух) цитологических препаратов, взятых из одного и того же очага поражения и различающихся по длительности пребывания в гипотоническом или гипертоническом растворе в процессе пробоподготовки. На фигурах 1 и 2 представлены размеры исследуемых клеток и эритроцитов при подсчете нормировочного коэффициента на основе цитологических препаратов с двумя различными гипотоническими растворами:
С1 - средняя толщина цитоплазмы клетки после процесса пробоподготовки с меньшим сроком пребывания клеток в гипотоническом растворе;
С2 - средняя толщина цитоплазмы клетки после процесса пробоподготовки с большим сроком пребывания клеток в гипотоническом растворе;
N1 - средняя высота ядра клетки после процесса пробоподготовки с меньшим сроком пребывания клеток в гипотоническом растворе;
N2 - средняя высота ядра клетки после процесса пробоподготовки с большим сроком пребывания клеток в гипотоническом растворе;
R1 - высота периферической части эритроцита после процесса пробоподготовки с меньшим сроком пребывания клеток в гипотоническом растворе;
r1 - высота внутренней части эритроцита после процесса пробоподготовки с меньшим сроком пребывания в гипотоническом растворе;
R2 - высота периферической части эритроцита после процесса пробоподготовки с большим сроком пребывания клеток в гипотоническом растворе;
r2 - высота внутренней части эритроцита после процесса пробоподготовки с большим сроком пребывания клеток в гипотоническом растворе.
Нами предложено искать «нормировочный множитель» для конкретной измеряемой клетки в виде:
где - среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита для того цитологического препарата, в котором и находится клетка; назовем эту величину «степенью набухания эритроцитов»;
Р - константа, физический смысл которой обозначить, какой показатель набухания эритроцитов взят в качестве начального (до воздействия гипотонических или гипертонических растворов);
α - нормировочный коэффициент, поставленный в соответствие данному клеточному элементу клеток данной локализации.
Процедура определения нормировочных коэффициентов на первом этапе проводится для каждой локализации патологических очагов, подлежащих диагностике.
1. В ходе непосредственных измерений клеточных элементов на двух цитологических препаратах, подготовленных с разными интенсивностями воздействия гипотонического окружения, но содержащих клетки, взятые из одного патологического очага, определяются величины C1, C2, R1, r1, R2, r2, N1, N2. Измерения проводятся методом АСМ.
2. Вычисляем цитоплазматический нормировочный коэффициент по формуле:
где (среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита для препаратов, i∈(1, 2)). Среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита вычисляется после проведения измерений эритроцитов с применением АСМ. Вместо точных средних значений допускается использование статистических оценок.
Легко видеть, что подсчитанный по формуле (II) нормировочный коэффициент является решением уравнения:
С1(1+α(ρ1-Р))=С2(1+α(ρ2-Р)),
которое, в свою очередь, является формальной записью условия 2 из требований к процедуре вычисления нормировочного множителя для точек ρ1 и ρ2 на оси ρ.
Постоянство значения любого нормировочного коэффициента, в том числе и подсчитанного по формуле (II), предполагает линейную зависимость нормировочного множителя (формула (I)) от степени набухания эритроцитов. Если указанная зависимость не является линейной (нормировочный коэффициент сам зависит от степени набухания эритроцитов), предлагается нормировочный коэффициент конкретного клеточного элемента находить в виде аналитической функции от степени набухания эритроцитов А(ρ), вид которой определяется после выполнения АСМ-измерений при наличии в распоряжении исследователя не менее трех (n>2) цитологических препаратов, взятых из одного патологического очага, но подготовленных с различными сроками пребывания клеточного материала в гипотоническом или гипертоническом растворе.
2.1. В ходе непосредственных измерений клеточных элементов на n цитологических препаратах, подготовленных с разными интенсивностями воздействия гипотонического окружения, но содержащих клетки, взятые из одного патологического очага, определяются величины Ci, Ri, ri, Ni, ρi i∈(1, 2,…n). Измерения проводятся методом АСМ.
2.2. Для точек min{ρi} и max{ρi} на оси ρ вычисляется нормировочный коэффициент α по формуле (II) в предположении линейности зависимости (I):
2.3. Подсчитываем нормированную величину рассматриваемого клеточного элемента Энорм в точках min{ρi} и max{ρi} по формуле:
Обозначим эту величину ЭН.
2.4. Для всех остальных точек из множества {ρi} на оси ρ подсчитываем значения нормировочных коэффициентов в этих точках по формулам:
Эти значения представляют собой решения относительно aiv уравнений:
Эi(1+αi(ρi-Р))=ЭН.
Таким образом получим таблично заданную на отрезке [min{ρi}], max{ρi}] в точках {ρi} функцию α=f(ρ).
2.5. Далее одним из известных методов вычислительной математики выполняется аппроксимация данной функции аналитической функцией А(ρ), например полиномом по методу наименьших квадратов. Это и будет аналитической функцией для подсчета нормировочного коэффициента в зависимости от степени набухания эритроцитов.
3. Далее с применением аналогичных формул и процедур вычисляются нуклеарный нормировочный коэффициент αN (вместо Ci вставляем Ni), ядрышковый нормировочный коэффициент (предварительно измеряем высоты ядрышек) и т.д.
Далее выбираем характеристические функции, то есть те математические функции от измерений клеточных элементов, которые статистически достоверно различаются для злокачественных клеток и незлокачественных клеток исследуемой локализации. Примеры характеристических функций:высота цитоплазмы, высота ядра, отношение высоты ядра к высоте цитоплазмы, шероховатость поверхности ядра, шероховатость поверхности цитоплазмы.
После осуществляем процедуру определения референтных значений характеристических функций (проводится для каждой локализации патологического очага) следующим образом:
Подбираем статистически значимое количество цитологических препаратов с биологическим материалом, взятым из различных патологических очагов исследуемой локализации. Диагноз заболевания, представленного в очаге, устанавливается одним из ранее известных способов: световая микроскопия, иммуноцитохимия и др.
Для каждого из выбранных цитологических препаратов многократно с помощью АСМ измеряем высоты внутренних и периферических частей эритроцитов и подсчитываем степень набухания эритроцитов (среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита).
Для каждого из заболеваний, которые предполагается различать с использованием выбранных характеристических функций, многократно совершаются измерения с помощью АСМ величин тех клеточных элементов, которые используются при подсчете выбранных характеристических функций. При этом используются цитологические препараты, содержащие материал из очага, в отношении которого установлен диагноз именно данного заболевания.
Далее для каждого набора измерений (число измерений в наборе равно числу величин различных клеточных элементов, используемых в аналитическом выражении для конкретной характеристической функции) подсчитываются характеристические функции, причем в аналитические выражения для характеристических функций подставляются не непосредственно измеренные величины клеточных элементов, а нормированные следующим образом:
где ρП - среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита для того препарата, на котором совершается измерение величины клеточного элемента (степень набухания эритроцитов данного цитологического препарата);
αЭ(ρП) - нормировочный коэффициент конкретного клеточного элемента, соответствующий данной степени набухания эритроцитов.
В ходе многократных подсчетов указанным способом характеристических функций определяются статистические параметры этих функций: средние значения и стандартные отклонения, соответствующие отдельным заболеваниям, которые предполагается диагностировать.
На втором этапе, который проводится для каждого набора цитологических препаратов из патологического очага, подлежащего диагностике, определяется величина ρП - среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита для каждого исследуемого препарата (степень набухания эритроцитов данного цитологического препарата).
На каждом препарате многократно измеряются величины клеточных элементов, участвующие в подсчете характеристических функций, поставленных в соответствии с исследуемой локализацией патологического очага ранее на первом этапе.
Каждому клеточному элементу ставится в соответствие нормировочный коэффициент для этого элемента, подсчитанный на первом этапе.
Многократно подсчитываются указанные характеристические функции, причем в расчетах используются не непосредственно измеренные, а нормированные (формула (III)) значения величин клеточных элементов.
Определяются средние значения всех характеристических функций по всему набору цитологических препаратов, взятых из исследуемого очага.
Для каждой характеристической функции выбирается диагноз по критерию близости среднего значения, подсчитанной на втором этапе величины характерической функции, к какому-либо из референтных значений, определенных на первом этапе. В частности, диагноз «рак» устанавливается, если подсчитанное среднее значение характеристической функции ближе всего к референтному значению этой функции, поставленному в соответствие раку на первом этапе.
Примеры осуществления способа:
Локализации: молочная железа, щитовидная железа, шейка матки.
Первый этап - определение нормировочных коэффициентов, характеристических функций и их референтных значений.
Были взяты по два окрашенных цитологических препарата тканей молочной железы и щитовидной железы, различающиеся интенсивностями воздействия на клетки гипотонических растворов во время пробоподготовки. При наблюдении в световой микроскоп эти препараты различались выраженностью просветления в центральной части эритроцитов. В препаратах с длительным сроком воздействия гипотонических растворов для большинства эритроцитов центральная и периферические части клетки различались мало, в то же время в препаратах с небольшим сроком воздействия гипотонических растворов срединное просветление в большинстве эритроцитов было хорошо заметно. Далее с помощью АСМ были проделаны измерения и подсчитаны следующие величины:
Э1 - средняя высота клеточного элемента после процесса пробоподготовки с меньшим сроком пребывания клеток в гипотоническом растворе;
Э2 - средняя высота клеточного элемента после процесса пробоподготовки с большим сроком пребывания клеток в гипотоническом растворе;
- безразмерная величина - среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита после процесса пробоподготовки с меньшим сроком пребывания клеток в гипотоническом растворе (степень набухания эритроцитов данного цитологического препарата);
- безразмерная величина - среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита после процесса пробоподготовки с большим сроком пребывания клеток в гипотоническом растворе (степень набухания эритроцитов данного цитологического препарата).
Для каждой локализации вычислялась своя пара значений (ρ1, p2).
В качестве клеточных элементов использовались цитоплазма, ядро, ядрышко.
В соответствии с приемами предложенного способа осуществили определение нормировочных коэффициентов для каждой локализации патологических очагов, подлежащих диагностике, по описанной выше методике. Были определены цитоплазматический, нуклеарный и ядрышковый нормировочные коэффициенты. Затем осуществили выбор характеристических функций от морфологических параметров клеток. Были выбраны следующие характеристические функции: толщина цитоплазмы, высота ядра, высота ядрышка, шероховатость цитоплазмы. Для каждой функции путем многократно проведенных измерений элементов тех клеток, в отношении которых другими способами была установлена их принадлежность к злокачественным, нашли интервалы ее значений, при попадании в которые с доверенностью не менее 95% возможно установление диагноза злокачественного новообразования, то есть были установлены референтные значения каждой характиристической функции. При этом в аналитических выражениях для характеристических функций использовались не непосредственно измеренные величины клеточных элементов, а нормированные в соответствии с нашим предложением, а именно
где Энорм - нормированное значение величины клеточного элемента;
Эизм - измеренное значение величины клеточного элемента;
ρП - среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита для того препарата, на котором совершается измерение величины клеточного элемента (степень набухания эритроцитов данного цитологического препарата);
αЭ(ρП) - нормировочный коэффициент конкретного клеточного элемента, соответствующий данной степени набухания эритроцитов;
величину Р положили равной .
Второй этап - исследование с целью подтвердить или отвергнуть диагноз злокачественного заболевания
Исследовали 51 цитологический препарат опухолей молочной и щитовидной желез, полученные путем тонкоигольной аспирационной биопсии под контролем ультразвукового исследования и путем соскоба с операционного материала. Кроме того, анализу подвергли 17 соскобов с поверхности шейки матки. Критерии отбора препаратов для исследования - невозможность средствами световой микроскопии исключения диагноза рака и в то же время наличие в препарате клеток с признаками тяжелой дисплазии.
Условия подготовки препаратов были различными, однако все они были проанализированы с помощью атомно-силовой микроскопии (АСМ).
На втором этапе, который проводился для каждого цитологического препарата из патологического очага, подлежащего диагностике, определялась величина ρП - среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита для каждого исследуемого препарата (степень набухания эритроцитов данного цитологического препарата).
Каждому клеточному элементу ставился в соответствие нормировочный коэффициент для этого элемента, подсчитанный на первом этапе.
На каждом препарате многократно измерялись величины клеточных элементов, участвующие в подсчете характеристических функций, поставленных в соответствии с исследуемой локализацией патологического очага на первом этапе, то есть толщина цитоплазмы, высота ядра, высота ядрышка, шероховатость цитоплазмы.
Многократно подсчитывались указанные характеристические функции, причем в расчетах использовались не непосредственно измеренные, а нормированные (формула (III)) значения величин клеточных элементов.
Были определены значения всех характеристических функций по всем цитологическим препаратам.
В соответствии со значениями характеристических функций был поставлен диагноз по критерию близости значения подсчитанного на втором этапе значения характеристической функции к какому-либо из референтных значений, определенных на первом этапе. В частности, диагноз «рак» был установлен тогда, когда подсчитанное значение характеристической функции было ближе всего к референтному значению этой функции, поставленному в соответствие раку на первом этапе. Из 51+17 исследованных препаратов диагноз рак был поставлен в 43 случаях. Больным было назначено адекватное лечение. Во всех 43 случаях диагноз подтвердился при послеоперационных гистологических исследованиях.
1. Способ проведения исследования для диагностики злокачественного новообразования, включающий проведение атомно-силовой микроскопии (АСМ) цитологического препарата, отличающийся тем, что при проведении АСМ измеряют вертикальные размеры клеточных элементов, нормируют эти размеры, подсчитывают значения характеристических функций от нормированных размеров измеренных клеточных элементов и на основании критерия близости подсчитанных значений характеристических функций их референтным значениям, поставленным в соответствие тем или иным заболеваниям, в том числе злокачественным новообразованиям, ставят или исключают диагноз злокачественного новообразования.
2. Способ по п.1, отличающийся тем, что нормированные значения размеров клеточных элементов подсчитываются по формуле где ρП - показатель степени набухания эритроцитов исследуемого цитологического препарата, вычисляемый как среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита; αэ(ρП) - нормировочный коэффициент конкретного измеренного клеточного элемента, соответствующий данной степени набухания эритроцитов, вычисляемый по формуле где Э1 - средняя высота клеточного элемента после процесса пробоподготовки с меньшим сроком пребывания клеток в гипотоническом растворе; Э2 - средняя высота клеточного элемента после процесса пробоподготовки с большим сроком пребывания клеток в гипотоническом растворе; - среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита после процесса пробоподготовки с меньшим сроком пребывания клеток в гипотоническом растворе; - среднее отношение высоты центральной части эритроцита к высоте периферической части эритроцита после процесса пробоподготовки с большим сроком пребывания клеток в гипотоническом растворе; R - высота периферической части эритроцита; r - высота внутренней части эритроцита; Р - константа, обозначающая, какая степень набухания эритроцитов взята в качестве начальной - до воздействия гипотонических или гипертонических растворов, вычисляемая по формуле
3. Способ по п.2, отличающийся тем, что нормировочный коэффициент конкретного клеточного элемента подсчитывается отдельно и независимо от нормировочных коэффициентов других клеточных элементов.
4. Способ по п.1, отличающийся тем, что в качестве значений характеристических функций используют высоту цитоплазмы клетки, высоту ядра клетки, высоту ядрышка клетки, шероховатость поверхности цитоплазмы клетки, шероховатость поверхности ядра клетки, а также любые аналитические выражения от этих величин.
5. Способ по п.1, отличающийся тем, что нормировочный коэффициент конкретного клеточного элемента вычисляется как аналитическая функция от степени набухания эритроцитов А(ρ), вид которой определяется после выполнения АСМ-измерений при наличии в распоряжении исследователя не менее трех цитологических препаратов, взятых из одного патологического очага, но подготовленных с различными сроками пребывания клеточного материала в гипотоническом растворе, согласно следующей процедуре: в ходе непосредственных измерений клеточных элементов на n цитологических препаратах, подготовленных с разными интенсивностями воздействия гипотонического раствора, но содержащих клетки, взятые из одного патологического очага, с помощью АСМ измеряют величины Эi, ρi i∈(1, 2, … n); определяют P по формуле , для точек min{ρi} и max {ρi} на оси ρ вычисляют нормировочный коэффициент согласно формуле (II) , подсчитывают нормированную величину рассматриваемого клеточного элемента Энорм в точках min{ρi} и max{ρi} по формуле для всех остальных точек из множества {ρi} на оси ρ подсчитывают значения нормировочных коэффициентов в этих точках по формулам , получая таблично заданную на отрезке [min{ρi}, max {ρi}] в точках {ρi} функцию α=f(ρ), далее одним из известных методов вычислительной математики выполняют аппроксимацию данной функции аналитической функцией А(ρ).