Средство для лечения инфекционных заболеваний дыхательного тракта "глюкаферон®"
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к патогенетическим средствам лечения инфекционных заболеваний органов дыхания, полученным на основе натурального растительного сырья. Средство для лечения заболеваний дыхательного тракта содержит экстракт базидиальных грибов, протеолитический фермент растительного происхождения «Бромелаин», янтарную кислоту рутин и стеарат кальция при следующих соотношениях ингредиентов (% мас.):
Протеолитический фермент «Бромелаин» - 3-10;
Экстракт пищевых базидиальных грибов - 20-25;
Рутин (витамин Р) - 20- 25;
Янтарная кислота - 40-50;
Стеарат кальция - остальное.
В качестве экстракта базидиальных грибов оно содержит экстракт Вешенки обыкновенной, экстракт гриба Шиитаке или экстракт гриба Рейши.
Средство «Глюкаферон®» обладает комплексным воздействием на организм, позволяет существенно повысить его противоинфекционные свойства. Оно может использоваться как самостоятельно, так и на фоне традиционной терапии с использованием противовирусных препаратов или антибиотиков. 3 з.п. ф-лы, 5 табл., 5 пр., 6 ил.
Реферат
Изобретение относится к области медицины, а именно к патогенетическим средствам лечения инфекционных заболеваний органов дыхания, полученным на основе натурального растительного сырья.
Существующая терапия острых респираторных заболеваний органов дыхания вирусной этиологии базируется в основном на применении препаратов этиотропной, симптоматической и патогенетической направленности [Киселев О.И., Маринич И.Г., Соминина А.А. Грипп и другие респираторные вирусные инфекции: эпидемиология, профилактика, диагностика и терапия. СПб., РАМН, СЗО, НИИ Гриппа. 2003, 244 с.; Исаков В.А. Современные средства симптоматической терапии гриппа и ОРЗ. Terra Medica. 1999, №1 (14), c.3-5].
Однако известные этиотропные противовирусные химиопрепараты (ремантадин, амантадин, рибавирин, ацикловир и др.) характеризуются узким спектром действия по отношению к вирусам, имеющим этиологическую связь с острыми респираторными вирусными инфекциями (ОРВИ) и гриппом; наличием неблагоприятных побочных реакций; отсутствием или существенным снижением терапевтического эффекта при использовании данной группы препаратов на поздних сроках развития заболевания (2-3 сутки и более); быстрым формированием резистентности вирусов к химиопрепаратам.
Указанные недостатки свидетельствуют о наличии нерешенных проблем современной этиотропной химиотерапии респираторных вирусных инфекций, что повышает актуальность разработки и/или совершенствования патогенетических и симптоматических средств лечения респираторных инфекционных заболеваний.
Широкую практическую распространенность получили симптоматические и патогенетические средства лечения ОРВИ и гриппа на основе нестероидных противовоспалительных веществ (НПВВ) - парацетамол, метамизол натрия, ацетилсалициловая кислота, ибупрофен и т.д. [Справочник Видаль. Лекарственные препараты в России: Справочник. М.: АстраФармСервис, 2007; Фисенко В.П. Безопасность и токсичность мультисимптомных средств от простуды и гриппа в преддверии холодного сезона, Фармацевтический вестник, №28, сент., 2002]. На фоне таких препаратов, как фервекс, колдрекс, терафлю, ринзасип и т.п., содержащих в своем составе НПВВ, снижается выраженность локальных воспалительных реакций (насморк, кашель, заложенность носа, боль или першение в носоглотке) и общих токсических проявлений (головная боль, слабость, вялость, повышение температуры, боль в мышцах) [McQuay H.J., Edvards J.E., Moore R.A. Mechanism of action of anti-inflammatory drugs, Amer. J. Ther., 2000, v.9, p.179-187].
Вместе с тем, при продолжительном применении НПВВ ингибируется выработка цитопротекторных ПГ в слизистых оболочках желудочно-кишечного тракта (ЖКТ), что является причиной кишечных кровотечений. Риск развития этих осложнений не снижается при использовании быстрорастворимых форм таких препаратов, а также при парентеральном или ректальном пути их введения. Кроме того, НПВВ провоцируют развитие приступов бронхиальной астмы, аллергических реакций, понижают скорость почечной фильтрации, изменяют картину периферической крови и т.д. [Rainsford K.D. Influenza ("Bird Flu"), inflammation and anti-inflammatory/analgesic drugs. Inflammopharmacology, 2006, vol.14, №1-2, p.2-9; Miller S.B. Prostaglandins in Health and Disease: An Overview. Seminars in Arthritis and Rheumatism. 2006, vol.36, №1, p.37-49; Rainsford K.D. Antiinflammatory drugs in the 21st century. Subcell Biochem., 2007, vol.42, p.3-27; Карпов О.И., Зайцев А.А. Нестероидные противовоспалительные препараты аспекты безопасности длительного применения. Новые Санкт-Петербургские врачебные новости. 2001, №4, с.79-82].
Короткие курсы применения НПВВ (1-2 дня) не сокращают продолжительность течения воспалительного процесса [Мусил Я. Основы биохимии патологических процессов. Пер. с чешск., М.: Медицина, 1985, 432 с.; Маршалл В.Дж. Клиническая биохимия. Пер с англ., М.: СПб: Издательство БИНОМ - Невский Диалект, 1999, 368 с.], приводят к возникновению бактериальных осложнений, способствуют развитию вирусной астении организма. Кроме того, симптоматические и патогенетические средства терапии ОРВИ и гриппа, содержащие НПВВ, имеют ряд фармакодинамических ограничений, совокупность которых снижает эффективность лечебно-профилактических процедур.
Известно использование для лечения гриппа и ОРВИ препаратов, полученных на основе растительного лекарственного сырья, такие как экстракты или настойки черной смородины, лука, малины, володушки серповидной, горькой полыни, корней листовки, аира, сабельника болотного и т.д. [Полная энциклопедия народной медицины, т.1, АНС, 1996, с.178-183; Соколова И.С. Дикорастущие и культурные растения. - М., Медицина, 1990].
Препараты из растительного сырья, как правило, оказывают позитивное воздействие на симптоматические и патогенетические механизмы развития инфекционно-воспалительных процессов дыхательного тракта, в основном, за счет активации противовоспалительной или иммунной защиты организма. Однако, по сравнению с препаратами других классов, они имеют, как правило, более низкую активность и значительное число противопоказаний.
Одной из перспективных и в настоящее время недостаточно исследованной группой препаратов этого типа, способной повысить эффективность терапии респираторных инфекций, являются экстракты базидиальных грибов (Basidiomycetes spp.).
Грибные экстракты содержат полисахариды, одним из действующих компонентов которых являются бета-Д-глюканы. В основном, эти биополимеры обеспечивают более выраженную активацию факторов неспецифической защиты организма. В частности, усиливается фагоцитоз, хемотаксис и адгезивные свойства нейтрофилов, повышается функциональная активность системы комплемента, естественных киллеров, макрофагов, дендритных клеток, стимулируется гемопоэз, индуцируется продукция медиаторов иммунной системы (цитокинов, интерферонов), отвечающих за развитие воспалительной реакции, иммунного ответа, противовирусной защиты организма.
Экстракты базидиальных грибов нетоксичны (по классификации FDA бета-Д-глюканы отнесены к группе GRAS - «generally recognized as safe», т.е. являются безопасными), не обладают антигенными и пирогенными свойствами, что также свидетельствуют о целесообразности их включения в полифункциональные препараты, предназначенные для патогенетической и/или симптоматической терапии респираторных инфекций [Shamtsyan M.M., Konusova V.G., Goloshev A.M. et al. Immunomodulating and antitumour effect of basidiomycetes Pleorotus ostreatus. J. Biological Physics and Chemistry. 2004, №4, p.157-161; Shamtsyan Mark, Konusova Valentina, Maksimova Yulia et al. Immunomodulating and antitumour action of extracts of several mushrooms. J. Biotechnology, №11, p.77-83; Rop О., Micek J., Yurikava T. Beta-glucans in higher fungi and their health effects. Nutr. Rev., 2009, v.11, p.624-631; Беседнова Н.Н., Иванушко Л.А., Звягинцева Т.Н., Елякова Л.А. Иммунотропные свойства 1->3; 1->6 β-Д-глюканов. Антибиотики и химиотерапия, 2000, №2, с.37-44; Akramiene D., Kondrotos A., Didziapetriene J., Kevelaitis E. Effects of β-glucans on the immune system. Medicina (Kaunas), 2007, v.43 (8), p.597-606; Rondanelli M., Opizzi A., Montoferrario F. The biological activity of beta-glucans. Minerva Med., 2009, v.100 (3), p.237-245].
В настоящее время экстракты из стром и/или плодовых тел таких видов грибов, как Вешенка обыкновенная или устричная (Pleurotus ostreatus); Шиитаке (Lentinus edodes); Рейши (Ganoderma lusidum) и т.п., предлагается использовать в первую очередь для лечения онкологических заболеваний, профилактики и лечения сахарного диабета и сердечно-сосудистых заболеваний, а также в качестве средства для противовирусной терапии [http://www.rutravi.ru/e/status-1-364276-shiitake-ekstrakt; http://www.bezbolezni.ru/ishop/product/23; http://www.bezbolezni.ru/site/3; http://e-grib.ru/lentinus_edodes.php; http://nuskine.ru/zdorove/reishiax.html; http://www.bezbolezni.ru/ishop/product/24; Белова Н.В. Перспективы использования биологически активных соединений высших базидиомицетов в России. Микология и фитопатология, 2004, т.38, вып.2, с.1-7].
Основным недостатком данных препаратов является относительно невысокая эффективность при лечении инфекционных заболеваний верхних дыхательных путей.
Наиболее близким по технической сущности к заявляемому изобретению является экстракт гриба Шиитаке, выпускаемый компанией "Fungi Pharmaceutical Co.,Ltd" (КНР), 1 кг которого получают из 10 кг сухих грибов [http://e-grib.ru/lentinus_edodes.php], предлагаемый для лечения онкологических, сердечно-сосудистых и инфекционных заболеваний, а также сахарного диабета. Препарат назначают в ежедневной дозе 2-6 г.
Недостатком экстракта является его относительно невысокая патогенетическая эффективность лечения вирусных и бактериальных заболеваний дыхательного тракта.
Задачей, решаемой авторами изобретения, является создание на основе экстрактов пищевых базидиальных грибов более эффективного полифункционального средства для лечения инфекционных заболеваний дыхательного тракта.
Поставленная задача решалась путем создания средства для патогенетической терапии инфекционно-воспалительных заболеваний дыхательного тракта, получившее условное название «Глюкаферон (Glucaferon)» (положительное решение по заявке на товарный знак №2010721404 от 29.06.2010 г.), позволяющего оказывать при пероральном введении в организм комплексное воздействие, обеспечивая оптимальное сочетание иммуностимулирующих, антиоксидантных и иных антиинфекционных свойств, в частности за счет обеспечения большей биологической доступности полисахаридов базидиальных грибов в условиях желудочно-кишечного тракта (ЖКТ).
Технический результат изобретения заключался в том, что в создании средства, в состав которого дополнительно входит протеолитический фермент растительного происхождения «Бромелаин», янтарная кислота и рутин, а также вспомогательное вещество - стеарат кальция при следующих соотношениях ингредиентов конечного средства (% мас.):
Протеолитический фермент «Бромелаин» - 3-10;
Экстракт пищевых базидиальных грибов - 20-25;
Рутин (витамин Р) - 20- 25;
Янтарная кислота - 40-50;
Стеарат кальция - остальное.
В качестве «Бромелаина» использовался промышленно выпускаемый препарат «Bromelain SGMV» по свидетельству о госрегистрации СГР 77.99.11.3.У.1977.3.10 от 19.03.2010. В качестве источника полисахаридов использовали следующие экстракты пищевых грибов:
- экстракт пищевого гриба Вешенки обыкновенной (Pleurotus ostreatus), полученный по технологии, защищенной авторами патентом RU 2189825, 2001;
- экстракт пищевого гриба Шиитаке (Lentinus edodes), производства "Fungi Pharmaceutical Co.,Ltd" (КНР);
- экстракт измельченных спор пищевого гриба Рейши (Ganoderma lusidum) ReishiMax Gip® производства Pharmanex в качестве иммуностимулирующего средства.
При использовании заявляемой композиции ингредиентов протеолитический фермент в низких концентрациях совместно с янтарной кислотой способствует высвобождению полисахаридов и, в частности, бета-Д-глюканов из частиц экстракта гриба и ускоряет их взаимодействие с рецепторами клеток, отвечающих за врожденный иммунитет, что повышает и стабилизирует активность всех систем защиты организма от патогенов. Стимулированный бета-Д-глюканами макрофаг запускает спектр защитных реакций, включающих продукцию: цитокинов, интерферонов, ферментов воспаления, свободно-радикальных форм кислорода, оксида азота и т.д. Совокупность развития этих реакций обеспечивает быстрое формирование неспецифического противоинфекционного иммунитета широкого спектра, усиливающего неспецифическую иммунную, противовоспалительную и антиоксидантную защиту организма.
Введение в препарат рутина снижает негативные реакции, защищает сосуды и капилляры от повреждений, уменьшает их ломкость и проницаемость, усиливает репарационные процессы тканей организма. Введение стеарата кальция улучшает физико-химические характеристики заявляемого средства (улучшает сыпучесть, препятствует комкованию).
Заявляемое соотношение ингредиентов является оптимальным. Снижение концентрации экстракта ведет к резкому снижению эффективности, повышение его концентрации неоправданно удорожает средство. Уменьшение концентрации «Бромелаина» ниже заявляемой концентрации не обеспечивает полный выход бета-Д-глюканов и также снижает эффективность средства, повышение его концентрации неэффективно. Понижение концентрации янтарной кислоты менее заявляемой, по-видимому, снижает эффективность взаимодействия бета-Д-глюканов с клетками, повышение ее концентрации экономически неоправданно. Кроме того, понижение концентрации янтарной кислоты менее заявляемой снижает эффективность коррекции клеточного метаболизма, повышение ее концентрации увеличивает допустимый уровень суточной потребности данного компонента. Концентрация рутина менее 20% не гарантирует формирование эффективной лечебно-профилактической защиты сосудов и капилляров на фоне развития респираторных инфекционных заболеваний вирусной природы. Повышение концентрации рутина более 25% превышает уровень суточной потребности этого компонента.
Все используемые компоненты препарата совместимы между собой, а также с противовирусными средствами и антибиотиками, применяемыми для лечения ОРВИ и гриппа.
В приведенных рисунках иллюстрируется эффективность применения заявляемого средства.
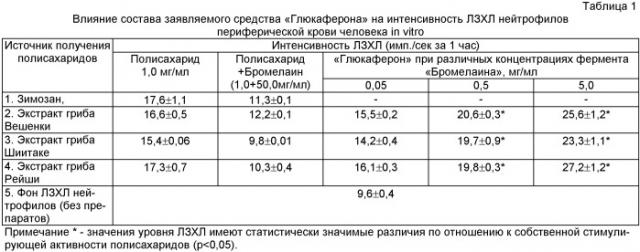
На фиг.1 приведены результаты исследования воздействия заявляемого средства на основе экстракта Pleurotus ostreatus и его отдельных компонентов на интенсивность люминолзависимой хемилюминесценции (ЛЗХЛ) нейтрофилов крови человека, индуцированной ФМА. При этом показана эффективность следующих составов на интенсивность ЛЗХЛ нейтрофилов (сумма импульсов за 1 ч): 1 - фон (клетки без препаратов); 2 - клетки, обработанные ФМА (10 нг/мл); 3 - клетки, обработанные ФМА+Бромелаин (0,5 мг/мл); 4 - клетки, обработанные ФМА+Бромелаин (0,5 мг/мл)+Экстракт (Pleurotus ostreatus, 1,0 мг/мл); 5 - клетки, обработанные ФМА+Бромелаин (0,5 мг/мл)+Экстракт (Pleurotus ostreatus, 1,0 мг/мл)+Рутин (1,0 мг/мл); 6 - клетки, обработанные ФМА+ЗC1 - (Бромелаин (0,5 мг/мл+Рутин (1,0 мг/мл)+Экстракт (Pleurotus ostreatus, 1,0 мг/мл)+Янтарная кислота(2,0 мг/мл)).
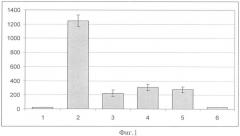
На фиг.2 приведены результаты исследования воздействия заявляемого средства на основе экстракта Lentinus edodes и его отдельных компонентов на интенсивность люминолзависимой хемилюминесценции (ЛЗХЛ) нейтрофилов крови человека, индуцированной ФМА. При этом показана эффективность следующих составов на интенсивность ЛЗХЛ нейтрофилов (сумма импульсов за 1 ч): 1 - фон (клетки без препаратов); 2 - клетки, обработанные ФМА (10 нг/мл); 3 - клетки, обработанные ФМА+Бромелаин (0,5 мг/мл); 4 - клетки, обработанные ФМА+Бромелаин (0,5 мг/мл)+Экстракт (Lentinus edodes, 1,0 мг/мл); 5 - клетки, обработанные ФМА+Бромелаин (0,5 мг/мл)+Экстракт (Lentinus edodes, 1,0 мг/мл)+Рутин (1,0 мг/мл); 6 - клетки, обработанные ФМА+ЗС2 - (Бромелаин (0,5 мг/мл)+Рутин (1,0 мг/мл)+Экстракт (Lentinus edodes, 1,0 мг/мл)+Янтарная кислота (2,0 мг/мл)).
На фиг.3 приведены результаты исследования воздействия заявляемого средства на основе экстракта Ganoderma lusidum и его отдельных компонентов на интенсивность люминолзависимой хемилюминесценции (ЛЗХЛ) нейтрофилов крови человека, индуцированной ФМА. При этом показана эффективность следующих составов на интенсивность ЛЗХЛ нейтрофилов (сумма импульсов за 1 ч): 1 - фон (клетки без препаратов); 2 - клетки, обработанные ФМА (10 нг/мл); 3 - клетки, обработанные ФМА+Бромелаин (0,5 мг/мл); 4 - клетки, обработанные ФМА+Бромелаин (0,5 мг/мл)+Экстракт (Ganoderma lusidum, 1,0 мг/мл); 5 - клетки, обработанные ФМА+Бромелаин (0,5 мг/мл)+Экстракт (Ganoderma lusidum, 1,0 мг/мл)+Рутин (1,0 мг/мл); 6 - клетки, обработанные ФМА+ЗС3[Бромелаин (0,5 мг/мл)+Рутин (1,0 мг/мл)+Экстракт (Ganoderma lusidum, 1,0 мг/мл)+Янтарная кислота (2,0 мг/мл)].
На фиг 4 представлены данные о выживаемости мышей (S(t), %) при экспериментальной интраназальной гриппозной инфекции [А/Виктория/72 (Н3N2)] и перорального введения различных препаратов в зависимости от времени, прошедшего после заражения животных в сутках. Время начала введения препаратов - через 24 ч после заражения животных. Используются следующие обозначения на приведенных графиках: 1 - выживаемость контрольной группы зараженных животных; 2 - выживаемость контрольной группы зараженных животных при использовании «Глюкаферона»; 3 - выживаемость контрольной группы зараженных животных при использовании ремантадина; 4 - выживаемость контрольной группы зараженных животных при использовании сочетания ремантадина и заявляемого средства.
На фиг.5 показана оценка риска развития неблагоприятного исхода (R) лечения интраназальной летальной гриппозной инфекции мышей на 15-й день эксперимента на фоне перорального введения ремантадина и сочетания заявляемого средства и ремантадина. Используются следующие обозначения на приведенных графиках: 1 - значения параметра (R) в контрольной группе зараженных животных, которым не вводили препараты; 2 - значения параметра (R) в группе животных, которые получали ремантадин; 3 - значения параметра (R) в группе животных, которым вводили заявляемое средство и ремантадин. Продолжительность перорального введения ремантадина составляла 5 дней, заявляемого средства - 10 дней.
На фиг.6 показана оценка риска развития неблагоприятного исхода (R) лечения интраназальной пневмококковой инфекции мышей на 15-й день эксперимента на фоне курсового перорального введения антибиотика, а также сочетания заявляемого средства и антибиотика. Используются следующие обозначения на приведенных графиках: 1 - значения параметра (R) в контрольной (зараженной) группе животных (№1), которым не вводили препараты; 2 - значения параметра (R) в группе животных (№5), которым вводили антибиотик; 3 - значения параметра (R) в объединенной группе животных, которым вводили заявляемое средство и антибиотик. Продолжительность перорального введения препаратов составляла 10 дней.
Заявляемое средство получают путем смешивания указанных ингредиентов и последующей фасовки конечной смеси веществ в желатиновые капсулы. Такой подход является экономичным, т.к. в процессе производства не проводится первичный синтез компонентов заявляемого средства.
В приведенных примерах показана эффективность ряда вариантов использования заявляемого средства «Глюкаферон».
Пример 1. Оценка иммупотропных свойств заявляемого средства в условиях in vitro
Известно, что важным компонентом антиинфекционной защиты организма является система врожденного иммунитета [Галактионов В.Г. Иммунология. М. 1998, с.5-13; А.Ройт, Дж.Бростофф, Д.Мейл. Иммунология. - Мир, 2001, с.38-90; Меджидов Р., Джанавей Ч. Врожденный иммунитет. Казанский мед. журнал, 2004, 85(3), с.161-163; Pirofski L.A., Casadevall A. Immunomodulators as an antimicrobial tool. Curr. Opin. Microbiol. 2006, v.9, p.489-495; Cristofaro P., Opal S.M. Role of Toll-like receptors in infection and immunity: clinical implications. Drugs, 2006, v.66, p.15-29]. Функции врожденного иммунитета неспецифичны и реализуются за счет: механической защиты (кожа, слизистые оболочки); фагоцитоза; разрушения инфицированных клеток (комплемент, естественные киллеры); секреции цитокинов (интерферон, интерлейкины); синтеза антибактериальных пептидов, хемокинов и т.д.
Оценка иммуностимулирующего действия средства «Глюкаферон» проводилась исходя из его воздействия на фагоцитарный процесс. Исследования были проведены на клетках крови человека с использованием метода люминолзависимой хемилюминесценции (ЛЗХЛ) [Земсков В.М. Хемилюминесценция крови. Методические рекомендации. М. 1988; Владимиров Ю.А., Шерстнев М.П. Хемилюминесценция клеток животных. Итоги науки и техники, биофизика, 1989, т.24, с.3-176], позволяющего определять активность фагоцитарной реакции нейтрофилов по интенсивности продукции свободнорадикальных форм кислорода.
В качестве препарата сравнения был использован зимозан, препарат, который широко применяется в экспериментальных целях для изучения активности фагоцитарных реакций [Ushijima Y., Tosune H., Nakano M. Chemiluminescence from human PMN leukocytes activated with opsonized zymosan. Free radical Biology and Medicine. 1997, 22(3), p.401-409; Xia Y., Borland G., Huang J. Function of the lectin domain of Mac-1/complement receptor type 3 (CD 11b/CD 18) in regulation neutrophil adgesion. J.Immunol., 2002, 169, p.6417-6426].
Для исключения неспецифической активации клеток, связанной с процессом выделения нейтрофильных клеток, все исследования проведены на цельной донорской крови. Регистрацию хемилюминесценцию осуществляли с помощью хемилюминометра «Victor-2» фирмы Pribori Oy (Финляндия).
Донорскую кровь получали венепункцией локтевой вены. В качестве стабилизатора использовали гепарин (20 МЕ/мл). Для проведения метода ЛЗХЛ использовали следующие реагенты:
1. Люминол (фирма «Serva», кат. №28085) - 5 амино 1,2,3,4 тетра-гидро 1,4 фталазиндион, гидразид 3 аминофталевой кислоты. Для приготовления базового раствора навеску 1,77 мг люминола растворяли в 10 мл диметилсульфоксида (ДМСО). Базовый раствор хранили при +4,0°С. Перед исследованием базовый раствор люминола разводили в 0,9% растворе хлорида натрия в 10 раз;
2. Стерильный раствор Хенкса (фирма «Биолот», катал. №2-513);
3. Препарат зимозан производства фирмы «Sigma», кат.№4250. Приготовление раствора зимозана: 1 мг зимозана растворяли в 1 мл 0,9% NaCl. Для получения гомогенной взвеси раствор зимозана кипятили в течение 30 минут.
В качестве исследуемых препаратов использовали вышеуказанные экстракты пищевых базидиальных грибов, протеолитический фермент Бромелаин, а также средство «Глюкаферон» следующего состава: экстракт грибов - 1,0 мг/мл, фермента Бромелаина 0,05-5,0 мг/мл, янтарной кислоты 1,0 мг/мл, рутина 1,0 мг/мл, стеарат кальция - до 100%.
Реакцию ЛЗХЛ проводили в белых непрозрачных 96 луночных платах, специально выпускаемых для этих целей (фирма «Costar», кат.№3912). В лунки платы вносили: 20 мкл цельной донорской крови, 20 мкл растворов исследуемых препаратов, 40 мкл раствора люминола в концентрации 10-4 М. Раствором Хенкса доводили объем реакционной взвеси до 200 мкл. Все исследования проводили в трех параллелях.
Платы помещали в термостатируемую кювету хемилюминометра при температуре +37,0°С. Исследование проводили в течение 1 часа, регистрируя импульсы через каждые 3 минуты. За время эксперимента фиксировали 20 циклов. Результаты реакции выражали интеграционным показателем - светосуммой или количеством импульсов в секунду, накапливаемых в течение 1-го часа эксперимента.
В таблице 1 представлены результаты исследований как собственной иммуностимулирующей активности указанных видов грибных полисахаридов, так и иммуностимулирующей активности средства («Глюкаферон») на фоне различных концентраций фермента «Бромелаина».
Результаты исследования показывают, что по сравнению с фоновыми значениями ЛЗХЛ нейтрофилов полисахариды базидиальных грибов вызывают достоверное увеличение уровня ЛЗХЛ (р<0,05), что свидетельствует об образовании активных форм кислорода, которые сопровождают фагоцитарный процесс в нейтрофилах периферической крови [Segal A. How neutrophils kill microbes. Ann. Rev. Immunology, 2005, 23, p.198-223]. Биологическая активность экстрактов пищевых грибов сопоставима со стимулирующим действием зимозана, использованного в качестве препарата сравнения. Введение в композицию «Бромелаина» несколько понижает иммуностимулирующее действие полисахаридов, однако использование «Бромелаина» в составе композиции «Глюкаферона» в заданных интервалах способствует повышению иммуностимулирующего действия, достигая максимума в интервале его концентрации от 0,5 до 5,0 мг/мл.
Этот эффект практически не зависит от источника получения грибных полисахаридов, что позволяет использовать любой источник полисахаридов указанных видов базидиальных грибов в составе заявляемого средства в качестве натурального иммунотропного компонента.
Пример 2. Оценка антиоксидантной активности препарата в условиях in vitro
Одним из ведущих патогенетических механизмов развития острых респираторных вирусных инфекций (ОРВИ) и гриппа является образование в клетках инфицированного организма свободнорадикальных форм кислорода [Карпухин Г.И., Грипп.Л. Медицина, 1996; Хаитов P.M., Пинегин Б.Б. Современные представления о защите организма от инфекции. Иммунология, 2000, т.1, с.61-64]. Радикалы кислорода превращаются в высокотоксичные вещества, которые повреждают мембраны клеток. Это способствует деструкции капиллярной сети и капиллярных стенок, нарушению микроциркуляции, быстрому распространению вируса, генерализации инфекционного процесса, развитию тяжелых осложнений, например, пневмоний [Шепелев А.П., Корниенко И.В., Шестопалов А.В., Антипов А.Ю. Роль процессов свободнорадикального окисления в патогенезе инфекционных болезней. Вопросы медицинской химии, 2000, т.2, с.12-20].
Процессы, протекающие в активированных нейтрофилах, получили название «респираторный взрыв» [Маянский А.Н., Маянский Д.Н. Очерки о нейтрофиле и макрофаге. Новосибирск. Наука. 1989; Владимиров А.Ю., Азизова О.А., Деев А.И. и др. Свободные радикалы в живых системах. Итоги науки и техники. Биофизика, 1992, т.29, с.3-250]. Образующиеся в результате «респираторного взрыва» перекисные соединения взаимодействуют с белками, аминокислотами, липидами, что приводит к повреждению клеточных мембран, нарушению функций клеток и их гибели [Кулинский В.И. Активные формы кислорода и окислительная модификация макромолекул. Соросовский образовательный журнал. 1999, №1, с.2-7]. Это позволяет рассматривать воздействие на интенсивность «респираторного взрыва» как модель воздействия на антиоксидантные процессы, протекающие при ОРВИ и гриппе.
Для возникновения «респираторного взрыва» в нейтрофилах можно использовать, в частности, такие препараты, как кальциевый ионофор А23187, форболовые сложные эфиры [Руководство по иммунофармакологии под ред. Дейла М.М., Дж.К.Формена. - М.: Медицина, 1998, с.33-48]. Для оценки эффективности «Глюкаферона» для купирования вышеупомянутых процессов было изучено влияние его компонентов и их совокупности на «респираторный взрыв», индуцированный в нейтрофилах периферической крови форбол-12-миристат-13-ацетатом (ФМА).
Эксперименты были выполнены на нейтрофилах, выделенных из цельной донорской крови человека. Цельную донорскую кровь в соотношении 1:10 смешивали с 10% стерильным раствором желатина. Через 40 минут отбирали в пробирку плазму, в которой с помощью желатина были сконцентрированы клетки белой крови. Далее плазму наслаивали на фиколлпак («Serva») в соотношении 2:1.
После центрифугирования в течение 40 минут при 400 g нейтрофилы вместе с примесью эритроцитов находились на дне пробирки. Двукратным центрифугированием при 1200 об/мин в течение 10 минут удаляли примесь фиколлпака, после чего из клеточной взвеси гипотоническим шоком убирали эритроциты. Гипотонический шок проводили 10-кратным объемом дистиллированной воды в течение 40 секунд. Затем добавляли эквивалентное количество 1,8% раствора хлорида натрия, что позволяло довести его концентрацию до 0,9%.
После однократного отмывания при 1200 об/мин в течение 10 минут нейтрофильная взвесь клеток была готова для исследования. Жизнеспособность клеток составила 96% (оценка с помощью трипанового синего). Концентрация клеток, используемая для изучения ЛЗХЛ, составляла 2,0×106.
Исследование свободнорадикальных процессов, сопровождающих «респираторный взрыв», проводили с помощью метода люминолзависимой хемилюминесценции (ЛЗХЛ). Реакцию ЛЗХЛ осуществляли следующим образом. В лунки камеры одновременно вносили по 20 мкл нейтрофильной взвеси, 20 мкл ФМА в концентрации 10 нг/мл, 20 мкл растворов исследуемых препаратов, 40 мкл люминола. Раствором Хенкса доводили объем до 200 мкл. Все исследования были проведены в трех параллелях.
После внесения исследуемого материала платы помещали в термостатируемую кювету хемилюминометра (+37,0°С). Исследование проводили в течение 1 часа, регистрируя показания через каждые 3 минуты. За время эксперимента фиксировали 20 циклов. Результаты реакции выражали интегрированным показателем - светосуммой, т.е. количеством импульсов в секунду в течение 1-го часа эксперимента.
Эксперимент проводили по следующей схеме. К нейтрофилам донора, стимулированных ФМА (10 нг/мл), добавляли последовательно:
- Фермент бромелаин (0,5 мг/мл);
- Фермент бромелаин (0,5 мг/мл)+экстракт пищевых грибов (1,0 мг/мл);
- Фермент бромелаин (0,5 мг/мл)+экстракт пищевых грибов (1,0 мг/мл)+рутин (1,0 мг/мл);
- Фермент бромелаин (0,5 мг/мл)+экстракт пищевых грибов (1,0 мг/мл)+рутин (1,0 мг/мл)+янтарная кислота (2,0 мг/мл) («Глюкаферон»).
Результаты эксперимента, представленные на фиг.1-3, показали, что ФМА в концентрации 10,0 нг/мл индуцирует мощный «респираторный взрыв» нейтрофильных клеток. При этом интенсивность ЛЗХЛ клеток составляет более 1200 импульсов/с. Добавление к реагирующей смеси протеолитического фермента Бромелаина уменьшает в 6 раз интенсивность ЛЗХЛ нейтрофилов и свидетельствует о снижении продукции активных форм кислорода (АФК). Введение в анализируемую систему экстрактов пищевых грибов независимо от их природы (Вешенки обыкновенной, Шиитаке или Рейши), а также рутина существенно не влияет на интенсивность свободнорадикальных процессов, индуцированных ФМА. Вместе с тем использование для данной цели «Глюкоферона» приводит к практически полному подавлению «респираторного взрыва».
Таким образом, в условиях in vitro продемонстрировано возможность подавления средством «Глюкоферон» свободнорадикальных процессов, которые являются эффекторами воспалительной реакции организма при развитии инфекционных заболеваний вирусной и/или бактериальной этиологии.
Пример 3. Влияние состава «Глюкоферона» на его антиоксидантпую активность в условиях in vitro
В условиях примера 2 было изучено влияние состава препарата «Глюкоферон» на интенсивность ЛЗХЛ нейтрофилов крови человека, стимулированную ФМА. Результаты эксперимента приведены в таблице 2.
Представленные результаты исследования показывают, что максимальный эффект ингибирования интенсивности стимулированной ЛЗХЛ нейтрофилов наблюдается при следующих соотношениях ингредиентов ЗС (% мас.): фермент «Бромелаин» - 3-10; экстракт грибов - 20-25; янтарная кислота - 40-50; рутин - 20-25, стеарат кальция - остальное. При снижении концентрации указанных компонентов отмечается уменьшение эффективности ингибирования величины стимулированной ЛЗХЛ нейтрофилов. При увеличении концентрации этих ингредиентов значительного ингибирования стимулированной ЛЗХЛ нейтрофилов не происходит.
Таким образом, в условиях in vitro полученные соотношения (% мас.) основных компонентов предлагаемого препарата являются оптимальными для достижения максимальной антиоксидантной и противовоспалительной активности заявляемого средства.
Пример 4. Оценка эффективности применения заявляемого средства на модели экспериментальной гриппозной инфекции
Оценка лечебной эффективности заявляемого средства проводилась по его воздействию на течение экспериментальной гриппозной инфекции животных.
Все исследования проведены на белых беспородных мышах массой 16-18 г. Во время двухнедельного карантина и в процессе эксперимента животных содержали в стандартных условиях на полноценном рационе питания [Руководящие методические материалы по экспериментальному и клиническому изучению новых лекарственных средств. М., 1984, 192 с.].
Для заражения животных использовали вирус гриппа А/Виктория/72 (H3N2), который предварительно пассировали в аллантоисной полости 10-дневных куриных эмбрионов. Для воспроизведения гриппозной инфекции мышам под легким эфирным наркозом интраназально вводили вируссодержащую аллантоисную жидкость со следующими характеристиками: титр ЭИД50 (эмбриональная инфицирующая доза) от 1,0×10-6 до 1,0×10-8; заражающая доза от 3 до 5 ЛД50.
В качестве этиотропного противовирусного препарата использовали ремантадин, который предварительно растворяли в 0,9% растворе хлорида натрия и перорально вводили животным через 24 ч после их заражения. Противовирусный химиопрепарат применяли в дозе 0,1 мг/мышь 1 раз день. Продолжительность введения составляла 5 дней.
В качестве иммунотропного препарата использовали различные варианты заявляемого средства «Глюкаферон (Glucaferon)® следующего состава (мас. %): фермента бромелаина - 5,0; экстракта базидиальных грибов - 25,0; янтарной кислоты - 40; рутина - 25; стеарата кальция - 5,0.
Первый вариант содержал экстракт грибов Вешенки обыкновенной (ЗC1), второй вариант - экстракт грибов Шиитаке (ЗС2), третий вариант - экстракт грибов Рейши (ЗС3).
Указанные варианты «Глюкаферона» перорально вводили животным через 24 ч после их заражения в дозе 0,15 мг/мышь 1 раз в день. Продолжительность введения составляла 10 дней.
Наблюдение за животными осуществляли в течение 15 дней. Ежедневно фиксировали смертность животных в контрольных и опытных группах. На 15-й день эксперимента во всех группах животных определяли выживаемость (S(t)) и среднюю продолжительность жизни (S50). Для этого использовали метод Каплана-Мейера [Гланц С. Медико-биологическая статистика. Пер. с англ., М., Практика, 1998, 459 с.]. Для оценки риска (R) развития неблагоприятного исхода течения экспериментальной гриппозной инфекции у данного вида животных на фоне перорального введения препаратов использовали выражение: R=A/A+B, где: А - число погибших животных на 15-й день эксперимента, шт.; В - число выживших животных на 15-й день эксперимента.
На первом этапе исследования проведена оценка эффективности перорального применения различных вариантов заявляемого средства (ЗC1,2,3) у мышей на фоне развития экспериментальной гриппозной инфекции. В таблице 3.1 представлены результаты исследования. Так выживаемость мышей, которым вводили различные варианты ЗС, находилась на уровне 20-30% или 26,7±8,1%. Отсутствие существенных различий в выживаемости животных в группах №3, 4 и 5 позволяет заключить, что в составе средства могут быть использованы различные экстракты базидиальных грибов (Pleurotus ostreatus, Lentinus edodes или Ganoderma lusidum).
По сравнению с контрольными группами животных (№1-2), средняя продолжительность жизни мышей (S50), в опытных группах №4, 5 и 6 увеличивается в 2 раза. Это означает, что на фоне развития экспериментальной гриппозной инфекции пероральное введение средства обеспечивает выраженную активацию неспецифических факторов иммунной, антиоксидантной и противовоспалительной защиты организма зараженных животных. Следовательно, его применение самостоятельно или в сочетании с противовирусными химиопрепаратами является целесообразным.
На втором этапе исследования была проведена оценка комбинированной терапии экспериментальной гриппозной инфекции на основе перорального применения ремантадина и «Глюкаферона». В таблице 3 и на фиг.4. представлены результаты данного этапа работы.
Результаты исследований демонстрируют, что по сравнению с контрольной группой мышей выживаемость зараженных животных на фоне применения ремантадина увеличивается в 7 раз (58,3±10,1%), а выживаемость животных на фоне введения ремантадина и «Глюкаферона» повышается в 9,2 раза (76,4±5,0%). Это означает, что комбинированное введение животным ремантадина и ЗС на фоне гриппозной инфекции повышает результативность этиотропной противовирусной терапии в 2,2 раза (18,0%).
На фиг.5 представлены значения риска (R) развития неблагоприятного исхода экспериментальной гриппозной инфекции у мышей на фоне перорального применения: ремантадина, сочетания «Глюкаферона» и ремантадина, а также контрольной группы зараженных животных, которым не вводили указанные препараты.
Графическая интерпретация результатов исследования показывает, что риск развития неблагоприятного исхода терапии животных на фоне введения «Глюкаферона» и ремантадина в 3,8 раза ниже, чем в контрольной группе зараженных животных, и в 1,75 раза ниже у группы животных, которые получали один этиотропный противовирусный препарат. Снижение риска развития неблагоприятного исхода лечения зараженных животных на основе «Глюкаферона» и ремантадина свидетельствует об эффективности и целесообразности использования комбинированной терапии, имеющей этиотропную и патогенетическую направленность.
Таким образом, приведенные результаты позволяют сделать следующее заключение:
1. Пероральное использование «Глюкаферона» и ремантадина повышает эффективность и результативность лечения экспериментальной интраназальной гриппозной инфекции. Выживаемость животных на фоне введения ЗС и ремантадина достигает 76,4±5,0%. Риск развития неблагоприятного исхода терапии на фоне средства и ремантадина значительно снижается и составляет 0,24. Это свидетельствует о необходимости одновременного применения этиотропных химиопрепаратов и ЗС, что усиливает патогенетическую эффективность противовирусной терапии;
2. В компонентном составе заявляемого средства могут с равной возможностью быть использованы различные экстракты базидиальных грибов.
3. На фоне развития экспериментальной гриппозной инфекции Глюкаферон» обеспечивает достаточно выраженную активацию неспецифических факторов иммунной, противовоспалительной и антиоксидантной защиты организма зараженных животных. Совокупность активации этих эффектов увеличив