Средство для лечения связанных со стрессовыми условиями заболеваний и расстройств у человека и животных, а также способ лечения и/или профилактики с использованием этого средства
Иллюстрации
Показать всеГруппа изобретений относится к медицине и фармакологии. Средство для лечения и профилактики связанных со стрессовыми условиями заболеваний и расстройств у человека и животных представляет собой нонапептид KND следующей формулы: Trp-Lys-Gly-Gly-Asn-Ala-Ser-Gly-Glu, или нонапептид Trp-Lys-Gly-Gly-Asp-Ala-Ser-Gly-Glu, или гексапептид Trp-Lys-Gly-Gly-Asn-Ala, или их фармацевтически приемлемые соли. Фармацевтическая композиция для лечения и профилактики связанных со стрессовыми условиями заболеваний и расстройств у человека и животных включает нонапептид KND или нонапептид Trp-Lys-Gly-Gly-Asp-Ala-Ser-Gly-Glu, или гексапептид Trp-Lys-Gly-Gly-Asn-Ala и глицин и/или естественный антиоксидант, в частности карнозин или гомокарнозин. Соотношение компонентов в фармацевтической композиции: нонапептид или гексапептид: глицин:естественный антиоксидант по массе составляет 1:(10-125):(10-125). Фармацевтическая композиция используется в форме носовых капель, в виде спрея, распыляемого порошка, аэрозоля, сублингвально, в форме рассасывающихся таблеток, капсул и порошков, в виде различных инъекций, в виде суппозиториев, мазей, кремов, лосьонов. Способ лечения и профилактики связанных со стрессовыми условиями заболеваний и расстройств у человека и животных заключается во введении в организм указанной фармацевтической композиции в дозе от 10 мкг/кг до 10 мг/кг из расчета на нонапептид KND или нонапептид Trp-Lys-Gly-Gly-Asp-Ala-Ser-Gly-Glu, или гексапептид Trp-Lys-Gly-Gly-Asn-Ala. Изобретение обеспечивает повышение эффективности лечения и профилактики связанных со стрессовыми условиями заболеваний и расстройств у человека и животных. 3 н. и 3 з.п. ф-лы, 5 табл., 1 ил.
Реферат
Данное изобретение относится к олигопептидам с положительными фармакологическими свойствами и применению этих олигопептидов для лечения и/или предотвращения, в частности, связанных со стрессовыми условиями заболеваний и расстройств у человека и животных.
Изобретение также охватывает применение этих пептидов для приготовления фармацевтических композиций. Дальнейшим объектом данного изобретения является способ лечения и/или профилактики, в частности, связанных со стрессовыми условиями заболеваний и расстройств у человека и животных, с применением заявленных пептидов, в частности, в терапевтически эффективном количестве. Заявленные олигопептиды обладают фармакологической активностью и являются пригодными веществами для терапии и предотвращения, в частности, возникающих связанных со стрессом патологических состояний, которые относятся к центральной нервной системе (ЦНС).
Сокращения
АДГ - антидиуретический гормон
ВОЗ - всемирная организация здравоохранения
ДСИП - дельта-сон индуцирующий пептид
СДСИП - семейство дельта-сон индуцирующего пептида
KND - KN-DSIP, KN-ДСИП, (что соответствует (Lys,Asn)-DSIP. Согласно однобуквенному коду аминокислот Lys обозначается символом К, a Asn обозначается символом N)
CKND - семейство KND-пептидов
USP = фармакопея США
ЦНС - центральная нервная система
ГЭБ - гематоэнцефалический барьер
МАО - моноаминооксидаза
МДА - малоновый диальдегид
ГАМК - гамма-аминомасляная кислота
НАДФ - никотинамидадениндинуклеотидфосфат
Аналоги пептидов
В смысле заявленного изобретения термин "аналог" относится к пептидам, отличающимся от пептида с основной заявляемой аминокислотной последовательностью (I) или заменой одних аминокислотных остатков на другие или изменением длины аминокислотной цепи или соответствует продуктам модификации пептидной цепи.
Протеиногенными (белковыми) аминокислотами называются аминокислоты, являющиеся структурными элементами белков живых организмов.
Фармацевтически приемлемыми солями называются соли, приведенные в Фармакопее США или любой другой принятой фармакопее.
К этим солям относятся, но не ограничиваются ими, соли минеральных или органических кислот, таких как угольной, соляной, серной кислоты, фосфорной кислоты, а также молочной, бензойной, лимонной, щавелевой кислоты и других кислот, в том числе и соответствующие кислотно-аддитивные соли.
Носители и вспомогательные вещества (адъюванты)
Соответствующие носители и вспомогательные вещества обеспечивают возможность медицинского применения и/или введения фармацевтической композиции и при необходимости способствуют стабильности заявленных олигопептида(ов), в частности при хранении и производстве готовых лекарственных форм.
Указанные вещества хорошо известны специалистам и могут быть найдены в стандартной литературе.
Соответствующими, но не ограничивающимися только нижеследующими являются, например, карбонат/фосфат кальция, различные моно- и дисахариды, полисахариды (например, крахмал), жиры, биополимеры, такие как человеческий альбумин, а также биосовместимые полимеры, например, полиэтиленгликоль.
Стресс отнесен ВОЗ к одному из основных угрожающих здоровью человека факторов 21 века. Стрессовые реакции являются физиологическим ответом организма на повреждающие факторы различного происхождения или угрозу воздействия таких факторов.
Стресс может быть вызван рядом факторов, так называемых стрессоров: кроме физических и психических травм, вызванных, например, несчастными случаями или инфекционными заболеваниями, химические раздражения или радиация также способны способствовать возникновению стресса.
Приводимые источники информации (1-28) иллюстрируют как природу стресса, так и являются предшествующим уровнем знаний относительно заявляемых изобретений.
Острый и хронический стресс могут нарушать гомеостаз организма или ослаблять его, что выражается в ухудшении способности поддерживать физиологический баланс жизненно важных функций, например поддержания сердечной деятельности или дыхания.
Потеря организмом способности к поддержанию гомеостаза может приводить к постоянному нарушению функционирования основных органов и систем, таких как центральной нервной, эндокринной и сердечно-сосудистой.
Типичными последствиями нарушения способности адекватно реагировать на продолжительный стресс могут быть: психосоматические или иммунологические расстройства и повреждения органов, такие как инфаркт миокарда или, например, стресс-индуцированные язвы желудка.
Гомеостаз нервной системы и организма в целом поддерживается в существенной степени за счет нейрорегуляторных факторов - нейрогормонов, нейромодуляторов и нейротрансмиттеров, которые могут непосредственно секретироваться клетками гипоталамуса (1), а также различными секреторными клетками, расположенными в том числе и вне пределов ЦНС, например в тонком кишечнике.
Нейрорегуляторные факторы вызывают изменения функционирования организма млекопитающих, некоторые из них способствуют поддержанию гомеостаза.
Часто нейрорегуляторные факторы имеют пептидную природу (2).
В качестве примера таковых можно привести нонапептид АДГ (антидиуретический гормон, вазопрессин), который в качестве "гормона жажды" регулирует реабсорбцию воды в почках.
К эндогенным регуляторным пептидам модуляторного типа относится так называемый дельта-сон индуцирующий пептид (ДСИП), который является наиболее близким аналогом к настоящему изобретению и отличается от заявленных молекул, описанных ниже, своей первичной структурой.
Структура ДСИП была установлена в 1977 г. Было показано, что у кроликов при низкочастотной электростимуляции таламуса в дельта-фазе сна в церебральной венозной крови обнаруживается нейропептид с аминокислотной последовательностью Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu (3-4).
Последующее подробное изучение этого фактора различными группами ученых во всем мире показали, что основным возможным полем его применения является не только терапия расстройств сна (5-7), а область предотвращения развития стресс-индуцированной патологии организма и терапия последствий развития патологии.
Исследования физиологических свойств ДСИП показали его терапевтический эффект при эндо- и экзогенных нарушениях гомеостаза ЦНС (8-11).
В ЕР 1949906 А1 (12) ДСИП описывается как средство для лечения и профилактики против стресс-индуцированного массивного повреждения нервных клеток, вызываемого стресс-индуцирующими факторами, такими как радиация, инфекция либо травма.
ДСИП стабилизирует базовые функции ЦНС и вследствие этого оказывает корригирующее действие на нарушения гомеостаза организма в целом.
Различные эффекты ДСИП на эндокринную регуляцию организма не ограничиваются улучшением его сопротивления стрессорам: описаны и более фундаментальные свойства пептида, такие как взаимодействие с системой кортикотропина, антиоксидантные, иммуномодулирующие эффекты и мембранотропные свойства (13-15).
Наличие целого семейства пептидов, к которому относится ДСИП, было предположено еще в 1990-е годы, поскольку известно, что эндогенный ДСИП (как иммунореактивный фактор) может обнаруживаться как в исходной, так и в фосфорилированной или гликолизированной форме (16).
Предшествующим уровнем техники относительно данного изобретения являются также патент ЕР 0065747 В1 (23), который описывает ДСИП в качестве агента, пригодного к контролированию симптомов абстинентного синдрома, патент RU 2099078 С1 (24), описывающий медицинское использование антистрессового средства на основе ДСИП, и патент RU 2115660 С1 (25), описывающий аналоги ДСИП в качестве антистрессовых и противосудорожных агентов.
Задачей настоящего изобретения с учетом ближайшего уровня техники (ДСИП) является предоставление нового семейства фармакологически активных пептидов, более эффективно регулирующих функции организма, с предпочтительно возникающими терапевтическими, в особенности стресс-протективными и адаптогенными свойствами.
Поставленная задача решается основным заявляемым пептидом KND и его предпочтительными аналогами, формулы которых приведены ниже:
Trp-Lys-Gly-Gly-Asn-Ala-Ser-Gly-Glu (KND)
Trp-Lys-Gly-Gly-Asp-Ala-Ser-Gly-Glu (KND-5),
гексапептид
Trp-Lys-Gly-Gly-Asn-Ala
Представлено новое семейство регуляторных пептидов (CKND), родственных ДСИП, но неизвестного ранее строения. Основной заявляемый пептид KND (I) отличается от ДСИП природой двух аминокислотных остатков пептидной цепи, соответствующей известной структуре ДСИП: Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu. Такие изменения в структуре 2-х аминокислотных остатков приводят (см. примеры ниже) к улучшению фармакологических свойств, а также могут привести, в особенности, к усилению предполагаемого терапевтического эффекта, в частности, в предотвращении и лечении связанных со стрессом заболеваний у человека и животных. Пептиды CKND, включающие основной заявляемый пептид KND и родственные ему аналоги, различаются как природой отдельных аминокислотных остатков, так и изменением длины пептидной цепи. Предпочтительные аналоги отличаются от основного заявляемого пептида KND или изменением длины цепи в случае гексапептида или изменением одного аминокислотного остатка в случае нонапептида KND-5.
Приведенные ниже экспериментальные данные физиологического теста с форсированным плаванием крыс однозначно свидетельствуют о том, что заявленным веществом (I) достигается увеличение стресс-устойчивости животных при сравнении с ДСИП, проявляющееся в том числе повышением их выносливости и физической силы.
Настоящее изобретение, в частности, относится к профилактике и лечению патологических и связанных со стрессом нарушений гомеостаза организма человека и животных.
Что касается механизма действия олигопептидов из CKND, авторы изобретения предполагают, что предлагаемые пептиды оказывают модулирующее влияние на уровень возбуждающих и ингибиторных нейротрансмиттеров, в том числе ГАМК, серотонина или глутамата.
Как и СДСИП, предлагаемые пептиды CKND (I-IV), предположительно могут также модулировать активность ключевых мембранных митохондриальных ферментов, а также ферментов, контролирующих метаболизм в ЦНС и периферических тканях, таких как: моноаминоксидазы А, гексокиназы, НАДФ-зависимой малатдегидрогеназы, креатинкиназы, ферментов дыхательной цепи, гипоталамической глутаминсинтетазы, супероксиддисмутазы (8, 9, 13).
Компьютерный поиск аминокислотных последовательностей, гомологичных веществу согласно изобретению с помощью программы поиска BLAST (PubMed, Basic Local Alignment Search Tool) выявил наличие 100%-ного соответствия основного пептида KND участку человеческого ядерного белка 1В, (называемого «Jumonji domain containing 1B»), продукта гена, локализованного на 5 хромосоме генома человека, и состоящего из 1551 аминокислотных остатков (17).
JMJD1B является членом семейства гистоновых деметилаз типа JHDM1 и JHDM2, включающих домен JmjC.
JmjC-домен-содержащие гистоновые деметилазы способны деметилировать лизиновые остатки гистонов, консервативны у разных видов от дрожжей до человека. Метилирование-деметилирование гистонов является важным механизмом посттрансляционных модификаций и играет исключительную роль в регуляции структуры хроматина и транскрипции генов. Сайт-специфичное обратимое деметилирование гистонов отражает процесс динамичной регуляции активности хроматина в ответ на возникающие потребности клеток адаптироваться к действию стрессовых внешних и внутренних стимулов. Эти ферменты убиквитарно экспрессируются в различных тканях млекопитающих. Первые исследования базового гена JMJ предполагают его важную роль в развитии нервной системы и некоторых органов, таких как печень, селезенка, тимус (18, 19).
В ЕР 1950286А1 (22) описывается использование смеси деметилирующих ферментов, содержащих домен Jumonji, в особенности для лечения рака предстательной железы.
Согласно предпочтительной форме выполнения заявленного изобретения предлагаемый пептид KND из группы пептидов CKND общей формулы (I) имеет структуру: Trp-Lys-Gly-Gly-Asn-Ala-Ser-Gly-Glu. Другими предпочтительными формами выполнения изобретения являются приведенные ниже пептиды семейства KND (CKND) или аналоги KND (2-4):
Trp-Lys-Gly-Gly-Asp-Ala-Ser-Gly-Glu (KND-2),
Trp-Lys-Gly-Gly-Asn-Ala-Ser-Gly-Glu-Pro (KND-3),
Trp-Lys-Gly-Gly-Asn-Ala (KND-4).
Вышеприведенные пептиды семейства KND можно синтезировать классическими методами синтеза пептидов, как традиционным способом синтеза в растворе, так и твердофазным способом синтеза на полимерном носителе. Очистку пептидов проводят хроматографическими методами. Анализ структуры и степени индивидуальности синтетических пептидов осуществляют современными физико-химическими методами. Эти методы хорошо разработаны и описаны в соответствующей литературе (20, 21).
Пептиды CKND и их фармацевтически приемлемые соли полностью или частично могут входить в состав фармацевтических композиций с фармацевтически приемлемыми носителями.
Данное изобретение также относится к смесям, соответственно, комбинациям пептидов настоящего изобретения с другими нейропептидами, например ДСИП, его аналогами и с фармацевтически подходящими растворителями и/или растворами, и/или наполнителями, например дистиллированная вода, физиологический раствор, подходящие буферные растворы, карбонат/фосфат кальция, различные моно- и дисахариды, полисахариды, жиры, и прочими инертными наполнителями. Данное изобретение также относится к смесям с другими известными нейропротективными агентами, такими как, например, пирацетам или мексидол.
Можно полагать, что совместное применение пептидов данного изобретения с пирацетамом или мексидолом будет способствовать усилению протективного эффекта, как это было описано ранее для смеси ДСИП и пирацетама или его комбинации с мексидолом (27-28).
Эти смеси могут быть использованы в производстве фармацевтических композиций, при получении лекарственных форм, подходящих для лечения и/или предотвращения заболеваний, в особенности связанных со стресс-индуцированными заболеваниями и расстройствами функций организма у людей и животных.
Предметом настоящего изобретения являются также фармацевтические композиции, соответственно, комбинации пептидов семейства KND и одного или более прочих действующих компонентов, таких как белковые аминокислоты (например, нейротрансмиттер глицин или прочие аминокислоты), естественные антиоксиданты, например карнозин, гомокарнозин или их предшественники, например ацетилпроизводные.
Соотношение основных компонентов вышеуказанных фармацевтических композиций по массе предпочтительно следующее: пептид CKND:аминокислотный компонент:естественный антиоксидант: 1:(10-125):(10-125) для трехкомпонентных композиций или следующее для двухкомпонентных композиций типа: пептид CKND: аминокислотный компонент (или естественный антиоксидант): 1:(10-125).
Композиции могут включать другие приемлемые ингредиенты, обычно используемые для приготовления лекарств, такие как наполнители, улучшители вкуса и отдушки, подсластители, консерванты и т.д.
Настоящие композиции могут также включаться в парафармацевтические биологически активные добавки, гомеопатические средства и детское питание.
Согласно изобретению предлагаемое вещество в основном используют в терапевтически эффективном количестве, предпочтительно в диапазоне доз от 10 мкг/кг до 10 мг/кг или в гомеопатических дозах в случае гомеопатических лечебных форм (26).
Известно, что вещества пептидной природы оказывают свое действие не только при введении путем различных инъекций, но и с использованием других способов введения, в частности интраназального (11) или сублингвального.
Заявляемые вещества или фармацевтические композиции с ними могут вводиться, например, интраназально в форме носовых капель, в виде спрея, распыляемого порошка, аэрозоля, сублигвально, в форме рассасывающихся таблеток, капсул и порошков; в виде различных инъекций (внутривенных, внутримышечных, подкожных и внутрикожных); чрескожно с помощью приборов для лечебного электрофореза; в виде суппозиториев, мазей, кремов, лосьонов, а также включаться в продукты детского питания.
Настоящее изобретение относится к веществам, которые обладают фармакологической активностью и, в частности, являются средствами, пригодными для терапии и предотвращения стресс-индуцированных патологических изменений. Эти изменения относятся, в основном, к ЦНС, но только ей не ограничиваются.
Экзогенные и эндогенные факторы, такие как интоксикации, травма, тяжелые заболевания, вызывают стресс и могут провоцировать нарушение гомеостаза организма в целом. В случае если организм не способен справиться с данными нарушениями гомеостаза, вследствие различных заболеваний или хронических нарушений, как функциональных, так и органических, могут развиваться так называемые стресс-индуцированные заболевания и расстройства.
Часто имеют место не только функциональные, но и морфологически видимые органические повреждения ЦНС, характеризующиеся массивной гибелью нейронов. Предлагаемые вещества, в особенности предпочтительные формы выполнения изобретения, равно как и фармацевтически приемлемые соли, способны предотвращать развитие дефицита эндогенных регуляторных пептидов, например ДСИП и прочих, которые могут возникать в случае тяжелых или хронических стрессовых ситуаций.
Эксперименты на животных показали сходную направленность действия ДСИП и KND, причем KND превосходил ДСИП по эффективности действия.
Нижеприведенные опыты иллюстрируют заявленное изобретение. Заявленное изобретение не ограничивается данными примерами.
Вышеупомянутая активность заявленного вещества KND и его аналогов KND-(2-4) однозначно вытекает из нижеприведенных опытов, при проведении которых проводилось сравнение заявленного вещества с известным пептидом ДСИП и контрольной группой.
Примеры.
1. Исследование токсичности (см. пункт 1 формулы изобретения).
18 крыс-самцов линии Вистар в возрасте 3 месяца были разделены на 3 группы по 6 крыс. Животные в каждой группе получали подкожно в течение 2 периодов введения по 4 суток в течение 2 недель дозы по 100 мкг/кг пептида KND или 100 мкг/кг ДСИП, растворенных в воде для инъекций в объеме 0,2 мл, либо воду для инъекций в объеме 0,2 мл на крысу. Введение пептидов осуществлялось утром, по окончанию эксперимента оценивали изменение массы тела животных. Изменения массы тела взрослых грызунов является общепринятым параметром для исследования токсичности различных веществ. Увеличение массы тела между днями первого и последнего введений было одинаковым во всех экспериментальных группах (таблица 1).
Таким образом, исследованное вещество KND не является токсичным.
| Таблица 1 | |||
| Сравнение среднего увеличения массы тела | |||
| Увеличение массы тела, г | Контроль | ДСИП | KND |
| Среднее значение | 22,20 | 24,00 | 22,00 |
| Стандартное отклонение | 7,79 | 5,90 | 13,13 |
| N | 5 | 5 | 6 |
2. Тест форсированного плавания (см. пункт 1 формулы изобретения).
Через два часа после последнего введения KND, ДСИП или воды в условиях предыдущего исследования на токсичность подопытные крысы прошли исследование в тесте форсированного плавания, который позволяет оценивать как физическую силу и выносливость животного, так и его психоэмоциональное состояние.
Тест проводился в бассейне с водой, температура которой составляла на протяжении всего эксперимента 30±1°С. К шее крыс на мягком не стесняющем движений животного и не затрудняющем приток воздуха ошейнике крепился груз, состоящий из металлических элементов, вес которых рассчитывался, исходя из веса крысы, и всегда составлял 20% от него.
Крысу взвешивали, и вес металлических элементов рассчитывали непосредственно перед погружением животного в воду. После погружения крысы в воду оценивали продолжительность плавания, которую фиксировали секундомером и измеряли в секундах.
За конец времени плавания принимался момент, когда крыса переставала плавать, опускалась на дно бассейна и в течение как минимум 10 секунд не предпринимала дальнейших попыток всплыть. В этот момент животное извлекали из воды для дальнейшего исследования. В то время как в группе, получавшей ДСИП, наблюдалось только немногим большее время плавания, чем в группе контроля, в группе KND время плавания было чаще всего значительно более длительным, чем в группах ДСИП и контроля (таблица 2).
| Таблица 2 | |||
| Показатели крыс в тесте плавания с форсированием | |||
| продолжительность плавания, с | контроль | ДСИП | KND |
| средняя | 306,25 | 329,50 | 568,00 |
| стандартное отклонение | 110,56 | 237,32 | 327,76 |
| N | 4 | 5 | 5 |
Исходя из полученных результатов, можно констатировать, что при применении KND не только не наблюдалось ухудшения физической силы, выносливости и психоэмоционального состояния, но имело место явное улучшение этих параметров по сравнению как с группой контроля, так и с группой, получавшей ДСИП.
Как показано в приведенном примере, крысы, получавшие по 100 мкг/кг средства KND, чаще всего имели большую выносливость по показателю плавания в воде, чем контрольные животные. Это указывает на большую физическую силу, а равно и лучшую стресс-устойчивость. Результаты теста форсированного плавания демонстрируют потенциал предмета изобретения по поддержке физической силы при стрессе, что является чрезвычайно важной характеристикой при тяжелых заболеваниях. Также очевидно превосходство KND по этому показателю не только по сравнению с контрольной группой, но и с группой ДСИП.
3. Сравнительная оценка влияния ДСИП и KND на состояние антиокислительной системы организма при стрессе (см. пункт 1 формулы изобретения).
Непосредственно после окончания теста форсированного плавания животных сакрифицировали путем гильотинирования и проводили аутопсию. Кровь забирали на анализ содержания малонового диальдегида (МДА). Показано, что применение как ДСИП, так и KND не приводило к достоверному изменению уровня антиокислительной активности организма в условиях теста форсированного плавания (Таблица 3).
| Таблица 3 | |||
| Уровень МДА в крови животных | |||
| Активность МДА, ед. | Контроль | ДСИП | KND |
| средняя | 9,84 | 11,04 | 10,92 |
| стандартное отклонение | 1,80 | 1,21 | 0,91 |
| N | 5 | 5 | 5 |
Сравнивались средние значения по группам для демонстрации тенденций.
В целом увеличение содержания МДА может рассматриваться как последствие хронического стресса. Однако проведенные ранее эксперименты продемонстрировали, что ДСИП в первые минуты после введения, равно как и в первые минуты после стрессового воздействия, оказывает легкое прооксидантное действие, затем сменяющееся достоверным антиоксидантным (14).
4. Опыт по гипокинетическому стрессу (см. пункты 1-4 формулы изобретения).
Кроме основной группы экспериментов по изучению действия KND на животных в условиях гипокинетического стресса, была проведена дополнительная оценка эффективности KND в различных дозах, либо в смеси с фармакологически активной аминокислотой глицином или в смеси с глицином и прямым антиоксидантом карнозином, или в смеси только с карнозином.
Опыты проводили на белых крысах обоего пола массой 150-200 г. Гипокинетический стресс вызывали помещением крыс в специальные камеры, ограничивающие подвижность животных сроком на 6 часов. За 1 час до начала стресса крысам вводили внутрибрюшинно KND в различных дозах, либо в смеси с глицином или карнозином или в смеси глицина и карнозина, либо только физиологический раствор.
Об уровне стресса судили по накоплению в мозге животных МДА. Были получены следующие результаты (Таблица 4). Длительная гипокинезия приводила к двукратному увеличению содержания МДА в мозге, в то время как предварительное введение животным KND или его композиций с глицином и/или карнозином полностью предотвращало стресс-индуцированное накопление МДА в мозге.
Таким образом, KND и его композиции с глицином и/или карнозином проявили выраженные антиоксидантные свойства и полностью предотвращали стресс-индуцированное накопление в мозге конечных продуктов перекисного окисления липидов клеточных мембран.
| Таблица 4 | |
| Контроль | 35,47±2,53 |
| Гипокинезия + физиологический раствор (гипокинезия) | 70,05±2.61* |
| Гипокинезия + KND (120 мкг/кг) | 35.58±2.20** |
| Гипокинезия + KND (120 мкг/кг) + глицин (1,2 мг/кг) | 32.72±1.45** |
| Гипокинезия + KND (200,0 мкг/кг) + глицин (10 мг/кг) | 29.91±1.63** |
| Гипокинезия + KND (200 мкг/кг) + глицин (10 мг/кг) + карнозин (15 мг/кг) | 28,04±1.45** |
| Гипокинезия + KND (120 мкг/кг) + карнозин (15 мг/кг) | 26,33±1.85** |
| * - достоверность отличий по сравнению с контролем p<0,05 | |
| ** - достоверность отличий по сравнению с гипокинезией p<0,05, в каждой группе по 6 крыс. Содержание МДА указано в нмолях на 1 г ткани мозга |
5. Опыт по гипоксическому стрессу (см. пункт 1 формулы изобретения).
Эксперименты по гипоксическому стрессу проводили на белых крысах самках Rattus norvegicus массой 180-200 г в возрасте 6 месяцев, все животные были разделены на 4 группы по 8 крыс: 1 группа - контроль - интактные животные; 2 группа - крысы, подвергнутые действию гипобарической гипоксии; 3 группа - крысы, которым внутрибрюшинно за 20 мин до гипоксии вводили пептид KND в дозе 120 мкг/кг веса в физиологическом растворе, 4 группа - контрольные крысы, которым внутрибрюшинно вводили пептид в дозе 120 мкг/кг веса в физиологическом растворе.
Моделирование гипоксии осуществляли в режиме 230 мм рт. ст. (9000 м над уровнем моря) в течение 180 минут. Подопытные животные помещались в барокамеру объемом 20 л, снабженную щелочным поглотителем углекислоты. Декомпрессию и компрессию проводили в течение 15 мин. Изопрессия составляла 150 минут.
По завершению сеанса гипоксии и декапитации животных определяли известными методами биохимические показатели состояния процессов перекисного окисления липидов (ПОЛ) мембран клеток крови: уровень малонового диальдегида (МДА), шиффовых оснований (ШО) и диеновых конъюгатов (ДК).
Действие гипоксии, соответствующей высоте 9000 м над уровнем моря в течение 3 часов, сопровождалось активизацией ПОЛ, что выражалось в достоверном накоплении первичных (ДК), вторичных (МДА) и конечных (ШО) продуктов окисления липидов в плазме крови. Было обнаружено, что вследствие гипоксии содержание ДК, МДА и ШО в плазме крови крыс достоверно увеличивалось на 50,7%, 23,7% и 31,6%, соответственно, по сравнению с контролем (Р<0,05).
Применение к животным преадаптации путем введения пептида KND перед сеансом гипоксии оказывало корригирующее влияние на процессы ПОЛ. По сравнению с показателями животных, подвергнутых гипоксии без введения пептида, содержание ДК, МДА и ШО в плазме крови крыс, которым вводили KND, было статистически достоверно меньше на 23,4%, 41,7% и 31,4%, соответственно, Р<0,05.
Таким образом, KND в условиях экспериментальной гипоксии проявил при предварительном введении крысам достоверные и выраженные антиоксидантные свойства по подавлению стресс-индуцированного накопления в крови начальных и конечных продуктов перекисного окисления липидов клеточных мембран.
6. Оценка детоксицирующего действия пептидов CKND (см. пункт 1 формулы изобретения).
Проведена серия экспериментов по оценке детоксицирующего действия KND и нонапептида KND-2 в сравнении с ДСИП в различных дозах на мышах, получавших полулетальную дозу цитотоксического препарата «цисплатин». ДСИП, KND и KND-2 вводили внутривенно в течение 4-х дней в разовой дозе 50 мкг/кг или 100 мкг/кг через 24 ч после введения цитостатика. Цитостатик цисплатин вводился однократно внутривенно в разовой дозе 15 мг/кг, вызывающей 50% гибель животных. Исследования проведены на 50 мышах, гибридах BDF1, самках. Регистрировали гибель животных от острой токсичности цитостатика.
Введение KND в курсовой дозе 200 и 400 мкг/кг приводило к двукратному снижению гибели животных от острой токсичности цисплатина. KND-2 в тех же дозах вызывал снижение гибели животных на 30%, а ДСИП в этих же дозах вообще не снижал токсичности цитостатика, а проявлял детоксицирующее действие лишь при увеличении курсовой дозы до 1000 мкг/кг. Таким образом, в этой серии экспериментов показано выраженное антитоксическое действие пептидов CKND, которое было значительно более эффективным, чем в случае ДСИП.
7. Кардиопротективные свойства пептидов CKND (см. пункт 1 формулы изобретения).
Проведено исследование кардиопротективной активности некоторых пептидов CKND, а именно: нонапептида KND и гексапептида в сравнении с ДСИП на модели острого инфаркта миокарда у крыс линии CD. Животных под уретановым наркозом подвергали 25-минутной окклюзии левой коронарной артерии с последующей 2-часовой реперфузией при искусственной вентиляции легких. В момент снятия окклюдера, крысы получали внутрибрюшинную инъекцию одного из изучаемых пептидов в дозе 150 мкг/кг. Контролем служили животные, которым вводился растворитель в эквивалентном объеме. Эффекты веществ оценивали путем определения отношения зоны инфаркта к зоне риска при сканировании специальным образом прокрашенных срезов сердца. Пептиды CKND и ДСИП, введенные в начале реперфузии, как видно из таблицы 5, достоверно уменьшали зону инфаркта. Пептид KND оказался значительно эффективнее ДСИП и статистически достоверно уменьшал зону инфаркта в 2 раза по сравнению с контролем (19,1±2,6 против 42,1±4,1) и достоверно превышал активность ДСИП. Пептиды KND-3, KND-4 и ДСИП также достоверно уменьшали зону инфарктного поражения в 1,5 раза по сравнению с контролем.
| Таблица 5 | |
| Группы крыс (n=8) | Зона инфаркта/зона риска в % |
| Контроль (острый инфаркт) | 42,1±4,1 |
| KND (120 мкг/кг) | 19,1±2,6*,** |
| гексапептид Trp-Lys-Gly-Gly-Asn-Ala | |
| 29,8±1,8* | |
| ДСИП | 28,7±3,3* |
Размер зоны инфаркта, выраженный в процентах от зоны риска в контрольной и опытных группах. * - Р<0.05 по t-критерию Стьюдента относительно группы «контроль»; ** - Р<0.05 по t-критерию Стьюдента относительно группы «ДСИП»
Таким образом, пептиды CKND обладают кардиопротективной активностью при введении в раннем реперфузионном периоде, являются потенциальными кардиопротекторами и могут найти применение в кардиохирургии.
8. Противосудорожная активность пептида KND (см. пункт 1 формулы изобретения).
С целью оценки противосудорожной активности KND проведены эксперименты по изучению влияния KND на коразоловые судороги у крыс линии Вистар. Исследование выполнено на крысах-самцах весом 200-220 г. KND вводили животным внутрибрюшинно в дозе 100 мкг/кг веса. Контрольным животным вводили стерильную воду для инъекций. В качестве активного контроля использовалась группа крыс с введением ДСИП внутрибрюшинно в дозе 100 мкг/кг веса. Тестирование крыс начиналось через 3 часа после введения пептидных препаратов.
Судороги у крыс индуцировали внутрибрюшинной инъекцией конвульсантной дозы коразола (50 мг/кг, пентилентетразол, Sigma, США). Период наблюдения судорожной активности и последующих двигательных нарушений составлял 30 мин после введения коразола. Регистрировали следующие поведенческие показатели: латентный период (ЛП) судорожного припадка, который оценивался от момента введения коразола до первого миоклонического подергивания скелетной мускулатуры туловища, ЛП генерализованного клонического припадка, продолжительность генерализованного клонического и тонического компонентов судорог, количество животных с клоническими и тоническими судорогами. В связи с этими особенностями для оценки тяжести коразоловых судорог использовали модификацию шкалы Рэсин (Racine 1972). После окончания судорожного припадка регистрировали тяжесть симптомов атаксии. Статистическую обработку полученных результатов проводили с использованием статпакетов EXCEL и Statistica. При сравнении средних значений анализируемых показателей применялся параметрический t-критерий Стьюдента и двухфакторный дисперсионный анализ ANOVA (LSD тест) или непараметрический критерий Вилкоксона. Различия полученных результатов считались статистически достоверными при уровне значимости р<0.05.
Исследования показали, что введение крысам (n=10) конвульсантных доз коразола приводило к развитию судорожного припадка с латентным периодом 58±3,9 с. Припадок начинался с отдельных подергиваний скелетной мускулатуры туловища и развитием орально-лицевых судорог, далее следовала фаза клонических судорог (длительностью 14,7±5,0 с), а затем фаза тонических судорог (длительностью 9,8±2,3 с). После окончания судорожного припадка у животных наблюдались двигательные нарушения в виде симптомов атаксии (длительностью 872±149 с). Длительность и тяжесть атаксии оценивались по шкале Стерджин (Рукояткина и др., 2000). Симптомы атаксии проявлялись в виде значительного ухудшения антигравитационных рефлексов, полной неспособности к перемещению.
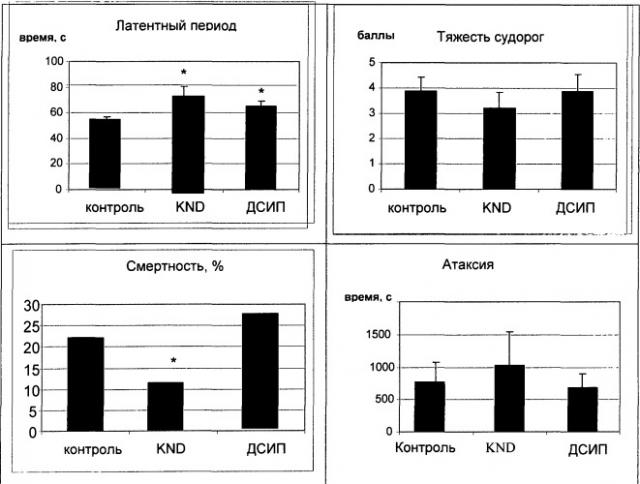
В получавших KND и ДСИП группах наблюдалось увеличение ЛП судорожного припадка на 22,0±1,7 с и на 11,6±1,9 с соответственно. После инъекций KND обнаружено значительное снижение смертности животных (Рис.1). Эти данные свидетельствуют о наличии защитного действия у KND и, в меньшей степени, у ДСИП. Достоверного влияния на длительность атаксии не выявлено.
Рис.1. Изменения показателей судорожного припадка, вызванного коразолом (50 мг/кг) через 3 часа после введения ДСИП или KND в дозе 100 мкг/кг. * - достоверные различия при p<0.05.
Таким образом, в исследовании показано, что KND способствует уменьшению длительности компонентов судорожного припадка и летальности животных на моделях коразол-индуцированных судорог. Сходное защитное действие KND было выявлено также и на модели аудиогенных судорог.
Полученные в дополнительных экспериментах результаты свидетельствуют о том, что применение пептидов CKND способствует повышению активности системы антистрессорной защиты организма, подавляет вызываемую гипокинетическим воздействием интенсификацию окислительных процессов, ограничивает зону инфарктного поражения сердца в ишемических условиях при моделирования острого инфаркта миокарда у экспериментальных животных, а также увеличивает выживаемость животных в условиях воздействия токсических препаратов.
Показано выраженное антистрессорное, антиишемическое, нейротропное и антитоксическое действие пептидов CKND.
В целом, результаты указывают на то, что заявляемые пептиды CKND оказывают нормализующее действие в условиях выраженных стресс-индуцированных нарушений гомеостаза, предположительно, посредством нормализации в организме баланса возбуждающих и тормозных нейротрансмиттеров, таких как ГАМК, глутаминовая кислота, аспарагиновая кислота и серотонин и таким образом проявляют антиоксидантное, ангипоксическое, противосудорожное и антитоксическое действие.
Среди возможных объектов воздействия KND могут быть митохондриальные ферменты, контролирующие метаболизм ЦНС и периферических нервных тканей, например МАО А, гексокиназа, НАДФ-зависимая малатдегидрогеназа, креатинкиназа, а также ферменты дыхательной цепи, гипоталамическая глутаминсинтетаза, СОД и каталаза.
Средство - семейство фармакологически активных пептидов, CKND - вследствие этого потенциально пригодно для терапии широкого круга заболеваний, связанных со стрессом, так и в виде фармацевтических комбинаций с различными лекарственными препаратами, травяными препаратами, пищевыми добавками, а также для терапии различных проявлений и последствий нарушенного гомеостаза.
Таковые включают в себя, но не ограничиваются нейрогуморальными и эндокринными расстройствами, вызванными внешними и внутренними нарушениями.
Механизм действия предлагаемых пептидов может быть описан, например, как стресс-протективный, адаптогенный, нейропротективный, антиоксидантный, кардио- и геропротективный, противосудорожный, антитоксический.
Пептиды CKND, очевидно, по аналогии с родственными пептидами СДСИП, подходят для терапии и предотвра