Палладиево-медные катализаторы гомогенного селективного окисления тиольных групп, комбинация и композиция на их основе и способ терапевтического воздействия
Иллюстрации
Показать всеИзобретение относится к бионеорганической химии, медицинской химии и медицине. Палладиево-медный катализатор гомогенного селективного окисления тиолов сочетает в себе функциональное биядерное тиолатмостиковое координационное соединение палладия(II) и модифицирующий тиолатный комплекс меди(I), имеющий общую формулу SR представляет собой остаток тиолатного лиганда глутатиона или ацетилцистеина, k=2÷14, m≥3k. Также предложены каталитическая комбинация, стимулирующая пролиферативную активность фармакологическая комбинация для усиления терапевтической активности пуринового и (или) пиримидинового основания или ионов лития, фармацевтические композиции, стимулирующие пролиферативную активность и для усиления терапевтической активности указанных оснований или ионов лития, и способы терапевтического воздействия на организм пациента на основе указанного катализатора. Катализатор обладает сниженной токсичностью и может быть использован в фармакологических решениях с лекарственными средствами для терапии различной длительности, при которой востребована каталитическая активность в реакциях окислительной модификации тиолов до дисульфидов в составе молекул пептидной природы. 7 н. и 12 з.п. ф-лы, 3 ил., 11 табл., 12 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к бионеорганической химии, медицинской химии и медицине, а именно к области получения лекарственных препаратов, и может быть использовано в бионеорганической химии, фармакологии, медицине и ветеринарии.
Предшествующий уровень техники
Повышение терапевтической эффективности фармакологических молекул посредством оптимизации их фармакокинетики и/или фармакодинамики и/или снижения токсичности за счет химической модификации молекулы лекарственного средства и/или ее сочетанным использованием с другим химическим соединением или соединениями является одним из направлений создания лекарственных препаратов нового поколения, проявляющих свою активность в физиологически более оптимальных дозах.
Так, известен ряд комбинированных средств, в том числе Амоксиклав, содержащий в своем составе амоксициллин и клавулановую кислоту, Тиенам, содержащий имипенем в сочетании со специфическим ингибитором фермента дигидропептидазы почек циластатином. Клавулановая кислота препятствует разложению бактериальными ферментами амоксициллина, а циластатин тормозит метаболизм имипенема в почках, что значительно повышает концентрацию неизмененного антибиотика в почках и мочевыводящих путях.
Существует, однако, масса других лекарственных средств, потенциально полезных для лечения заболеваний, однако не обеспечивающих желаемого эффекта в силу развития к ним того или иного вида устойчивости.
В настоящее время известно вещество дисульфид N-глутамил-L-цистеинил-глицина - окисленный глутатион (GSSG), которое само по себе обладает разнообразной фармакологической активностью. В частности, выявлена способность окисленного глутатиона инициировать процессы, осуществляющие различные виды химической модификации: фосфорилирование, глутатионелирование, окисление и др., - которые предшествуют формированию определенной структурной конформации с высоким сродством к лиганду и способностью к выполнению физиологической функции. Показана способность окисленного глутатиона усиливать продукцию широкого спектра цитокинов, контролирующих комплекс защитных реакций организма, включая противовирусное, антибактериальное, противоопухолевое, антифибротическое действие. Предложен спектр фармакологических решений по созданию композитов, включающих комплексное соединение окисленного глутатиона и цисплатина в сочетании с фармакологически активными молекулами для лечения различных заболеваний, включая сахарный диабет, ишемическую болезнь сердца, вирусные гепатиты, злокачественные опухоли, гнойные инфекции и ряд других. В частности, для лечения лекарственно резистентных форм вирусных гепатитов В и С предложено фармакологическое решение по усилению противовирусной активности инозина, применяемого в форме органической соли с окисленным глутатионом (RU 2153350, RU 2153351).
Однако в состав препарата окисленного глутатиона, раскрытого в RU 2153350, входит цисплатин, представляющий собой комплексное соединение платины (Pt), применение которой сопряжено с опасностью токсического и мутагенного действия. При этом именно платина проявляет каталитический эффект при использовании ее в минимальном количестве.
Опасность токсического действия платины в составе препарата окисленного глутатиона при многократном введении доказана в эксперименте на клетках, где ежедневное введение комплексного соединения платины на протяжении пяти дней привело к подавлению пролиферативной активности культуры и ее гибели. Использование окисленного глутатиона также накладывает определенные ограничения на возможные фармакологические решения, так как позволяет создавать лекарственные формы преимущественно парентерального введения.
Поэтому существует необходимость в разработке новых препаратов, обладающих способностью повышать терапевтическую эффективность фармакологических молекул посредством оптимизации их фармакокинетики и/или фармакодинамики, пригодных для создания лекарственные формы энтерального, парентерального и иных возможных способов введения.
Сущность изобретения
Данная задача решена тем, что предложен палладиево-медный катализатор гомогенного селективного окисления тиолов, сочетающий в себе функциональное биядерное тиолатмостиковое координационное соединение палладия(II) и модифицирующий тиолатный комплекс меди(I), имеющий общую формулу
,
где
SR представляет собой остаток тиолатного лиганда, выбранный из группы, включающей в себя остаток глутатиона и ацетилцистеина,
k=2÷14,
m≥3k.
Предпочтительно окисление представляет собой гомогенное селективное окисление тиолов с образованием дисульфидных связей между тиольными остатками, причем тиол, в отношении окисления которого осуществляется каталитическая функция, представляет собой N-ацетил-цистеин или N-глутамил-L-цистеинил-глицин.
Предпочтительно катализатор получают путем взаимодействия моноядерных аминатных комплексов палладия(II) и соответствующих тиолов с комплексами, образующимися из солей меди(II) и соответствующих тиолов.
Целесообразно в катализаторе по изобретению мольное соотношение Pd:Cu лежит в интервале от 1:0,1 до 1:2, более предпочтительно в интервале от 1:0,2 до 1:1.
Катализатор по изобретению можно применять в терапии.
Предложена также каталитическая комбинация, образованная тиолом, выбранным из ацетилцистеина, глутатиона, их сольватов и солей, и катализатором по изобретению.
Предпочтительно в комбинации катализатор присутствует в количестве от 1·10-2 до 1·10-7 г на моль тиола. Причем предложенная комбинация может по существу состоять только из дисульфида ацетилцистеина и/или глутатиона, их сольватов и солей и катализатора по изобретению.
Комбинацию по изобретению можно применять в терапии.
Предложена также фармакологическая комбинация, включающая в себя указанную каталитическую комбинацию и фармакологически активное соединение, способное к вступлению в реакцию присоединения с компонентами комбинации.
Эту комбинацию целесообразно применять для повышения терапевтической активности фармакологически активного соединения.
Указанное фармакологически активное соединение может представлять собой лекарственную или биологически активную молекулу, выбранную из пуриновых или пиримидиновых оснований или их производных.
Эту комбинацию можно применять в терапии инфекционных и неинфекционных заболеваний.
Фармакологически активное соединение может представлять собой инозин или рибавирин.
Предложена также фармацевтическая композиция, включающая в себя описанные катализатор или комбинацию и фармацевтически приемлемый эксципиент. Такая фармацевтическая композиция повышает терапевтическую активность фармакологически активных соединений.
Предложен также способ терапевтического воздействия на организм пациента для повышения терапевтической активности фармакологически активного соединения, при котором нуждающемуся в этом пациенту вводят эффективное количество катализатора, комбинации или композиции по изобретению.
Описание графических материалов
На Фиг.1 представлена зависимость накопления дисульфида N-глутамил-L-цистеинил-глицина как функция соотношения числа молей Pd:Cu в системе: «» (tg(α) - тангенс угла наклона для реакции окисления глутатиона пероксидом водорода в присутствии катализатора Pd-Cu, L=n(Cu)/n(Pd), 25±0.1°C, CGSH 2 мг/мл, рН 6.0, Cpd 3.4e-6 моль/литр).
Фиг.2 демонстрирует относительную каталитическую эффективность комплексов в реакции окисления N-глутамил-L-цистеинил-глицина пероксидом водорода по сравнению с биядерным комплексом палладия [Pd2(µ-SG)2(NH3)4]2+ (25±0.1°C, CGSH=2 мг/мл, рН=5.3, Cм=6.5е-6 моль/литр).
На Фиг.3 представлены кривые окисления N-глутамил-L-цистеинил-глицина комплексами палладия, меди и бинарным катализатором Pd-Cu (25±0.1°C, CGSH 2 мг/мл, рН 6.0, Cм 6.3е-6 моль/литр).
Подробное описание изобретения
Попытки авторов изобретения использовать препарат дисульфида N-глутамил-L-цистеинил-глицина, получаемый без использования цисплатина или с использованием другого металла, привели к снижению терапевтических результатов.
Авторами данного изобретения было обнаружено, что множество проявлений фармакологической активности дисульфида N-глутамил-L-цистеинил-глицина, получаемого по способу из RU 2153350, сопряжено со способностью препарата осуществлять каталитическое окисление сульфгидрильных групп до дисульфидов в составе молекул пептидной природы.
Авторы изобретения выявили необходимость осуществления управляемого катализа, что было достигнуто с помощью предложенного катализатора по изобретению.
Тиолатные комплексы меди(I), будучи добавленными к биядерным тиолатмостиковым координационным соединениям палладия(II), способны значительно изменять скорость, но не глубину окисления тиола. На Фиг.1 в качестве примера представлены зависимости накопления дисульфида N-глутамил-L-цистеинил-глицина (GSSG) как функции соотношения Pd:Cu в системе «».
Как можно видеть из результатов, приведенных на Фиг.1, каталитическая эффективность палладиевого катализатора, модифицированного ионами меди(I), возрастает при изменении соотношения Pd:Cu от 1:0 до 1:2.
Хорошо известно, что ионы Cu2+ сами способны эффективно катализировать окисление тиоаминокислот до образования в них связей -S-S-. Поэтому для установления области изменения соотношения Pd:Cu в предлагаемых бинарных каталитических системах Pd-Cu авторами были отдельно рассмотрены каталитические эффективности биядерных тиолатмостиковых комплексов палладия(II), тиолатных комплексов меди(I) и их совместная работа.
Окисление тиолов биядерными комплексами палладия
При каталитическом окислении тиолов RSH одной из наиболее важных функций палладия является образование координационных соединений - продуктов присоединения к иону палладия тиолат-ионов RS-, с последующим их окислением и разрушением координационного полиэдра.
Пространственная близость тиолатных ионов, входящих как лиганды в координационную сферу металла, легко может быть достигнута в биядерных соединениях палладия(II), в которых тиолатные ионы RS- занимают бидентатномостиковую координацию, приводящую к формированию остова
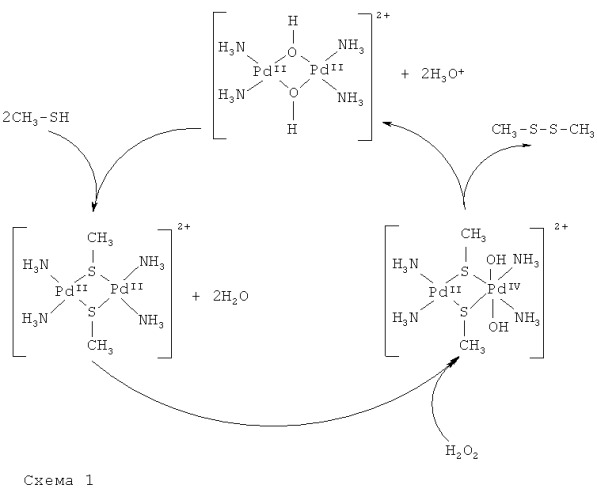
Для окисления тиолат-ионов был рассмотрен каталитический цикл с участием биядерного гидроксомостикового аммиачного комплекса палладия(II) - [Pd2(µ-OH)2(NH3)4]2+, для которого в качестве доминирующих были рассмотрены следующие реакции:
Уравнения (5) и (7) представляют ступени, в ходе которых катализатор [Pd2(µ-ОН)2(NH3)4]2+ расходуется и вновь регенерируется. Реакция (6) является основной ступенью, по которой возможно образование промежуточного неустойчивого комплекса палладия {[Pd2(µ-SR)2(NH3)4(OH)2]2+}.
Квантово-химические расчеты показали, что при окислении биядерного металлического остова пероксидом водорода в промежуточном биметаллическом соединении наиболее энергетически выгодным является присоединение обеих ОН-групп к одному атому палладия, что позволило рассматривать интермедиат как биядерный смешанновалентный комплекс с остовом PdIIPdIV(µ-SR)2. Такой остов, в свою очередь, восстанавливаясь, окисляет мостиковые тиолатные группы.
Квантово-химические расчеты координационных соединений проводилась методом DFT B3LYP в 6-31G** базисе по программе Jaguar 7.5. Для атомов Pd использовался эффективный псевдопотенциал остова HW с соответствующим валентным базисом. Анализ частот нормальных колебаний показал, что все полученные в результате оптимизации геометрии структуры соединений в газовой фазе соответствуют минимумам на поверхности потенциальной энергии. Энергии сольватации соединений рассчитывались в модели поляризуемого континуума. Для сокращения числа базисных функций молекулы глутатиона, ацетилцистеина или тиогликолевой кислоты RSH были моделированы простейшим тиолом CH3SH.
Причина нестабильности промежуточного координационного соединения PdIIPdIV связана с наличием в его внутренней сфере окислителя (иона PdIV) и восстановителей (лигандов µ-SR), что приводит к внутрисферному окислительно-восстановительному процессу. Этот процесс включает синхронный перенос двух электронов с пары координированных тиольных мостиков на ион PdIV, приводящий к разрыву мостиковых связей Pd-SR и объединению двух тиольных радикалов RS · в дисульфид R2S2. Далее в координационной сфере восстановленного палладиевого димера происходит внутримолекулярная перегруппировка лигандов ОН-, координированных ранее к PdIV, в мостиковое положение. В результате образуется соединение , исходное для рассматриваемого каталитического цикла (схема 1).
Следует отметить, что в отсутствие пероксида водорода (O2 или каких-либо других окислителей) водные растворы биядерных тиолатмостиковых комплексов палладия(II) не катализируют окисление тиоаминокислоты.
Оценка эффективности каталитического действия соединения [Pd2(µ-SG)2(NH3)4]2+ на процесс окисления глутатиона (GSH) пероксидом водорода, проводимая с помощью метода высокоэффективной жидкостной хроматографии (ВЭЖХ), показала их большую (~30%) каталитическую эффективность, чем используемый в настоящее время цис-[Pt(NH3)2Cl2].
Окисление тиолов комплексами меди(I)
При внесении в водный раствор простых солей меди(II), таких как CuCl2 или CuBr2, происходит их аквотация, сопровождающаяся последующим гидролизом и образованием в растворе олигоядерных аквагидроксокомплексов меди(II).
Эти аквагидроксокомплексы меди(II) в водных растворах, содержащих тиолы, почти мгновенно восстанавливаются, образуя тиолатные комплексы меди(I) - , где k=2÷14, m≥3k. Состав и строение может иметь самый разнообразный характер, начиная от биядерных (k=2) до четырнадцатиядерных (k=14) координационных соединений; причем нередко происходит формирование смесей комплексов разного строения. Однако какими бы не были эти комплексы по составу и строению, все они эффективно катализируют процессы окисления -S-H групп до дисульфидных сшивок -S-S- под действием любых, даже очень слабых окислителей.
На Фиг.2 в качестве примера приведены результаты исследования относительной каталитической эффективности комплексов в реакции окисления глутатиона пероксидом водорода, по сравнению с биядерным палладиевым комплексом [Pd2(µ-SG)2(NH3)4]2+.
Как можно видеть из результатов, приведенных на Фиг.2, комплексы заметно более эффективно действуют в качестве катализаторов процесса окисления. Однако водные растворы дисульфида глутатиона, содержащие , по данным 1H ЯМР, ИК спектроскопии и ВЭЖХ, неустойчивы, и в аэробных условиях через 30-60 мин начинаются процессы более глубокого окисления образовавшихся дисульфидов. Это делает практически невозможным использование координационных соединений в качестве селективных катализаторов окисления тиолов до их дисульфидных форм.
Окисление тиолов с использованием Cu-Pd катализаторов
Экспериментальные исследования каталитических систем с применением медно-палладиевых катализаторов показывают их значительно большую каталитическую эффективность по сравнению с биядерными тиолатмостиковыми соединениями палладия(II) - (Фиг.3). Но, в отличие от водных растворов окисленного глутатиона GSSG, содержащих тиолатные комплексы меди , водные растворы, содержащие Pd-Cu катализаторы, по данным 1H ЯМР, ИК спектроскопии и ВЭЖХ устойчивы к процессам разложения в том случае, когда концентрация атомов меди не превышает концентрацию атомов палладия. Превышение соотношения Pd:Cu большее чем 1:1 в аэробных условиях сопровождается медленным распадом GSSG. Так, при соотношении Pd:Cu, равном уже только 1:2, понижение концентрации GSSG достигает величины 96% примерно через 1 неделю.
Исследования показывают, что в Pd-Cu катализаторах соотношения Pd:Cu лежат в пределах от 1:0.2 до 1:2, в зависимости от необходимости варьирования активностью работы катализатора.
Суммируя, для процессов мягкого селективного окисления тиолов GSH до GSSG, можно сделать вывод о том, что биядерные тиолатмостиковые комплексы палладия(II) выполняют основную функцию катализаторов окисления, а тиолатные комплексы меди(I) следует отнести к химическим сайтам, меняющим их каталитическую активность или, говоря иначе, управляющим их каталитической активностью.
Таким образом, сочетание функциональных биядерных палладиевых координационных соединений с бидентатномостиковой координацией глутатиона или ацетилцистеина с управляющим сайтом , образующимся из солей меди CuX2 (где Х=Cl- или Br-), превращающихся в среде тиолов в соответствующие тиолатные производные комплексов меди(I), показывает один из наиболее эффективных подходов к управлению активностью каталитических систем на основе комплексов палладия и CuI.
Повышение каталитической эффективности палладий-медных катализаторов общей формулы по сравнению с функциональным химическим сайтом обусловлено тем, что пероксид водорода окисляет не ионы PdII, а ионы .
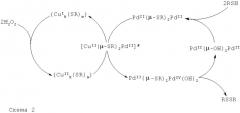
Управляющий химический сайт, образующийся за счет окислительно-восстановительной реакции
выступает в роли окислителя функционального сайта в соответствии со схемой 2.
Для окислительно-восстановительных реакций координационных соединений d-элементов существуют два общих типа переходных состояний, так называемые внешнесферный и внутрисферный типы. Для внешнесферного типа внутренние координационные оболочки ионов обоих металлов не затрагиваются. Для внутрисферного типа ионы обоих металлов связываются мостиковым лигандом, общим для обеих координационных оболочек.
Результаты квантово-химических расчетов показали, что в каталитических системах на основе биядерного металлического остова в водных растворах будет происходить формирование промежуточного смешанного Cu-Pd биметаллического центра - [CuII(µ-SR)2PdII]# (интермедиата), легко диспропорционирующего на и [PdII(µ-SR)PdIV(OH)2].
Анализ структуры граничных молекулярных орбиталей (МО) объясняет экспериментально выявленную более высокую реакционную способность каталитической системы на основе смешанных Cu-Pd координационных соединений, чем на основе биядерных комплексов, содержащих только ионы PdII.
Участие атомных d-орбиталей (d-AO) металлов в каталитических процессах приводит к снятию запретов на протекание стадии реакции по симметрии молекулярных орбиталей (МО), часто определяющих высокую энергию активации процессов. Основная идея для объяснения катализа ионами металлов для реакций, запрещенных по симметрии, состоит в том, что ионы переходных металлов имеют доступные и близколежащие по энергии d-AO. Это дает возможность частицам, координирующимся к иону металла, отдавать пару своих электронов на одни d-орбитали металла, а получать их с других d-орбиталей металла.
Анализ характера граничных МО в координационном соединении с центром CuII(µ-SR)2PdII показал, что его высшая занятая молекулярная орбиталь (ВЗМО) состоит в большой степени из d-AO меди и не пригодна для образования окисленного продукта, содержащего ион PdIV. Для осуществления процесса необходим перенос пары электронов на низшую свободную молекулярную орбиталь (НСМО) с большой долей 4d-орбиталей PdII. Чем меньше разница в энергиях этих МО, тем меньшие затраты требуются для достижения переходного состояния. В рассматриваемом координационном соединении со смешанным биметаллическим центром CuII(µ-SR)2PdII энергетическая разность между этими орбиталями составляет 2.61 эВ. В координационном соединении с центром PdII(µ-SR)2PdII разница в энергиях соответствующих занятых и свободных орбиталей значительно больше: 4.18 эВ (для PtII(µ-SR)2PtII 4.79 эВ).
Таким образом, каталитическая система для селективного окисления тиолов на основе смешанных промежуточно образуемых комплексов CuI и PdII должна обладать большей активностью, чем система на основе аналогичных комплексов PdII. Причина этого заложена на уровне энергетики d-орбиталей меди.
Образование промежуточного биметаллического центра [CuII(µ-SR)2PdII]# в цикле объясняет причину повышения каталитической эффективности катализаторов общей формулы , а целенаправленно заданное число активных биметаллических центров [CuII(µ-SR)2PdII]# позволяет менять суммарную активность палладий-медных катализаторов.
Предложенные катализаторы по изобретению могут сочетаться с дисульфидами N-глутамил-L-цистеинил-глицина и/или N-ацетил-L-цистеина, формируя комбинацию, обладающую как естественной биологической, так и каталитической активностью. Избыток тиола обеспечивает возможность изготовления и использования малых и ультрамалых доз непосредственно катализатора, обеспечивая его к тому же необходимым для каталитического цикла субстратом.
Свободные молекулы дисульфидов N-ацетил-цистеина и/или N-глутамил-L-цистеинил-глицина в составе препарата могут находиться как в катионной, так и в анионной форме или же в форме нейтральных частиц.
В качестве противоиона могут быть использованы неорганические ионы, например катионы натрия, лития, калия, кальция, магния, селена, марганца, цинка, ванадия и других химических элементов, или ионы органических соединений, например аминокислот, алифатические и ароматические ионы органических молекул из различных химических групп, обладающие биологической активностью (пример 12).
Комбинации по изобретению могут содержать также другие фармакологически активные соединения, в частности пуриновые и/или пиримидиновые основания, их производные или соединения на их основе (примеры 10 и 11).
Под фармакологически активным соединением подразумевается любое вещество, которое используется с терапевтическими целями, представляющее собой молекулы лекарственных или биологически активных веществ, в частности пуриновых и/или пиримидиновых оснований и соединений на их основе, например: Аденозин (9-β-D-рибофуранозиладенин), Гуанозин (9-β-D-рибофуранозилгуанидин), Дезоксиаденозин (9-β-D-дезоксирибофуранозиладенин), Дезоксигуанозин (9-β-D-дезоксирибофуранозилгуанидин), 9-β-D-рибофуранозиладенина моно-, ди-, трифосфат, 9-β-D-рибофуранозилгуанидин моно-, ди-, трифосфат, 9-β-D-дезоксирибофуранозиладенина моно-, ди-, трифосфат (кордицепин), 9-β-D-дезоксирибофуранозилгуанидин моно-, ди-, трифосфат, Цитидин (4-амино-1-[3,4-дигидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил]пиримидин-2-он), 1-[(2R,4S,5R)-4-гидрокси-5-(гидрокси)тетрагидрофуран-2-ил]-5-пиридин-2,4-дион, Дезоксицитидин (4-амино-1-[4-гидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил]пиримидин-2-он), Тимидин или дезокситимидин 1-[(2R,4S,5R)-4-гидрокси-5-(гидрокси)тетрагидрофуран-2-ил]-5-метилпиридин-2,4-дион, Инозин 9-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-6,9-дигидро-3Н-пурин-6-он, Рибаверин: 1-(3,4-дигидрокси-5-гидроксиметил-тетрагидрофуран-2-ил)-1Н-[1,2,4]триазол-3-карбоновой кислоты амид, Занамивир (2R,3R,4S)-4-[(диаминометилиден)амино]-3-ацетамидо-2-[(1R,2R)-1,2,3-тригидроксипропил]-3,4-дигидро-2H-пиран-6-карбоновая кислота, Фармцикловир: 2-[2-(2-амино-9Н-пурин-9-ил)этил]-1,3-пропандиол диацетат(эфир), Ганцикловир (2-амино-1,9-дигидро-9-2-гидрокси-1-(гидроксиметил)этоксиметил-6Н-пурин-6-он), Зидовудин (3′-азидо-3′-дезокситимидин), Ацикловир: 2-амино-9-((2-гидроксиэтокси)метил)-1Н-пурин-6(9Н)-он, Фторурацил: 5-фтор-1Н-пиримидин-2,4-дион, 1-(2,3-Дидезокси-бета-D-глицеропент-2-енофуранозил)Тимин, Фтортиоурацил: 5-фтор-1Н-пиримидин-2-тион-4-он, Тиоурацил: 1Н-пиримидин-2-тион-4-он, S-аденозилгомоцистеин: 4[5-(6-амино-пурин-9-ил)-3,4-дигидрокси-тетрагидро-фуран-2-илметилсульфанил]-2-меркапто-бутановая кислота, S-Аденозилметионин: (2S)-2-амино-4-[[(2S,3S,4R,5R)-5-(6-аминопурин-9-ил)-3,4-дигидрокмиоксолан-2-ил]метил-метилсульфонио]бутаноат, циклический аденозинмонофосфат (цАМФ) 6-(6-амино-пурин-9-ил)-2-оксо-тетрагидро-2λ-5-фуро[3,2-d][1,2,3]d-изооксофосфинин-2,7-диол, 8-хлор-цАМФ: 6-(6-амино-8-хлор-пурин-9-ил)-2-оксо-тетрагидро-2λ-5-фуро[3,2-d][1,2,3]d-изооксофосфинин-2,7-диол, N-6,2′-O-дибутирил-8-SH-цАМФ, N-6,2′-O-дибутирил-8-SH-цАМФ, циклический гуанозинмонофосфат, cGMP, N6-монобутирил-8-S-метил-цАМФ, Формицин: 2-(7-амино-1Р-пиразоло[4,3-d]пиримидин-3-ил)-5-гидроксиметил-тетрагидрофуран-3,4-диол, Метилизогуанозин: 6-амино-1-метил-1,9-дигидро-пурин-2-он.
Фармакологически активное соединение может быть связанно с избытком дисульфидов N-ацетил-цистеина и/или N-глутамил-L-цистеинил-глицина ван-дер-ваальсовыми силами (ионными, водородными и иными нековалентными связями).
Комбинации по изобретению могут быть изготовлены согласно известным из уровня техники методам с учетом особенностей химических свойств палладиево-медных катализаторов по изобретению, дисульфидов (N-ацетил-цистеина и/или N-глутамил-L-цистеинил-глицина) и фармакологически активных веществ. Предпочтительно, когда доля катализатора по изобретению в препарате составляет от 1·10-2 до 1·10-7 г на моль дисульфида алифатического тиола - N-ацетил-цистеина и/или N-глутамил-L-цистеинил-глицина.
Согласно изобретению предложенный палладиево-медный катализатор или каталитическая комбинация по изобретению могут быть использованы для усиления терапевтической активности пуринового и/или пиримидинового основания или производного на их основе. В контексте данного описания повышение терапевтической эффективности фармакологически активного соединения представляет собой снижение разовой или курсовой дозы или снижение общей токсичности и достижение более выраженного терапевтического эффекта при принятой терапевтической дозе или меньшей для этого фармакологически активного соединения.
Палладиево-медный катализатор по изобретению, каталитическая комбинация и фармакологическая комбинация по изобретению могут быть использованы в форме фармацевтических композиций.
Для получения фармацевтических композиций по изобретению используют фармацевтически приемлемые эксципиенты. В частности, это неорганические или органические носители. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.п. могут быть использованы, например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.п. Подходящими носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические композиции могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подсластители, красители, корригенты, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты и другие необходимые компоненты.
Палладиево-медный катализатор или каталитическая комбинация по изобретению и фармакологически активные вещества, эффективность которых они усиливают, могут находиться как в одной лекарственной форме, так и в отдельных лекарственных формах. Введение в отдельных лекарственных формах может быть осуществлено одновременно (одновременный прием двух твердых дозированных лекарственных форм, например таблеток, одновременная инъекция, в частности в одном шприце) либо последовательно, когда пациенту дают или вводят сначала первую лекарственную форму, а затем вторую лекарственную форму. Интервал между введением предпочтительно составляет не более 1 часа, однако может быть увеличен до тех пор, пока наблюдается синергический эффект. Оптимальный порядок введения зависит от фармакокинетики и фармакодинамики фармакологически активного вещества, эффективность которого должна быть усилена (скорость всасывания, распределение, скорость выведения, особенности клеточной, органной тропности или системной тропности) и может быть подобрана для каждого конкретного вещества индивидуально.
Количество вводимого палладиево-медного катализатора определяется массовой долей Pd и Cu в составе катализатора, которое может соответствовать или быть ниже суточной потребности в каждом металле. В противном случае количество вводимого d-металла в составе координационного соединения определяется необходимостью достижения результата лечения.
Терапевтический результат может быть достигнут при введении катализатора в количестве от 1·10-3 до 1·10-8 г на кг массы тела пациента, что в пересчете на количество дисульфида в комбинации составит от 1×10-2 до 1×10-5 моль дисульфида на кг массы тела.
ПРИМЕРЫ
Далее изобретение поясняется конкретными примерами.
Пример 1. Получение катализатора Pd-Cu на основе аммиачного комплекса палладия(II) с N-глутамил-L-цистеинил-глицином (GSH)
50 мг (237 мкмоль) цис-[Pd(NH3)2Cl2] вносят в 10 мл раствора, содержащего 75 мг (244 мкмоль) GSH, и гомогенизируют в ультразвуковой ванне до образования светло-желтого раствора. К полученной системе приливают 5 мл раствора, содержащего 20 мг (117 мкмоль) CuCl2·2H2O, и корректируют рН полученного желто-зеленого раствора до 5.0-5.2 раствором гидроксида натрия (~0.01 М).
Полученный раствор катализатора может быть использован для проведения окисления водорастворимых тиолов (например: GSH или ацетилцистеина).
В полученном растворе катализатора мольное соотношение палладий-медь составляет 2:1.
Пример 2. Получение катализатора Pd-Cu на основе аммиачного комплекса палладия(II) с глутатионом и его использование для синтеза дисульфида N-глутамил-L-цистеинил-глицина (GSSG).
Стадия 1. Получение аммиачного комплекса палладия(II) с глицилцистеинилглутаматом
10 мг (47.3 мкмоль) цис-[Pd(NH3)2Cl2] на холоде диспергируют в 10-15 мл дистиллированной воды, в полученную суспензию вносят 145 мг (0.473 ммоль) GSH и перемешивают на магнитной мешалке до образования светло-желтого гомогенного раствора.
Стадия 2. Получение Pd-Cu катализатора
В ранее полученную реакционную смесь приливают 5 мл раствора, содержащего 8.06 мг (47.3 мкмоль) дигидрата хлорида меди(II). рН полученного желто-зеленого раствора катализатора доводят до значения 5.5-5.8 0.01 М раствором гидроксида натрия.
Стадия 3. Использование каталитической системы Pd-Cu для синтеза GSSG
В стеклянный стакан отвешивают 29.09 г (0.946 ммоль) GSH, приливают при перемешивании 150-200 мл дистиллированной воды, охлаждают до 10-15°C. Отдельно растворяют в 50-60 мл дистиллированной воды 3.78 г NaOH (0.946 ммоль) и полученный раствор приливают к суспензии GSH при интенсивном перемешивании и не позволяя реакционной массе разогреваться выше 15-20°C и перемешивают до образования прозрачного гомогенного раствора. рН реакционной смеси корректируют до 5.5-5.8 0.1 М раствором гидроксида натрия. В полученную реакционную систему приливают ранее приготовленный раствор катализатора и небольшими порциями приливают 50 мл 1 М свежеприготовленного раствора пероксида водорода при интенсивном перемешивании, не допуская нагревания реакционной смеси свыше 15°C. Полноту протекания реакции контролируют методом ВЭЖХ.
После окончания реакции и стерилизующей фильтрации раствор замораживают и подвергают вакуумно-сублимационной (лиофильной) сушке.
В полученном препарате мольное соотношение «натриевая соль дисульфида N-глутамил-L-цистеинил-глицина - палладий - медь» составляет 1000-1-1.
Пример 3. Получение катализатора Pd-Cu на основе аммиачного комплекса палладия(II) с N-глутамил-L-цистеинил-глицином (GSH) и его использование для получения глицилцистеинилглутамат рибофуранозилгипоксантина-динатрия
Стадия 1. Получение аммиачного комплекса палладия(II) с GSH
20 мг (94.6 мкмоль) цис-[Pd(NH3)2Cl2] на холоде диспергируют в 20 мл дистиллированной воды, в полученную суспензию вносят 30 мг GSH (97.6 мкмоль) и перемешивают до образования светло-желтого гомогенного раствора.
Стадия 2. Получение Pd-Cu катализатора
В ранее полученную реакционную смесь приливают 5 мл раствора, содержащего 14.52 мг (85.2 мкмоль) дигидрата хлорида меди(II). рН полученного желто-зеленого раствора катализатора доводят до значения 5.5-6.0 0.01 М раствором гидроксида натрия.
Стадия 3. Использование каталитической системы Pd-Cu для получения N-глутамил-L-цистеинил-глицина рибофуранозилгипоксантина-динатрия
В стеклянный стакан отвешивают 58.19 г (0.189 моль) GSH, приливают при перемешивании 200 мл дистиллированной воды, охлаждают до 10-15°C. Отдельно растворяют в 50-60 мл дистиллированной воды 7.57 г NaOH (0.189 моль) и полученный раствор приливают к суспензии GSH при интенсивном перемешивании и не позволяя реакционной массе разогреваться выше 15-20°C и перемешивают до образования прозрачного гомогенного раствора. Если необходимо, рН реакционной смеси корректируют до 5.5-6.0 0.01 М раствором гидроксида натрия. В полученную реакционную систему приливают ранее приготовленный раствор катализатора, стакан переносят на ледяную баню (5-10°С) и небольшими порциями, в течение 45-60 мин приливают 100-102 мл (~0.1 моля) 1 М свежеприготовленного раствора пероксида водорода при интенсивном перемешивании. Полноту протекания реакции контролируют методом ВЭЖХ.
Отдельно в 150 мл горячей дистиллированной воды (60-70°C) растворяют 25.38 г (0.095 моль) рибофуранозилгипоксантина (инозин). После полного растворения раствор охлаждают до комнатной температуры и приливают к реакционной смеси. После стерилизующей фильтрации раствор замораживают и подвергают вакуумно-сублимационной (лиофильной) сушке.
В полученном препарате мольное соотношение GSSG-инозин-палладий-медь составляет 1000-1000-1-0.9.
Пример 4. Получение катализатора Pd-Cu на основе аммиачного производного биядерного координационного соединения Pd(II) с N-ацетил-L-цистеином
120 мг (568 мкмоль) цис-[Pd(NH3)2Cl2] диспергируют в ультразвуковой ванне в 20 мл водного раствора N-ацетил-L-цистеина (648.5 мг, 3.97 ммоль) до образования желтого гомогенного раствора. В полученную систему приливают 5 мл раствора, содержащего 48.4 мг (284 мкмоль) CuCl2·2H2O. Выпавший белый осадок растворяется при подщелачивании реакционной системы до рН 4.5-5.0 0.1 М раствором гидроксида натрия.
Полученный желто-зеленый раствор катализатора может быть использован для проведения