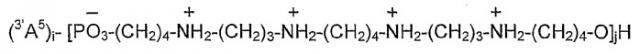Катионные олигонуклеотиды, автоматизированные способы их получения и их применение
Иллюстрации
Показать всеНастоящее изобретение относится к олигонуклеотид-олигокатионным молекулам AiBjH, применяемым в молекулярной биологии, диагностике и терапевтических вариантах использования. Олигонуклеотид-олигокатионные молекулы AiBjH могут быть синтезированы посредством автоматизированной фосфорамидитной химии и имеют олигонуклеотидные фрагменты Ai и олигокатионные фрагменты Bj. Фрагмент Ai представляет собой i-мерный олигонуклеотидный остаток, с индексом i = от 5 до 50, в котором нуклеотид А представляет собой олигомер с природными или неприродными нуклеиновыми основаниями и/или пентафуранозильными группами и/или нативными сложными фосфодиэфирными связями, а также их химические модификации или замещения. Фрагмент Bj представляет собой j-мерный органический олигокатионный фрагмент с индексом j = от 1 до 50, в котором В выбран из группы, включающей -HPO3-R1-(X-R2 n)n1-X-R3-O-, где R1, R2 n и R3, идентичные или различные, представляют собой С1-С5 алкилен, Х представляет собой NH или NC(NH2)2, индекс n1 = от 2 до 20; -HPO3-R4-CH(R5X1)-R6-O-, где R4 представляет собой С1-С5 алкилен, R5 и R6, идентичные или различные, представляют собой С1-С5 алкилен и X1 представляет собой путресциновый, спермидиновый или сперминовый остаток. 5 н. и 13 з.п. ф-лы, 16 ил., 5 пр.
Реферат
Изобретение относится к катионным олигонуклеотидам, то есть олигонуклеотид-олигокатионным молекулам, также называемым катионными олигонуклеотидами в описании (независимо от их общего заряда), которые могут быть синтезированы постадийно на олигонуклеотидном синтезаторе. Изобретение также относится к их применению в молекулярной биологии, в диагностике и терапевтических вариантах использования.
Олигонуклеотиды находят чрезвычайно широкое применение в молекулярной биологии и диагностике и могут составлять очень избирательный класс лекарственных средств для лечения обширного круга заболеваний.
Олигонуклеотиды представляют собой полианионы, которые проявляют свою специфическую активность сообразно гибридизации с комплементарной последовательностью, созданной другой полианионной нуклеиновой кислотой.
В качестве потенциальных лекарственных средств (кандидатов лекарственных средств) они должны также быть способны проходить через анионную клеточную мембрану.
Из простых электростатических соображений можно заключить, что для энергии гибридизации и клеточного связывания могло бы быть благоприятным добавление катионных групп к олигонуклеотидной структуре.
В плане указанной задачи были исследованы многие синтетические подходы для введения аммониевых или гуанидиновых остатков в олигонуклеотиды: замещение в фосфатном каркасе, модификация рибозы или нуклеинового основания и концевое конъюгирование поликатиона. Однако специфичность гибридизации, активность взаимодействующего с нуклеиновой кислотой фермента, а также токсичность метаболитов во всех отношениях касается блокового подхода, где поликатион присоединяется к во всем остальном природному олигонуклеотиду, в качестве наилучшего решения. К сожалению, постадийный автоматизированный синтез конъюгатов олигонуклеотидов с катионными пептидами все еще не является общепринятой практикой. С другой стороны, химические основы конъюгации предварительно сформированных крупных молекулярных блоков остаются непростыми, в особенности в водной среде, где «супер»-цвиттерионы создают трудноразрешимые проблемы в отношении растворимости, очистки и охарактеризовывания. Более того, применение в молекулярной биологии и диагностике нуждается в быстром и однозначном синтезе любой данной последовательности оснований, связанной с органическим катионом любой длины.
Авторы настоящего изобретения обнаружили, что проводимый в режиме реального времени при компьютерном управлении синтез олигонуклеотид-олигокатионных молекул был возможен при установке пробирок, содержащих должным образом активированные и защищенные олигокатионные производные, в олигонуклеотидный синтезатор, с добавлением к ним четырех природных оснований.
Таким образом, цель изобретения состоит в получении новых катионных олигонуклеотидов.
Еще одна цель изобретения состоит в разработке автоматизированного синтеза указанных катионных олигонуклеотидов с высоким выходом.
В дальнейшей цели изобретение относится к применению указанных катионных олигонуклеотидов, в особенности в молекулярной биологии, диагностике и терапевтических методах.
Изобретение тем самым относится к смешанным олигонуклеотид-олигокатионным молекулам, которые могут быть синтезированы посредством автоматизированной фосфорамидитной химии, то есть с помощью сложных полифосфодиэфиров.
Более конкретно, катионные олигонуклеотиды AiBjH согласно изобретению имеют олигонуклеотидные фрагменты Ai и олигокатионные фрагменты Bj, где
Ai представляет собой i-мерный олигонуклеотидный остаток, с индексом i = от 5 до 50, с природными или неприродными нуклеиновыми основаниями и/или пентафуранозильными группами и/или нативными сложными фосфодиэфирными связями;
Bj представляет собой j-мерный органический олигокатионный фрагмент, с индексом j = от 1 до 50, где В выбран из группы, включающей
-HPO3-R1-(X-R2)n1-X-R3-O-, где R1, R2 и R3, идентичные или различные, представляют собой низший алкилен, Х представляет собой NH или NC(NH2)2, и индекс n1 = от 2 до 20,
-HPO3-R4-СН(R5Х1)-R6-O-, где R4 представляет собой низший алкилен, R5 и R6, идентичные или различные, представляют собой низший алкилен, и Х1 представляет собой путресциновый, спермидиновый или сперминовый остаток,
-HPO3-R7-(аа)n2-R8-O-, где R7 представляет собой низший алкилен и R8 представляет собой низший алкилен, серин, природный аминоспирт, полученный восстановлением природной аминокислоты, (аа)n2 представляет собой пептид, содержащий природные аминокислоты с катионными боковыми цепями, такие как аргинин, лизин, орнитин, гистидин, диаминопропионовая кислота, и индекс n2 = от 2 до 20.
«Низший алкил» или «низший алкилен», как используется в описании и пунктах формулы изобретения, преимущественно обозначает необязательно замещенный линейный или разветвленный С1-С5-алкильный или -алкиленовый радикал, соответственно.
А, например, выбран из группы, включающей дезоксирибо-, рибо-, замкнутые (LNA) нуклеотиды, а также их химические модификации или замещения, такие как фосфоротиоат (также называемый тиофосфатом), 2'-фтор-, 2'-О-алкильная или маркерная группа, такая как флуоресцентный агент.
Смешанные олигонуклеотид-олигокатионные молекулы согласно изобретению имеют 3'A5'-B-последовательность.
Другие молекулы согласно изобретению имеют В-3'A5-последовательность.
Еще другие молекулы согласно изобретению имеют В-3'A5'-B- или 3'A5'-B-3'A5'-последовательность.
Такая последовательность иллюстрируется примерами олигонуклеотид-сперминовой молекулы, имеющей следующую структуру:
в которой А и индексы i и j такие, как определено выше.
Молекулы с А, представляющим собой фосфоротиоатный нуклеотид, в особенности предпочтительны с точки зрения их биологического применения, поскольку фосфоротиоатные олигонуклеотиды не гидролизуются в биологических жидкостях.
Вышеописанные катионные олигонуклеотиды формируют прочные и стабильные комплексы с комплементарными им последовательностями в контексте одноцепочечного замещения и даже в контексте плазмидной одноцепочечной инвазии, как иллюстрируется примерами.
Благодаря концевой конъюгации селективность последовательности остается такой же высокой, как для природных нуклеотидов.
Соответственно указанному, катионные олигонуклеотиды согласно изобретению представляют огромный интерес для молекулярной биологии, в качестве реагентов для исследований и в области диагностического применения, например, в ПЦР, ПЦР в реальном времени, генотипировании, in situ гибридизации и ДНК-чипах.
Такие применения также охватываются изобретением и включают использование таких олигонуклеотид-олигокатионных молекул, какие определены выше.
В отличие от анионных олигонуклеотидов катионные олигонуклеотиды согласно изобретению, как показано в примерах, спонтанно проникают в цитоплазму и ядро живых клеток.
Принимая во внимание их усиленную гибридизацию и свойства проникновения в клетку, они также полезны для терапевтических методов, таких как методы, использующие деградацию матричной РНК, направляемую антисмысловыми и короткими некодирующими РНК (siРНК), пропуск экзона во время созревания матричной РНК, образование тройной спирали хроматином, хроматиновую одноцепочечную инвазию (генная коррекция)...
Изобретение тем самым относится также к фармацевтическим композициям, содержащим эффективное количество олигонуклеотид-олигокатионных молекул, таких как описанные выше, в сочетании с фармацевтически приемлемым носителем.
Изобретение также относится к способу лечения, включающему применение эффективного количества олигонуклеотид-олигокатионных молекул, таких как описанные выше, в сочетании с фармацевтически приемлемым носителем.
Вышеописанные смешанные олигонуклеотид-олигокатионные молекулы преимущественно синтезируются постадийно в олигонуклеотидном синтезаторе, по фосфорамидитному пути, согласно способу, включающему
- размещение пробирок, содержащих активированные и защищенные олигокатионы В в олигонуклеотидном синтезаторе, с добавлением в пробирки олигонуклеотидов А, таких как описанные выше, или наоборот,
- остановку синтеза, когда достигается желаемая длина,
- отщепление олигомеров от твердого носителя,
- удаление защитных групп.
Изобретение имеет непосредственное отношение к синтезе для конструирования олигокатионного повторяющегося блока В. Для указанной цели могут быть использованы следующие фосфорамидитные реагенты
P(OR9)(N(R10)2)-O-R1-(X-R2)n1-X-R3-O-Prot, где R1, R2, R3 и индекс n1 такие, как определено выше, Х представляет собой подходящим образом защищенный NH или NC(NH2)2, R9 представляет собой -CH2CH2CN или низший алкил, R10 представляет собой низший алкил, или -N(R10)2 представляет собой пирролидиновую, пиперидиновую или морфолиновую группу, и Prot представляет собой защитную группу, используемую в олигонуклеотидном синтезе, такую как DMT, MMT;
P(OR9)(N(R10)2)-O-R4-СН(R5Х1)-R6-O-Prot, где R4, R5 и R6 представляют собой низший алкилен, Х1 представляет собой подходящим образом защищенный путресцин, спермидин или спермин, R9 и R10 такие, как описанные выше;
P(OR9)(N(R10)2)-O-R7-(аа)n2-R8-O-Prot, где R7, R8, R9, R10, n2 и Prot такие, как описанные выше, (аа)n2 представляет собой пептид, содержащий природные аминокислоты с подходящим образом защищенными катионными боковыми цепями, такие как аргинин, лизин, орнитин, гистидин, диаминопропионовая кислота, и индекс n2 = от 2 до 20.
«Подходящим образом защищенный NH или NC(NH2)2» означает, что на амино- или гуанидиновом остатке, соответственно, присутствуют защитные группы, чтобы сделать указанные функциональные группы инертными в условиях химических реакций, которым подвергается реагент.
Такими защитными группами являются, например, фталимидная (РНТН), трифторацетатная, аллилоксикарбонильная (Alloc), бензилоксикарбонильная (CBZ), хлорбензилоксикарбонильная, трет-бутилоксикарбонильная (Вос), флуоренилметоксикарбонильная (Fmoc) и изоникотинилоксильная (i-Noc) группы.
Согласно варианту осуществления изобретения постадийный синтез олигонуклеотидной последовательности продолжается постадийным синтезом олигокатионного компонента для получения соединений, имеющих последовательность (3'A5'-B).
Согласно еще одному варианту осуществления изобретения выполняется обратный порядок стадий, с постадийным синтезом олигокатионного компонента, который продолжается постадийным синтезом олигонуклеотидной последовательности для получения соединений с последовательностью (В-3'A5').
Согласно еще одному дальнейшему варианту осуществления изобретения синтезируются смешанные последовательности.
В частности, олигонуклеотидные последовательности, кэпированные на обоих концах (В-3'A5'-В), могут быть устойчивыми к экзонуклеазам в биологических жидкостях, и последовательности с катионным прерыванием (3'A5'-В-3'A5') позволяют позиционировать смежные («вицинальные») последовательности нуклеиновых кислот.
Применением природных аминов, таких как спермин, или пептидов, таких как олигоаргинины, исключается потенциальная токсичность метаболитов. Спермин на самом деле присутствует в миллимолярной концентрации в клетках, и его концевое алкилирование безвредно. Более того, базовые пептидные последовательности наличествуют во многих ядерных белках.
Активированные и защищенные олигокатионы В преимущественно получают путем защиты аминогрупп полиамина, с последующим α,ω-бисгидроксиалкилированием, ведущим к диолам, совместимым с олигонуклеотидным синтезом.
Классический химический подход DMT и фосфорамидитного наращивания цепи предпочтительно применяется вместе с использованием чувствительных к основаниям защитных групп ТFA.
Химически защищенные диолы являются новыми продуктами и входят в объем изобретения.
Изобретение, в частности, относится к промежуточным продуктам, выбранным из группы, включающей
P(OR9)(N(R10)2)-O-R1-(X-R2)n1-XR3-O-Prot, где R1, R2, R3 и индекс n1 такие, как определено выше, Х представляет собой подходящим образом защищенный NH или NC(NH2)2, R9 представляет собой -CH2CH2CN, или низший алкил, R10 представляет собой низший алкил, или -N(R10)2 представляет собой пирролидиновую, пиперидиновую или морфолиновую группу, и Prot представляет собой защитную группу, используемую в олигонуклеотидном синтезе, такую как DMT, MMT;
P(OR9)(N(R10)2)-O-R4-СН(R5Х1)-R6-O-Prot, где R4, R5, R6 представляют собой низший алкилен, Х1 представляет собой подходящим образом защищенный путресцин, спермидин или спермин, R9 и R10 такие, как описанные выше;
P(OR9)(N(R10)2)-O-R7-(аа)n2-R8-O-Prot, где R7, R8, R9, R10, n2 и Prot такие, как описанные выше, (аа)n2 представляет собой пептид, содержащий природные аминокислоты с подходящим образом защищенными катионными боковыми цепями, такие как аргинин, лизин, орнитин, гистидин, диаминопропионовая кислота, и индекс n2 = от 2 до 20.
Другие характеристики и преимущества изобретения приведены ниже. В частности, синтез декамерных олигонуклеотидных последовательностей (А10) со спермином (S), в последующем обозначаемых А10Sn, будет приведен в качестве иллюстративного примера, без ограничения изобретения. В примерах он будет описан фиг.1-14, которые представляют, соответственно:
фиг.1 - анализ ВЭЖХ катионных олигонуклеотидов N10Sn (n=1-2) на колонке с обращенной фазой,
фиг.2 - анализ ВЭЖХ очищенных олигонуклеотидов N10Sn (n=1-6) на анионообменной колонке,
фиг.3 - анализ электрофоретической подвижности N10Sn (n=1-6) при электрофорезе в полиакриламидном геле,
фиг.4 - спонтанное замещение N10 фрагментами N10·С10 при различных температурах,
фиг.5 - одноцепочечное замещение между N10 и N10Sn, как проявляющееся при электрофорезе в полиамидном геле,
фиг.6 - температуры плавления дуплексов N10Sn·С10 (где С представляет собой нуклеотид, комплементарный N),
фиг.7 - сравнительные результаты температур плавления дуплексов, образованных олигонуклеотидами N10Sn (n=0-6) с 5'GTGGCATCGC3' и 5'GTGGCGTCGC3',
фиг.8 - анализ методом масс-спектрометрии с ионизацией распылением в электрическом поле (электроспрей, ES-МС) очищенных N10Sn (n=1-6) олигонуклеотидов,
фиг.9 - ВЭЖХ обнаруживает фосфоротиоатные олигонуклеотиды N12S11F (9А) и N12S2F (9В),
фиг.10 - масс-спектры MALDI-TOF МС N12S2F (10А) и N12S11F (10В),
фиг.11 - ВЭЖХ обнаруживает N14S4F (11А) и N20S5F (11В), соответственно,
фиг.12 - масс-спектры MALDI-TOF МС N14S4F (12А) и N20S5F (12В),
фиг.13 - одноцепочечная инвазия плазмид pGL2 и pGL3 олигонуклеотидами N14SnF (13А) и N20SnF (13В).
фиг.14А и 14В - проникновение катионного олигонуклеотида F-S18N19 в клетки HeLa.
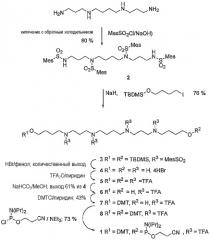
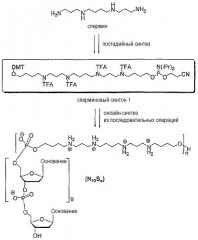
Пример 1: Синтез фосфорамидитного сперминового синтона
Фосфорамидит 1 на основе спермина был синтезирован из спермина, как показано на следующей схеме 1:
(Mes = 2,4,6-триметилфенил; TBDMS = трет-бутилдиметилсилил; TFA = CF3CO-; DMT = 4,4'-диметокситритил)
Тетракис(мезитилсульфонил)спермин 2, приготовленный из спермина, подвергали бисалкилированию с образованием полупродукта 3. После полного снятия защитных групп с полупродукта 3 в кислотных условиях сырой тетрагидробромид бис(С4-ОН)спермина 4 полностью защищали действием трифторуксусного ангидрида в пиридине, затем две концевых сложноэфирных группы в полупродукте 5 гидролизовали в нейтральных условиях с образованием диола 6. Монотритилирование полупродукта 5 выполняли в статистическом режиме с использованием одного мольного эквивалента реагента DMTCl (диметокситритилхлорид) с образованием полупродукта 7 с выходом 43%. Непрореагировавший диол 6 и бистритилированное соединение 8 извлекали и приводили к новому равновесному состоянию в мягких кислотных условиях (трифторуксусная кислота в дихлорметане) с образованием полупродукта 7. Фосфитилированием полупродукта 7 получали желаемый фосфорамидит 1.
N1,N4,N9,N12-тетракис(мезитилсульфонил)спермин (2): Указанное соединение было приготовлено согласно работе: Bergeron et al., J. Med. Chem., 2001, том 44, стр. 232-244.
N1,N12-бис[4-(трет-бутилдиметилсилилокси)бутил]-N1,N4,N9,N12-тетракис(мезитилсульфонил)спермин (3): К раствору соединения 2 (9,31 г, 10,0 ммоль) в диметилформамиде (ДМФА) (20 мл) при перемешивании в атмосфере азота при температуре 0ºС порциями добавляли гидрид натрия (60%-ный, 1,0 г, 25 ммоль). После перемешивания при комнатной температуре в течение 30 мин одной порцией добавляли трет-бутил(4-иодбутокси)диметилсилан (7,86 г, 25 ммоль). Смесь перемешивали в течение ночи при комнатной температуре и затем разбавляли водой (100 мл) и экстрагировали дихлорметаном (100 мл). Органическую фазу отделяли, и водную фазу трижды экстрагировали дихлорметаном (50 мл). Объединенные органические фазы промывали раствором NaHCO3 (1 М) и затем высушивали над MgSO4. После упаривания пастообразный остаток очищали с помощью флэш-хроматографии с использованием смеси AcOEt:циклогексан 1:4 в качестве элюента. Фракции, содержащие продукт 3, упаривали с образованием вязкого масла, которое далее промывали холодным пентаном для удаления высокоподвижной (на хроматограмме) примеси, и затем высушивали в вакууме с образованием 9,97 г (76%) продукта 3 в виде масла: ТСХ (AcOEt/циклогексан 1:4): Rf=0,28. IR (KRS-5): 2937, 1604, 1471, 1320, 1151, 1101, 838, 777, 657, 578 см-1. 1H-ЯМР (300 МГц, CDCl3): δ=-0,01 (с, 12H), 0,85 (с, 18H), 1,20-1,45 (м, 12H), 1,62 (м, 4H), 2,28 (с, 6H), 2,29 (с, 6H), 2,53 (с, 12H), 2,54 (с, 12H), 2,90-3,10 (м, 16H), 3,42 (т, J=6,1 Гц, 4H), 6,91 (с, 4H), 6,92 (с, 4H). 13C-ЯМР (75 МГц, CDCl3): δ=4,7, 18,9, 21,6, 23,4, 23,5, 24,1, 24,9, 25,7, 26,6, 30,4, 43,5, 43,6, 45,6, 45,7, 62,9, 132,59, 132,64, 133,8, 140,7, 143,0, 143,1. МС-ESI (MeOH): m/z=1325,85 [M+Na]+, 1303,83 [M+H]+. C66H110N4O10S4Si2 (Mw=1304,03) рассчитано C 60,79, H 8,50, N 4,30, S 9,84; найдено C 60,74, H 8,55, N 4,21, S 9,63.
Тетрагидробромид N1,N12-бис(4-гидроксибутил)спермина (4): К раствору соединения 3 (9,87 г, 7,57 ммоль) и фенола (29,0 г, 0,31 моль, 40 эквивалентов) в CH2Cl2 (80 мл) по каплям добавляли раствор бромоводорода в уксусной кислоте (33%-ный по весу раствор, 80 мл, 1,4 моль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. При охлаждении в ледяной бане добавляли при перемешивании холодную воду (100 мл). Органический слой отделяли и трижды экстрагировали водой (20 мл). Объединенные водные слои пять раз промывали CH2Cl2 (30 мл) и упаривали досуха. Полученный сырой твердый остаток суспендировали в эфире, растирали шпателем, и надосадочный слой эфира сливали. Указанные операции повторяли (пять раз), пока не получали суспензию твердого вещества. После упаривания и высушивания в вакууме получали соединение 4 в виде твердого вещества (5,32 г). Полученный сырой материал использовали без дальнейшей очистки: 1Н-ЯМР (300 МГц, D2O): δ=1,75-2,10 (м, 12Н), 2,27 (м, 4Н), 3,15-3,35 (м, 16Н), 3,76 (т, J=12,2 Гц, 4Н). 13С-ЯМР (75 МГц, D2O): δ=22,9, 23,2, 23,4, 29,0, 45,0, 45,2, 47,7, 48,3, 61,5. МС-ESI (МеОН): m/z=347,39 [M+H]+.
N1,N12-бис(4-(трифторацетокси)бутил)-N1,N4,N9,N12-тетракис(трифторацетил)спермин (5) (из соединения 4 с ТFA2O/NEt3): К суспензии соединения 4 (5,3 г, 7,6 ммоль) в CH2Cl2 (50 мл) одной порцией добавляли триэтиламин (11,5 г, 114 ммоль, 15 эквивалентов). Смесь охлаждали в ледяной бане и при перемешивании в атмосфере азота добавляли по каплям трифторуксусный ангидрид (19,1 г, 90,9 ммоль, 12 эквивалентов). Смесь перемешивали при комнатной температуре в течение 3,5 ч. После охлаждения в ледяной бане полученный раствор трижды промывали холодной водой (20 мл), высушивали над MgSO4 и затем упарили с образованием маслообразного остатка (11,7 г), который в качестве побочного продукта указанной реакции содержит (TFA)2C=CH-NEt2 (ссылка: Schreber, S. L., Tetrahedron Lett., 1980, том 21, стр. 1027). Полученный продукт удаляли двумя последовательными операциями флэш-хроматографии (элюент в градиенте от 1:1 до 60:40 AcOEt:циклогексан, и затем 5-10% Et2O/CH2Cl2) с образованием продукта 5 (5,59 г, 81%) в виде масла: ТСХ (AcOEt/циклогексан 1:1): Rf=0,25. IR (KRS-5): 2955, 1789, 1690, 1467, 1352, 1197, 1147, 759, 731, 692 см-1. 1H-ЯМР (300 МГц, CDCl3): δ=1,52-2,06 (м, 16H), 3,33-3,49 (м, 16H), 3,38 (м, 4H). 13C-ЯМР (75 МГц, CDCl3): Полученный спектр усложнен наличием вращательной изомерии четырех амидных групп. Описаны только резонансные сигналы высокой интенсивности, как следует ниже: δ=23,3, 23,9, 24,1, 24,8, 25,3, 25,6, 26,0, 26,55, 26,61, 44,4, 44,8, 45,7, 46,1, 46,4, 47,3, 48,0, 56,6, 67,3, 67,5, 116,6 (кв, J=288 Гц), 156,9, 157,4, 157,8, 158,6.
N1,N12-бис(4-гидроксибутил)-N1,N4,N9,N12-тетракис(трифторацетил)спермин (6): К раствору соединения 5 (5,39 г, 5,84 ммоль) в МеОН (50 мл) одной порцией добавляли NaHCO3 (0,1 г, твердый), и полученную суспензию перемешивали в течение 2 часов при комнатной температуре. После упаривания маслообразный остаток растворяли в CH2Cl2 (с образованием суспензии некоторого количества волокнистого NaHCO3) и очищали с помощью флэш-хроматографии, вымывая смесью 5-10% MeOH/CH2Cl2 с образованием 3,61 г (85%) продукта 6 в виде масла: ТСХ (5% MeOH/CH2Cl2): Rf=0,14. (10% MeOH/CH2Cl2): Rf=0,45. 1Н-ЯМР (300 МГц, CDCl3): δ=1,51-2,02 (м, 18Н), 3,33-3,51 (м, 16Н), 3,68 (м, 4Н). МС-ESI (МеОН): m/z=753,33 [M+Na]+. С26Н38F12N4O6·H2O (Mw=748,60) рассчитано С 41,72, Н 5,39, N 7,48, F 30,45; найдено C 41,97, H 5,26, N 7,37, F 30,14.
Получение продукта 6 из соединения 4 (TFA2O/пиридин, затем NaHCO3): К суспензии соединения 4 (15,3 г, 22,8 ммоль) в CH2Cl2 (100 мл) и пиридине (44 мл, 0,54 моль) при охлаждении в ледяной бане и перемешивании в атмосфере азота добавляли по каплям трифторуксусный ангидрид (46 мл, 0,33 моль). Смесь перемешивали при комнатной температуре в течение 3 часов. Избыток трифторуксусного ангидрида разлагали добавлением холодной воды (100 мл) при охлаждении в ледяной бане, затем полученный раствор экстрагировали дихлорметаном CH2Cl2 (четыре раза, 100 мл + 50 мл + 25 мл ×2). Объединенные экстракты промывали холодной водой (50 мл ×3), высушивали над MgSO4 и затем упаривали с образованием сырого продукта 5 (19,4 г, 92%) в виде масла. Полученное масло растворяли в МеОН (100 мл). Добавляли NaHCO3 (твердый, 0,1 г), и суспензию перемешивали в течение ночи. После упаривания растворителя остаток очищали флэш-хроматографией с использованием смеси 5-7% МеОН:CH2Cl2 в качестве элюента с образованием 10,1 г (61%) продукта 6 в виде масла.
N1-[4-(диметокситритилокси)бутил]-N12-(4-гидроксибутил)-N1,N4,N9,N12-тетракис(трифторацетил)спермин (7): К раствору соединения 6 (1,46 г, 2,00 ммоль) в пиридине (3 мл) добавляли DMTCl (757 мг, 2,23 ммоль), используя 1 мл пиридина для полноты смывания. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре в атмосфере азота, и затем пиридин удаляли повторным переупариванием с толуолом. Остаток очищали двумя последовательными операциями флэш-хроматографии (элюент 2-5% МеОН/CH2Cl2 и затем 10-15% ацетон/CH2Cl2) с образованием продукта 7 (879 мг, 43%) в виде пены, и бис-DMT-защищенного производного 8 (648 мг, 24%). Также возвращали исходный диол 6 (350 мг, 24%). Данные для 7: ТСХ (ацетон/СН2Cl2 1:9): Rf=0,20. 1Н-ЯМР (300 МГц, CDCl3): δ=1,51-2,03 (м, 17Н), 3,11 (м, 2Н), 3,32-3,51 (м, 16Н), 3,71 (м, 2Н), 3,81 (с, 6Н), 6,84 (м, 4Н), 7,19-7,46 (м, 9Н). МС-ESI (МеОН): m/z=1055,52 [M+Na]+. C47H56F12N4O8 (Mw=1032,95) рассчитано С 54,65, Н 5,46, N 5,42, F 22,07; найдено C 54,46, H 5,58, N 5,37, F 21,63.
Соединение (7) из диола (6) и бис-DMT-защищенного производного (8): К раствору соединения 6 (1,4 г, 1,9 ммоль) и соединения 8 (2,5 г, 1,9 ммоль) в CH2Cl2 добавляли трифторуксусную кислоту (50 мкл, 0,6 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Раствор трижды промывали 1 М раствором Na2CO3, высушивали над MgSO4 и упаривали. Остаток отделяли флэш-хроматографией (диаметр колонки: 50 мм, высота SiO2: 15 см) с использованием последовательно элюентов 5% AcOEt/CH2Cl2 (750 мл), 33% AcOEt/CH2Cl2 (500 мл), 7% МеОН/CH2Cl2 (500 мл) и 10% МеОН/CH2Cl2 (500 мл) с образованием продукта 8 (1,1 г), продукта 7 (1,2 г) и продукта 6 (1,3 г).
Фосфорамидит на основе спермина (1): К раствору соединения 7 (844 мг, 817 мкмоль) и триэтиламина (230 мкл, 1,65 ммоль, 2 эквивалента) в CH2Cl2 (4 мл) добавляли 2-цианоэтил-(N,N-диизопропиламино)хлорфосфит (205 мкл, 0,92 ммоль, 1,1 эквивалента), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 40 минут. Реакционную смесь пропускали через колонку с SiO2 (диаметр: 20 мм, высота: 15 см), насыщенным NEt3 (1% NEt3 в CH2Cl2:циклогексан 1:2, 400 мл) с использованием смеси 1% NEt3 в CH2Cl2:циклогексан 1:2 (125 мл) и затем 1% NEt3 в CH2Cl2:циклогексан 1:1 (100 мл) с образованием продукта 1 (735 мг, 73%) в виде масла: 1Н-ЯМР (200 МГц, CDCl3): δ=1,13-1,35 (м, 12Н), 1,51-2,06 (м, 16Н), 2,66 (т, J=6,4 Гц, 2Н), 3,11 (м, 2Н), 3,32-3,98 (м, 20Н), 3,81 (с, 6Н), 6,84 (м, 4Н), 7,15-7,51 (м, 9Н). 31Р-ЯМР (81 МГц, CDCl3): 148,06, 148,13, 148,19, 148,3 (расщепление вследствие вращательной изомерии амидных групп).
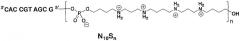
Пример 2: Синтез, очистка и охарактеризовывание декамерных олигонуклеотидов, имеющих формулу
Названные олигонуклеотиды будут далее обозначаться N10Sn (N10 = олигонуклеотидный фрагмент; S = сперминовый остаток, и индекс n=1-6).
Автоматизированный синтез: Серию декамерных олигонуклеотидов с идентичными последовательностями N10 = 3'CACCGTAGCG5', соединенными с нарастающим числом сперминовых остатков S, синтезировали с использованием стандартного химического подхода твердофазным цианоэтилфосфорамидитным методом в синтезаторе Expedite DNA, согласно следующей схеме:
с нуклеозидом в качестве последнего N-фрагмента согласно классическому олигонуклеотидному синтезу.
Реагенты, использованные для автоматизированного синтеза ДНК, были приобретены в фирме Glen Research (Eurogentec).
В ходе автоматизированного синтеза использовали стандартный 1-микромольный цикл сочетания, за исключением сочетания сперминового фосфорамидита 1, которое было проведено с пролонгированным временем сочетания (15 минут) и с использованием слегка более концентрированного раствора фосфорамидита (90 мг амидита в 1 мл ацетонитрила).
Тритильные фракции собирали, разбавляли и анализировали в спектрофотометре для определения выходов постадийного сочетания.
Выходы сочетания четырех природных нуклеотидов превышали 97%, тогда как выходы сочетания сперминового фосфорамидита составляли между 90 и 96% в вышеназванных условиях сочетания.
Во всех случаях применяли вариант DMT-ON (ON = олигонуклеотид) (олигонуклеотид с диметокситритильной защитой), сохраняя 5'-концевую DMT-группу неотщепленной на олигомерах для целей очистки и идентификации.
Обработка после синтеза: После автоматизированного синтеза проводили отщепление от твердого носителя и полное снятие защитных групп с олигомеров с использованием стандартных условий (обработка концентрированным водным аммиаком в течение 90 минут при комнатной температуре для отщепления и затем в течение ночи при температуре 55ºС для снятия защитных групп).
Очистка: Первые два анионных олигонуклеотида N10S1 и N10S2 были первоначально очищены в DMT-защищенном состоянии по стандартной ВЭЖХ-методике на колонке с обращенно-фазным носителем Nucleosil C-18 (фирма Macherey-Nagel, размер 10×250 мм) с линейным градиентом ацетонитрила (5-35% в течение 20 минут) в 20 мМ растворе ацетата аммония (рН 7). С очищенных олигонуклеотидов затем удаляли тритильную защиту обработкой смесью АсОН/Н2О=4/1 (500 мл) при комнатной температуре в течение 20 минут. После разбавления водой (5 мл) образовавшийся DMT-OH удаляли путем экстрагирования эфиром (3×2 мл), и водную фазу концентрировали для получения олигомеров.
Данные ВЭЖХ олигонуклеотидов N10S1 и N10S2 приведены на фиг.1; колонка с обращенно-фазным носителем Nucleosil C-18 (фирма Macherey-Nagel, 4,6×250 мм) с линейным градиентом ацетонитрила (5-35% в течение 20 минут) в 20 мМ растворе ацетата аммония (рН 7): а) N10S1, сырой, DMT-защищенный олигонуклеотид (DMT-ОN); b) N10S1, очищенный; с) N10S2, сырой, DMT-защищенный олигонуклеотид (DMT-ОN); d) N10S2, очищенный. *Бензамид; **Укороченные последовательности.
Нейтральный олигомер N10S3 и катионные олигомеры N10S4, N10S5 и N10S6 (с защитной DMT-группой или без таковой) были очищены с использованием колонок Poly-Pak IITM (Glen Research/Eurogentec) согласно инструкции, приведенной изготовителем, за исключением конечного элюирования олигонуклеотида, которое проводили смесью ацетонитрил/концентрированный водный аммиак/вода (20:4:80). Фракции, содержащие олигонуклеотиды, могли быть выявлены с помощью ТСХ. После сбора фракций растворители были удалены путем лиофилизации. Полученные таким образом олигомеры в общем были загрязнены бензамидом. Его удаляли путем экстрагирования эфиром (три раза) после растворения в разбавленном растворе водного аммиака (50 мМ). Очищенные олигонуклеотиды были растворены в разбавленном растворе водного аммиака (50 мМ), и их концентрацию определяли с использованием следующего коэффициента экстинкции (260 нм, моль-1дм3см-1):
ε=(15,4NА+11,5NG+7,4NC+8,7NT)×0,9×103.
Данные ВЭЖХ очищенных олигонуклеотидов приведены на фиг.2: анионообменная колонка (Dionex PA-100, 9×250 мм) с линейным градиентом раствора NaCl (с концентрациями от 100 мМ до 350 мМ в течение 10 минут)/NaOH, 25 мМ (рН 12,4): а) N10S1, b) N10S2, с) N10S3, d) N10S4, е) N10S5, f) N10S6.
Благодаря применению конъюгационного химического подхода каждый полиамин поступает с фосфатной группой, тем самым внося в систему дополнительные катионные заряды. Семь олигонуклеотидов, (N10Sn)3n-9 n=0...6, с общими зарядами -9, -6, -3, 0, +3, +6, +9, будучи полностью ионизированными, тем самым являются доступными в количествах, варьирующих от 80 до 250 наномоль.
Электрофоретическая подвижность
Их миграцию в электрическом поле при величине рН 7 изучали методом электрофореза в полиакриламидном геле с проявлением по пятну серебряного зеркала. Соединения (0,5 нмоль) в 10 мкл буферного носителя (10 мМ буфер HEPES с рН 7,4, 150 мМ NaCl, глицерин) были помещены в неденатурирующий полиакриламидный гель (15% в ТАЕ-буфере, рН 7). Электрофорез проводили при 5 В/см в течение 17 часов при температуре 4ºС. Серебряное прокрашивание выполняли согласно работе Rabilloud et al., Electrophoresis, 1987, том 9, стр. 288-291. Результаты приведены на фиг.3. Олигонуклеотид N10 (дорожка 1) без спермина быстро двигался к аноду и проявлял только слабое серебряное прокрашивание в условиях, где выявлялись олигонуклеотиды, содержащие полиамины.
Спонтанное замещение N 10 фрагментами N 10 ·С 10
Олигонуклеотид С10 (где С представляет собой нуклеотид, комплементарный N) (50 пмоль или 500 пмоль) добавляли к раствору флуоресцентного дуплекса N10·C10* (50 пмоль в 10 мМ буфере HEPES, рН 7,4, 150 мМ NaCl). Смеси инкубировали в течение 4 часов при температуре 37ºС, 20ºС или 10ºС и помещали в неденатурирующий полиакриламидный гель (15% в ТАЕ-буфере, рН 7). Электрофорез проводили при температуре 4ºС в течение 17 часов при 5 В/см. С10*-флуоресценцию детектировали сканированием геля с использованием прибора Typhoon 8600 Imager. Как показано результатами, приведенными на фиг.4, спонтанное замещение N10 фрагментами N10·С10 не является значительным при температуре 10ºС.
Одноцепочечное замещение между N 10 и N 10 S n
Способность к одноцепочечному замещению N10Sn в отношении природного дуплекса N10·C10 тестировали в условиях физиологического раствора.
Сперминовые конъюгаты N10Sn (50 или 500 пмоль) добавляли к раствору флуоресцентного дуплекса N10·C10* (50 пмоль в 10 мМ буфере HEPES, рН 7,4, 150 мМ NaCl). Смеси инкубировали в течение 4 часов при температуре 10ºС, и помещали в неденатурирующий полиакриламидный гель (15% в ТАЕ-буфере, рН 7). Электрофорез проводили при температуре 4ºС в течение 17 часов при 5 В/см. Флуоресценцию детектировали сканированием геля с использованием прибора Typhoon 8600 Imager.
Конъюгация спермина оказывала сильное влияние на реакцию одноцепочечного замещения, как показано на фиг.5. Полоса, соответствующая N10·C10*, становилась слабее по мере увеличения числа сперминовых остатков в конкурирующем N10Sn, в пользу менее подвижного менее анионного комплекса N10Sn·C10*. Указанный эффект был в особенности выраженным для N10S3, то есть для конъюгатов, которые уже не несли формального отрицательного заряда. Действительно, спермин скрепляет дуплексные структуры ДНК путем формирования межцепочечной сети из NH2 +-бидентатных водородных связей в малой бороздке спирали ДНК, тем самым способствуя связыванию N10Sn по сравнению с N10. К тому же еще и дополнительно благоприятствующий кинетический фактор может действовать, когда одноцепочечное замещение происходит в предварительно сформированном электростатическом комплексе (N10Sn)3n-9/(N10·C10)18-, который может иметь место для n>3.
Температуры плавления дуплексов N 10 S n ·C 10
Стабильности двухцепочечных нуклеиновых кислот сравнивали измерением их температуры плавления, то есть температуры, при которой комплементарные цепочки кооперативно расходятся. Для этого фиксировали при длине волны 260 нм оптическую плотность (ОD) растворов N10Sn·C10 относительно температуры Т.
Температуры плавления Tпл измеряли в 10 мМ буфере HEPES, рН 7,4 (черная линия, ромбики) и в 10 мМ буфере HEPES, рН 7,4 + 150 мМ NaCl (серая линия, кружки). Профили плавления всех дуплексов (3,75 нмоль в 1 мл буфера) наблюдали с использованием спектрофотометра CARY 4000, оснащенного блоком температурного контроля, при постепенном нагревании образцов (1ºС/мин), в то же время записывая их поглощение при длине волны 260 нм. Плавление дуплексов проявлялось в гиперхромном сдвиге, и Tпл представляет собой температуру, при которой кривая первой производной dOD/dT=f(T) достигает своего максимума. Результаты приведены на фиг.5.
Природный дуплекс плавится при Tпл=30ºС в 10 мМ буфере HEPES с рН 7,4 (фиг.5). Конъюгация с нарастающим количеством сперминовых остатков ведет к заметному повышению значения Tпл. N10S6·C10 плавится при Tпл=75,2ºС, почти на 45ºС выше, чем природный дуплекс. Кривая Tпл=f(n) обнаруживает сигмоидальную форму с перегибом для нейтрального олигонуклеотида N10S3.
Температуры плавления были также записаны в условиях физиологического раствора. Кривая Tпл=f(n) проявляется более спрямленной и, что примечательно, пересекает предыдущую кривую в точке для N10S3. Таким образом, для n<3 как олигонуклеотиды N10Sn, так и олигонуклеотиды С10 являются анионными и отталкиваются друг от друга в дуплексе; повышение концентрации соли в растворе экранирует силы отталкивания, тем самым повышая значение Tпл. Для n>3 N10Sn становится катионным и притягивает С10; здесь обусловленное солью электростатическое экранирование снижает стабильность.
Для нейтрального N10S3 стабильность дуплекса не зависит от концентрации соли.
Сравнение температур плавления дуплексов, сформированных N 10 S n (n=0-6) с 5' GTGGCATCGC 3' и с 5' GTGGCGTCGC 3'
Было испытано различение ошибочного спаривания («мисматча») о