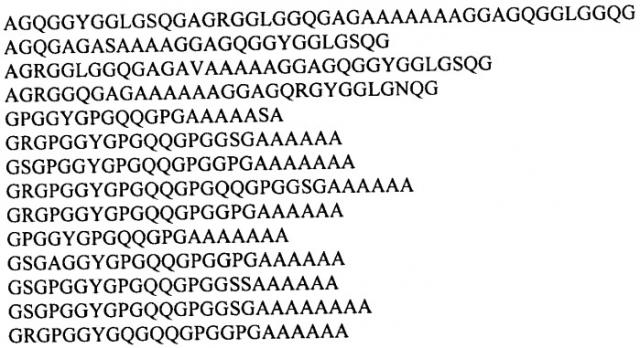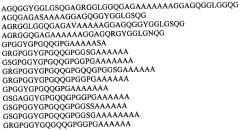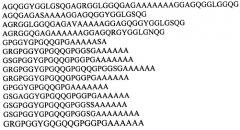Способ получения рекомбинантного белка паутины, слитый белок, рекомбинантная днк, вектор экспрессии, клетка-хозяин и штаммы-продуценты
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается способа получения рекомбинантных белков паутины паука-кругопряда в клетках дрожжей, слитых белков, содержащих последовательности рекомбинантных белков паутины паука-кругопряда, рекомбинантных ДНК, кодирующих слитые белки, клеток-хозяев дрожжей и векторов экспрессии, используемых для осуществления способа, а также штаммов - продуцентов рекомбинантных белков паутины паука-кругопряда. Способ включает конструирование вектора экспрессии, содержащего последовательность ДНК, кодирующую рекомбинантный белок паутины паука-кругопряда, слитую с последовательностью, кодирующую убиквитин или убиквитин-подобный белок SUMO дрожжей Saccharomyces cerevisiae, которая занимает в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, трансформацию клеток дрожжей полученным вектором экспрессии и экспрессию в трансформированных клетках белка паутины паука-кругопряда. Представленный способ позволяет увеличить продукцию рекомбинантного белка паутины при накоплении последнего в клетках дрожжей в водонерастворимой фракции в виде белка, не содержащего гибридный компонент. 7 н. и 17 з.п. ф-лы, 6 ил., 12 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии и направлено на способ получения рекомбинантных белков паутины пауков-кругопрядов, слитые белки, содержащие последовательности рекомбинантных белков паутины пауков-кругопрядов и последовательности убиквитин подобных белков, рекомбинантные ДНК, кодирующие слитые белки, хозяйские клетки дрожжей и векторы экспрессии, используемые для осуществления способа, а также штаммы-продуценты рекомбинантных белков паутины пауков-кругопрядов.
Уровень техники
Паутина является уникальным биоматериалом, сочетающим в себе удивительную прочность и эластичность. По этим показателям она не имеет аналогов как в природе, так и среди материалов, созданных человеком. Так, например, каркасная нить паутины паука-кругопряда Nephila clavipes по значениям прочности на разрыв превосходит сталь и сопоставима с кевларом, а по величине энергии разрыва превосходит и кевлар; в то же время она может растягиваться до 35% своей длины [Gosline J.M. et al. Endeavor, 1986, v.10, 37-43].
Получение промышленных количеств таких материалов возможно лишь с помощью генно-инженерных и биотехнологических методов. К настоящему времени несколько генов, кодирующих белки паутины, выделены и достаточно полно охарактеризованы [Xu М. & Lewis R. Proc. Natl. Acad. Sci., USA, 1990, v.87, 7120-7124; Hinnman M. & Lewis R. J. Biol. Chem., 1992, v.267, 19320-19324; Guerette P. et al. J. Science, 1996, v.272, 112-115; Hayashi C.Y. & Lewis R.V. J. Mol. Biol., 1998, v.275, 773-784]. Эти гены относятся к наиболее протяженным из известных цистронов (размеры мРНК лежат в диапазоне от 7,5 до 15,5 т.н.) и состоят из большого числа тандемно повторяющихся протяженных последовательностей, которые заметно различаются у разных генов. Наиболее изученная каркасная нить паука-кругопряда Nephila clavipes состоит из двух белков - спидроина 1 и спидроина 2 (MaSp1 и MaSp2, соответственно), синтезируемых большой ампуловидной железой [Hinnman M. & Lewis R. J. Biol. Chem., 1992, v.267, 19320-19324; Guerette P. et al. Science, 1996, v.272, 112-115]. Повторяющийся элемент спидроина 1 можно представить в виде следующей консенсусной последовательности:
[GGAGQGGYGGLGSQGAGRGGLGGQGAG(A)4-7],
а повторяющуюся последовательность спидроина 2 - в виде
[GPGGYGPGQQGPGGYAPGQQPSGPGS(A)6-10],
Принципиальным различием между этими белками является то, что в случае спидроина 1 элементарным повтором является трипептид GGX (X=А, S или Y), а в случае спидроина 2 - пентапептиды GPGGX и GPGQQ. При этом для спидроина 1 характерна повышенная прочность, а для спидроина 2, способного образовывать β-спирали [Hayashi et al., 1999, Int. J. Biol. Macromol., v.24, 271-275], - большая эластичность. Взаимодействие этих белков в составе каркасной нити паутины и обеспечивает уникальное сочетание ее свойств.
Белки MiSp1 и MiSp2, синтезируемые малой ампуловидной железой, и белок Flag ловчей нити паука-кругопряда также имеют повторяющуюся структуру. Повторяющиеся области обогащены аланином и глицином. Мотивы GGX и GA представлены по всей длине аминокислотной последовательности как белка MiSp1, так и белка MiSp2 [K.Vasanthavada et al. Cell. Mol. Life Sci, 2006, v.63, 1986-1999]. В последовательности белка Flag ловчей нити доминантные повторяющияся мотивы представлены пентапептидом GPGGlX и трипептидом GGX.
Результаты исследования белков каркасной нити паука-кругопряда Nephila clavipes, а также белка ловчей нити и белков, синтезируемых малой ампуловидной железой [Kohler T. & Vollrath F. J. Exp. Zool., 1995, v.271, 1-17; Colgin M.A. & Lewis R., Protein Sci., 1998, v.7, 667-672], позволили выдвинуть модульную гипотезу строения белков паутины [Hinman at al., 2000, TIBTECH, v.1, 374-379]. Структурный анализ белков паутины свидетельствует о наличии в них кристаллических областей, образованных β-складчатыми структурами (считается, что они формируются блоками (А)n и (GA)n), которые обеспечивают прочность нитей паутины и которые погружены в менее структурированный Gly-обогащенный матрикс, ответственный за эластичность. На концах молекул содержатся неповторяющиеся (NR) уникальные консервативные последовательности, которые необходимы, как полагают, для повышения растворимости белков в концентрированном растворе внутри железы, а также для правильной подгонки молекул при формировании нити при прядении.
Были предприняты попытки клонирования и оптимизации экспрессии кДНК-копий природных генов, кодирующих белки каркасной нити паутины, в клетках Е.coli [Arcidiacono S. et al. Appl. Microbiol. Biotechnol., 1998, v.49, 1-38]. Однако достигнутый уровень экспрессии был достаточно низким, что объясняется, в первую очередь, несоответствием частоты встречаемости определенных аминокислотных кодонов в генах паука и генах использованного микроорганизма-реципиента.
Более успешным оказался путь химико-ферментативного синтеза генов белков паутины с последующим клонированием в клетках бактерий, дрожжей, табака, картофеля, используя синтетические модули ДНК с частотой использования кодонов, адаптированной к соответствующей хозяйской клетке [Prince J.T. et al. Biochemistry, 1995, v.34, 10879-10884; Winkler S. et al. Int. J. Biol. Macromol, 1999, v.24, 265-270; Fahnestock S.R. & Bedzyk L.A. Appl. Microbiol. Biotechnol, 1997, v.47, 33-39; Fahnestock S.R. & Irwin S.L., Appl. Microbiol. Biotechnol., 1997, v.47, 23-32; Lewis, R.V. et al., 1996, Protein Expr. Purif., v.7, 400-406; Scheller, J. et al., 2001, Nat. Biotechnol., v.19, 573-577]. Указанные работы в основном касались экспрессии генов, кодирующих рекомбинантные белки каркасной нити паутины пауков-кругопрядов, содержащих консенсусную последовательность или ее небольшие фрагменты. В результате экспрессии синтетических генов были получены искусственные белки, содержащие варианты первичных повторов спидроинов 1 и 2, сходные с повторяющимися областями природных белков. Эти белки хотя и обладали особенностями вторичной структуры, характерными для белков паутины, но созданные на их основе нити по механическим свойствам были далеки от нитей природной паутины. Ни один из этих искусственных белков не содержал С-концевых NR-областей, которые найдены во всех белках каркасной нити. Свойствами, наиболее близкими к свойствам природных белков, обладали искусственные аналоги, содержавшие 800 и 1600 аминокислотных остатков, полученные в результате экспрессии синтетических генов в клетках E.coli [Fahnestock & Irwin, 1997, Appl. Microbiol. Biotechnol., v.47, 23-32] или дрожжей Pichia pastoris [Fahnestock & Bedzyk, 1997, Appl. Microbiol. Biotechnol, v.47, 33-39].
Первым шагом в направлении исследований молекулярных механизмов сборки нитей паутины было изучение первичной структуры каркасных белков ADF-3 и ADF-4 паутины садового паука (Araneus diadematus), соответствующих белкам MaSp2 и MaSp1 (спидроины 2 и 1 большой ампуловидной железы). Рекомбинантные белки паутины, состоящие из синтетических повторяющихся последовательностей и уникальных аутентичных NR-областей на концах молекул, были экспрессированы в клетках Е. coli, выход очищеного белка составлял около 1 г на литр бактериальной культуры [WO/2006/008163].
Сравнительный анализ вторичной структуры, растворимости и агрегационных свойств полученных белков позволил выявить роль различных элементов первичной структуры белков паутины. Было обнаружено, что повторяющиеся области, занимающие основную по протяженности часть белков паутины и содержащие консенсусную последовательность, включающую поли-А блок, детерминируют растворимость синтетических белков. Важным для обеспечения растворимости является чередование гидрофобных и гидрофильных сегментов в первичных повторах.
Неповторяющиеся области С-конца играют важную роль в инициации сборки белков. В этой системе экспрессии были использованы в качестве синтетических строительных блоков два модуля: модуль поли-А и второй модуль, состоящий из четырх повторов GPGQQ. Модули такого типа также описаны Хаммерих с соавторами [Hummerich, D. et al., 2004, Biochemistry, v.43, 13604-13612].
Процесс сборки паутины был изучен на модели двух рекомбинантных аналогов спидроина 1 (белок 1F9) и спидроина 2 (белок 2Е12), входящих в состав каркасных нитей паутины пауков Nephila clavipes и Nephila madagascariensis, соответственно [Bogush V.G. & Debabov V.G., 2009, J. Neuroimmune Pharmacol., v.4, 17-27].
Синтетический ген белка 1F9 был экспрессирован в дрожжах Saccharomyces cerevisiae под контролем промотора GAL1 с использованием бирепликонного экспрессионного вектора [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, стр.11-22] и в клетках метилотрофных дрожжей Pichia pastoris под контролем метанолиндуцибельного промотора AOXI с использованием интегративного вектора pHIL-D2 [Богуш В.Г. с соавт., 2006, Биотехнология, т.4, 3-12].
В первом случае более 80% целевого белка обнаруживалось в водонерастворимой фракции, и средний выход составлял 6-8 мг белка на 1 литр ферментационной культуры дрожжей. В дрожжах Pichia pastoris средний выход чистого белка 1F9 составил приблизительно 70 мг на 1 кг влажной клеточной массы (приблизительно 23 мг/л ферментационной культуры). Последовательности рекомбинантных белков были максимально приближены к последовательностям природных белков, в частности, повторяющаяся область белка 1F9 содержала 9 повторов «мономера», состоящего из пяти вариантов первичных повторов, обнаруженных в природном спидроине 1. С целью увеличения уровня синтеза рекомбинантного белка в клетках дрожжей структура генов 1f9 и 2Е12 была модифицирована путем замены "редких" триплетов на кодоны, характерные для эффективно экспрессирующихся генов дрожжей, а количество внутренних повторов нуклеотидных последовательностей сведено к минимуму. Фрагменты ДНК, кодирующие соответствующие мономеры обоих белков, были получены в результате химико-ферментативного синтеза и затем амплифицированы. Конечный ген белка 1F9 кодировал девять повторов соответствующего «мономера», составляющих белок с молекулярной массой 94 кДа; белок 2Е12 (молекулярная масса 113 кДа) содержал 12 «мономерных» повторов.
В растворах белков 1F9 и 2Е12, очищенных с использованием катионобменной хроматографии, были исследованы структурные переходы, возникающие при определенных воздействиях [Bogush V.G. & Debabov V.G., 2009, J. Neuroimmune Pharmacol., v.4, 17-27]. Несмотря на отсутствие гидрофильных N- и С-концевых уникальных последовательностей (NR), которые, как предполагалось ранее, необходимы для формирования нанофибрилл и мицелл, оба белка в водном растворе спонтанно формировали нанофибриллы длиной 100 нм - 1 мкм и мицеллы диаметром около 1 мкм. Причем нанофибриллы имели спиралевидную структуру с периодом в 40 нм.
Однако уровень синтеза рекомбинантных белков паутины с использованием известных способов не позволял нарабатывать белки паутины в количествах, достаточных не только для изучения их структуры и свойств, но и для разработки и испытания нового класса медицинских материалов и изделий из них. Одним из способов увеличения экспрессии слабо экспрессируемого белка методами генной инженерии является его биосинтез в виде гибридного белка, в котором целевой белок слит с эффективно экспрессируемым белком [Shatzman and Rosenberg, 1987, Methods Enzynol., v.152, 661-673]. Однако обычно преимущества такого подхода в значительной степени нивелируются необходимостью на завершающих стадиях очистки осуществлять процессинг гибридного продукта для высвобождения из его состава целевого белка, что нетехнологично в случае рекомбинантных белков паутины. Было показано, что при использовании дрожжевого убиквитина в качестве эффективно экспрессируемого компонента гибриды подвергаются высокоспецифичному внутриклеточному процессингу в клетках дрожжей. Убиквитин дрожжей, состоящий из 76 аминокислотных остатков, является представителем семейства убиквитин-подобных белков эукариот, к которому относятся сравнительно небольшие структурно консервативные белки, обладающие экстраординарной скоростью сворачивания, высокой растворимостью и термостабильностью; in vivo белки этого семейства служат для обратимой модификации и изменения функционального состояния других белков. Представители семейства убиквитин-подобных белков содержат консервативный С-концевой мотив Gly-Gly, являющийся сайтом процессинга [Müller et al., 2001, Nature, v.2, 202-210]. Присутствие этого сайта в составе гибридных белков с убиквитином приводит к тому, что в клетках дрожжей гибриды подвергаются высокоспецифичному внутриклеточному процессингу под действием убиквитин-специфичных протеиназ DUB, в результате чего в составе конечных продуктов экспрессии убиквитиновый компонент отсутствует.
Позднее было обнаружено, что помимо убиквитина для усиления экспрессии могут использоваться и другие представители белков убиквитинового семейства, в частности, дрожжевой вариант белка SUMO. Зрелый белок SUMO дрожжей Saccharomyces cerevisiae, кодируемый уникальным геном SMT3 (Johnson et al., 1997, EMBO J, v.16, 5509-5519; Muller et al., 1998, EMBO J, v.17, 61-70), содержит в своем составе 98 аминокислотных остатков, из которых остатки 13-98 важны для формирования его нативной структуры [Mossessova Е. & Lima CD., 2000, Mol. Cell, v.5, 865-876]. Аналогично убиквитин-специфичным протеиназам, SUMO-специфичные протеиназы дрожжей обеспечивает высокую эффективность и специфичность процессинга SUMO-содержащих гибридных белков [Malakhov et al., 2004, J. Struct. Funct. Genom., v.5, 75-86; Butt et al., 2005, Protein Expr. Purif., v.43, 1-9].
Однако эффективность технологии гибридизации рекомбинантных белков паутины с убиквитином или другими убиквитин-подобными белками для увеличения биосинтеза белков паутины не была продемонстрирована. Таким образом, разработка способа микробиологического биосинтеза, позволяющего существенно повысить продукцию рекомбинантных белков паутины, обладающих свойствами, приближенными к свойствам природных белков, является актуальной задачей, решение которой открывает принципиальную возможность создания на основе рекомбинантных белков паутины биоматериалов с уникальными свойствами.
Раскрытие изобретения
Авторами настоящего изобретения впервые предложен способ получения рекомбинантных белков паутины пауков-кругопрядов (Araneidae) в клетках дрожжей, обеспечивающий продукцию рекомбинантных белков в количествах, в десятки раз превышающих количества рекомбинантных белков паутины, продуцируемых в соответствии со способами, известными из предшествующего уровня техники.
Согласно предложенному способу рекомбинантные белки паутины пауков-кругопрядов экспрессируют в клетках дрожжей в виде гибрида с убиквитин-подобным белком, занимающим в составе гибрида N-концевое положение и содержащим сайт процесинга, распознаваемый природными дрожжевыми протеиназами, предпочтительно, убиквитин-специфичными протеиназами DUB или SUMO-специфичными протеиназами дрожжей, в результате чего в ходе экспрессии гибридные белки подвергаются процессингу под действием протеиназ, что обеспечивает накопление в клетках дрожжей зрелого белка паутины, не содержащего гибридный компонент, причем белок накапливается в водонерастворимой фракции дрожжевых клеток.
Предпочтительно, способ согласно изобретению предусматривает получение рекомбинантного белка паутины, консенсусные последовательности которого происходят из каркасных белков большой ампуловидной железы и/или белков малой ампуловидной железы, или белка ловчей нити паука-кругопряда.
В одном из предпочтительных воплощений способ согласно изобретению предусматривает получение рекомбинантных белков паутины, консенсусные последовательности которых происходят из каркасных белков большой ампуловидной железы Nephila clavipes и/или Nephila madagascariensis, и убиквитин-подобный белок выбирают из группы, включающей убиквитин и белок SUMO дрожжей Saccharomyces cerevisiae.
В одном из наиболее предпочтительных воплощений способ согласно изобретению направлен на получение рекомбинантного белка 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis в клетках Saccharomyces cerevisiae под контролем промотора гена GAL1 дрожжей, причем ген рекомбинантного белка слит с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В еще одном наиболее предпочтительном воплощении способ согласно изобретению направлен на экспрессию гена рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes в клетках Saccharomyces cerevisiae под контролем промотора гена GAL1 дрожжей, причем ген рекомбинантного белка слит с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В одном из аспектов изобретение направлено на слитый белок, включающий последовательности рекомбинантного белка паутины паука-кругопряда и убиквитин-подобного белка, занимающего в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков каркасной нити MaSp1 и MaSp2 большой ампуловидной железы, белков MiSp1 и MiSp2 малой ампуловидной железы и белка Flag ловчей нити паука-кругопряда.
В одном из предпочтительных воплощений изобретение направлено на слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, и последовательность рекомбинантного белка паутины включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков каркасной нити MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
Наиболее предпочтительно, слитый белок включает рекомбинантный белок 1F9 каркасной нити паука-кругопряда Nephila clavipes, последовательность которого слита с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В еще одном наиболее предпочтительном воплощении слитый белок включает рекомбинантный белок 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis, последовательность которого слита с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В одном из аспектов изобретение направлено на рекомбинантную ДНК, кодирующую слитый белок, включающий в себя рекомбинантный белок паутины паука-кругопряда и убиквитин-подобный белок, занимающий в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков каркасной нити MaSp1 и MaSp2 большой ампуловидной железы, белков MiSp1 и MiSp2 малой ампуловидной железы и белка ловчей нити паука-кругопряда.
Предпочтительно, рекомбинантная ДНК кодирует слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, и последовательность рекомбинантного белка паутины паука-кругопряда включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
Наиболее предпочтительно, рекомбинантная ДНК согласно изобретению кодирует слитый белок, включающий последовательности рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes и убиквитина или белка SUMO дрожжей Saccharomyces cerevisiae, и имеющий последовательность, как представлено в Перечне последовательностей (SEQ ID NO: 1 и SEQ ID NO: 3, соответственно).
В еще одном наиболее предпочтительном воплощении рекомбинантная ДНК кодирует слитый белок, включающий последовательности рекомбинантного белка 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis и убиквитина или белка SUMO Saccharomyces cerevisiae.
В одном из аспектов изобретение касается векторов экспрессии, которые включают последовательности ДНК, кодирующие рекомбинантные белки паутины паука-кругопряда, слитые с последовательностью гена убиквитин-подобного белка, занимающего в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, и последовательности высокоэффективных регулируемых промоторов дрожжей.
В предпочтительном воплощении изобретение обеспечивает векторы экспрессии, которые содержат рекомбинантную ДНК, кодирующую слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, а последовательность рекомбинантного белка паутины включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
В одном из наиболее предпочтительных воплощений изобретение обеспечивает вектор экспрессии, представляющий бирепликонный вектор pPDX3-HUB-2E12, содержащий область инициации репликации эндогенной 2 мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 2Е12, слитую последовательностью, кодирующей убиквитин Saccharomyces cerevisiae.
В другом наиболее предпочтительном воплощении изобретение обеспечивает вектор экспрессии, представляющий бирепликонный вектор pPDX3-HUB-1F9, содержащий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 1F9, слитую с последовательностью, кодирующей убиквитин Saccharomyces cerevisiae.
В еще одном наиболее предпочтительном воплощении изобретение обеспечивает вектор экспрессии, представляющий бирепликонный вектор pPDX3-SUMO-1F9, включающий область инициации репликации эндогенной 2-мкм плазмиды дрожжей, промоторную область гена дрожжей GAL1, последовательность ДНК, кодирующую рекомбинантный белок 1F9, слитую с последовательностью, кодирующей белок SUMO Saccharomyces cerevisiae.
В соответствии с еще одним аспектом изобретение обеспечивает хозяйские клетки дрожжей, продуцирующие рекомбинантные белки паутины паука-кругопряда. Наиболее предпочтительными хозяйскими клетками согласно изобретению являются клетки дрожжей Saccharomyces cerevisisae. В еще одном аспекте изобретение обеспечивает штаммы-продуценты рекомбинантых белков 1F9 и 2Е12 каркасной нити паука-кругопряда.
Краткое описание чертежей Фиг.1. Электрофорез в 12% ПААГ с ДДС-Na фракций 1F9 после хроматографии на катионообменной колонке HiPrep 16/10 SP FF. Дорожки: 1 - исходный раствор перед нанесением на колонку; 2 - проскок; 3-6 - фракции, содержащие белок 1F9, 7 - образец стандартного 1F9. Фиг.2. Электрофорез в 12% ПААГ с ДДС-Na фракций 2Е12 после хроматографии на катионообменной колонке HiPrep 16/10 SP FF. Дорожки: 1 - Исходный раствор перед нанесением на колонку; 2 - проскок; 3 - Стандарты молекулярных масс (сверху вниз, в кДа): 170, 130, 95, 72, 55, 43, 34, 26, 17; 4 - фракция, содержащая 2Е12, 5 - образец стандартного 2Е12. Фиг.3. Карта вектора pPDX3-HUB-1F9.
Обозначения: SPIDROIN - синтетический ген рекомбинантного белка 1F9 (спидроин-1 паука N. clavipes); HUB - ген убиквитина дрожжей S.cerevisiae; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae, соответственно; cyc1T - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации, обеспечивающий селективную амплификацию вектора в клетках E.coli.
Фиг.4. Карта вектора pPDX3-SUMO-1F9.
Обозначения: SPIDROIN - синтетический ген рекомбинантного белка 1F9 (рекомбинантный спидроин-1 паука N. clavipes); SUMO - ген SMT3 дрожжей S.cerevisiae, кодирующий белок SUMO; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae, соответственно; cyc1T - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2 - микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации дрожжей; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации для обеспечения селективной амплификации вектора в клетках Е. coli. Фиг.5. Схема вектора pPDX3-HUB-2E12.
Условные обозначения: SPIDROIN - последовательность ДНК, кодирующая рекомбинантный белок 2Е12; HUB - последовательность ДНК, кодирующая убиквитин дрожжей S.cerevisiae; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae, соответственно; cyc1T - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации, обеспечивающий селективную амплификацию вектора в клетках E.coli. Фиг.6. Фотография искусственной нити из белка 1F9 в сосуде с этанолом.
Осуществление изобретения
Настоящее изобретение основано на неожиданном открытии, что экспрессия рекомбинантного белка паутины паука-кругопряда в клетках дрожжей в виде слитого белка с убиквитин-подобным белком, занимающим в составе гибрида N-концевое положение, позволяет в десятки раз увеличить продукцию рекомбинантного белка паутины, причем рекомбинантный белок, экспрессируемый в виде гибридного белка, накапливается в клетках дрожжей в водонерастворимой фракции в виде процессированного белка, не содержащего гибридный компонент.
Следовательно, в одном из аспектов настоящее изобретение обеспечивает способ получения рекомбинантного белка паутины паука-кругопряда в клетках дрожжей, предусматривающий конструирование вектора экспрессии, трансформацию клеток дрожжей полученным вектором экспрессии и экспрессию в трансформированных клетках гена рекомбинантного белка паутины паука-кругопряда, отличающийся тем, что используют вектор экспрессии, который включает последовательность ДНК, кодирующую рекомбинантный белок паутины паука-кругопряда, слитую с последовательностью, кодирующей убиквитин-подобный белок, занимающий в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины и содержащий сайт процессинга, распознаваемый природными дрожжевыми протеиназами, предпочтительно, убиквитин-специфичными протеиназами DUB или SUMO-специфичными протеиназами дрожжей, в результате чего в ходе экспрессии гибридные белки подвергаются процессингу под действием протеиназ, что обеспечивает накопление в клетках дрожжей в водонерастворимой фракции рекомбинантного белка паутины в виде процессированного белка, не содержащего гибридный компонент.
Рекомбинантные белки, получаемые способом согласно изобретению, имеют явно выраженную перидическую структуру, которая может быть представлена в виде ряда консенсусных последовательностей, выведенных путем выравнивания повторяющихся единиц природных белков паутины пауков-кругопрядов. Рекомбинантные белки согласно изобретению представляют собой белки, последовательности которых содержат как повторы одной консенсусной последовательности, так и комбинации повторов консенсусных последовательностей различного типа, происходящих из каркасных белков большой ампуловидной железы и/или белков малой ампуловидной железы, и/или белков Flag ловчей нити паука-кругопряда, в частности, выбираемых из группы, включающей консенсусные последовательности:
где MaSp1 и MaSp1 - белки каркасной нити большой ампуловидной железы Latrodectus hesperus [Lawrence В.A. et al., 2004, Biomacromolecules, v.5, 689-695];
MiSp1 и MiSp1 - белки малой ампуловидной железы Nephila clavipes [Colgin M.A. & Lewis R.V., 1998, Protein Sci., v.7, 667-672];
Flag - белок ловчей нити Nephila madagascariensis [Hayashi C. & Lewis R.V., 1998, J. Mol. Biol., v.275, 773-784].
Предпочтительно, согласно предложенному способу используют консенсусные последовательности, происходящие из повторяющихся последовательностей белков большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
Конструирование искусственных генов, кодирующих рекомбинантные белки большой и/или малой ампуловидных желез, или белки Flag ловчей нити паука-кругопряда, включает реконструкцию последовательности ДНК, кодирующей консенсусную последовательность или комбинации повторов консенсусных последовательностей различного типа, происходящие из повторяющихся последовательностей указанных выше белков; конструирование и химический синтез серии праймеров к консенсусной последовательности/последовательностям; единовременный отжиг смеси всех синтезированных праймеров, необходимых для образования двухцепочечной молекулы ДНК, и последующую обработку их лигазой для удаления однонитевых разрывов ДНК, или реакцию ПЦР с последовательным использованием необходимых праймеров и поэтапным достраиванием растущего фрагмента ДНК, причем образуемый фрагмент («мономер») затем подвергается поэтапному удвоению в составе плазмиды до получения гена необходимой длины [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22; Богуш В.Г. с соавт., 2006, Биотехнология, т.4, 3-12; Bogush V.G. & Debabov V.G., 2009, J. Neuroimmune Pharmacol., v.4, 17-27].
Последовательности соответствующих кДНК могут быть выведены на основе последовательности природного белка с учетом вырожденности кода и частоты встречаемости кодонов у дрожжей. В частности, при конструировании гена, кодирующего белок 1F9 и содержащего 9 копий "мономера", фрагменты, кодирующие наиболее типичные первичные повторы, были выбраны из последовательности природного белка и отличались друг от друга набором делеций. Реконструированная последовательность ДНК включала приблизительно 400 п.н. и кодировала полипептид, соответствующий 134 аминокислотным остаткам. «Редкие» кодоны в последовательности искусственного гена были заменены на наиболее часто используемые у дрожжей. «Мономер» был получен с помощью химико-ферментативного синтеза и мультимерная форма получена путем пошаговой мультипликации мономера в составе рекомбинантной плазмиды [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22].
При конструировании гена 2Е12 были использованы последовательности спидроинов типа 2 большой ампуловидной железы, содержащиеся в базе данных белковых последовательностей NCBI и включающие более 200 аминокислотных остатков. На основании математического анализа всех последовательностей были разработаны последовательности блоков (каждый состоял из 3-5 первичных повторов) и составлена формула полного искусственного гена [Bogush V.G. et al., 2009, J. Neuroimmune Pharmacol., v.4, 17-27].
В одном из предпочтительных воплощений предложенный способ получения рекомбинантного белка паутины паука-кругопряда в клетках дрожжей предусматривает слияние гена рекомбинантного белка паутины с последовательностью ДНК, кодирующей убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae.
В одном из наиболее предпочтительных воплощений изобретения в клетках Saccharomyces cerevisiae получают рекомбинантный белок 1F9 каркасной нити паутины паука-кругопряда Nephila clavipes, причем структурный ген белка 1F9 слит с последовательностью ДНК, кодирующей убиквитин Saccharomyces cerevisiae. Еще в одном наиболее предпочтительном воплощении изобретения в клетках Saccharomyces cerevisiae получают рекомбинантный белок 2Е12 каркасной нити паутины паука-кругопряда Nephila madagascariensis, причем ген белка 2Е12 слит с последовательностью ДНК, кодирующей убиквитин Saccharomyces cerevisiae.
В еще одном наиболее предпочтительном воплощении изобретения в клетках дрожжей Saccharomyces cerevisiae экспрессируют слитый белок, содержащий последовательность рекомбинантного белка 1F9, причем последовательность белка 1F9 слита с последовательностью белка SUMO дрожжей Saccharomyces cerevisiae. Рекомбинантные белки, получаемые согласно предложенному способу, были выделены из водонерастворимой фракции хозяйских клеток Saccharomyces cerevisiae с помощью хроматографии на катионообменной колонке (примеры 9 и 11). Электрофоретический анализ фракций (Фиг.1 и 2) показал, что рекомбинантные белки 1F9 и 2Е12 накапливаются во фракции водонерастворимых белков клеток дрожжей (в водорастворимой фракции рекомбинантные белки практически отсутствуют) и не содержат компонент убиквитин-подобного белка. На это указывает электрофоретическая подвижность анализируемых белков и отсутствие в геле полос, соответствующих по подвижности слитым белкам (убиквитин-1F9 и убиквитин-2Е12). Аналогичные результаты получены для рекомбинантных белков, выделенных и очищенных из водонерастворимой фракции хозяйских клеток Saccharomyces cerevisiae, продуцирующих рекомбинантные белки паутины, слитые с белком SUMO. Продукция рекомбинантных белков клетками Saccharomyces cerevisiae составляет не менее 100 мг/л ферментационной культуры.
Отсутствие рекомбинантных белков, получаемых в соответствии с предложенным изобретением, в водорастворимой фракции позволяет практически избежать потери белка в процессе выделения и очистки в отличие от известного способа [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22], согласно которому только около 80% целевого белка обнаруживалось в водонерастворимой фракции.
Таким образом, при осуществлении способа получения рекомбинантного белка паутины согласно изобретению рекомбинантный белок, синтезируемый в клетках Saccharomyces cerevisiae, накапливается во фракции водонерастворимых белков в виде процессированного белка, не содержащего гибридный компонент, причем клетки, экспрессирующие рекомбинантный белок паутины, накапливают в десятки раз больше рекомбинантного белка, чем в соответствии со способами, известными из предшествующего уровня техники.
Очищенные рекомбинантные белки паутины паука-кругопряда, согласно изобретению, способны образовывать надмолекулярные структуры различных типов, в частности анализируемые белки формируют не растворяющиеся в воде нити (Пример 12, Фиг.8).
В еще одном из аспектов изобретение направлено на слитые белки, включающие последовательности рекомбинантного белка паутины паука-кругопряда и убиквитин-подобный белок, занимающий в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы, белков MiSp1 и MiSp2 малой ампуловидной железы и белка Flag ловчей нити паука-кругопряда.
В одном из предпочтительных воплощений изобретение направлено на слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, и последовательность рекомбинантного белка паутины паука-кругопряда включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
Наиболее предпочтительно, слитый белок содержит последовательность рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes, слитую с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae, как представлено в Перечне последовательностей (SEQ ID NO:1 и SEQ ID NO:3, соответственно).
В еще одном наиболее предпочтительном воплощении слитый белок содержит последовательность рекомбинантного белка 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis, слитую с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В еще одном аспекте изобретение охватывает рекомбинантные ДНК, кодирующие слитые белки. Синтезированные и клонированные последовательности ДНК, используемые в соответствии с изобретением для получения рекомбинантных белков паутины, кодируют слитые белки, включающие последовательности рекомбинантного белка паутины паука-кругопряда и убиквитин-подобного белка, занимающего в составе слитого белка N-концевое положение по отношению к рекомбинантному белку, причем последовательность рекомбинантного белка паутины включает консенсусные последовательности, которые происходят из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы, белков MiSp1 и MiSp2 малой ампуловидной железы и белка ловчей нити Flag паука-кругопряда.
Предпочтительно, рекомбинантная ДНК кодирует слитый белок, в котором убиквитин-подобный белок представляет собой убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae, и последовательность рекомбинантного белка паутины паука-кругопряда включает консенсусные последовательности, происходящие из повторяющихся последовательностей белков MaSp1 и MaSp2 большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
Наиболее предпочтительно, рекомбинантные ДНК, используемые в соответствии с изобретением для получения рекомбинантных белков паутины, кодируют рекомбинантный белок 1f9 каркасной нити паука-кругопряда Nephila clavipes или рекомбинантный белок 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis, последовательности которых слиты с последовательностью, кодирующей убикви